生物人教版(2019)必修1 5.1.2酶的特性(共26张ppt)
文档属性
| 名称 | 生物人教版(2019)必修1 5.1.2酶的特性(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 生物学 | ||
| 更新时间 | 2024-02-22 23:21:11 | ||
图片预览






文档简介
(共26张PPT)
第1节 降低化学反应活化能的酶
二 酶的特性
“人是铁,饭是钢,一顿不吃饿得慌!”随着人们生活水平的提高,宴请、聚餐的机会也日益增多,暴饮暴食现象日趋严重,当人们暴饮暴食或消化不良后,往往会服用多酶片以缓解不适症状。
回顾人体每日摄入食物的种类、去向,思考为什么会出现消化不良等现象?
讨论
蛋白酶
脂肪酶
淀粉酶
酶具有什么特性?
讨论
问题一:多酶片含有哪些酶?
酶具有专一性
二、酶的特性
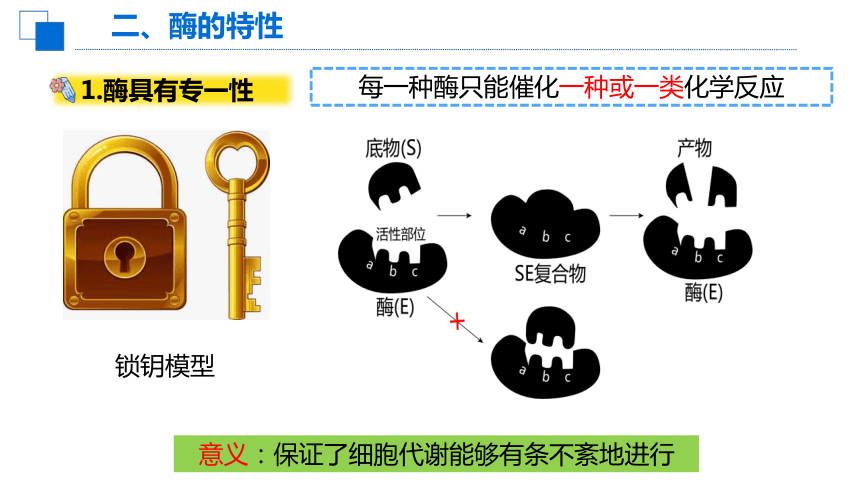
1.酶具有专一性
每一种酶只能催化一种或一类化学反应
意义:保证了细胞代谢能够有条不紊地进行
锁钥模型
二、酶的特性
1.酶具有专一性
如何验证酶具有专一性?
①同一种酶分别作用于不同底物
②不同种酶分别作用于同一底物
设计思路
淀粉酶对淀粉和蔗糖的水解作用
探究·实践
二、酶的特性
探究·实践
淀粉和蔗糖都是非还原糖。
它们在酶的催化作用下都能水解成还原糖。
在淀粉溶液和蔗糖溶液中分别加入淀粉酶,再用斐林试剂鉴定溶液中有无还原糖,就可以看出淀粉酶是否只能催化特定的化学反应。
1. 实验原理
淀粉酶对淀粉和蔗糖的水解作用
1.酶具有专一性
二、酶的特性
探究·实践
淀粉酶对淀粉和蔗糖的水解作用
试管1 试管2
自变量 2ml 淀粉溶液 2ml 蔗糖溶液
无关变量 加入2ml淀粉酶,在相同 pH( 中性) 、温度( 37℃ ) 条件下保温一段时间。 因变量 加入等量的斐林试剂,水浴加热一段时间 预测实验现象 出现砖红色沉淀 不出现砖红色沉淀
实验结论 淀粉酶能催化淀粉水解,产生还原糖。不能催化蔗糖水解。
1.酶具有专一性
资料:成年人一顿饭摄入的食物总量约为 600 g
如此少量的酶是能分解大量食物的
讨论
问题二:多酶片中每种酶的含量能说明什么问题
3号
4号
2号
1号
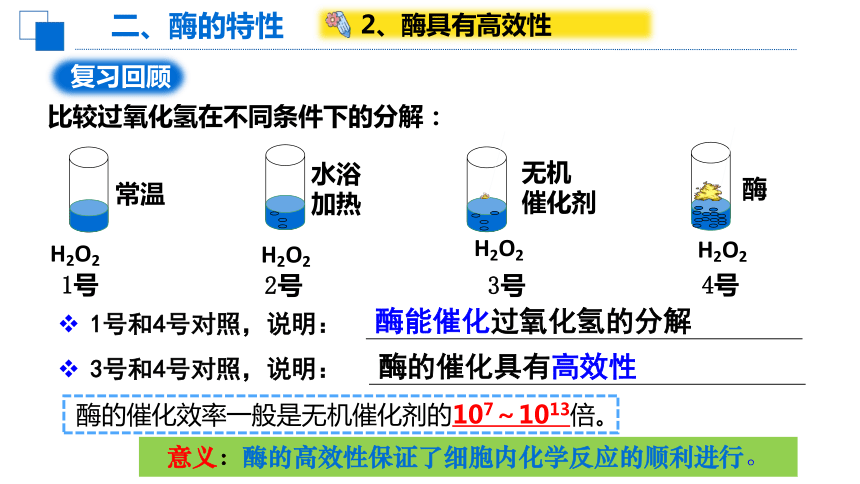
比较过氧化氢在不同条件下的分解:
1号和4号对照,说明:
3号和4号对照,说明:
酶能催化过氧化氢的分解
酶的催化具有高效性
H2O2
H2O2
H2O2
常温
水浴
加热
无机
催化剂
酶
H2O2
二、酶的特性
2、酶具有高效性
复习回顾
酶的催化效率一般是无机催化剂的107~1013倍。
意义:酶的高效性保证了细胞内化学反应的顺利进行。
哪些因素可能会影响酶活性
问题三:多酶片在食用时需要注意什么
温度
PH
酶的活性受什么因素影响?
酶的活性受温度、pH的影响
提出问题
作出假设
探究·实践
影响酶活性的条件
设计思路
T1 底物+酶液
T2 底物+酶液
Tn 底物+酶液
检测
单位时间内底物消耗量或反应物的生成量
温度对酶活性的影响
PH对酶活性的影响
pH1 底物+酶液
pH2 底物+酶液
pHn 底物+酶液
检测
单位时间内底物消耗量或反应物的生成量
酶活性:酶催化特定化学反应的能力。酶活性可用在一定条件下酶催化某一化学反应的速率表示。
二、酶的特性
探究·实践
质量分数为2%新配制的淀粉酶溶液,新鲜的质量分数为20%的肝脏研磨液,缓冲液。
质量分数为3%的可溶性淀粉溶液,体积分数为3%的过氧化氢溶液。物质的量浓度为0.01mol/L的盐酸,物质的量浓度为0.01mol/L的NaOH溶液,热水,蒸馏水,冰块,碘液,斐林试剂。
试管,量筒,小烧杯,大烧杯,滴管,试管夹,酒精灯,三脚架,陶土网,温度计,pH试纸,火柴。
材料用具
探究温度或PH对酶活性的影响
二、酶的特性
探究·实践
设计实验
探究温度或PH对酶活性的影响
1、本实验的自变量是什么?如何控制?
本实验的自变量是温度或pH。
温度的控制可用冰块降温或水浴加热,用温度计随时测量;
pH的控制可加入强酸或强碱,用pH试纸进行测量。
二、酶的特性
探究·实践
设计实验
探究温度或PH对酶活性的影响
2、因变量是什么?如何观察和检测因变量?
因变量是酶的活性。用淀粉和淀粉酶做实验时,可利用加碘液后看溶液是否变蓝以及蓝色深浅来判断淀粉是否水解,从而了解淀粉酶的活性;
用过氧化氢酶做实验时,可根据产生气泡的数量和速度或插入卫生香,观察复燃所需时间来判断酶的活性。
方 法 步 骤 取六只试管编号 1 1' 2 2' 3 3'
淀粉溶液 2ml 2ml 2ml
淀粉酶溶液 1ml 1ml 1ml
温度处理5min 100℃ 60℃ 0℃ 混合后保温 将同一温度内的两物质混合,保温5min 滴加碘液 1滴 1滴 1滴 结果 现象 结论 变蓝
不变蓝
变蓝
酶的催化作用需要在合适的温度下进行,温度过高或过低都会影响酶的活性。
1.操作时将底物和酶先混合再保温,还是先保温再混合?为什么?
2. 能否选择斐林试剂作为检测材料?
3.如何进一步探究淀粉酶的最适温度?
先保温再混合。
缩小温度梯度(梯度要均匀),重复进行上述实验。
探究温度对酶活性的影响
探究·实践
不能,斐林试剂需水浴加热,而本实验需严格控制温度
H2O2在不同温度下分解速率不同,高温下自身分解。
酶具有高效性,若酶和底物没有在对应温度混合,一混合就已发生反应,降低了实验的说服力。
二、酶的特性
温度对酶活性的影响
B
C
A
(1)在一定温度范围内,酶促反应速率随温度的升高而_______,但当温度升高到一定限度时,酶促反应速率不仅不再加快反而随着温度的升高而________。
(2)在一定条件下,酶活性最大时的温度称为该酶的_________。
(3)低温影响酶的活性,但不会使酶的_________遭到破坏,温度升高后,酶________恢复活性。但高温会导致酶_________,酶会_______活性。
升高
降低
最适温度
空间结构
能够
变性
失去
低温保存酶等蛋白质制品
二、酶的特性
探究·实践
探究pH对酶活性的影响
选择淀粉酶还是H2O2酶作实验材料?为什么选择这种酶?
2. 本实验的自变量是什么?需要设计几组实验?设定几个pH?
3. 本实验的因变量是什么?怎样检测因变量?
设计实验
H2O2酶;因为淀粉在酸性条件下也会分解,影响实验观察效果
pH;三组;酸性、中性和碱性
酶的活性;看气泡产生多少或卫生香复燃程度
二、酶的特性
探究·实践
探究pH对酶活性的影响
步骤 试管1 试管2 试管3
1 加入2ml H2O2溶液 2 1ml pH=7的缓冲液 1ml 盐酸溶液 1ml NaOH溶液
3 加入2滴肝脏研磨液 4 观察气泡生成速率,或插入卫生香,观察复燃所需时间 实验现象 有大量气泡产生/迅速复燃 基本无气泡产生/不复燃 基本无气泡/不复燃
实验结论 酶的催化作用需要适宜的pH,pH偏低或偏高都会影响酶的活性
必须先调pH,然后再将反应物与酶混合。否则反应物会在未调节好pH的情况下就在酶的作用下发生反应,影响实验的准确性。
本实验中,能否将底物和酶混合均匀后,再在不同pH下处理?
二、酶的特性
PH对酶活性的影响
υ/mmol. s-1
最适pH
0
pH
酶活性受pH影响示意图
(1)在一定条件下,酶活性最大时的pH值称为该酶的________。偏离该pH,不论升高还是降低,酶促反应速率都会________。
(2)过酸,过碱都会使酶的_________遭到破坏,使酶___________。
最适pH
降低
空间结构
永久失活
为什么多酶片的说明书中包括“本品在酸性条件下易破坏,故服用时切勿嚼碎”的提示内容
酶的名称 最适pH
动物体内酶 6.5-8.0
植物体内酶 4.5-6.5
胰蛋白酶 8.0-9.0
胃蛋白酶 1.5-2.2
糖衣(主要成分是蔗糖,在酸性条件下溶解,具防潮、隔绝空气、掩盖药物不良气味作用)
胃蛋白酶(胃部唯一的蛋白质,在PH1.5-5.0条件下,可将蛋白质分解为肽、部分氨基酸)
胰酶(主要是胰蛋白酶、胰淀粉酶、和胰脂肪酶,在中性或弱碱性条件下活性较强)
肠溶衣(主要成分为丙烯酸树脂,在37℃人工胃液中2h以内不溶解、在人工肠液中1h内溶解)
问题四、多酶片的结构特点和作用原理是什么
高温
强酸
强碱
酶
酶
失活
单击添加标题
低温保存
酶
酶
抑制酶活性
二、酶的特性
酶具有专一性
课堂小结
比较过氧化氢在不同条件下的分解
淀粉酶对淀粉和蔗糖的水解作用
影响酶活性的条件
2.酶具有高效性
1.酶具有专一性
3.酶的作用条件较温和
酶的特性
每一种酶只能催化一种或一类化学反应
酶的催化效率一般是无机催化剂的107~1013倍。
强酸、强碱、高温会使酶失活,低温抑制酶的活性
酶为生活添姿彩
酶的应用
脂肪酶
含酶牙膏
多酶片
胰蛋白酶
加酶洗衣粉
果胶酶
溶菌酶
青霉素酰化酶
P85页拓展2:下图表示的是在最适温度下,反应物浓度对酶所催化的化学反应速率的影响。:(1)请解释在A、B、C三点时该化学反应的状况。
(2)如果在A点时温度升高10℃,曲线会发生什么变化?为什么?请画出变化后的曲线。
(3)如果在B点时往反应混合物中加入少量同样的酶,曲线会发生什么变化?为什么?请画出相应的曲线。
A点反应速率随反应物浓度增大而升高.B点反应速率在此时达到最高。C点反应速率不再随反应物浓度增大而升高,维持在相对稳定的水平。
(2)原因:原曲线表示最适温度下的酶促反应速率随底物浓度的变化。温度高于或低于最适温度,反应速率都会下降。
(3)该曲线表示,B点的反应底物的浓度足够大,是酶的数量限制了反应速率的提高,这时加入少量的酶,会使反应速率加快。
A
B
C
反应速度
反应物浓度
B
C
C
1.抑制剂
抑制剂与底物竞争酶。
如图,抑制剂的结构与酶的活性中心相似,当抑制抑制与酶结合时,就阻止了底物与酶结合,如果底物与酶结合也会阻止抑制与酶结构。
①竞争性抑制剂
由于竞争性抑制剂与底物竞争酶,因此,增大底物浓度,就是使抑制剂与酶结合的减少,从而减小抑制作用。因此,竞争性抑制剂的抑制作用可以通过增大底物的浓度来抵消其抑制作用。
②非竞争性抑制剂
抑制剂改变酶的结构,使之无法与原底物结合
第1节 降低化学反应活化能的酶
二 酶的特性
“人是铁,饭是钢,一顿不吃饿得慌!”随着人们生活水平的提高,宴请、聚餐的机会也日益增多,暴饮暴食现象日趋严重,当人们暴饮暴食或消化不良后,往往会服用多酶片以缓解不适症状。
回顾人体每日摄入食物的种类、去向,思考为什么会出现消化不良等现象?
讨论
蛋白酶
脂肪酶
淀粉酶
酶具有什么特性?
讨论
问题一:多酶片含有哪些酶?
酶具有专一性
二、酶的特性
1.酶具有专一性
每一种酶只能催化一种或一类化学反应
意义:保证了细胞代谢能够有条不紊地进行
锁钥模型
二、酶的特性
1.酶具有专一性
如何验证酶具有专一性?
①同一种酶分别作用于不同底物
②不同种酶分别作用于同一底物
设计思路
淀粉酶对淀粉和蔗糖的水解作用
探究·实践
二、酶的特性
探究·实践
淀粉和蔗糖都是非还原糖。
它们在酶的催化作用下都能水解成还原糖。
在淀粉溶液和蔗糖溶液中分别加入淀粉酶,再用斐林试剂鉴定溶液中有无还原糖,就可以看出淀粉酶是否只能催化特定的化学反应。
1. 实验原理
淀粉酶对淀粉和蔗糖的水解作用
1.酶具有专一性
二、酶的特性
探究·实践
淀粉酶对淀粉和蔗糖的水解作用
试管1 试管2
自变量 2ml 淀粉溶液 2ml 蔗糖溶液
无关变量 加入2ml淀粉酶,在相同 pH( 中性) 、温度( 37℃ ) 条件下保温一段时间。 因变量 加入等量的斐林试剂,水浴加热一段时间 预测实验现象 出现砖红色沉淀 不出现砖红色沉淀
实验结论 淀粉酶能催化淀粉水解,产生还原糖。不能催化蔗糖水解。
1.酶具有专一性
资料:成年人一顿饭摄入的食物总量约为 600 g
如此少量的酶是能分解大量食物的
讨论
问题二:多酶片中每种酶的含量能说明什么问题
3号
4号
2号
1号
比较过氧化氢在不同条件下的分解:
1号和4号对照,说明:
3号和4号对照,说明:
酶能催化过氧化氢的分解
酶的催化具有高效性
H2O2
H2O2
H2O2
常温
水浴
加热
无机
催化剂
酶
H2O2
二、酶的特性
2、酶具有高效性
复习回顾
酶的催化效率一般是无机催化剂的107~1013倍。
意义:酶的高效性保证了细胞内化学反应的顺利进行。
哪些因素可能会影响酶活性
问题三:多酶片在食用时需要注意什么
温度
PH
酶的活性受什么因素影响?
酶的活性受温度、pH的影响
提出问题
作出假设
探究·实践
影响酶活性的条件
设计思路
T1 底物+酶液
T2 底物+酶液
Tn 底物+酶液
检测
单位时间内底物消耗量或反应物的生成量
温度对酶活性的影响
PH对酶活性的影响
pH1 底物+酶液
pH2 底物+酶液
pHn 底物+酶液
检测
单位时间内底物消耗量或反应物的生成量
酶活性:酶催化特定化学反应的能力。酶活性可用在一定条件下酶催化某一化学反应的速率表示。
二、酶的特性
探究·实践
质量分数为2%新配制的淀粉酶溶液,新鲜的质量分数为20%的肝脏研磨液,缓冲液。
质量分数为3%的可溶性淀粉溶液,体积分数为3%的过氧化氢溶液。物质的量浓度为0.01mol/L的盐酸,物质的量浓度为0.01mol/L的NaOH溶液,热水,蒸馏水,冰块,碘液,斐林试剂。
试管,量筒,小烧杯,大烧杯,滴管,试管夹,酒精灯,三脚架,陶土网,温度计,pH试纸,火柴。
材料用具
探究温度或PH对酶活性的影响
二、酶的特性
探究·实践
设计实验
探究温度或PH对酶活性的影响
1、本实验的自变量是什么?如何控制?
本实验的自变量是温度或pH。
温度的控制可用冰块降温或水浴加热,用温度计随时测量;
pH的控制可加入强酸或强碱,用pH试纸进行测量。
二、酶的特性
探究·实践
设计实验
探究温度或PH对酶活性的影响
2、因变量是什么?如何观察和检测因变量?
因变量是酶的活性。用淀粉和淀粉酶做实验时,可利用加碘液后看溶液是否变蓝以及蓝色深浅来判断淀粉是否水解,从而了解淀粉酶的活性;
用过氧化氢酶做实验时,可根据产生气泡的数量和速度或插入卫生香,观察复燃所需时间来判断酶的活性。
方 法 步 骤 取六只试管编号 1 1' 2 2' 3 3'
淀粉溶液 2ml 2ml 2ml
淀粉酶溶液 1ml 1ml 1ml
温度处理5min 100℃ 60℃ 0℃ 混合后保温 将同一温度内的两物质混合,保温5min 滴加碘液 1滴 1滴 1滴 结果 现象 结论 变蓝
不变蓝
变蓝
酶的催化作用需要在合适的温度下进行,温度过高或过低都会影响酶的活性。
1.操作时将底物和酶先混合再保温,还是先保温再混合?为什么?
2. 能否选择斐林试剂作为检测材料?
3.如何进一步探究淀粉酶的最适温度?
先保温再混合。
缩小温度梯度(梯度要均匀),重复进行上述实验。
探究温度对酶活性的影响
探究·实践
不能,斐林试剂需水浴加热,而本实验需严格控制温度
H2O2在不同温度下分解速率不同,高温下自身分解。
酶具有高效性,若酶和底物没有在对应温度混合,一混合就已发生反应,降低了实验的说服力。
二、酶的特性
温度对酶活性的影响
B
C
A
(1)在一定温度范围内,酶促反应速率随温度的升高而_______,但当温度升高到一定限度时,酶促反应速率不仅不再加快反而随着温度的升高而________。
(2)在一定条件下,酶活性最大时的温度称为该酶的_________。
(3)低温影响酶的活性,但不会使酶的_________遭到破坏,温度升高后,酶________恢复活性。但高温会导致酶_________,酶会_______活性。
升高
降低
最适温度
空间结构
能够
变性
失去
低温保存酶等蛋白质制品
二、酶的特性
探究·实践
探究pH对酶活性的影响
选择淀粉酶还是H2O2酶作实验材料?为什么选择这种酶?
2. 本实验的自变量是什么?需要设计几组实验?设定几个pH?
3. 本实验的因变量是什么?怎样检测因变量?
设计实验
H2O2酶;因为淀粉在酸性条件下也会分解,影响实验观察效果
pH;三组;酸性、中性和碱性
酶的活性;看气泡产生多少或卫生香复燃程度
二、酶的特性
探究·实践
探究pH对酶活性的影响
步骤 试管1 试管2 试管3
1 加入2ml H2O2溶液 2 1ml pH=7的缓冲液 1ml 盐酸溶液 1ml NaOH溶液
3 加入2滴肝脏研磨液 4 观察气泡生成速率,或插入卫生香,观察复燃所需时间 实验现象 有大量气泡产生/迅速复燃 基本无气泡产生/不复燃 基本无气泡/不复燃
实验结论 酶的催化作用需要适宜的pH,pH偏低或偏高都会影响酶的活性
必须先调pH,然后再将反应物与酶混合。否则反应物会在未调节好pH的情况下就在酶的作用下发生反应,影响实验的准确性。
本实验中,能否将底物和酶混合均匀后,再在不同pH下处理?
二、酶的特性
PH对酶活性的影响
υ/mmol. s-1
最适pH
0
pH
酶活性受pH影响示意图
(1)在一定条件下,酶活性最大时的pH值称为该酶的________。偏离该pH,不论升高还是降低,酶促反应速率都会________。
(2)过酸,过碱都会使酶的_________遭到破坏,使酶___________。
最适pH
降低
空间结构
永久失活
为什么多酶片的说明书中包括“本品在酸性条件下易破坏,故服用时切勿嚼碎”的提示内容
酶的名称 最适pH
动物体内酶 6.5-8.0
植物体内酶 4.5-6.5
胰蛋白酶 8.0-9.0
胃蛋白酶 1.5-2.2
糖衣(主要成分是蔗糖,在酸性条件下溶解,具防潮、隔绝空气、掩盖药物不良气味作用)
胃蛋白酶(胃部唯一的蛋白质,在PH1.5-5.0条件下,可将蛋白质分解为肽、部分氨基酸)
胰酶(主要是胰蛋白酶、胰淀粉酶、和胰脂肪酶,在中性或弱碱性条件下活性较强)
肠溶衣(主要成分为丙烯酸树脂,在37℃人工胃液中2h以内不溶解、在人工肠液中1h内溶解)
问题四、多酶片的结构特点和作用原理是什么
高温
强酸
强碱
酶
酶
失活
单击添加标题
低温保存
酶
酶
抑制酶活性
二、酶的特性
酶具有专一性
课堂小结
比较过氧化氢在不同条件下的分解
淀粉酶对淀粉和蔗糖的水解作用
影响酶活性的条件
2.酶具有高效性
1.酶具有专一性
3.酶的作用条件较温和
酶的特性
每一种酶只能催化一种或一类化学反应
酶的催化效率一般是无机催化剂的107~1013倍。
强酸、强碱、高温会使酶失活,低温抑制酶的活性
酶为生活添姿彩
酶的应用
脂肪酶
含酶牙膏
多酶片
胰蛋白酶
加酶洗衣粉
果胶酶
溶菌酶
青霉素酰化酶
P85页拓展2:下图表示的是在最适温度下,反应物浓度对酶所催化的化学反应速率的影响。:(1)请解释在A、B、C三点时该化学反应的状况。
(2)如果在A点时温度升高10℃,曲线会发生什么变化?为什么?请画出变化后的曲线。
(3)如果在B点时往反应混合物中加入少量同样的酶,曲线会发生什么变化?为什么?请画出相应的曲线。
A点反应速率随反应物浓度增大而升高.B点反应速率在此时达到最高。C点反应速率不再随反应物浓度增大而升高,维持在相对稳定的水平。
(2)原因:原曲线表示最适温度下的酶促反应速率随底物浓度的变化。温度高于或低于最适温度,反应速率都会下降。
(3)该曲线表示,B点的反应底物的浓度足够大,是酶的数量限制了反应速率的提高,这时加入少量的酶,会使反应速率加快。
A
B
C
反应速度
反应物浓度
B
C
C
1.抑制剂
抑制剂与底物竞争酶。
如图,抑制剂的结构与酶的活性中心相似,当抑制抑制与酶结合时,就阻止了底物与酶结合,如果底物与酶结合也会阻止抑制与酶结构。
①竞争性抑制剂
由于竞争性抑制剂与底物竞争酶,因此,增大底物浓度,就是使抑制剂与酶结合的减少,从而减小抑制作用。因此,竞争性抑制剂的抑制作用可以通过增大底物的浓度来抵消其抑制作用。
②非竞争性抑制剂
抑制剂改变酶的结构,使之无法与原底物结合
同课章节目录
- 第1章 走近细胞
- 第1节 细胞是生命活动的基本单位
- 第2节 细胞的多样性和统一性
- 第2章 组成细胞的分子
- 第1节 细胞中的元素和化合物
- 第2节 细胞中的无机物
- 第3节 细胞中的糖类和脂质
- 第4节 蛋白质是生命活动的主要承担者
- 第5节 核酸是遗传信息的携带者
- 第3章 细胞的基本结构
- 第1节 细胞膜的结构和功能
- 第2节 细胞器之间的分工合作
- 第3节 细胞核的结构和功能
- 第4章 细胞的物质输入和输出
- 第1节 被动运输
- 第2节 主动运输与胞吞、胞吐
- 第5章 细胞的能量供应和利用
- 第1节 降低化学反应活化能的酶
- 第2节 细胞的能量“货币”ATP
- 第3节 细胞呼吸的原理和应用
- 第4节 光合作用与能量转化
- 第6章 细胞的生命历程
- 第1节 细胞的增殖
- 第2节 细胞的分化
- 第3节 细胞的衰老和死亡
