湖南省邵阳市第二中学2023-2024学年高三下学期2月入学考试化学试题(PDF版含答案)
文档属性
| 名称 | 湖南省邵阳市第二中学2023-2024学年高三下学期2月入学考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 780.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-24 12:12:45 | ||
图片预览


文档简介
邵阳市二中 2024 年高三入学考试
化 学
可能用到的相对原子量:H:1 N:14 O:16 S:32 Hg:201
一、选择题(本题共 14 小题,每小题 3 分,共 42 分。每小题只有一项是符合题目要求的。)
1.化学与生产生活、社会发展息息相关,下列说法不正确的是
A.铬是硬度最高的金属,常添加在不锈钢中以增强其耐腐蚀性
B.飞船返回舱表层材料中的玻璃纤维属于天然有机高分子
C.卡塔尔光伏电站实现了将光能转化为电能,用到的材料主要为硅单质
D.在合金中加入适量稀土金属可改善合金的性能,因而稀土元素又被称为“冶金工
业的维生素”
2.下列化学用语表达正确的是
A.CH3CH(CH3 )CH2COOH用系统命名法命名为 3 甲基丁酸
B.空间填充模型 既可以表示甲烷分子,也可以表示四氯化碳分子
C.CH3OH分子中,碳原子与氧原子之间形成的共价键类型为 sp3 p 键
D.基态铍原子最外层电子的电子云轮廓图:
3.M、T、X、Y、Z为原子序数依次增加的短周期元素,其中M为周期表中原子半径
最小的元素,T、X为同一周期且相邻,XM3的空间构型为三角锥形,Y是地壳中含量
第三的元素,Z是同周期元素中原子半径最小的元素。下列说法正确的是
A.粒子键角:TM4> XM+4 B.电负性:MC.XZ3和 YZ3中 Z的化合价相同 D.XM4Z和 YZ3形成的晶体类型相同
4.下列过程中的化学反应,相应的离子方程式书写正确的是
A .用 Cl2制备漂白粉:Cl2 2OH Cl ClO H2O
B.向 FeSO4溶液中加入 NH4HCO3溶液制备FeCO3:
Fe2 2HCO 3 FeCO 3 CO 2 H 2O
C 2 .向氨水中滴加少量 CuSO4溶液:Cu 2NH3 H2O=Cu(OH)2 2NH4
D.向酸性 K2Cr2O7溶液中滴入C2H5OH:
2Cr O2 C H 3 2 7 2 5OH 16H 4Cr 2CO2 11H2O
试卷第 1页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
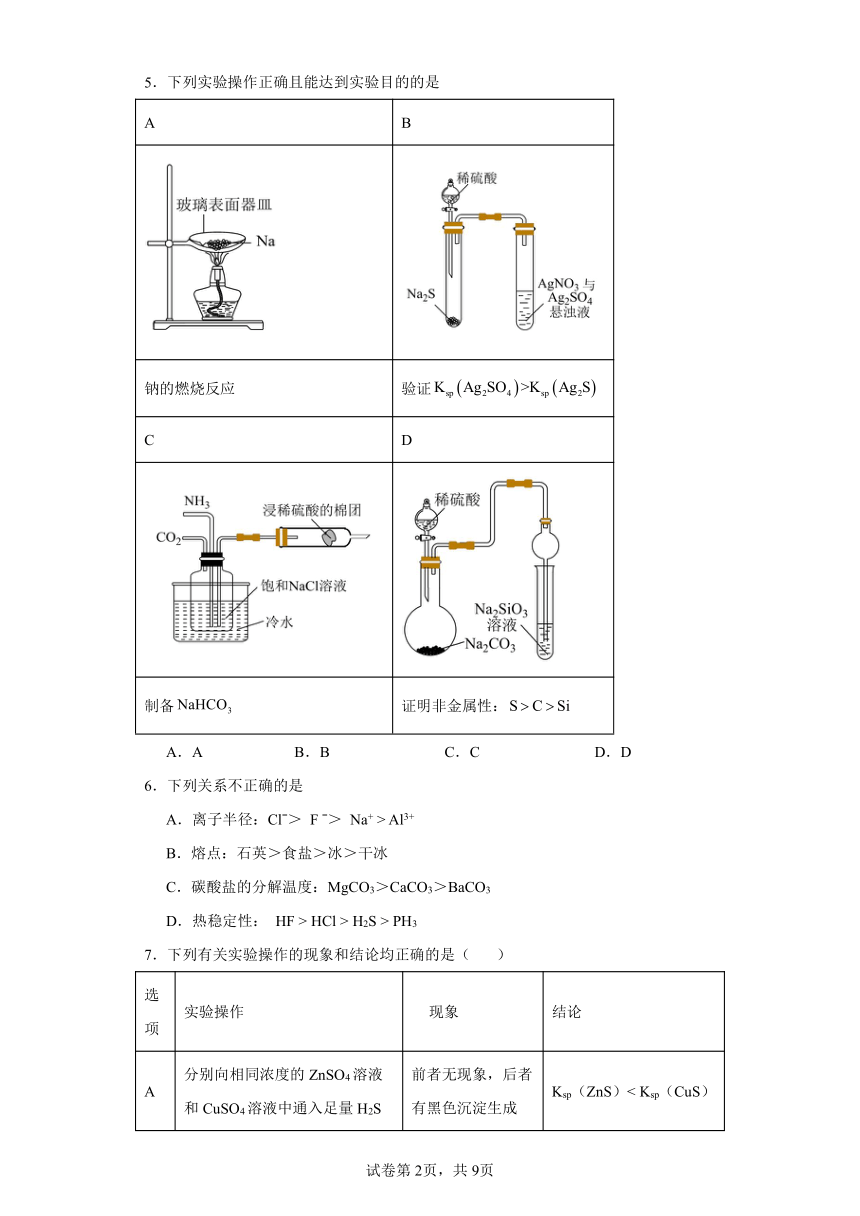
5.下列实验操作正确且能达到实验目的的是
A B
钠的燃烧反应 验证Ksp Ag2SO4 >Ksp Ag2S
C D
制备NaHCO3 证明非金属性:S C Si
A.A B.B C.C D.D
6.下列关系不正确的是
A.离子半径:Clˉ> F ˉ> Na+ > Al3+
B.熔点:石英>食盐>冰>干冰
C.碳酸盐的分解温度:MgCO3>CaCO3>BaCO3
D.热稳定性: HF > HCl > H2S > PH3
7.下列有关实验操作的现象和结论均正确的是( )
选
实验操作 现象 结论
项
分别向相同浓度的 ZnSO4溶液 前者无现象,后者
A Ksp(ZnS)< Ksp(CuS)
和 CuSO4溶液中通入足量 H2S 有黑色沉淀生成
试卷第 2页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
常温下,分别测等浓度的 NaX
B 前者 pH小于后者 酸性:HX >H2CO3
溶液和 Na2CO3溶液的 pH
溶液变蓝,有黑色
C 将铜粉加入 FeCl3溶液中 金属铁比铜活泼
固体出现
将表面附有黑色的 Ag2S银器浸 银器为正极,Ag2S得
D 黑色逐渐褪去
入盛有食盐水的铝质容器中 电子生成单质银
A.A B.B C.C D.D
8.联氨(NH2-NH2)是一种绿色无污染的还原剂,NH2-NH2分子可能有以下两种不同的构
象,沿 N-N键轴方向的投影如图所示。下列说法错误的是
A.NH2-NH2中 N原子杂化方式为 sp3
B.实验测得 NH2-NH2分子的极性很大,则其结构为构象 b
C.NH2-NH2的沸点高于 CH3-CH3的沸点
D.NH2-NH2中的键角∠N-N-H小于 H2O2中的键角∠O-O-H
9.葫芦脲是超分子领域近年来发展迅速的环状分子之一,具有疏水的纳米空腔,其结
构如图所示。对位取代的苯的衍生物恰好可以进入葫芦[6]脲的空腔。下列叙述正确的是
A.葫芦[6]脲是超分子且能发生丁达尔效应
B.葫芦[6]脲中 C N C键角为109 28
C.可装入对甲基苯甲酸体现了超分子的“分子识别”功能
D.葫芦[6]脲形成的超分子中分子间存在范德华力、氢键、共价键等作用
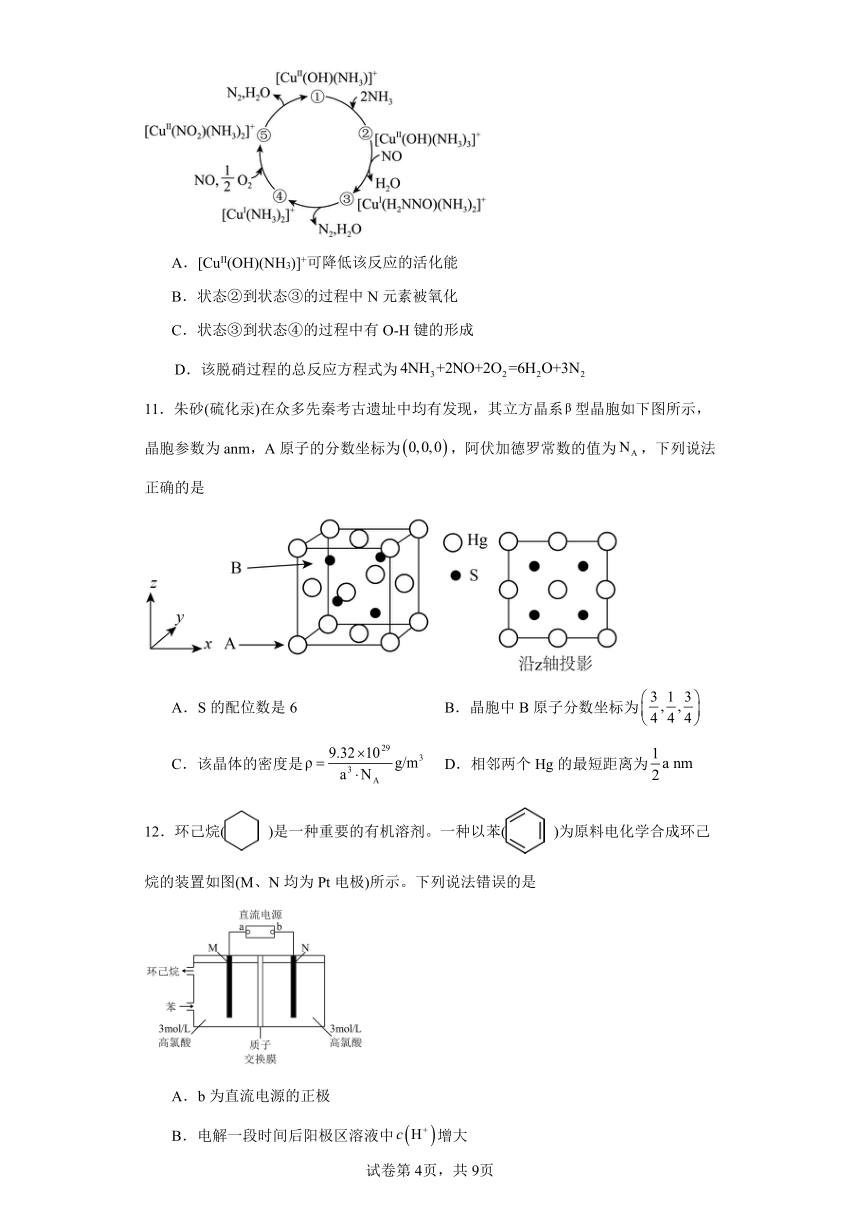
10.某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图所
示,下列说法错误的是
试卷第 3页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
A.[CuII(OH)(NH3)]+可降低该反应的活化能
B.状态②到状态③的过程中 N元素被氧化
C.状态③到状态④的过程中有 O-H键的形成
D.该脱硝过程的总反应方程式为 4NH3+2NO+2O2=6H2O+3N2
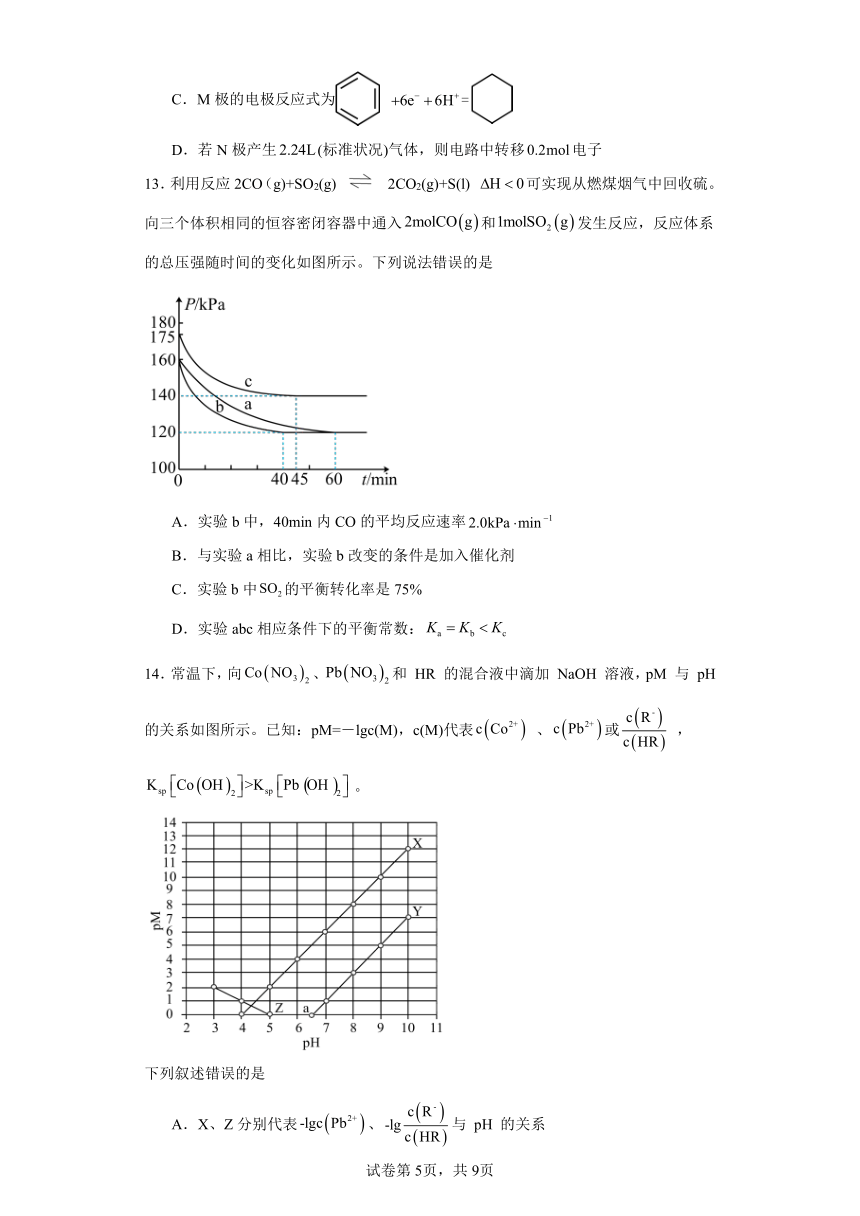
11.朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系β型晶胞如下图所示,
晶胞参数为 anm,A原子的分数坐标为 0,0,0 ,阿伏加德罗常数的值为NA ,下列说法
正确的是
3 1 3
A.S的配位数是 6 B.晶胞中 B原子分数坐标为 , ,
4 4 4
9.32 1029 1
C 3.该晶体的密度是ρ 3 g/m D.相邻两个 Hg的最短距离为 a nma NA 2
12.环己烷( )是一种重要的有机溶剂。一种以苯( )为原料电化学合成环己
烷的装置如图(M、N均为 Pt电极)所示。下列说法错误的是
A.b为直流电源的正极
B .电解一段时间后阳极区溶液中 c H 增大
试卷第 4页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
C.M极的电极反应式为 6e 6H =
D.若 N极产生 2.24L (标准状况)气体,则电路中转移0.2mol电子
13.利用反应 2CO(g)+SO2(g) 2CO2(g)+S(l) H 0可实现从燃煤烟气中回收硫。
向三个体积相同的恒容密闭容器中通入 2molCO g 和1molSO2 g 发生反应,反应体系
的总压强随时间的变化如图所示。下列说法错误的是
A.实验 b中,40min 内 CO的平均反应速率 2.0kPa min 1
B.与实验 a相比,实验 b改变的条件是加入催化剂
C.实验 b中SO2的平衡转化率是 75%
D.实验 abc相应条件下的平衡常数: Ka Kb Kc
14.常温下,向Co NO3 Pb NO2、 3 2和 HR 的混合液中滴加 NaOH 溶液,pM 与 pH
c R -
的关系如图所示。已知:pM=-lgc(M),c(M)代表 c Co2+ 、 c Pb2+ 或 ,
c HR
Ksp Co OH 2 >Ksp Pb OH 2 。
下列叙述错误的是
c R -
A.X、Z 2+分别代表 -lgc Pb 、 -lg 与 pH 的关系
c HR
试卷第 5页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
B 5.常温下,弱酸 HR 的电离常数Ka=1 10
C.图中 a 点对应的 pH 为 6.5
D.常温下,Co OH 和Pb OH 共存时: c Pb2 :c Co2 =105:12 2
二、非选择题(本题共 4 小题,共 58 分)
15.(14分)肼(N2H4 )可作火箭发射的燃料。某实验兴趣小组利用氨与次氯酸钠反应制
备N2H4,并探究N2H4的性质,其制备装置如图所示。
回答下列问题:
(1)仪器 b的名称为 ,仪器 a的作用是 。
(2)装置 A试管中发生反应的化学方程式为 。
(3)上述装置 B、C间缺少一个装置,可能导致的结果是 。
(4)探究N2H4的性质。将制得的N2H4分离提纯后,进行如下实验。
[查阅资料]AgOH不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
[提出假设]黑色固体可能是 Ag、Ag2O中的一种或两种。
[实验验证]设计如下方案,进行实验。
操作 现象 结论
ⅰ.取少量黑色固体于试管中,加入足量 黑色固体
黑色固体中有Ag2O
① ,振荡 部分溶解
ⅱ.取少量黑色固体于试管中,加入足量 黑色固体是 Ag和Ag2O,则肼
②
稀硝酸,振荡 具有的性质是碱性和③
试卷第 6页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
(5)实验制得的肼往往以N2H4 H2O的形式存在于溶液中,其原因是 。
(6)肼又称联氨,是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。
理论上 1kg 联氨可除去水中溶解的O2的质量为 kg。
16.(15分)活性氧化锰(Mn3O4 )和硫酸铅(PbSO4 )均为重要的电极材料,利用下列流
程可实现二者的联合生产。回答下列问题:
已知:软锰矿的主要成分为MnO2,铅闪矿的主要成分是 PbS和铁的硫化物。
(1)为了提高“热浸出”的速率,除了升温、搅拌、粉碎之外,还可采用 ,“热
浸出”时温度不超过 80℃,其主要原因是 。
(2)PbCl2在冷水中溶解度不大,易沉积在矿石表面阻碍矿石的溶解,为了避免此种情况
的出现,生产过程的“热浸出”步骤中采用了两种措施:
①采用“热浸出”,增大PbCl2的溶解度;
②加入 NaCl,将PbCl2转化为可溶的Na2PbCl4。
[PbCl2 (s) 2Cl
(aq) PbCl2 4 (aq) H 0 ]。
写出“热浸出”步骤中 PbS 转化为PbCl2的化学方程式 ,“分铅”步骤中有利于
从溶液中析出PbCl2的措施有 、 (从平衡移动角度作答)。
(3)“除杂”步骤中加入MnCO3的作用是 。
(4)“沉锰”步骤需要在加热条件下进行,写出反应的离子方程式 。
(5)“ 2 转化”步骤完成后溶液中的SO 浓度为1 10 54 mol / L,则此时溶液中的Cl 浓度为
mol/L。(已知:PbCl2、PbSO4的溶度积分别为1.6 10 5、1.6 10 8 )
17.(14分)能源的合理开发和利用,低碳减排是人类正在努力解决的大问题。2023年
2月 21日,中国气候变化特使谢振华获得首届诺贝尔可持续发展特别贡献奖,以表彰
试卷第 7页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
他在全球生态保护中做出的贡献。
(1)在 298K、100kPa 时,已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ mol-1;
H 12(g)+ 2 O2(g)=H2O(l) △H2=-285.8kJ mol
-1;
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599.0kJ mol-1。
298K时,写出 1molC(s,石墨)和 H2(g)反应生成 C2H2(g)的热化学方程式: 。
(2)在固相催化剂作用下 CO2加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H1=-156.9kJ mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ mol-1
工业合成甲烷通常控制温度为 500℃左右,其主要原因为 。
(3)向密闭容器中充入一定量的 CH4(g)和 NO(g),保持总压为 100kPa,发生反应:
n(NO)
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H<0。当 n(CH ) =1时,NO的平衡转化4
1 n(NO)
率~ ;T2时 NO平衡转化率~ n(CH ) 的关系如图:T 4
①能表示此反应已经达到平衡的是 (填字母)。
A.气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
n(NO)
C. n(N ) 不再变化2
n(NO)
②表示 T2时 NO平衡转化率~ n(CH ) 的关系是 (填“I”或“Ⅱ”),T1 T2(填“>”4
或“<”)。
n(NO)
③当 n(CH ) =1、T3时,CH4的平衡分压为 kPa。已知:该反应的标准平衡常数4
p(CO2) [ p(N 2) ]2 p(H O)θ θ [
2 2
θ ]
Kθ
p p p
= θ
[p(NO) ]4 p(CH )
,其中 p =100kPa,p(CH4)、p(NO)、p(CO2)、p(N2)
θ
4
p p θ
试卷第 8页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
和 p(H2O)为各组分的平衡分压,则该温度下 Kθ= (分压=总压×物质的量分数)。
(4)工业上利用废气中的 CO2、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知 B中
的电解装置使用了阳离子交换膜。
B中发生的总反应离子方程式为 。
18.(15分)有机物 G 是一种合成药物的重要中间体,其合成路线如图所示:回答下
列问题:
(1)有机物 A 的名称为 。
(2)B→C 的化学方程式为 ,D 中含氧官能团的名称为 。
(3)C→D 的过程为先发生 反应,再发生水解反应,最后发生消去反应,写出消
去过程中另一种有机副产物的结构简式: 。
(4)有机物 H 是 F 与足量氢气加成反应的产物,H 中含有 个手性碳原子
(手性碳指:连有四个不同的基团的碳原子)。
(5)化合物 C 的同分异构体中,写出同时满足下列条件的结构简式 (写三种)。
①能与 NaHCO3溶液发生反应产生 CO2;
②既能发生银镜反应,又能发生水解反应且水解产物酸化后可使 FeCl3 溶液显紫色;
③核磁共振氢谱有 6 组峰,且峰面积之比为 6:2:2:2:1:1。
(6)请参照上述合成信息,以苯、 及 CH3MgBr为原料设计 的合成路线
(要求:不超过 3 步,无机试剂任选)
试卷第 9页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
邵阳市二中2024年高三入学考试
化学参考答案:
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一项是符合题目要
求的。)
1.B
2.A
3.B
【分析】已知X、Y、Z、W为原子序数依次增大的短周期主族元素,M为周期表中原
子半径最小的元素,可知,M为H,Y是地壳中含量第三的元素可知Y为Al,T、X为同
一周期且相邻,XM3的空间构型为三角锥形,可知X为N,T为C,Z是同周期元素中原
子半径最小的元素可知Z为Cl。即:M为H,T为C,X为N,Y为Al,Z是Cl;
4.B
【详解】A.用Cl2制备漂白粉时是Cl2与冷的石灰乳反应,离子方程式为,A错误;
B.向FeSO4溶液中加入NH4HCO3溶液制备:,B正确;
C.向氨水中滴加少量CuSO4溶液,会溶于过量的氨水生成,离子方程式为,C错误
;
D.酸性K2Cr2O7溶液中滴入,酒精被氧化为醋酸,离子方程式为,D错误。
5.D
6.C
【详解】A.离子电子层数越多,半径越大;具有相同核外电子排布的离子,原子
序数越大半径越小,Clˉ>Fˉ>Na+>Al3+,A正确;
B.一般情况下,熔点:原子晶体>离子晶体>分子晶体,石英为原子晶体,食盐为
离子晶体,冰和干冰为分子晶体,且水含有氢键,则熔点:石英>食盐>冰>干冰
,B正确;
C.MgCO3、CaCO3、BaCO3均为离子晶体,晶格能与离子半径有关,半径越小,晶格
能越大,晶体的分解温度越低,碳酸盐的分解温度:MgCO3D.非金属性越强,其气态氢化物的稳定性越强,热稳定性:HF>HCI>H2S>PH3,D正
确;
答案为C;
7.D
【详解】A.ZnSO4无现象,CuSO4生成黑色沉淀, ZnS的溶解度比CuS的大,因两者
是相同类型的沉淀,则证明Ksp(CuS)< Ksp(ZnS),A项错误;
B.测定盐溶液的pH,可比较HX、碳酸氢根离子的酸性,不能比较HX与碳酸的酸性
,B项错误;
C.铁离子具有强氧化性,Cu加入到铁离子中,生成亚铁离子和铜离子,不会有固
体产生,C项错误;
D.铝比银活泼,将银器放入铝容器中,会形成原电池,活泼的铝做负极,失去电
子,不活泼的氧化银做正极,得到电子,所以银器做正极,硫化银得电子,生成银
单质,黑色会褪去,D项正确;
8.D
D.两种分子中,N和O均为sp3杂化,而NH2-NH2中N原子的孤电子对数为1,而H2O2
中O原子的孤电子对数为2,孤电子对数越多,对成键电子对的斥力越大,键角越小
,D错误;
9.C
10.D
B.状态②到③的过程中,Cu和N的化合价发生变化,Cu得电子化合价降低,N失电
子被氧化,B正确;D.从图中可知,该反应的总反应方程式为4NH3+4NO+O2=6H2O+
4N2,D错误;
11.C
12.D
13.D
【详解】A.反应时混合气体减小的物质的量相同于消耗SO2的物质的量,根据压强
之比等于物质的量之比,实验b中, 40min内体系压强减小了,相当于二氧化硫的
分压强减小了40kPa,则CO的分压强减小了80kPa,故CO的平均反应速率为,A正确
;
B.根据分析知实验b改变的条件是加入催化剂,B正确;
C.设达到平衡状态时,SO2消耗了,列三段式得:
40min达到平衡,此时压强为120kPa,根据压强之比等于物质的量之比,得:,解
得,故二氧化硫的转化率为,C正确;
D.平衡常数只受温度影响,根据分析知实验a、b反应温度相同,则。反应,说明
该反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,实验c 温度比实验
a、b高,则,D错误;
故选D。
14.D
D.常温下,和共存时:,D错误;
{#{QQABaYgAogCAQBAAAQgCEwFqC二gEQk、BEAA非IoGg选AAAo择AAB题CBFA(BAA=本}#} 题共4小题,共58分)
15.(14分)(1) 恒压滴液漏斗(1分) 导气和防倒吸(1分)
(2)(2分)
(3)肼的产率降低(2分)
(4) 氨水 (1分) 黑色固体全部溶解,产生无色气体,无色气体迅速变为
红棕色 (2分) 还原性(1分)
(5)能与形成氢键(2分) (6)1(2分)
16.(15分)(1) 提高盐酸的浓度 (1分) 温度太高会导致盐酸大量挥发
,导致浸出率降低(2分)
(2) (2分) 降温 (2分) 稀释(2分)
(3)调节溶液pH,除去溶液中的(2分)
(4)(2分)
(5)0.1(2分)
17.(14分)(1)C(s,石墨)+H2(g)=C2H2(g) △H=+113.35kJ mol-1(2分)
(2)温度低于500℃,反应速率低;温度高于500℃,对副反应影响较大,化学平衡
向生成CO的方向移动程度增大,不利于甲烷的生成(2分)
(3) C(2分) II (1分) > (1分) 40 (2分) 4(2分)
(4)2H2O+2Cl-H2↑+2OH-+Cl2↑(2分)(条件写电解给分)
18.(15分)(1)2-甲基苯酚(或邻甲基苯酚)(1分)
(2) + (2分) 醚键和羧基(1分)
(3) 加成 (1分) (2分)
(4)6(2分)
(5)、、、(写三种,写对一个一分,写错一个0分)(3分)
(6)(3分)
化 学
可能用到的相对原子量:H:1 N:14 O:16 S:32 Hg:201
一、选择题(本题共 14 小题,每小题 3 分,共 42 分。每小题只有一项是符合题目要求的。)
1.化学与生产生活、社会发展息息相关,下列说法不正确的是
A.铬是硬度最高的金属,常添加在不锈钢中以增强其耐腐蚀性
B.飞船返回舱表层材料中的玻璃纤维属于天然有机高分子
C.卡塔尔光伏电站实现了将光能转化为电能,用到的材料主要为硅单质
D.在合金中加入适量稀土金属可改善合金的性能,因而稀土元素又被称为“冶金工
业的维生素”
2.下列化学用语表达正确的是
A.CH3CH(CH3 )CH2COOH用系统命名法命名为 3 甲基丁酸
B.空间填充模型 既可以表示甲烷分子,也可以表示四氯化碳分子
C.CH3OH分子中,碳原子与氧原子之间形成的共价键类型为 sp3 p 键
D.基态铍原子最外层电子的电子云轮廓图:
3.M、T、X、Y、Z为原子序数依次增加的短周期元素,其中M为周期表中原子半径
最小的元素,T、X为同一周期且相邻,XM3的空间构型为三角锥形,Y是地壳中含量
第三的元素,Z是同周期元素中原子半径最小的元素。下列说法正确的是
A.粒子键角:TM4> XM+4 B.电负性:M
4.下列过程中的化学反应,相应的离子方程式书写正确的是
A .用 Cl2制备漂白粉:Cl2 2OH Cl ClO H2O
B.向 FeSO4溶液中加入 NH4HCO3溶液制备FeCO3:
Fe2 2HCO 3 FeCO 3 CO 2 H 2O
C 2 .向氨水中滴加少量 CuSO4溶液:Cu 2NH3 H2O=Cu(OH)2 2NH4
D.向酸性 K2Cr2O7溶液中滴入C2H5OH:
2Cr O2 C H 3 2 7 2 5OH 16H 4Cr 2CO2 11H2O
试卷第 1页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
5.下列实验操作正确且能达到实验目的的是
A B
钠的燃烧反应 验证Ksp Ag2SO4 >Ksp Ag2S
C D
制备NaHCO3 证明非金属性:S C Si
A.A B.B C.C D.D
6.下列关系不正确的是
A.离子半径:Clˉ> F ˉ> Na+ > Al3+
B.熔点:石英>食盐>冰>干冰
C.碳酸盐的分解温度:MgCO3>CaCO3>BaCO3
D.热稳定性: HF > HCl > H2S > PH3
7.下列有关实验操作的现象和结论均正确的是( )
选
实验操作 现象 结论
项
分别向相同浓度的 ZnSO4溶液 前者无现象,后者
A Ksp(ZnS)< Ksp(CuS)
和 CuSO4溶液中通入足量 H2S 有黑色沉淀生成
试卷第 2页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
常温下,分别测等浓度的 NaX
B 前者 pH小于后者 酸性:HX >H2CO3
溶液和 Na2CO3溶液的 pH
溶液变蓝,有黑色
C 将铜粉加入 FeCl3溶液中 金属铁比铜活泼
固体出现
将表面附有黑色的 Ag2S银器浸 银器为正极,Ag2S得
D 黑色逐渐褪去
入盛有食盐水的铝质容器中 电子生成单质银
A.A B.B C.C D.D
8.联氨(NH2-NH2)是一种绿色无污染的还原剂,NH2-NH2分子可能有以下两种不同的构
象,沿 N-N键轴方向的投影如图所示。下列说法错误的是
A.NH2-NH2中 N原子杂化方式为 sp3
B.实验测得 NH2-NH2分子的极性很大,则其结构为构象 b
C.NH2-NH2的沸点高于 CH3-CH3的沸点
D.NH2-NH2中的键角∠N-N-H小于 H2O2中的键角∠O-O-H
9.葫芦脲是超分子领域近年来发展迅速的环状分子之一,具有疏水的纳米空腔,其结
构如图所示。对位取代的苯的衍生物恰好可以进入葫芦[6]脲的空腔。下列叙述正确的是
A.葫芦[6]脲是超分子且能发生丁达尔效应
B.葫芦[6]脲中 C N C键角为109 28
C.可装入对甲基苯甲酸体现了超分子的“分子识别”功能
D.葫芦[6]脲形成的超分子中分子间存在范德华力、氢键、共价键等作用
10.某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图所
示,下列说法错误的是
试卷第 3页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
A.[CuII(OH)(NH3)]+可降低该反应的活化能
B.状态②到状态③的过程中 N元素被氧化
C.状态③到状态④的过程中有 O-H键的形成
D.该脱硝过程的总反应方程式为 4NH3+2NO+2O2=6H2O+3N2
11.朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系β型晶胞如下图所示,
晶胞参数为 anm,A原子的分数坐标为 0,0,0 ,阿伏加德罗常数的值为NA ,下列说法
正确的是
3 1 3
A.S的配位数是 6 B.晶胞中 B原子分数坐标为 , ,
4 4 4
9.32 1029 1
C 3.该晶体的密度是ρ 3 g/m D.相邻两个 Hg的最短距离为 a nma NA 2
12.环己烷( )是一种重要的有机溶剂。一种以苯( )为原料电化学合成环己
烷的装置如图(M、N均为 Pt电极)所示。下列说法错误的是
A.b为直流电源的正极
B .电解一段时间后阳极区溶液中 c H 增大
试卷第 4页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
C.M极的电极反应式为 6e 6H =
D.若 N极产生 2.24L (标准状况)气体,则电路中转移0.2mol电子
13.利用反应 2CO(g)+SO2(g) 2CO2(g)+S(l) H 0可实现从燃煤烟气中回收硫。
向三个体积相同的恒容密闭容器中通入 2molCO g 和1molSO2 g 发生反应,反应体系
的总压强随时间的变化如图所示。下列说法错误的是
A.实验 b中,40min 内 CO的平均反应速率 2.0kPa min 1
B.与实验 a相比,实验 b改变的条件是加入催化剂
C.实验 b中SO2的平衡转化率是 75%
D.实验 abc相应条件下的平衡常数: Ka Kb Kc
14.常温下,向Co NO3 Pb NO2、 3 2和 HR 的混合液中滴加 NaOH 溶液,pM 与 pH
c R -
的关系如图所示。已知:pM=-lgc(M),c(M)代表 c Co2+ 、 c Pb2+ 或 ,
c HR
Ksp Co OH 2 >Ksp Pb OH 2 。
下列叙述错误的是
c R -
A.X、Z 2+分别代表 -lgc Pb 、 -lg 与 pH 的关系
c HR
试卷第 5页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
B 5.常温下,弱酸 HR 的电离常数Ka=1 10
C.图中 a 点对应的 pH 为 6.5
D.常温下,Co OH 和Pb OH 共存时: c Pb2 :c Co2 =105:12 2
二、非选择题(本题共 4 小题,共 58 分)
15.(14分)肼(N2H4 )可作火箭发射的燃料。某实验兴趣小组利用氨与次氯酸钠反应制
备N2H4,并探究N2H4的性质,其制备装置如图所示。
回答下列问题:
(1)仪器 b的名称为 ,仪器 a的作用是 。
(2)装置 A试管中发生反应的化学方程式为 。
(3)上述装置 B、C间缺少一个装置,可能导致的结果是 。
(4)探究N2H4的性质。将制得的N2H4分离提纯后,进行如下实验。
[查阅资料]AgOH不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
[提出假设]黑色固体可能是 Ag、Ag2O中的一种或两种。
[实验验证]设计如下方案,进行实验。
操作 现象 结论
ⅰ.取少量黑色固体于试管中,加入足量 黑色固体
黑色固体中有Ag2O
① ,振荡 部分溶解
ⅱ.取少量黑色固体于试管中,加入足量 黑色固体是 Ag和Ag2O,则肼
②
稀硝酸,振荡 具有的性质是碱性和③
试卷第 6页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
(5)实验制得的肼往往以N2H4 H2O的形式存在于溶液中,其原因是 。
(6)肼又称联氨,是一种常用的还原剂,可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。
理论上 1kg 联氨可除去水中溶解的O2的质量为 kg。
16.(15分)活性氧化锰(Mn3O4 )和硫酸铅(PbSO4 )均为重要的电极材料,利用下列流
程可实现二者的联合生产。回答下列问题:
已知:软锰矿的主要成分为MnO2,铅闪矿的主要成分是 PbS和铁的硫化物。
(1)为了提高“热浸出”的速率,除了升温、搅拌、粉碎之外,还可采用 ,“热
浸出”时温度不超过 80℃,其主要原因是 。
(2)PbCl2在冷水中溶解度不大,易沉积在矿石表面阻碍矿石的溶解,为了避免此种情况
的出现,生产过程的“热浸出”步骤中采用了两种措施:
①采用“热浸出”,增大PbCl2的溶解度;
②加入 NaCl,将PbCl2转化为可溶的Na2PbCl4。
[PbCl2 (s) 2Cl
(aq) PbCl2 4 (aq) H 0 ]。
写出“热浸出”步骤中 PbS 转化为PbCl2的化学方程式 ,“分铅”步骤中有利于
从溶液中析出PbCl2的措施有 、 (从平衡移动角度作答)。
(3)“除杂”步骤中加入MnCO3的作用是 。
(4)“沉锰”步骤需要在加热条件下进行,写出反应的离子方程式 。
(5)“ 2 转化”步骤完成后溶液中的SO 浓度为1 10 54 mol / L,则此时溶液中的Cl 浓度为
mol/L。(已知:PbCl2、PbSO4的溶度积分别为1.6 10 5、1.6 10 8 )
17.(14分)能源的合理开发和利用,低碳减排是人类正在努力解决的大问题。2023年
2月 21日,中国气候变化特使谢振华获得首届诺贝尔可持续发展特别贡献奖,以表彰
试卷第 7页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
他在全球生态保护中做出的贡献。
(1)在 298K、100kPa 时,已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ mol-1;
H 12(g)+ 2 O2(g)=H2O(l) △H2=-285.8kJ mol
-1;
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599.0kJ mol-1。
298K时,写出 1molC(s,石墨)和 H2(g)反应生成 C2H2(g)的热化学方程式: 。
(2)在固相催化剂作用下 CO2加氢合成甲烷过程中发生以下两个反应:
主反应:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H1=-156.9kJ mol-1
副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ mol-1
工业合成甲烷通常控制温度为 500℃左右,其主要原因为 。
(3)向密闭容器中充入一定量的 CH4(g)和 NO(g),保持总压为 100kPa,发生反应:
n(NO)
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H<0。当 n(CH ) =1时,NO的平衡转化4
1 n(NO)
率~ ;T2时 NO平衡转化率~ n(CH ) 的关系如图:T 4
①能表示此反应已经达到平衡的是 (填字母)。
A.气体总体积保持不变
B.混合气体的平均相对分子质量保持不变
n(NO)
C. n(N ) 不再变化2
n(NO)
②表示 T2时 NO平衡转化率~ n(CH ) 的关系是 (填“I”或“Ⅱ”),T1 T2(填“>”4
或“<”)。
n(NO)
③当 n(CH ) =1、T3时,CH4的平衡分压为 kPa。已知:该反应的标准平衡常数4
p(CO2) [ p(N 2) ]2 p(H O)θ θ [
2 2
θ ]
Kθ
p p p
= θ
[p(NO) ]4 p(CH )
,其中 p =100kPa,p(CH4)、p(NO)、p(CO2)、p(N2)
θ
4
p p θ
试卷第 8页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
和 p(H2O)为各组分的平衡分压,则该温度下 Kθ= (分压=总压×物质的量分数)。
(4)工业上利用废气中的 CO2、CO联合制取烧碱、氯代烃和甲醇的流程如图。已知 B中
的电解装置使用了阳离子交换膜。
B中发生的总反应离子方程式为 。
18.(15分)有机物 G 是一种合成药物的重要中间体,其合成路线如图所示:回答下
列问题:
(1)有机物 A 的名称为 。
(2)B→C 的化学方程式为 ,D 中含氧官能团的名称为 。
(3)C→D 的过程为先发生 反应,再发生水解反应,最后发生消去反应,写出消
去过程中另一种有机副产物的结构简式: 。
(4)有机物 H 是 F 与足量氢气加成反应的产物,H 中含有 个手性碳原子
(手性碳指:连有四个不同的基团的碳原子)。
(5)化合物 C 的同分异构体中,写出同时满足下列条件的结构简式 (写三种)。
①能与 NaHCO3溶液发生反应产生 CO2;
②既能发生银镜反应,又能发生水解反应且水解产物酸化后可使 FeCl3 溶液显紫色;
③核磁共振氢谱有 6 组峰,且峰面积之比为 6:2:2:2:1:1。
(6)请参照上述合成信息,以苯、 及 CH3MgBr为原料设计 的合成路线
(要求:不超过 3 步,无机试剂任选)
试卷第 9页,共 9页
{#{QQABaYgAogCAQBAAAQgCEwFqCgEQkBEAAIoGgAAAoAABCBFABAA=}#}
邵阳市二中2024年高三入学考试
化学参考答案:
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一项是符合题目要
求的。)
1.B
2.A
3.B
【分析】已知X、Y、Z、W为原子序数依次增大的短周期主族元素,M为周期表中原
子半径最小的元素,可知,M为H,Y是地壳中含量第三的元素可知Y为Al,T、X为同
一周期且相邻,XM3的空间构型为三角锥形,可知X为N,T为C,Z是同周期元素中原
子半径最小的元素可知Z为Cl。即:M为H,T为C,X为N,Y为Al,Z是Cl;
4.B
【详解】A.用Cl2制备漂白粉时是Cl2与冷的石灰乳反应,离子方程式为,A错误;
B.向FeSO4溶液中加入NH4HCO3溶液制备:,B正确;
C.向氨水中滴加少量CuSO4溶液,会溶于过量的氨水生成,离子方程式为,C错误
;
D.酸性K2Cr2O7溶液中滴入,酒精被氧化为醋酸,离子方程式为,D错误。
5.D
6.C
【详解】A.离子电子层数越多,半径越大;具有相同核外电子排布的离子,原子
序数越大半径越小,Clˉ>Fˉ>Na+>Al3+,A正确;
B.一般情况下,熔点:原子晶体>离子晶体>分子晶体,石英为原子晶体,食盐为
离子晶体,冰和干冰为分子晶体,且水含有氢键,则熔点:石英>食盐>冰>干冰
,B正确;
C.MgCO3、CaCO3、BaCO3均为离子晶体,晶格能与离子半径有关,半径越小,晶格
能越大,晶体的分解温度越低,碳酸盐的分解温度:MgCO3
确;
答案为C;
7.D
【详解】A.ZnSO4无现象,CuSO4生成黑色沉淀, ZnS的溶解度比CuS的大,因两者
是相同类型的沉淀,则证明Ksp(CuS)< Ksp(ZnS),A项错误;
B.测定盐溶液的pH,可比较HX、碳酸氢根离子的酸性,不能比较HX与碳酸的酸性
,B项错误;
C.铁离子具有强氧化性,Cu加入到铁离子中,生成亚铁离子和铜离子,不会有固
体产生,C项错误;
D.铝比银活泼,将银器放入铝容器中,会形成原电池,活泼的铝做负极,失去电
子,不活泼的氧化银做正极,得到电子,所以银器做正极,硫化银得电子,生成银
单质,黑色会褪去,D项正确;
8.D
D.两种分子中,N和O均为sp3杂化,而NH2-NH2中N原子的孤电子对数为1,而H2O2
中O原子的孤电子对数为2,孤电子对数越多,对成键电子对的斥力越大,键角越小
,D错误;
9.C
10.D
B.状态②到③的过程中,Cu和N的化合价发生变化,Cu得电子化合价降低,N失电
子被氧化,B正确;D.从图中可知,该反应的总反应方程式为4NH3+4NO+O2=6H2O+
4N2,D错误;
11.C
12.D
13.D
【详解】A.反应时混合气体减小的物质的量相同于消耗SO2的物质的量,根据压强
之比等于物质的量之比,实验b中, 40min内体系压强减小了,相当于二氧化硫的
分压强减小了40kPa,则CO的分压强减小了80kPa,故CO的平均反应速率为,A正确
;
B.根据分析知实验b改变的条件是加入催化剂,B正确;
C.设达到平衡状态时,SO2消耗了,列三段式得:
40min达到平衡,此时压强为120kPa,根据压强之比等于物质的量之比,得:,解
得,故二氧化硫的转化率为,C正确;
D.平衡常数只受温度影响,根据分析知实验a、b反应温度相同,则。反应,说明
该反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,实验c 温度比实验
a、b高,则,D错误;
故选D。
14.D
D.常温下,和共存时:,D错误;
{#{QQABaYgAogCAQBAAAQgCEwFqC二gEQk、BEAA非IoGg选AAAo择AAB题CBFA(BAA=本}#} 题共4小题,共58分)
15.(14分)(1) 恒压滴液漏斗(1分) 导气和防倒吸(1分)
(2)(2分)
(3)肼的产率降低(2分)
(4) 氨水 (1分) 黑色固体全部溶解,产生无色气体,无色气体迅速变为
红棕色 (2分) 还原性(1分)
(5)能与形成氢键(2分) (6)1(2分)
16.(15分)(1) 提高盐酸的浓度 (1分) 温度太高会导致盐酸大量挥发
,导致浸出率降低(2分)
(2) (2分) 降温 (2分) 稀释(2分)
(3)调节溶液pH,除去溶液中的(2分)
(4)(2分)
(5)0.1(2分)
17.(14分)(1)C(s,石墨)+H2(g)=C2H2(g) △H=+113.35kJ mol-1(2分)
(2)温度低于500℃,反应速率低;温度高于500℃,对副反应影响较大,化学平衡
向生成CO的方向移动程度增大,不利于甲烷的生成(2分)
(3) C(2分) II (1分) > (1分) 40 (2分) 4(2分)
(4)2H2O+2Cl-H2↑+2OH-+Cl2↑(2分)(条件写电解给分)
18.(15分)(1)2-甲基苯酚(或邻甲基苯酚)(1分)
(2) + (2分) 醚键和羧基(1分)
(3) 加成 (1分) (2分)
(4)6(2分)
(5)、、、(写三种,写对一个一分,写错一个0分)(3分)
(6)(3分)
同课章节目录
