化学人教版(2019)选择性必修2 3.3.3过渡晶体与混合型晶体(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.3过渡晶体与混合型晶体(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-23 21:25:38 | ||
图片预览



文档简介
(共21张PPT)
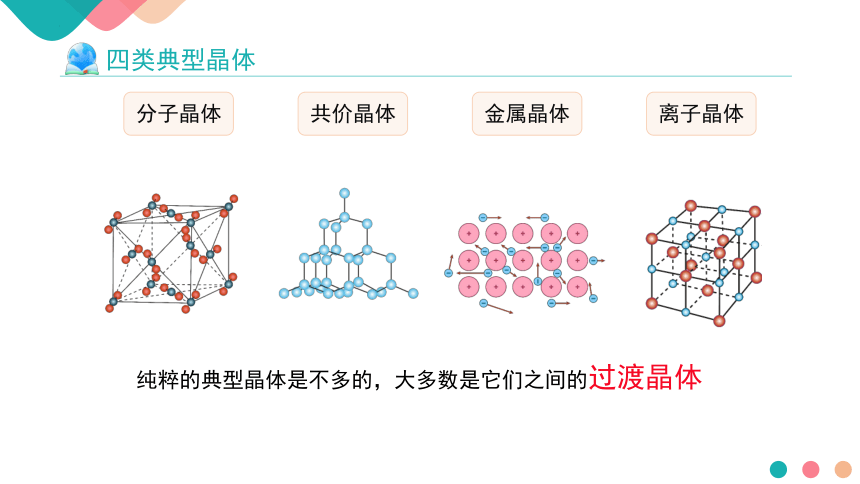
过渡晶体与混合型晶体
分子晶体
共价晶体
金属晶体
离子晶体
纯粹的典型晶体是不多的,大多数是它们之间的过渡晶体
四类典型晶体
一、过渡晶体
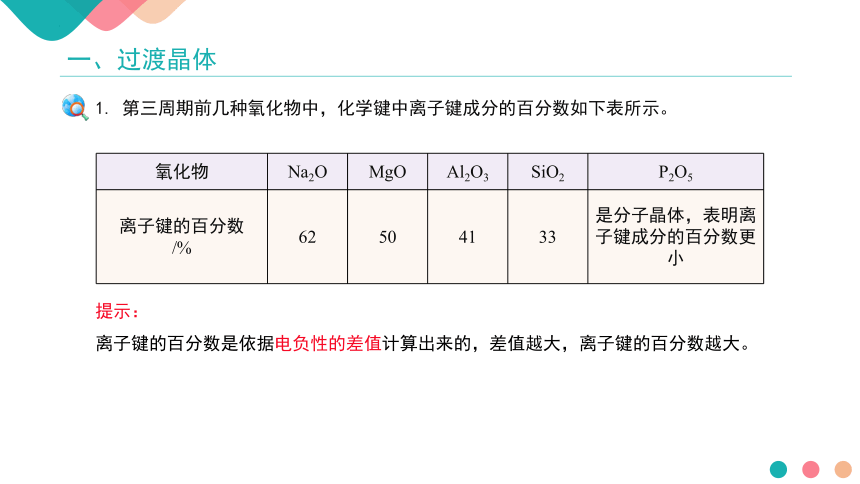
氧化物 Na2O MgO Al2O3 SiO2 P2O5
离子键的百分数 /% 62 50 41 33 是分子晶体,表明离子键成分的百分数更小
提示:
离子键的百分数是依据电负性的差值计算出来的,差值越大,离子键的百分数越大。
1. 第三周期前几种氧化物中,化学键中离子键成分的百分数如下表所示。
一、过渡晶体
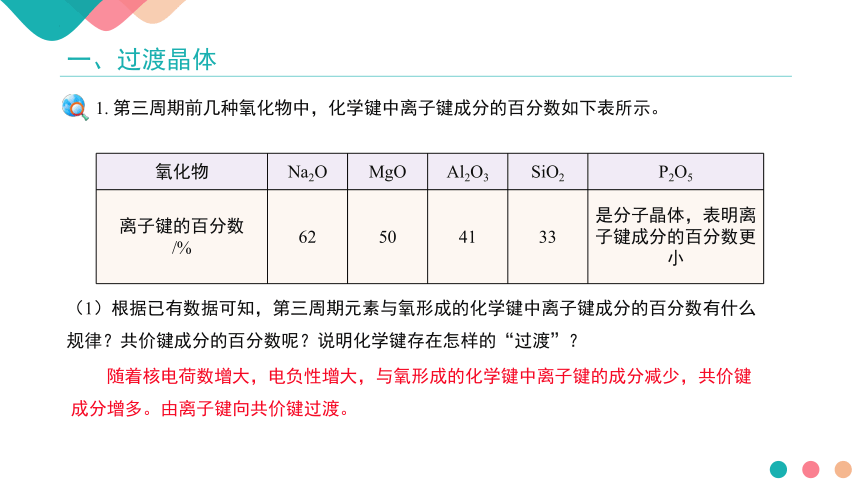
氧化物 Na2O MgO Al2O3 SiO2 P2O5
离子键的百分数 /% 62 50 41 33 是分子晶体,表明离子键成分的百分数更小
1. 第三周期前几种氧化物中,化学键中离子键成分的百分数如下表所示。
(1)根据已有数据可知,第三周期元素与氧形成的化学键中离子键成分的百分数有什么规律?共价键成分的百分数呢?说明化学键存在怎样的“过渡”?
随着核电荷数增大,电负性增大,与氧形成的化学键中离子键的成分减少,共价键成分增多。由离子键向共价键过渡。
一、过渡晶体
氧化物 Na2O MgO Al2O3 SiO2 P2O5
离子键的百分数 /% 62 50 41 33 是分子晶体,表明离子键成分的百分数更小
1.第三周期前几种氧化物中,化学键中离子键成分的百分数如下表所示。
(2)据此你还有哪些感悟?说出来与同学们分享。
① 表中的 4 种氧化物晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体。
② 偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如Na2O、MgO等。同样,偏向共价晶体的过渡晶体则当作共价晶体来处理,如SiO2等。
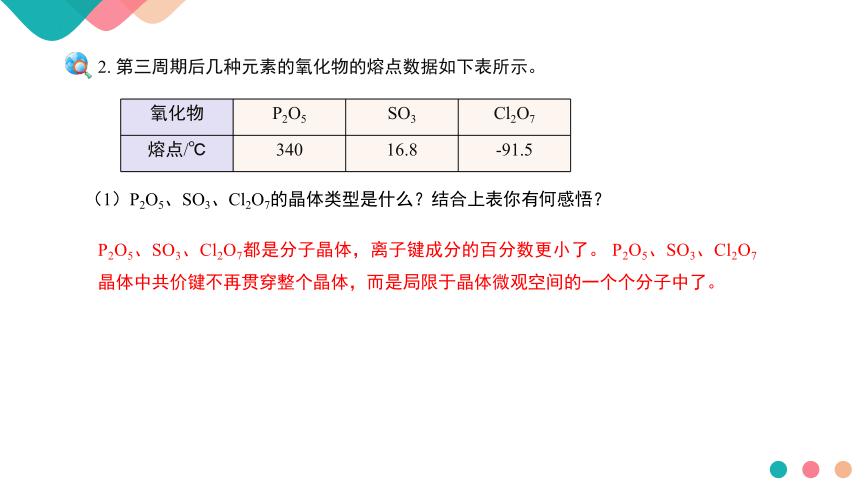
2. 第三周期后几种元素的氧化物的熔点数据如下表所示。
(1)P2O5、SO3、Cl2O7的晶体类型是什么?结合上表你有何感悟?
氧化物 P2O5 SO3 Cl2O7
熔点/℃ 340 16.8 -91.5
P2O5、SO3、Cl2O7都是分子晶体,离子键成分的百分数更小了。 P2O5、SO3、Cl2O7晶体中共价键不再贯穿整个晶体,而是局限于晶体微观空间的一个个分子中了。
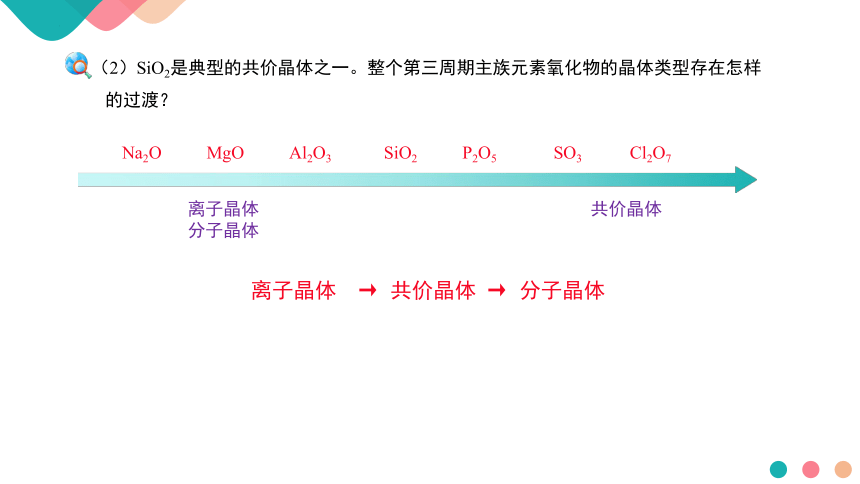
(2)SiO2是典型的共价晶体之一。整个第三周期主族元素氧化物的晶体类型存在怎样
的过渡?
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子晶体 共价晶体 分子晶体
离子晶体 → 共价晶体 → 分子晶体
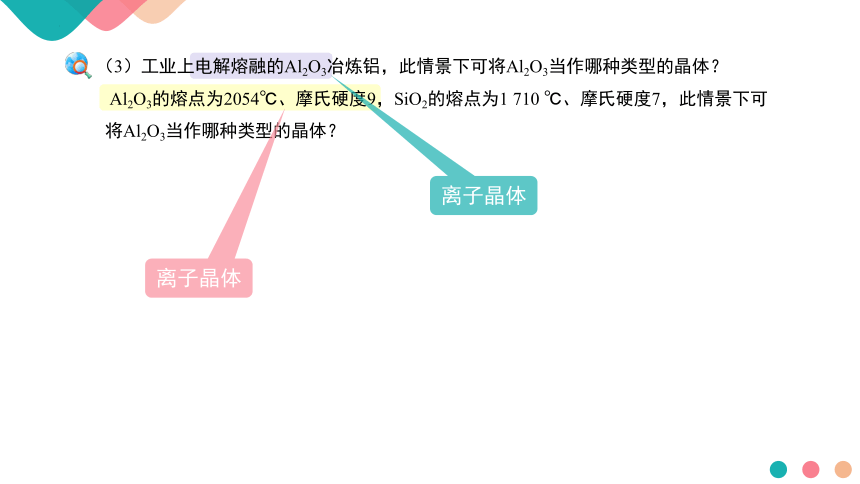
(3)工业上电解熔融的Al2O3冶炼铝,此情景下可将Al2O3当作哪种类型的晶体?
Al2O3的熔点为2054℃、摩氏硬度9,SiO2的熔点为1 710 ℃、摩氏硬度7,此情景下可
将Al2O3当作哪种类型的晶体?
离子晶体
离子晶体
(4)教材第82页指出:“常见的共价晶体还有锗和灰锡”,第86页又指出:“金属
(除汞外)在常温下都是金属晶体”。上述两句话矛盾吗?为什么?
不矛盾。锗和灰锡都是金属晶体和共价晶体之间的过渡晶体。
二、混合型晶体
—— 石墨
1. 石墨晶体的结构模型
碳原子采取 sp2 杂化与相邻3 个碳原子形成 σ 键
形成平面六元并环结构
石墨是层状结构
层间不存在化学键
靠范德华力维系
碳原子的配位数为 3
未参与杂化的2p电子的原子轨道垂直于碳原子平面
1. 石墨晶体的结构模型
碳原子与碳碳键个数比为多少?
C
C
C
C
碳原子与碳碳键个数比为2:3
2. 石墨性质及其解释
① 熔点高:
② 硬度小:
③ 能导电:
碳原子采取sp2杂化,平面内存在大π键,石墨晶体中 C-C键长更短,C-C键能更大,所以石墨的熔点高。
石墨的层与层之间以范德华力相结合,容易滑动,所以硬度小。
未参与杂化的2p电子可在整个碳原子平面中运动,类似金属晶体的导电性;
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面,所以石墨的导电性只能沿石墨平面的方向。
资料卡片
硅酸盐是地壳岩石的主要成分,硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离了,如SiO44-、Si2O76-、(SiO3)612-(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结白。部分Si被Al取代则得到记硅酸盐。
六元环
单链
双链
· 硅酸盐
资料卡片
· 纳米晶体
纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降,主要的原因是晶体的表面积增大。
1.下列氧化物中所含离子键成分的百分数最小的是( )
A.N2O3 B.P2O3 C.As2O3 D.Bi2O3
A
2.某化学兴趣小组,在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
根据这些数据分析,属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2 B.AlCl3、SiCl4
C.NaCl、CaCl2 D.全部
NaCl MgCl2 AlCl3 SiCl4 CaCl2
熔点/℃ 801 712 190 -68 782
沸点/℃ 1 465 1 418 230 57 1 600
B
3.石墨晶体是层状结构,在每一层内,每一个碳原子都与其他三个碳原子相结合。如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
A.10 B.18 C.24 D.14
D
4.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂;立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,下列关于这两种晶体的说法正确的是( )
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内一个硼原子与相邻
氮原子构成的空间结构为平面三角形
D
5.下列各组物质中,按熔、沸点由低到高顺序排列正确的是________(填字母)。
A.KCl、NaCl、MgCl2、MgO B.金刚石、SiC、SiO2、硅
C.H2O、H2S、H2Se、H2Te D.Na、K、Rb、Al
E.CO2、Na、KCl、SiO2 F.O2、I2、Hg、MgCl2
G.钠、钾、钠钾合金 H.CH4、H2O、HF、NH3
I.CH4、C2H6、C4H10、C3H8
J.CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、C(CH3)4
AE
6.SiO2以[SiO4]为基本单元形成空间立体网状结构,其晶体类型为________,在硅酸盐中,SiO44-四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根:Si与O的原子数之比为__________,化学式为____________________________。
共价晶体
1∶3
[SiO3] n2n-(或SiO32-)
过渡晶体与混合型晶体
分子晶体
共价晶体
金属晶体
离子晶体
纯粹的典型晶体是不多的,大多数是它们之间的过渡晶体
四类典型晶体
一、过渡晶体
氧化物 Na2O MgO Al2O3 SiO2 P2O5
离子键的百分数 /% 62 50 41 33 是分子晶体,表明离子键成分的百分数更小
提示:
离子键的百分数是依据电负性的差值计算出来的,差值越大,离子键的百分数越大。
1. 第三周期前几种氧化物中,化学键中离子键成分的百分数如下表所示。
一、过渡晶体
氧化物 Na2O MgO Al2O3 SiO2 P2O5
离子键的百分数 /% 62 50 41 33 是分子晶体,表明离子键成分的百分数更小
1. 第三周期前几种氧化物中,化学键中离子键成分的百分数如下表所示。
(1)根据已有数据可知,第三周期元素与氧形成的化学键中离子键成分的百分数有什么规律?共价键成分的百分数呢?说明化学键存在怎样的“过渡”?
随着核电荷数增大,电负性增大,与氧形成的化学键中离子键的成分减少,共价键成分增多。由离子键向共价键过渡。
一、过渡晶体
氧化物 Na2O MgO Al2O3 SiO2 P2O5
离子键的百分数 /% 62 50 41 33 是分子晶体,表明离子键成分的百分数更小
1.第三周期前几种氧化物中,化学键中离子键成分的百分数如下表所示。
(2)据此你还有哪些感悟?说出来与同学们分享。
① 表中的 4 种氧化物晶体中的化学键既不是纯粹的离子键,也不是纯粹的共价键,这些晶体既不是纯粹的离子晶体也不是纯粹的共价晶体,只是离子晶体与共价晶体之间的过渡晶体。
② 偏向离子晶体的过渡晶体在许多性质上与纯粹的离子晶体接近,因而通常当作离子晶体来处理,如Na2O、MgO等。同样,偏向共价晶体的过渡晶体则当作共价晶体来处理,如SiO2等。
2. 第三周期后几种元素的氧化物的熔点数据如下表所示。
(1)P2O5、SO3、Cl2O7的晶体类型是什么?结合上表你有何感悟?
氧化物 P2O5 SO3 Cl2O7
熔点/℃ 340 16.8 -91.5
P2O5、SO3、Cl2O7都是分子晶体,离子键成分的百分数更小了。 P2O5、SO3、Cl2O7晶体中共价键不再贯穿整个晶体,而是局限于晶体微观空间的一个个分子中了。
(2)SiO2是典型的共价晶体之一。整个第三周期主族元素氧化物的晶体类型存在怎样
的过渡?
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
离子晶体 共价晶体 分子晶体
离子晶体 → 共价晶体 → 分子晶体
(3)工业上电解熔融的Al2O3冶炼铝,此情景下可将Al2O3当作哪种类型的晶体?
Al2O3的熔点为2054℃、摩氏硬度9,SiO2的熔点为1 710 ℃、摩氏硬度7,此情景下可
将Al2O3当作哪种类型的晶体?
离子晶体
离子晶体
(4)教材第82页指出:“常见的共价晶体还有锗和灰锡”,第86页又指出:“金属
(除汞外)在常温下都是金属晶体”。上述两句话矛盾吗?为什么?
不矛盾。锗和灰锡都是金属晶体和共价晶体之间的过渡晶体。
二、混合型晶体
—— 石墨
1. 石墨晶体的结构模型
碳原子采取 sp2 杂化与相邻3 个碳原子形成 σ 键
形成平面六元并环结构
石墨是层状结构
层间不存在化学键
靠范德华力维系
碳原子的配位数为 3
未参与杂化的2p电子的原子轨道垂直于碳原子平面
1. 石墨晶体的结构模型
碳原子与碳碳键个数比为多少?
C
C
C
C
碳原子与碳碳键个数比为2:3
2. 石墨性质及其解释
① 熔点高:
② 硬度小:
③ 能导电:
碳原子采取sp2杂化,平面内存在大π键,石墨晶体中 C-C键长更短,C-C键能更大,所以石墨的熔点高。
石墨的层与层之间以范德华力相结合,容易滑动,所以硬度小。
未参与杂化的2p电子可在整个碳原子平面中运动,类似金属晶体的导电性;
由于相邻碳原子平面之间相隔较远,电子不能从一个平面跳跃到另一个平面,所以石墨的导电性只能沿石墨平面的方向。
资料卡片
硅酸盐是地壳岩石的主要成分,硅酸盐的阴离子结构丰富多样,既有有限数目的硅氧四面体构建的简单阴离了,如SiO44-、Si2O76-、(SiO3)612-(六元环)等,也有以硅氧四面体为结构单元构成一维、二维、三维无限伸展的共价键骨架。金属离子则以离子键与阴离子或阴离子骨架结白。部分Si被Al取代则得到记硅酸盐。
六元环
单链
双链
· 硅酸盐
资料卡片
· 纳米晶体
纳米晶体是晶体颗粒尺寸在纳米(10-9m)量级的晶体。纳米晶体相对于通常的晶体,在声、光、电、磁、热等性能上常会呈现新的特性,有广阔的应用前景。
仅以熔点为例,当晶体颗粒小至纳米量级,熔点会下降,主要的原因是晶体的表面积增大。
1.下列氧化物中所含离子键成分的百分数最小的是( )
A.N2O3 B.P2O3 C.As2O3 D.Bi2O3
A
2.某化学兴趣小组,在学习分子晶体后,查阅了几种氯化物的熔、沸点,记录如下:
根据这些数据分析,属于分子晶体的是( )
A.NaCl、MgCl2、CaCl2 B.AlCl3、SiCl4
C.NaCl、CaCl2 D.全部
NaCl MgCl2 AlCl3 SiCl4 CaCl2
熔点/℃ 801 712 190 -68 782
沸点/℃ 1 465 1 418 230 57 1 600
B
3.石墨晶体是层状结构,在每一层内,每一个碳原子都与其他三个碳原子相结合。如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
A.10 B.18 C.24 D.14
D
4.氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂;立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示,下列关于这两种晶体的说法正确的是( )
A.六方相氮化硼与石墨一样可以导电
B.立方相氮化硼含有σ键和π键,所以硬度大
C.两种晶体均为分子晶体
D.六方相氮化硼晶体层内一个硼原子与相邻
氮原子构成的空间结构为平面三角形
D
5.下列各组物质中,按熔、沸点由低到高顺序排列正确的是________(填字母)。
A.KCl、NaCl、MgCl2、MgO B.金刚石、SiC、SiO2、硅
C.H2O、H2S、H2Se、H2Te D.Na、K、Rb、Al
E.CO2、Na、KCl、SiO2 F.O2、I2、Hg、MgCl2
G.钠、钾、钠钾合金 H.CH4、H2O、HF、NH3
I.CH4、C2H6、C4H10、C3H8
J.CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、C(CH3)4
AE
6.SiO2以[SiO4]为基本单元形成空间立体网状结构,其晶体类型为________,在硅酸盐中,SiO44-四面体(如图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根:Si与O的原子数之比为__________,化学式为____________________________。
共价晶体
1∶3
[SiO3] n2n-(或SiO32-)
