化学人教版(2019)必修第二册5.2.1《氮和氮的氧化物》(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.1《氮和氮的氧化物》(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 20.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-23 22:18:07 | ||
图片预览


文档简介
(共23张PPT)
氮和氮的氧化物
模块一 氮气
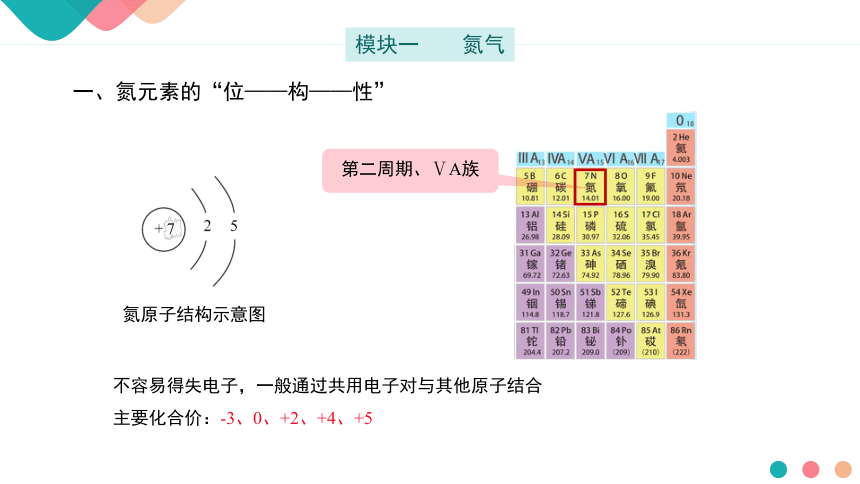
一、氮元素的“位——构——性”
第二周期、ⅤA族
氮原子结构示意图
5
7
不容易得失电子,一般通过共用电子对与其他原子结合
主要化合价:-3、0、+2、+4、+5
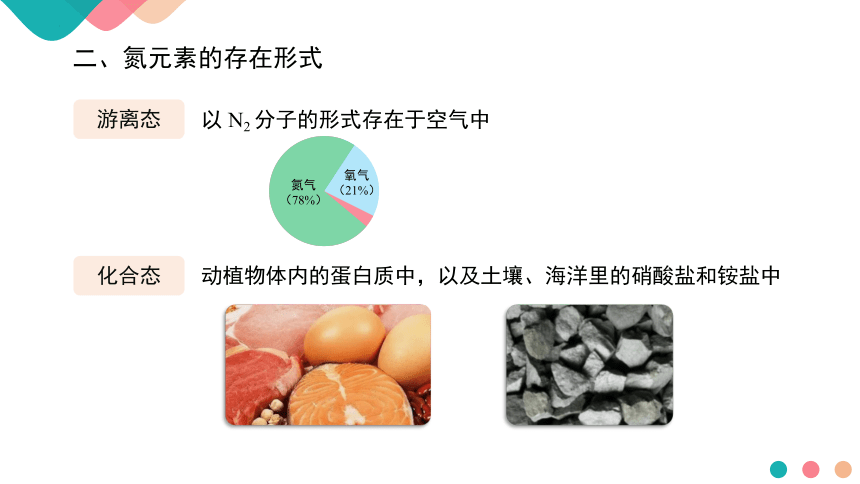
二、氮元素的存在形式
游离态
化合态
以 N2 分子的形式存在于空气中
动植物体内的蛋白质中,以及土壤、海洋里的硝酸盐和铵盐中
氮气
(78%)
氧气
(21%)
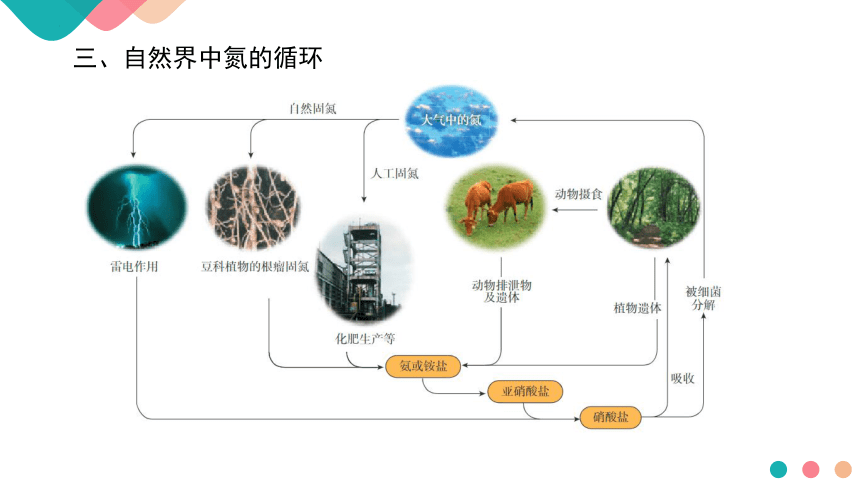
三、自然界中氮的循环
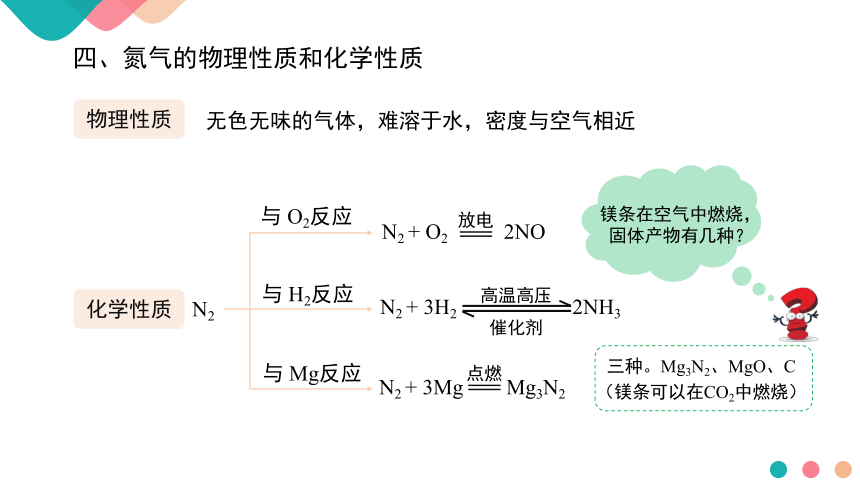
四、氮气的物理性质和化学性质
物理性质
化学性质
无色无味的气体,难溶于水,密度与空气相近
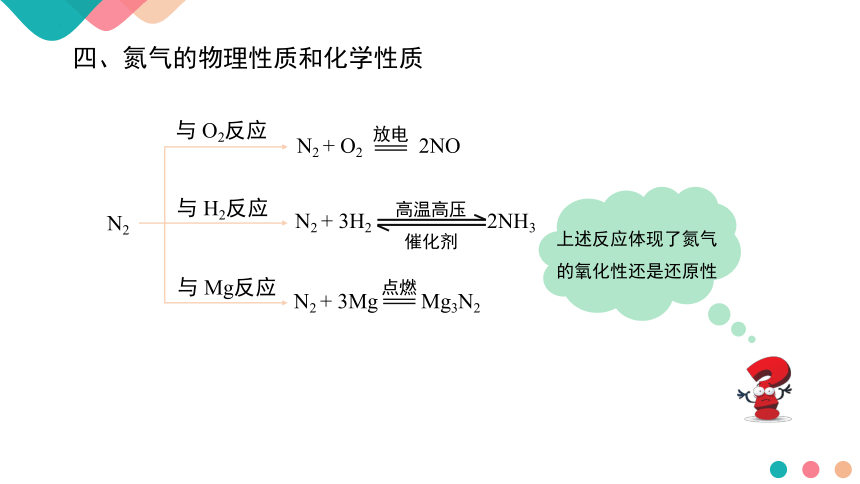
N2 + O2 2NO
放电
点燃
N2 + 3Mg Mg3N2
N2 + 3H2 2NH3
高温高压
催化剂
N2
与 O2反应
与 H2反应
与 Mg反应
镁条在空气中燃烧,固体产物有几种?
三种。Mg3N2、MgO、C
(镁条可以在CO2中燃烧)
四、氮气的物理性质和化学性质
N2 + O2 2NO
放电
点燃
N2 + 3Mg Mg3N2
N2 + 3H2 2NH3
高温高压
催化剂
N2
与 O2反应
与 H2反应
与 Mg反应
上述反应体现了氮气的氧化性还是还原性
N2
NH3
-3
NO
+2
Mg3N2
氧
化
性
氧化性
还原性
0
四、氮气的物理性质和化学性质
五、氮的固定
N2 + O2 2NO
放电
N2 + 3H2 2NH3
高温高压
催化剂
1.概念:把空气中游离态的氮转变为氮的化合物的过程。
2.分类:
(1)自然固氨:大自然通过闪电释放的能量将空气中的氨气转化为含氨的
化合物,或豆科植物根瘤菌将氨气转化为氨。
(2)人工固氮:如工业合成氨。
模块二 一氧化氮 二氧化氮
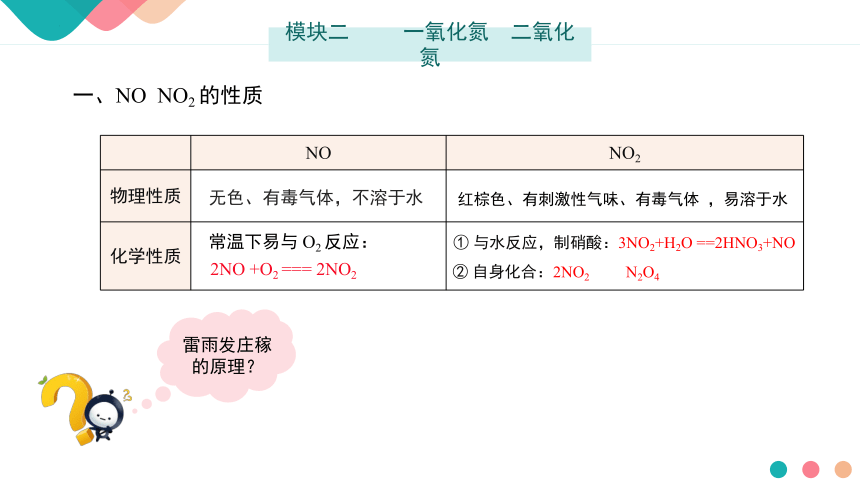
一、NO NO2 的性质
NO NO2
物理性质
化学性质
无色、有毒气体,不溶于水
常温下易与 O2 反应:
2NO +O2 === 2NO2
红棕色、有刺激性气味、有毒气体 ,易溶于水
① 与水反应,制硝酸:3NO2+H2O ==2HNO3+NO
② 自身化合:2NO2 N2O4
雷雨发庄稼的原理?
思考与讨论
1. NO、NO2是酸性氧化物吗?
2. 如何收集NO、NO2气体?
3. 氮氧化物可造成什么环境污染问题?
NO:排水法 NO2:向上排空气法
酸雨、光化学烟雾
不是。N2O3和N2O5才是酸性氧化物
资料卡片
汽车、工厂等污染源排入大气的氮氧化物与碳氨化合物(一次污染物),经紫外线照射发生光化学反应生成以臭氧为主的二次污染物,参与光化学反应过程的一次污染物和二次污染物的混合物,称为光化学烟雾。光化学烟雾危害人体健康和植物生长。
NO、NO2 的氧化性
知识拓展
6NO + 4NH3 5N2 + 6H2O
=======
催化剂
加热
2NO + 2CO N2 + 2CO2
=======
催化剂
NO 氧化性较弱:
NO2 氧化性较强:
NO2 + SO2 ==== NO + 2SO3
处理汽车尾气
实验5-5:NO2 溶于水
实验5-5:NO2 溶于水
实验操作 实验现象 实验结论
在一支 50mL 的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,
打开弹簧夹,快速吸入10mL空气后夹上弹簧夹
振荡注射器
无明显现象
无色气体变为红棕色
注射器活塞向左移动
红棕色气体变为无色
注射器活塞继续向左移动
NO不溶于水
NO与O2反应生成红棕色的NO2
NO溶于水生成无色的NO
2NO+O2 === 2NO2 3NO2+H2O === 2HNO3+NO
思考与讨论
1. 将充满 NO2 的试管倒置在装满水的水槽里,会有什么现象?最终试管里剩余气体占试管体积的几分之几?
2. 充分吸收后,试管内溶液的物质的量浓度是多少?
3NO2+H2O === 2HNO3+NO
红棕色逐渐褪去,水槽里的水倒吸入试管中,最终气体占1/3
思考与讨论
3. 要将剩余1/3的NO气体充分转化吸收,可以采取什么措施?
4. 若将一充满 NO 的试管倒置于水槽中,同时不断地缓慢通入 O2,最终液体充满整个试管,请写出该过程的总反应方程式
通入适量氧气
4NO + 3O2 + 2H2O === 4HNO3
4NO + 3O2 + 2H2O === 4HNO3
NO2和溴蒸气都是红棕色、有刺激性气味的气体,怎样加以区别?
由于NO2和Br2在性质上有不少相似性:
①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。
所以不能用淀粉-KI试纸、pH试纸、NaOH溶液来鉴别,但二者性质又有差别。
可以用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗法。
思维拓展
NO NO2
物性
毒性
与水
与O2
与O2、H2O
2NO + O2 = 2NO2
4NO + 3O2 + 2H2O = 4HNO3
4NO2 + O2 + 2H2O = 4HNO3
无色,无味
有毒(机理同CO)
有毒
红棕色,刺激性气味
归纳总结:NO与NO2的性质比较
1.下列说法中不正确的是( )
A. N2化学性质不活泼,所以N2可在电焊时作保护气
B. 氮气与氧气在汽车内燃机中反应,若氧气过量则可直接生成NO2
C. “雷雨发庄稼”所包含的化学变化有N2→NO→NO2→HNO3→硝酸盐
D. 在反应3Mg+N2 Mg3N2中,N2为氧化剂
B
2.下列关于NO的说法正确的是( )
A.NO是无色气体,易溶于水,是酸性氧化物
B.NO在人体内可作“信使分子”,能扩张血管,提高免疫力等,因此大气中的NO对人体无害
C.NO在空气中可以转化为NO2,二者都是大气污染物
D.NO在化学反应中,只作还原剂,不能作氧化剂
C
3. 下列有关NO2、NO的说法不正确的是( )
A. NO2是红棕色气体,易溶于水
B. NO可以用排水法收集,但不能由N2和O2化合得到
C. NO、NO2在一定条件下可以相互转化
D. NO、NO2都有毒,且NO是汽车尾气成分之一
B
4. 用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
①NO+NO2+2NaOH=== 2NaNO2+H2O
②2NO2+2NaOH=== NaNO2+NaNO3+H2O
下列说法错误的是( )
A. 在反应①中,参加反应的氧化剂和还原剂的质量之比为23∶15
B. 在反应②中,氧化产物是NaNO2,还原产物是NaNO3
C. 在反应①②中,参加反应的NaOH的物质的量均为2 mol时,两个反应转移电子数相等
D. 也可用氨气处理NO
B
氮和氮的氧化物
模块一 氮气
一、氮元素的“位——构——性”
第二周期、ⅤA族
氮原子结构示意图
5
7
不容易得失电子,一般通过共用电子对与其他原子结合
主要化合价:-3、0、+2、+4、+5
二、氮元素的存在形式
游离态
化合态
以 N2 分子的形式存在于空气中
动植物体内的蛋白质中,以及土壤、海洋里的硝酸盐和铵盐中
氮气
(78%)
氧气
(21%)
三、自然界中氮的循环
四、氮气的物理性质和化学性质
物理性质
化学性质
无色无味的气体,难溶于水,密度与空气相近
N2 + O2 2NO
放电
点燃
N2 + 3Mg Mg3N2
N2 + 3H2 2NH3
高温高压
催化剂
N2
与 O2反应
与 H2反应
与 Mg反应
镁条在空气中燃烧,固体产物有几种?
三种。Mg3N2、MgO、C
(镁条可以在CO2中燃烧)
四、氮气的物理性质和化学性质
N2 + O2 2NO
放电
点燃
N2 + 3Mg Mg3N2
N2 + 3H2 2NH3
高温高压
催化剂
N2
与 O2反应
与 H2反应
与 Mg反应
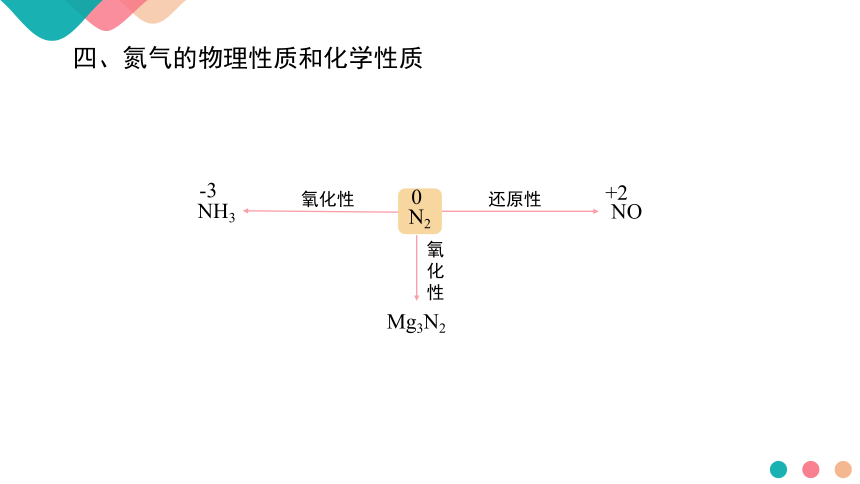
上述反应体现了氮气的氧化性还是还原性
N2
NH3
-3
NO
+2
Mg3N2
氧
化
性
氧化性
还原性
0
四、氮气的物理性质和化学性质
五、氮的固定
N2 + O2 2NO
放电
N2 + 3H2 2NH3
高温高压
催化剂
1.概念:把空气中游离态的氮转变为氮的化合物的过程。
2.分类:
(1)自然固氨:大自然通过闪电释放的能量将空气中的氨气转化为含氨的
化合物,或豆科植物根瘤菌将氨气转化为氨。
(2)人工固氮:如工业合成氨。
模块二 一氧化氮 二氧化氮
一、NO NO2 的性质
NO NO2
物理性质
化学性质
无色、有毒气体,不溶于水
常温下易与 O2 反应:
2NO +O2 === 2NO2
红棕色、有刺激性气味、有毒气体 ,易溶于水
① 与水反应,制硝酸:3NO2+H2O ==2HNO3+NO
② 自身化合:2NO2 N2O4
雷雨发庄稼的原理?
思考与讨论
1. NO、NO2是酸性氧化物吗?
2. 如何收集NO、NO2气体?
3. 氮氧化物可造成什么环境污染问题?
NO:排水法 NO2:向上排空气法
酸雨、光化学烟雾
不是。N2O3和N2O5才是酸性氧化物
资料卡片
汽车、工厂等污染源排入大气的氮氧化物与碳氨化合物(一次污染物),经紫外线照射发生光化学反应生成以臭氧为主的二次污染物,参与光化学反应过程的一次污染物和二次污染物的混合物,称为光化学烟雾。光化学烟雾危害人体健康和植物生长。
NO、NO2 的氧化性
知识拓展
6NO + 4NH3 5N2 + 6H2O
=======
催化剂
加热
2NO + 2CO N2 + 2CO2
=======
催化剂
NO 氧化性较弱:
NO2 氧化性较强:
NO2 + SO2 ==== NO + 2SO3
处理汽车尾气
实验5-5:NO2 溶于水
实验5-5:NO2 溶于水
实验操作 实验现象 实验结论
在一支 50mL 的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,
打开弹簧夹,快速吸入10mL空气后夹上弹簧夹
振荡注射器
无明显现象
无色气体变为红棕色
注射器活塞向左移动
红棕色气体变为无色
注射器活塞继续向左移动
NO不溶于水
NO与O2反应生成红棕色的NO2
NO溶于水生成无色的NO
2NO+O2 === 2NO2 3NO2+H2O === 2HNO3+NO
思考与讨论
1. 将充满 NO2 的试管倒置在装满水的水槽里,会有什么现象?最终试管里剩余气体占试管体积的几分之几?
2. 充分吸收后,试管内溶液的物质的量浓度是多少?
3NO2+H2O === 2HNO3+NO
红棕色逐渐褪去,水槽里的水倒吸入试管中,最终气体占1/3
思考与讨论
3. 要将剩余1/3的NO气体充分转化吸收,可以采取什么措施?
4. 若将一充满 NO 的试管倒置于水槽中,同时不断地缓慢通入 O2,最终液体充满整个试管,请写出该过程的总反应方程式
通入适量氧气
4NO + 3O2 + 2H2O === 4HNO3
4NO + 3O2 + 2H2O === 4HNO3
NO2和溴蒸气都是红棕色、有刺激性气味的气体,怎样加以区别?
由于NO2和Br2在性质上有不少相似性:
①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。
所以不能用淀粉-KI试纸、pH试纸、NaOH溶液来鉴别,但二者性质又有差别。
可以用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗法。
思维拓展
NO NO2
物性
毒性
与水
与O2
与O2、H2O
2NO + O2 = 2NO2
4NO + 3O2 + 2H2O = 4HNO3
4NO2 + O2 + 2H2O = 4HNO3
无色,无味
有毒(机理同CO)
有毒
红棕色,刺激性气味
归纳总结:NO与NO2的性质比较
1.下列说法中不正确的是( )
A. N2化学性质不活泼,所以N2可在电焊时作保护气
B. 氮气与氧气在汽车内燃机中反应,若氧气过量则可直接生成NO2
C. “雷雨发庄稼”所包含的化学变化有N2→NO→NO2→HNO3→硝酸盐
D. 在反应3Mg+N2 Mg3N2中,N2为氧化剂
B
2.下列关于NO的说法正确的是( )
A.NO是无色气体,易溶于水,是酸性氧化物
B.NO在人体内可作“信使分子”,能扩张血管,提高免疫力等,因此大气中的NO对人体无害
C.NO在空气中可以转化为NO2,二者都是大气污染物
D.NO在化学反应中,只作还原剂,不能作氧化剂
C
3. 下列有关NO2、NO的说法不正确的是( )
A. NO2是红棕色气体,易溶于水
B. NO可以用排水法收集,但不能由N2和O2化合得到
C. NO、NO2在一定条件下可以相互转化
D. NO、NO2都有毒,且NO是汽车尾气成分之一
B
4. 用NaOH溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
①NO+NO2+2NaOH=== 2NaNO2+H2O
②2NO2+2NaOH=== NaNO2+NaNO3+H2O
下列说法错误的是( )
A. 在反应①中,参加反应的氧化剂和还原剂的质量之比为23∶15
B. 在反应②中,氧化产物是NaNO2,还原产物是NaNO3
C. 在反应①②中,参加反应的NaOH的物质的量均为2 mol时,两个反应转移电子数相等
D. 也可用氨气处理NO
B
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
