第十单元酸和碱单元训练卷-2023-2024学年九年级化学人教版下册(含答案)
文档属性
| 名称 | 第十单元酸和碱单元训练卷-2023-2024学年九年级化学人教版下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 853.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-25 10:15:52 | ||
图片预览



文档简介
第十单元 酸和碱 单元训练卷
一、选择题
1.下列图像不能正确反映其对应变化关系的是
A.用等质量、等浓度的过氧化氢溶液在有无MnO2条件下制氧气
B.将一定量的浓硫酸加入适量水中
C.电解水生成两种气体
D.用红磷测定空气中氧气的含量
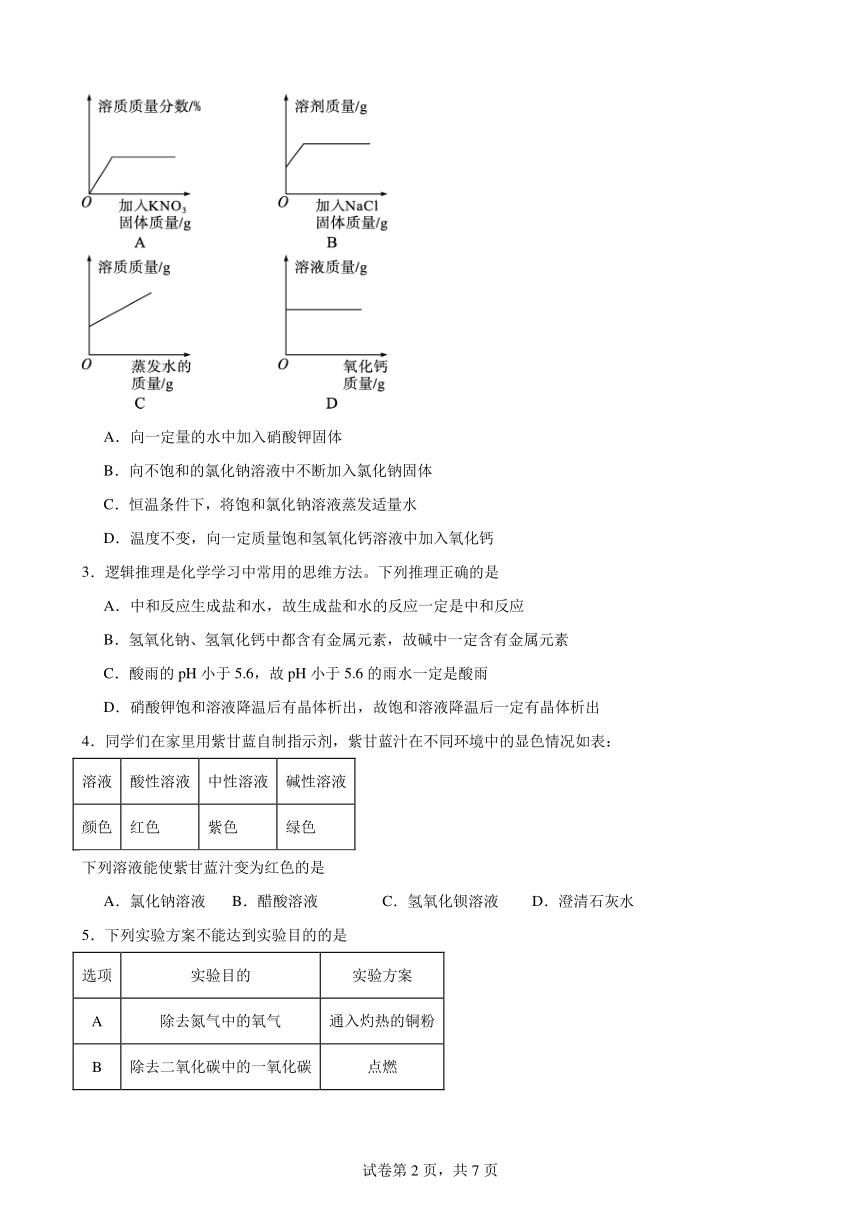
2.下列图像中有关量的变化趋势与对应叙述关系正确的是
A.向一定量的水中加入硝酸钾固体
B.向不饱和的氯化钠溶液中不断加入氯化钠固体
C.恒温条件下,将饱和氯化钠溶液蒸发适量水
D.温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙
3.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.中和反应生成盐和水,故生成盐和水的反应一定是中和反应
B.氢氧化钠、氢氧化钙中都含有金属元素,故碱中一定含有金属元素
C.酸雨的pH小于5.6,故pH小于5.6的雨水一定是酸雨
D.硝酸钾饱和溶液降温后有晶体析出,故饱和溶液降温后一定有晶体析出
4.同学们在家里用紫甘蓝自制指示剂,紫甘蓝汁在不同环境中的显色情况如表:
溶液 酸性溶液 中性溶液 碱性溶液
颜色 红色 紫色 绿色
下列溶液能使紫甘蓝汁变为红色的是
A.氯化钠溶液 B.醋酸溶液 C.氢氧化钡溶液 D.澄清石灰水
5.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A 除去氮气中的氧气 通入灼热的铜粉
B 除去二氧化碳中的一氧化碳 点燃
C 区分氧化钙和氢氧化钙 加入水
D 区分水和过氧化氢溶液 加入二氧化锰
A.A B.B C.C D.D
6.现有一瓶浓盐酸和一瓶浓硫酸,若将它们暴露在空气中一段时间,变化的结果是
A.两瓶酸的溶质质量分数都减小 B.两瓶酸的溶质质量分数都增大
C.两瓶酸的质量都减小 D.两瓶酸的质量都增大
7.2021年岁尾,新冠肺炎又在国内局地蔓延。过氯乙酸(化学式为C2H4O3)是消灭新冠病毒的主要消毒剂之一,下列关于过氧乙酸的说法正确的是
A.过氧乙酸是一种氧化物
B.1个过氧乙酸分子中含有2个碳原子、1个氧原子和2个水分子
C.过氧乙酸中碳、氢、氧三种元素的质量比是2:4:3
D.配制和保存过氧乙酸不宜使用铁制容器
8.如图所示,有关电解水实验的说法正确的是
A.a中产生的气体是氢气
B.水中加入少量NaOH以增强导电性
C.在该实验中生成的氢气和氧气的质量比为2:1
D.该实验证明水是由氢元素和氧元素构成的
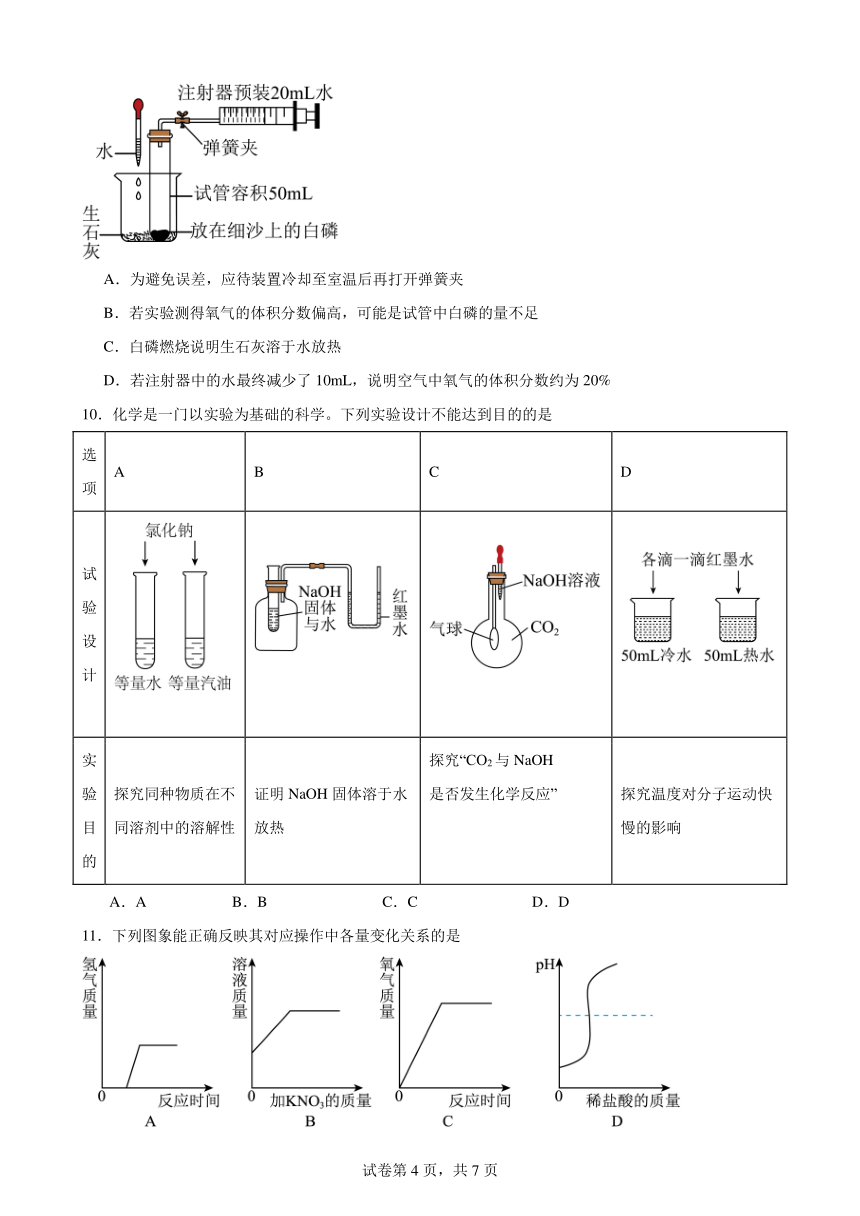
9.某化学小组利用如图所示的装置测定空气中氧气的含量,已知白磷燃烧的最低温度为40℃,下列关于该实验的说法错误的是
A.为避免误差,应待装置冷却至室温后再打开弹簧夹
B.若实验测得氧气的体积分数偏高,可能是试管中白磷的量不足
C.白磷燃烧说明生石灰溶于水放热
D.若注射器中的水最终减少了10mL,说明空气中氧气的体积分数约为20%
10.化学是一门以实验为基础的科学。下列实验设计不能达到目的的是
选项 A B C D
试验设计
实验目的 探究同种物质在不同溶剂中的溶解性 证明NaOH固体溶于水放热 探究“CO2与NaOH 是否发生化学反应” 探究温度对分子运动快慢的影响
A.A B.B C.C D.D
11.下列图象能正确反映其对应操作中各量变化关系的是
A.一定量的稀硫酸与锌粒反应
B.t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体
C.向一定量的过氧化氢溶液中加入少量二氧化锰
D.向10g溶质质量分数为2%的苛性钠溶液中逐滴滴入10g溶质质量分数为2%的盐酸
12.下列有关浓硫酸的实验操作正确的是
A.滴加 B.量取 C.稀释 D.干燥
A.A B.B C.C D.D
二、填空与简答
13.化学是以实验为基础的科学。根据下列实验图示,回答有关问题。
(1)图1实验操作中用玻璃棒不断搅拌的目的是 。
(2)指出图2中的错误 。
(3)图3是电解水的实验装置,a试管中所收集的气体是 。
(4)图4中可观察到的实验现象是 。
14.某化学兴趣小组将如图所示的实验搬上了舞台,震撼了师生,展示了化学的魅力。
(1)A实验可以比较空气与呼出气体中 含量的不同。
(2)B粉尘爆炸实验说明可燃物与氧气 ,燃烧越剧烈。
(3)C实验可用于研究CO2与NaOH溶液的反应。关闭止水夹K,将NaOH溶液全部挤入烧瓶,振荡;然后打开止水夹K。即可观察到水倒吸入烧瓶,变为红色,形成美丽喷泉。写出该反应的化学方程式 。
15.镓(Ga)及化合物应用广泛,常用于半导体、合金、磁性材料等领域,已知镓在化合物中通常为+3价。图甲是镓元素在元素周期表中的相关信息图,图乙是镓原子的原子结构示意图。请回答下列问题:
(1)由图甲可知镓的原子序数是 。
(2)图乙中的x的数值为 ,镓原子在化学反应中容易 (选填“得到”或“失去”)电子。
(3)镓(Ga)与常见金属铝有相似的化学性质。最外层电子数相同时,电子层数越多,原子核对核外电子的吸引力越小,越容易失去电子。比较两种金属原子失电子能力,镓原子的失电子能力比铝 (选填“强”或“弱”)。
(4)氢氧化镓是难溶于水的白色固体,取少量氢氧化镓固体于试管中,加入无色溶液X。充分振荡后固体完全溶解。溶液X可能是 (填化学式)。
(5)设计金属镓转化为氢氧化镓的一种方案: 、 (依次写出化学方程式)。
16.按要求回答下列问题:
Ⅰ.图a是将铜丝插入硝酸银溶液中反应的微观示意图。
(1)从微观粒子变化的角度分析该反应实际参加反应的粒子是 ,反应过程中溶液的质量 (填“增大、减小或不变”)。
Ⅱ.图b表示的是铁及其化合物的“化合价-物质类别”关系图。
(2)生铁和钢是常见的两种铁合金,其中含碳量相对较高的是 。
(3)暴露在空气中的化学方程式为,X的化学式为 。
(4)若a、b均代表硫酸盐,写出铁的氧化物与酸生成a的化学方程式 。
三、计算题
17.常温下,一锥形瓶中盛有20g溶质质量分数为4%的氢氧化钠溶液,再逐滴滴加溶质质量分数为3.65%的稀盐酸,用pH传感器测得溶液的pH与加入稀盐酸的关系曲线如图。请回答问题:
(1)把20g溶质质量分数为4%的氢氧化钠溶液稀释为2%,需加水 g。
(2)图中a点对应的溶液中溶质的化学式是 。
(3)pH=7时,此时消耗3.65%稀盐酸的质量是多少 ?(写出计算过程)。
(4)若改用溶质质量分数为7.3%的稀盐酸进行本实验,pH传感器测得的曲线可能经过 (填“甲”“乙”或“丙”)点。
18.现有一包Na2CO3和Na2SO4固体粉末混合物44.4g,向其中加入足量的稀H2SO4,产生气体的质量和加入稀H2SO4的质量关系如图所示。
(1)Na2CO3中钠元素与氧元素的质量比为 ,产生气体的质量为 g;
(2)恰好完全反应时,求所用稀H2SO4中溶质的质量;
(3)求恰好完全反应时溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.B
5.B
6.A
7.D
8.B
9.B
10.C
11.C
12.C
13.(1)防止滤液受热不均而飞溅
(2)NaOH固体不能直接放在托盘上称量
(3)氢气/
(4)红棕色粉末逐渐变黑
14.(1)氧气/O2
(2)接触面积越大
(3)CO2+2NaOH =Na2CO3+H2O
15.(1)31
(2) 8 失去
(3)强
(4)HCl/H2SO4
(5)
16.(1) Cu和 减小
(2)生铁
(3)
(4)
17.(1)20
(2)NaCl、HCl
(3)NaOH的质量为:20g×4%=0.8g
设消耗HCl的质量为x,则
x=0.73g
则稀盐酸的质量:0.73÷3.65%=20g
答:消耗3.65%稀盐酸的质量是20g。
(4)甲
18.(1) 46:48/23:24 4.4
(2)设:生成4.4g二氧化碳需要硫酸的质量为x。
x=9.8g。
答:所用稀H2SO4中溶质的质量为9.8g。
(3)设:生成4.4g二氧化碳需要碳酸钠的质量为y,生成硫酸钠的质量为z。
y =10.6g
恰好完全反应时溶液中溶质的质量分数:
答:恰好完全反应时溶液中溶质的质量分数为20%。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.下列图像不能正确反映其对应变化关系的是
A.用等质量、等浓度的过氧化氢溶液在有无MnO2条件下制氧气
B.将一定量的浓硫酸加入适量水中
C.电解水生成两种气体
D.用红磷测定空气中氧气的含量
2.下列图像中有关量的变化趋势与对应叙述关系正确的是
A.向一定量的水中加入硝酸钾固体
B.向不饱和的氯化钠溶液中不断加入氯化钠固体
C.恒温条件下,将饱和氯化钠溶液蒸发适量水
D.温度不变,向一定质量饱和氢氧化钙溶液中加入氧化钙
3.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.中和反应生成盐和水,故生成盐和水的反应一定是中和反应
B.氢氧化钠、氢氧化钙中都含有金属元素,故碱中一定含有金属元素
C.酸雨的pH小于5.6,故pH小于5.6的雨水一定是酸雨
D.硝酸钾饱和溶液降温后有晶体析出,故饱和溶液降温后一定有晶体析出
4.同学们在家里用紫甘蓝自制指示剂,紫甘蓝汁在不同环境中的显色情况如表:
溶液 酸性溶液 中性溶液 碱性溶液
颜色 红色 紫色 绿色
下列溶液能使紫甘蓝汁变为红色的是
A.氯化钠溶液 B.醋酸溶液 C.氢氧化钡溶液 D.澄清石灰水
5.下列实验方案不能达到实验目的的是
选项 实验目的 实验方案
A 除去氮气中的氧气 通入灼热的铜粉
B 除去二氧化碳中的一氧化碳 点燃
C 区分氧化钙和氢氧化钙 加入水
D 区分水和过氧化氢溶液 加入二氧化锰
A.A B.B C.C D.D
6.现有一瓶浓盐酸和一瓶浓硫酸,若将它们暴露在空气中一段时间,变化的结果是
A.两瓶酸的溶质质量分数都减小 B.两瓶酸的溶质质量分数都增大
C.两瓶酸的质量都减小 D.两瓶酸的质量都增大
7.2021年岁尾,新冠肺炎又在国内局地蔓延。过氯乙酸(化学式为C2H4O3)是消灭新冠病毒的主要消毒剂之一,下列关于过氧乙酸的说法正确的是
A.过氧乙酸是一种氧化物
B.1个过氧乙酸分子中含有2个碳原子、1个氧原子和2个水分子
C.过氧乙酸中碳、氢、氧三种元素的质量比是2:4:3
D.配制和保存过氧乙酸不宜使用铁制容器
8.如图所示,有关电解水实验的说法正确的是
A.a中产生的气体是氢气
B.水中加入少量NaOH以增强导电性
C.在该实验中生成的氢气和氧气的质量比为2:1
D.该实验证明水是由氢元素和氧元素构成的
9.某化学小组利用如图所示的装置测定空气中氧气的含量,已知白磷燃烧的最低温度为40℃,下列关于该实验的说法错误的是
A.为避免误差,应待装置冷却至室温后再打开弹簧夹
B.若实验测得氧气的体积分数偏高,可能是试管中白磷的量不足
C.白磷燃烧说明生石灰溶于水放热
D.若注射器中的水最终减少了10mL,说明空气中氧气的体积分数约为20%
10.化学是一门以实验为基础的科学。下列实验设计不能达到目的的是
选项 A B C D
试验设计
实验目的 探究同种物质在不同溶剂中的溶解性 证明NaOH固体溶于水放热 探究“CO2与NaOH 是否发生化学反应” 探究温度对分子运动快慢的影响
A.A B.B C.C D.D
11.下列图象能正确反映其对应操作中各量变化关系的是
A.一定量的稀硫酸与锌粒反应
B.t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体
C.向一定量的过氧化氢溶液中加入少量二氧化锰
D.向10g溶质质量分数为2%的苛性钠溶液中逐滴滴入10g溶质质量分数为2%的盐酸
12.下列有关浓硫酸的实验操作正确的是
A.滴加 B.量取 C.稀释 D.干燥
A.A B.B C.C D.D
二、填空与简答
13.化学是以实验为基础的科学。根据下列实验图示,回答有关问题。
(1)图1实验操作中用玻璃棒不断搅拌的目的是 。
(2)指出图2中的错误 。
(3)图3是电解水的实验装置,a试管中所收集的气体是 。
(4)图4中可观察到的实验现象是 。
14.某化学兴趣小组将如图所示的实验搬上了舞台,震撼了师生,展示了化学的魅力。
(1)A实验可以比较空气与呼出气体中 含量的不同。
(2)B粉尘爆炸实验说明可燃物与氧气 ,燃烧越剧烈。
(3)C实验可用于研究CO2与NaOH溶液的反应。关闭止水夹K,将NaOH溶液全部挤入烧瓶,振荡;然后打开止水夹K。即可观察到水倒吸入烧瓶,变为红色,形成美丽喷泉。写出该反应的化学方程式 。
15.镓(Ga)及化合物应用广泛,常用于半导体、合金、磁性材料等领域,已知镓在化合物中通常为+3价。图甲是镓元素在元素周期表中的相关信息图,图乙是镓原子的原子结构示意图。请回答下列问题:
(1)由图甲可知镓的原子序数是 。
(2)图乙中的x的数值为 ,镓原子在化学反应中容易 (选填“得到”或“失去”)电子。
(3)镓(Ga)与常见金属铝有相似的化学性质。最外层电子数相同时,电子层数越多,原子核对核外电子的吸引力越小,越容易失去电子。比较两种金属原子失电子能力,镓原子的失电子能力比铝 (选填“强”或“弱”)。
(4)氢氧化镓是难溶于水的白色固体,取少量氢氧化镓固体于试管中,加入无色溶液X。充分振荡后固体完全溶解。溶液X可能是 (填化学式)。
(5)设计金属镓转化为氢氧化镓的一种方案: 、 (依次写出化学方程式)。
16.按要求回答下列问题:
Ⅰ.图a是将铜丝插入硝酸银溶液中反应的微观示意图。
(1)从微观粒子变化的角度分析该反应实际参加反应的粒子是 ,反应过程中溶液的质量 (填“增大、减小或不变”)。
Ⅱ.图b表示的是铁及其化合物的“化合价-物质类别”关系图。
(2)生铁和钢是常见的两种铁合金,其中含碳量相对较高的是 。
(3)暴露在空气中的化学方程式为,X的化学式为 。
(4)若a、b均代表硫酸盐,写出铁的氧化物与酸生成a的化学方程式 。
三、计算题
17.常温下,一锥形瓶中盛有20g溶质质量分数为4%的氢氧化钠溶液,再逐滴滴加溶质质量分数为3.65%的稀盐酸,用pH传感器测得溶液的pH与加入稀盐酸的关系曲线如图。请回答问题:
(1)把20g溶质质量分数为4%的氢氧化钠溶液稀释为2%,需加水 g。
(2)图中a点对应的溶液中溶质的化学式是 。
(3)pH=7时,此时消耗3.65%稀盐酸的质量是多少 ?(写出计算过程)。
(4)若改用溶质质量分数为7.3%的稀盐酸进行本实验,pH传感器测得的曲线可能经过 (填“甲”“乙”或“丙”)点。
18.现有一包Na2CO3和Na2SO4固体粉末混合物44.4g,向其中加入足量的稀H2SO4,产生气体的质量和加入稀H2SO4的质量关系如图所示。
(1)Na2CO3中钠元素与氧元素的质量比为 ,产生气体的质量为 g;
(2)恰好完全反应时,求所用稀H2SO4中溶质的质量;
(3)求恰好完全反应时溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.A
3.C
4.B
5.B
6.A
7.D
8.B
9.B
10.C
11.C
12.C
13.(1)防止滤液受热不均而飞溅
(2)NaOH固体不能直接放在托盘上称量
(3)氢气/
(4)红棕色粉末逐渐变黑
14.(1)氧气/O2
(2)接触面积越大
(3)CO2+2NaOH =Na2CO3+H2O
15.(1)31
(2) 8 失去
(3)强
(4)HCl/H2SO4
(5)
16.(1) Cu和 减小
(2)生铁
(3)
(4)
17.(1)20
(2)NaCl、HCl
(3)NaOH的质量为:20g×4%=0.8g
设消耗HCl的质量为x,则
x=0.73g
则稀盐酸的质量:0.73÷3.65%=20g
答:消耗3.65%稀盐酸的质量是20g。
(4)甲
18.(1) 46:48/23:24 4.4
(2)设:生成4.4g二氧化碳需要硫酸的质量为x。
x=9.8g。
答:所用稀H2SO4中溶质的质量为9.8g。
(3)设:生成4.4g二氧化碳需要碳酸钠的质量为y,生成硫酸钠的质量为z。
y =10.6g
恰好完全反应时溶液中溶质的质量分数:
答:恰好完全反应时溶液中溶质的质量分数为20%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
