第八单元金属和金属材料单元训练题--2023-2024学年九年级化学人教版下册(含答案)
文档属性
| 名称 | 第八单元金属和金属材料单元训练题--2023-2024学年九年级化学人教版下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-25 10:16:39 | ||
图片预览




文档简介
第八单元 金属和金属材料 单元训练题
一、选择题
1.化学源于生活,也服务于生产、生活。下列说法不正确的是
A.用灼烧观察颜色的方法鉴别真假黄金
B.“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质稳定,在自然界以单质形式存在
C.生活中常用铁做炊具,利用了铁的导热性,也可以用来补充人体所需的铁元素。
D.焊锡具有熔点高的特性,常用来焊接电路板上的电子元件
2.实验室中有一定质量的Cu(NO3)2和Mg(NO3)2的混合溶液,向其中加agZn粉,充分反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,向滤渣中加入稀盐酸,有气泡冒出。下列说法中,不合理的是
A.滤液一定是无色溶液
B.滤渣中一定含有Cu,一定不含Mg
C.滤液中一定含有Zn2+、Mg2+
D.滤渣的质量一定大于ag
3.下列操作能达到实验目的的是
选项 实验目的 实验操作
A 除去CO中的CO2 通过灼热CuO
B 检验气体中是否含有CO2 将燃着的木条伸入气体中
C 除去CuO中的Cu 在空气中灼烧(已知:Cu能和O2反应生成CuO)
D 鉴别N2、O2和CO2 分别倒入澄清石灰水振荡
A.A B.B C.C D.D
4.将一定量的铝粉和镁粉加入溶液中,充分反应后过滤,得到滤液甲和固体乙。已知固体乙由两种物质组成,下列分析中正确的是
A.滤液甲可能呈蓝色
B.该过程中Al一定参与了反应
C.滤液甲中溶质的组成情况有3种
D.固体乙的成分一定为Cu、Al
5.2022年卡塔尔世界杯(英语:FIFA World Cup Qatar2022)是第二十二届世界杯足球赛。卡塔尔国,首都多哈,位于波斯湾西南岸的卡塔尔半岛上。属热带沙漠气候,全国地势低平,石油和天然气资源非常丰富。下列有关叙述错误的是
A.卡塔尔自然资源品种较为单一,盛产的石油和天然气中,天然气是比较清洁的燃料
B.卡塔尔世界杯使用的能源,来自郊外的一个太阳能电池板农场,亦是清洁环保的绿色能源
C. “974球场”建筑体7成由集装箱构成,集装箱数量为974个。为确保集装箱搭建的主体强度,球场钢架结构中大量使用了金属材料
D.卡塔尔推出电动巴士车队,接送球迷往返体育场和其他地区。在提供便利的同时,减少了二氧化硫和二氧化碳等汽车尾气的排放
6.将一定量金属M加入到ZnSO4和CuSO4的混合溶液中,充分反应后,过滤,得到滤渣,滤液为无色,向滤渣中滴加稀盐酸有气泡产生。下列有关判断正确的是
A.金属活动性:M>Zn>Cu
B.滤渣中一定含有金属M
C.该过程一定发生了如下反应:M+CuSO4=Cu+MSO4
D.滤液中可能只含一种金属阳离子
7.下列整理的与化学有关的知识,内容完全正确的一组是
A.测量空气中氧气含量偏低的原因 B.化学中的“先”与“后”
1.红磷的量不足 2. 燃烧匙伸入集气瓶中的速度太慢 1.点燃可燃性气体,先验纯后点燃 2.用一氧化碳还原氧化铁,先加热后通入一氧化碳
C物质的除杂(括号内为杂质) D.物质的鉴别
1.CO2(CO):点燃 2.Cu(Fe):放入过量稀硫酸,过滤 1.CO和CO2——澄清石灰水 2.黄铜和黄金——用火烧
A.A B.B C.C D.D
8.向AgNO3和Cu(NO3)2的混合液中加入一定量的Fe、Cu的混合粉末,充分反应后过滤、洗涤,得到滤液和滤渣。下列说法正确的是
A.滤渣中一定有Ag,滤液中可能有Fe(NO3)2、Cu (NO3)2、AgNO3
B.当滤液为蓝色时,滤渣中一定有Cu、Ag,一定没有Fe
C.向滤渣中加入盐酸,有气泡产生,则滤渣中一定有Fe、Cu、Ag
D.向滤液中加入KCl溶液,无明显现象,则滤液中一定有Fe(NO3)2、Cu(NO3)2,滤渣中可能有Fe
9.科学思维是化学核心素养的重要组成部分,下列示例说法错误的是
A.比较:钢的含碳量高于生铁
B.分类:煤、石油、天然气均属于混合物
C.分析:CO与化学性质差异大,是因为构成它们的分子种类不同
D.推理:二氧化碳能用于灭火,可推知二氧化碳不可燃也不支持燃烧
10.类比、总结是学好化学的重要方法。下列对化学知识的归纳总结正确的是
A.单质中只含一种元素,所以只含一种元素的物质一定是单质
B.氧化物中一定含有氧元素,所以含氧元素的化合物一定是氧化物
C.金属铝与盐酸反应生成AlCl3和H2,所以铁和盐酸反应也生成FeCl3和H2
D.点燃H2、O2的混合气体可能发生爆炸,所以点燃CO、O2的混合气体也可能发生爆炸
11.下列四个图像,分别对应四种操作。其中正确的是
A.向一定量过氧化氢溶液中加入少量的二氧化锰
B.将一定质量的水通电电解一段时间
C.向等质量的Mg、Fe中分别加入足量且质量分数相同的稀盐酸
D.加热一定质量的高锰酸钾固体
12.用“”和“”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如下所示,下列说法正确的是
A.该反应是化合反应
B.该反应有2种生成物
C.每个生成物分子由3个原子构成
D.参加反应的“”和“”分子的个数比是2:1
13.如图是一氧化碳还原氧化铁的实验。下列有关该实验的说法不正确的是
A.该装置缺少尾气处理装置,会污染空气
B.点燃酒精灯前应持续通入 CO 防止发生爆炸
C.改用氢气进行该实验也能看到完全相同的现象
D.利用反应前后固体质量之差能算出参加反应的一氧化碳的质量
二、填空与简答
14.“逊克玛瑙,北红之源”。黑龙江省逊克县是中国最重要的玛瑙产地之一,逊克北红玛瑙的密度和品质均居世界玛瑙前列,素有“世界玛瑙看中国,中国玛瑙看逊克”美誉。玛瑙的主要成分是二氧化硅,玛瑙可制成首饰。因为常温下二氧化硅的化学性质 (填“活泼”或“稳定”)。在高温下,二氧化硅能与氧化钙(CaO)发生化合反应生成硅酸钙,此反应前后各元素化价没有变化,此反应的化学方程式是 ,此反应可用于高炉炼铁时的除渣,高炉炼铁时,利用黄铁矿(主要成分是二硫化亚铁,化学式是FeS2)炼铁的原理是在高温下利用FeS2与氧气反应,生成氧化铁和一种空气污染物,写出此反应的化学方程式 ,此反应前后铁元素化合价的变化是 。
15.要想吃可口的饭菜,就得吃妈妈亲手做的。如图是某厨房的一角,请根据要求填空。
(1)厨房中的排油烟机表面材料是不锈钢制成的,这是利用了不锈钢的 性质。
A.韧性好、硬度小 B.强度好、密度小 C.抗腐蚀性好
(2)不锈钢中除含铁外,还含有铬(Cr)等,冶炼铬是用三氧化二铬(Cr2O3)和金属铝在高温下发生置换反应制得的,此反应的化学方程式为 ,反应前后铬元素的化合价分别为 。
(3)厨房中炉具上使用的照明设备是电灯,电灯在照明时的能量转化为 。
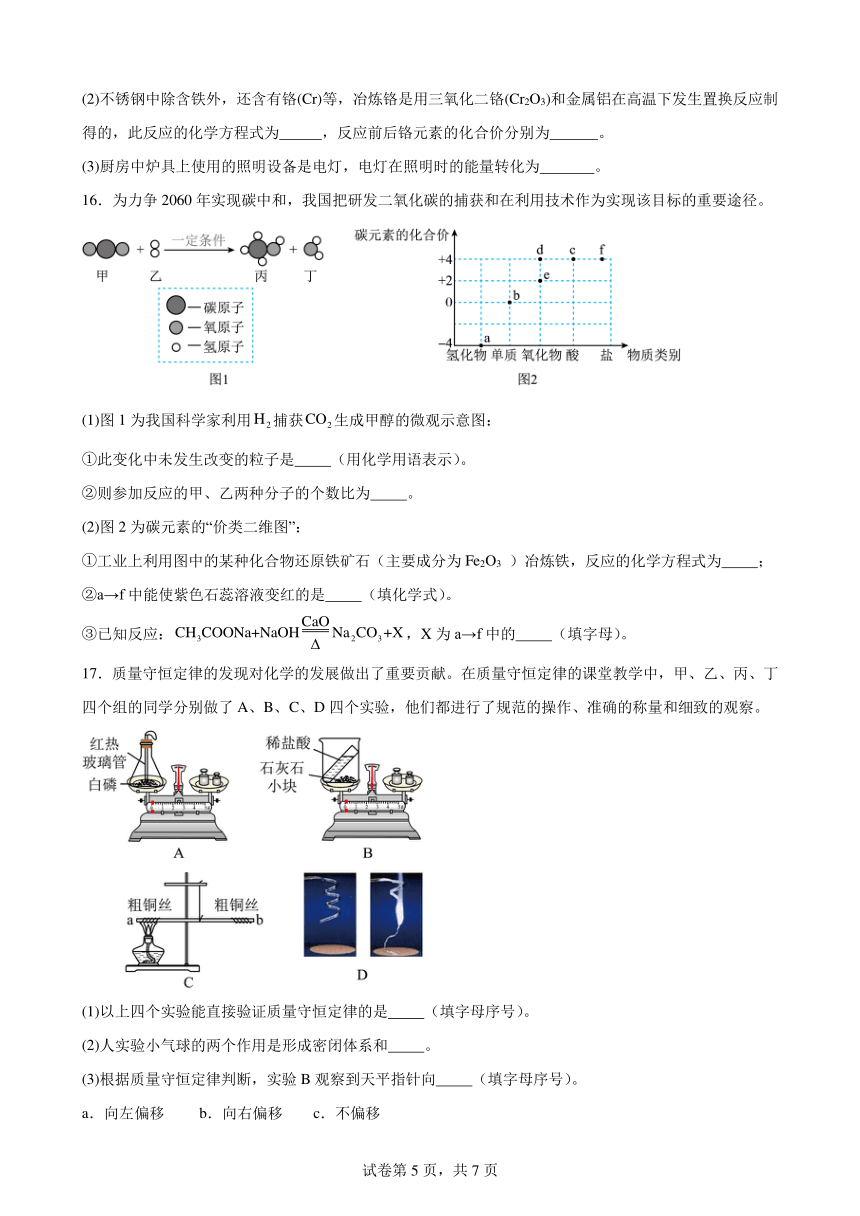
16.为力争2060年实现碳中和,我国把研发二氧化碳的捕获和在利用技术作为实现该目标的重要途径。
(1)图1为我国科学家利用捕获生成甲醇的微观示意图:
①此变化中未发生改变的粒子是 (用化学用语表示)。
②则参加反应的甲、乙两种分子的个数比为 。
(2)图2为碳元素的“价类二维图”:
①工业上利用图中的某种化合物还原铁矿石(主要成分为Fe2O3 )冶炼铁,反应的化学方程式为 ;
②a→f中能使紫色石蕊溶液变红的是 (填化学式)。
③已知反应:,X为a→f中的 (填字母)。
17.质量守恒定律的发现对化学的发展做出了重要贡献。在质量守恒定律的课堂教学中,甲、乙、丙、丁四个组的同学分别做了A、B、C、D四个实验,他们都进行了规范的操作、准确的称量和细致的观察。
(1)以上四个实验能直接验证质量守恒定律的是 (填字母序号)。
(2)人实验小气球的两个作用是形成密闭体系和 。
(3)根据质量守恒定律判断,实验B观察到天平指针向 (填字母序号)。
a.向左偏移 b.向右偏移 c.不偏移
(4)如图C所示的小实验。在一根用细铜丝吊着的长玻璃棒两端分别绕上长的粗铜线,并使玻璃棒保持水平。然后,用酒精灯给左边一端铜丝加热1~2分钟。冷却后,他们观察到左端下沉,其原因是 。
(5)如图D所示的实验,先在托盘天平上称量一小段洁净的镁条的质量,在空气中燃烧后再称量陶土网上燃烧产物的质量,观察到质量减小,其原因是 。
18.“共享单车”各大城市基本普及,骑单车出行的方式,不仅有利于节省我们的钱财,也能够很好的锻炼我们的身体,让我们拥有一个健康的体魄。请回答下列问题:
(1)自行车车架是锰钢制成的,锰钢具有的优良性能是_____(填字母)。
A.韧性好、硬度大 B.强度高、密度小 C.抗腐蚀性能好
(2)自行车的车架喷上油漆,其防锈的原理是:隔绝 ,防止金属生锈。
(3)铁锈的主要成分为: (填化学式)。
(4)单车的轮毂上需镀铬防腐,工业生产铬的方法是在高温条件下分解氧化铬(Cr2O3),同时可以得到一种化学性质比较活泼的气体,该反应的化学方程式为 ,反应前后铬元素的化合价的变化为 。
三、计算题
19.某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如下:
加入次数 第1次 第2次 第3次 第4次
加入稀硫酸质量(g) 100 100 100 100
充分反应后剩余固体质量(g) 43.5 37 35 n
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)计算第1次加入稀硫酸后产生的氢气的质量。(写出计算过程)
20.为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 20 20 20 20
烧杯中剩余物的质量(g) 39.92 59.84 79.80 99.80
(1)的相对分子质量为 ,中氢元素、硫元素和氧元素的质量比为 。
(2)黄铜粉末完全反应生成氢气的总质量为 g。
(3)该黄铜中铜的质量分数为多少?(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.C
4.D
5.D
6.D
7.D
8.C
9.A
10.D
11.A
12.A
13.C
14. 稳定 CaO+SiO2CaSiO3 4FeS2+11O22Fe2O3+8SO2 由+2价变为+3价
15.(1)C
(2) +3、0
(3)电能转化为光能
16.(1) C、O、H 1:3
(2) H2CO3 a
17.(1)A
(2)缓解压强
(3)b
(4)铜加热消耗氧气,固体质量增大
(5)扩散到空气中的白烟质量大于消耗的氧气的质量
18.(1)AC
(2)氧气和水
(3)Fe2O3
(4) +3到 0
19.(1)35
(2)70%
(3)解:由前面的分析可知,第1次加入100g的稀硫酸后反应掉6.5g的锌,设第1次加入稀硫酸后产生的氢气质量为x,则
解得x=0.2g
答:第1次加入稀硫酸后产生的氢气的质量为0.2g。
20.(1) 98 1:16:32
(2)0.2
(3)解:设黄铜中锌的质量为x
该黄铜中铜的质量分数为
答:该黄铜中铜的质量分数为67.5%。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.化学源于生活,也服务于生产、生活。下列说法不正确的是
A.用灼烧观察颜色的方法鉴别真假黄金
B.“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质稳定,在自然界以单质形式存在
C.生活中常用铁做炊具,利用了铁的导热性,也可以用来补充人体所需的铁元素。
D.焊锡具有熔点高的特性,常用来焊接电路板上的电子元件
2.实验室中有一定质量的Cu(NO3)2和Mg(NO3)2的混合溶液,向其中加agZn粉,充分反应后过滤,得到一定温度下的滤液(不饱和)和滤渣,向滤渣中加入稀盐酸,有气泡冒出。下列说法中,不合理的是
A.滤液一定是无色溶液
B.滤渣中一定含有Cu,一定不含Mg
C.滤液中一定含有Zn2+、Mg2+
D.滤渣的质量一定大于ag
3.下列操作能达到实验目的的是
选项 实验目的 实验操作
A 除去CO中的CO2 通过灼热CuO
B 检验气体中是否含有CO2 将燃着的木条伸入气体中
C 除去CuO中的Cu 在空气中灼烧(已知:Cu能和O2反应生成CuO)
D 鉴别N2、O2和CO2 分别倒入澄清石灰水振荡
A.A B.B C.C D.D
4.将一定量的铝粉和镁粉加入溶液中,充分反应后过滤,得到滤液甲和固体乙。已知固体乙由两种物质组成,下列分析中正确的是
A.滤液甲可能呈蓝色
B.该过程中Al一定参与了反应
C.滤液甲中溶质的组成情况有3种
D.固体乙的成分一定为Cu、Al
5.2022年卡塔尔世界杯(英语:FIFA World Cup Qatar2022)是第二十二届世界杯足球赛。卡塔尔国,首都多哈,位于波斯湾西南岸的卡塔尔半岛上。属热带沙漠气候,全国地势低平,石油和天然气资源非常丰富。下列有关叙述错误的是
A.卡塔尔自然资源品种较为单一,盛产的石油和天然气中,天然气是比较清洁的燃料
B.卡塔尔世界杯使用的能源,来自郊外的一个太阳能电池板农场,亦是清洁环保的绿色能源
C. “974球场”建筑体7成由集装箱构成,集装箱数量为974个。为确保集装箱搭建的主体强度,球场钢架结构中大量使用了金属材料
D.卡塔尔推出电动巴士车队,接送球迷往返体育场和其他地区。在提供便利的同时,减少了二氧化硫和二氧化碳等汽车尾气的排放
6.将一定量金属M加入到ZnSO4和CuSO4的混合溶液中,充分反应后,过滤,得到滤渣,滤液为无色,向滤渣中滴加稀盐酸有气泡产生。下列有关判断正确的是
A.金属活动性:M>Zn>Cu
B.滤渣中一定含有金属M
C.该过程一定发生了如下反应:M+CuSO4=Cu+MSO4
D.滤液中可能只含一种金属阳离子
7.下列整理的与化学有关的知识,内容完全正确的一组是
A.测量空气中氧气含量偏低的原因 B.化学中的“先”与“后”
1.红磷的量不足 2. 燃烧匙伸入集气瓶中的速度太慢 1.点燃可燃性气体,先验纯后点燃 2.用一氧化碳还原氧化铁,先加热后通入一氧化碳
C物质的除杂(括号内为杂质) D.物质的鉴别
1.CO2(CO):点燃 2.Cu(Fe):放入过量稀硫酸,过滤 1.CO和CO2——澄清石灰水 2.黄铜和黄金——用火烧
A.A B.B C.C D.D
8.向AgNO3和Cu(NO3)2的混合液中加入一定量的Fe、Cu的混合粉末,充分反应后过滤、洗涤,得到滤液和滤渣。下列说法正确的是
A.滤渣中一定有Ag,滤液中可能有Fe(NO3)2、Cu (NO3)2、AgNO3
B.当滤液为蓝色时,滤渣中一定有Cu、Ag,一定没有Fe
C.向滤渣中加入盐酸,有气泡产生,则滤渣中一定有Fe、Cu、Ag
D.向滤液中加入KCl溶液,无明显现象,则滤液中一定有Fe(NO3)2、Cu(NO3)2,滤渣中可能有Fe
9.科学思维是化学核心素养的重要组成部分,下列示例说法错误的是
A.比较:钢的含碳量高于生铁
B.分类:煤、石油、天然气均属于混合物
C.分析:CO与化学性质差异大,是因为构成它们的分子种类不同
D.推理:二氧化碳能用于灭火,可推知二氧化碳不可燃也不支持燃烧
10.类比、总结是学好化学的重要方法。下列对化学知识的归纳总结正确的是
A.单质中只含一种元素,所以只含一种元素的物质一定是单质
B.氧化物中一定含有氧元素,所以含氧元素的化合物一定是氧化物
C.金属铝与盐酸反应生成AlCl3和H2,所以铁和盐酸反应也生成FeCl3和H2
D.点燃H2、O2的混合气体可能发生爆炸,所以点燃CO、O2的混合气体也可能发生爆炸
11.下列四个图像,分别对应四种操作。其中正确的是
A.向一定量过氧化氢溶液中加入少量的二氧化锰
B.将一定质量的水通电电解一段时间
C.向等质量的Mg、Fe中分别加入足量且质量分数相同的稀盐酸
D.加热一定质量的高锰酸钾固体
12.用“”和“”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的微观示意图如下所示,下列说法正确的是
A.该反应是化合反应
B.该反应有2种生成物
C.每个生成物分子由3个原子构成
D.参加反应的“”和“”分子的个数比是2:1
13.如图是一氧化碳还原氧化铁的实验。下列有关该实验的说法不正确的是
A.该装置缺少尾气处理装置,会污染空气
B.点燃酒精灯前应持续通入 CO 防止发生爆炸
C.改用氢气进行该实验也能看到完全相同的现象
D.利用反应前后固体质量之差能算出参加反应的一氧化碳的质量
二、填空与简答
14.“逊克玛瑙,北红之源”。黑龙江省逊克县是中国最重要的玛瑙产地之一,逊克北红玛瑙的密度和品质均居世界玛瑙前列,素有“世界玛瑙看中国,中国玛瑙看逊克”美誉。玛瑙的主要成分是二氧化硅,玛瑙可制成首饰。因为常温下二氧化硅的化学性质 (填“活泼”或“稳定”)。在高温下,二氧化硅能与氧化钙(CaO)发生化合反应生成硅酸钙,此反应前后各元素化价没有变化,此反应的化学方程式是 ,此反应可用于高炉炼铁时的除渣,高炉炼铁时,利用黄铁矿(主要成分是二硫化亚铁,化学式是FeS2)炼铁的原理是在高温下利用FeS2与氧气反应,生成氧化铁和一种空气污染物,写出此反应的化学方程式 ,此反应前后铁元素化合价的变化是 。
15.要想吃可口的饭菜,就得吃妈妈亲手做的。如图是某厨房的一角,请根据要求填空。
(1)厨房中的排油烟机表面材料是不锈钢制成的,这是利用了不锈钢的 性质。
A.韧性好、硬度小 B.强度好、密度小 C.抗腐蚀性好
(2)不锈钢中除含铁外,还含有铬(Cr)等,冶炼铬是用三氧化二铬(Cr2O3)和金属铝在高温下发生置换反应制得的,此反应的化学方程式为 ,反应前后铬元素的化合价分别为 。
(3)厨房中炉具上使用的照明设备是电灯,电灯在照明时的能量转化为 。
16.为力争2060年实现碳中和,我国把研发二氧化碳的捕获和在利用技术作为实现该目标的重要途径。
(1)图1为我国科学家利用捕获生成甲醇的微观示意图:
①此变化中未发生改变的粒子是 (用化学用语表示)。
②则参加反应的甲、乙两种分子的个数比为 。
(2)图2为碳元素的“价类二维图”:
①工业上利用图中的某种化合物还原铁矿石(主要成分为Fe2O3 )冶炼铁,反应的化学方程式为 ;
②a→f中能使紫色石蕊溶液变红的是 (填化学式)。
③已知反应:,X为a→f中的 (填字母)。
17.质量守恒定律的发现对化学的发展做出了重要贡献。在质量守恒定律的课堂教学中,甲、乙、丙、丁四个组的同学分别做了A、B、C、D四个实验,他们都进行了规范的操作、准确的称量和细致的观察。
(1)以上四个实验能直接验证质量守恒定律的是 (填字母序号)。
(2)人实验小气球的两个作用是形成密闭体系和 。
(3)根据质量守恒定律判断,实验B观察到天平指针向 (填字母序号)。
a.向左偏移 b.向右偏移 c.不偏移
(4)如图C所示的小实验。在一根用细铜丝吊着的长玻璃棒两端分别绕上长的粗铜线,并使玻璃棒保持水平。然后,用酒精灯给左边一端铜丝加热1~2分钟。冷却后,他们观察到左端下沉,其原因是 。
(5)如图D所示的实验,先在托盘天平上称量一小段洁净的镁条的质量,在空气中燃烧后再称量陶土网上燃烧产物的质量,观察到质量减小,其原因是 。
18.“共享单车”各大城市基本普及,骑单车出行的方式,不仅有利于节省我们的钱财,也能够很好的锻炼我们的身体,让我们拥有一个健康的体魄。请回答下列问题:
(1)自行车车架是锰钢制成的,锰钢具有的优良性能是_____(填字母)。
A.韧性好、硬度大 B.强度高、密度小 C.抗腐蚀性能好
(2)自行车的车架喷上油漆,其防锈的原理是:隔绝 ,防止金属生锈。
(3)铁锈的主要成分为: (填化学式)。
(4)单车的轮毂上需镀铬防腐,工业生产铬的方法是在高温条件下分解氧化铬(Cr2O3),同时可以得到一种化学性质比较活泼的气体,该反应的化学方程式为 ,反应前后铬元素的化合价的变化为 。
三、计算题
19.某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如下:
加入次数 第1次 第2次 第3次 第4次
加入稀硫酸质量(g) 100 100 100 100
充分反应后剩余固体质量(g) 43.5 37 35 n
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)计算第1次加入稀硫酸后产生的氢气的质量。(写出计算过程)
20.为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 20 20 20 20
烧杯中剩余物的质量(g) 39.92 59.84 79.80 99.80
(1)的相对分子质量为 ,中氢元素、硫元素和氧元素的质量比为 。
(2)黄铜粉末完全反应生成氢气的总质量为 g。
(3)该黄铜中铜的质量分数为多少?(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.C
4.D
5.D
6.D
7.D
8.C
9.A
10.D
11.A
12.A
13.C
14. 稳定 CaO+SiO2CaSiO3 4FeS2+11O22Fe2O3+8SO2 由+2价变为+3价
15.(1)C
(2) +3、0
(3)电能转化为光能
16.(1) C、O、H 1:3
(2) H2CO3 a
17.(1)A
(2)缓解压强
(3)b
(4)铜加热消耗氧气,固体质量增大
(5)扩散到空气中的白烟质量大于消耗的氧气的质量
18.(1)AC
(2)氧气和水
(3)Fe2O3
(4) +3到 0
19.(1)35
(2)70%
(3)解:由前面的分析可知,第1次加入100g的稀硫酸后反应掉6.5g的锌,设第1次加入稀硫酸后产生的氢气质量为x,则
解得x=0.2g
答:第1次加入稀硫酸后产生的氢气的质量为0.2g。
20.(1) 98 1:16:32
(2)0.2
(3)解:设黄铜中锌的质量为x
该黄铜中铜的质量分数为
答:该黄铜中铜的质量分数为67.5%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
