化学人教版(2019)必修第二册7.3.1乙醇(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 119.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-25 19:08:20 | ||
图片预览







文档简介
第三节 乙醇与乙酸
第一课时 乙醇
1
2
知道乙醇的组成、结构、官能团、物理性质及用途。
了解烃的衍生物的概念及官能团与性质的关系,认识羟基与其性质的关系。
会运用乙醇的结构分析其化学性质。
3
核心素养
1
微观探析:从官能团的角度认识乙醇的组成、结构、性质和变化,形成
“结构决定性质”的观念。
2
科学探究:设计实验探究乙醇的结构与性质。
含酒精:3% - 5%
含酒精:75%
含酒精:38% - 65%
酒文化博大精深,源远流长,早在几千年前,人类就掌握了发酵法酿酒的技术,
酒精在生活中也很常见。
生活中的乙醇
啤酒
白酒
消毒液
乙醇(俗称酒精)
颜色:
状态:
气味:
沸点:
密度:
溶解度:
无色透明
特殊香味
液体
比水小 20℃时,密度是0.7893g/ml
跟水以任意比互溶,能够溶解多种有机物,是重要的有机溶剂。
78.5℃(易挥发)
乙醇的物理性质
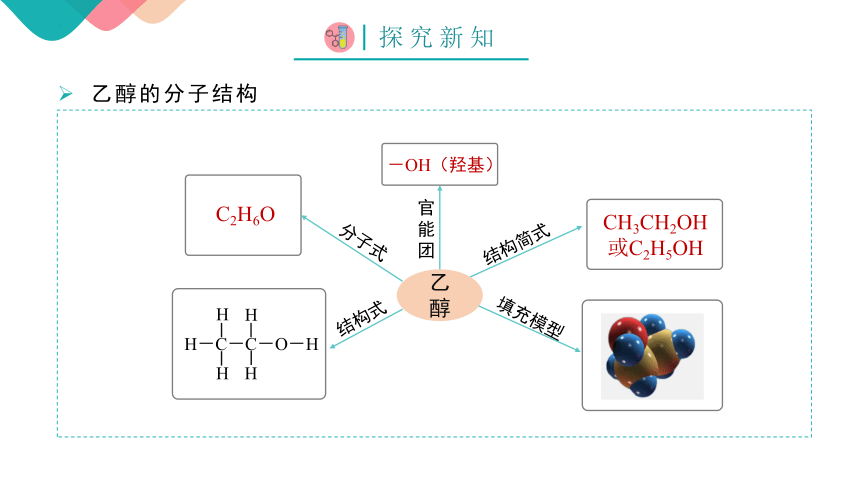
乙醇的分子结构
C2H6O
CH3CH2OH
或C2H5OH
乙 醇
-OH(羟基)
H-C-C-O-H
H
H
H
H
官
能
团
结构简式
结构式
分子式
填充模型
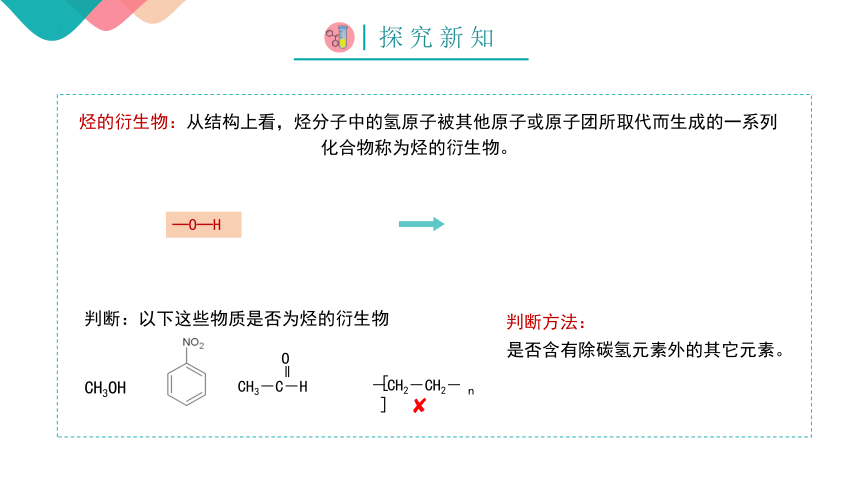
烃的衍生物:从结构上看,烃分子中的氢原子被其他原子或原子团所取代而生成的一系列
化合物称为烃的衍生物。
判断:以下这些物质是否为烃的衍生物
判断方法:
是否含有除碳氢元素外的其它元素。
—O—H
?
CH3OH
CH3-C-H
O
-CH2-CH2-
[ ]
n
乙基
烃基概念:烃分子失去1个氢原子后所剩余的部分叫烃基,可以用-R表示。
如-CH3 叫甲基,-CH2CH3 叫乙基。
—O—H
乙烷中的氢原子被氧氢原子团替代后,
性质上会有什么不同呢?
实验7-4:乙醇与钠反应
资料
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验现象
实验结论
点燃生成的气体,产生淡蓝色火焰,烧杯
内壁有水雾,澄清石灰水不变浑浊。
钠表面有气泡产生,随后逐渐浮到水面上,
慢慢消失
钠先沉入液体底部
钠的密度比乙醇的大
反应缓慢,产生气体
有氢气生成
实验7-4:乙醇与钠反应
1. 与活泼金属(如Na)反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
H H
│ │
H─ C ─ C─ O─ H
│ │
H H
乙醇钠
思考1:根据钠与乙醇、水反应的现象,比较氧氢键中氢的活泼性。
钠与水反应比钠与乙醇反应更剧烈。
所以乙醇氧氢键中的氢原子不如水分子中的氢原子活泼
乙醇的性质
官能团:决定有机化合物的化学特性的原子或原子团
碳碳双键
碳碳三键
H—C≡C—H
羟基,写作-OH
氧 氢
羟 qiǎng
—O—H
C C
H
H
H
H
(1)乙醇的燃烧
点燃
CH3CH2OH + 3O2 2CO2 + 3H2O
产物检验:
点燃酒精灯,将一个干燥烧杯罩在火焰上,烧杯内壁有水珠,燃烧产物有水。
将一个用澄清石灰水润湿内壁的烧杯罩在火焰上,内壁附着的石灰水变浑浊,
说明有二氧化碳生成。
写出乙醇燃烧的化学方程式,如何检验燃烧产物?
固态酒精
乙醇的化学性质
2. 乙醇的氧化反应
焊接银器、铜器时,表面会生成发黑的氧化膜,如果马上蘸一下酒精,铜银会光亮如初!这是何原理?
乙醇的化学性质
实验7-5:乙醇的催化氧化实验
资料
操作
现象
转化
将下端绕成螺旋状的铜丝在酒精灯上灼烧
将表面变黑的铜丝灼热后立即插入盛有无水乙醇的试管中,反复操作几次
铜丝由红色变为黑色
乙醇沸腾,铜丝表面恢复红亮,闻到刺激性气味
Cu→CuO
CuO→Cu
CH3CH2OH → CH3CHO
乙醛
实验7-5:乙醇的催化氧化实验
① 2Cu + O2 2CuO
Δ
总反应式(① + ②×2)
Cu/Ag
2 CH3CH2OH + O2 2 CH3CHO + 2 H2O
Δ
思考:反应整个过程铜的作用是什么?
催化剂
乙醇的化学性质
2. 乙醇的氧化反应
(2)乙醇的催化氧化
②
CH3 C H
H
OH
+ CuO
Δ
+ H2O + Cu
CH3 CH
O
( 乙醛 )
2 CH3CH2OH + O2 2 CH3CHO + 2 H2O
Cu/Δ
C2H6O C2H4O
去氢,被氧化
乙醛
乙醇
H H
│ │
H─ C ─ C─ O─ H
│ │
H H
H H
│ │
H─ C ─ C= O
│
H
乙醛是无色、有刺激性气味的液体,结构简式为CH3CHO,官能团为醛基-CHO)
乙醇的化学性质
2. 乙醇的氧化反应
(2)乙醇的催化氧化
CH3CH2OH
CH3CHO
Cu/O2
Δ
CH3COOH
O2
一定条件
CO2
O2
点燃
O2点燃
还原剂
氧化剂
乙醛加氧
乙醇去氢
不同条件,氧化产物不同
KMnO4 / H+
K2Cr2O7 / H+
不同氧化剂,氧化产物不同
小 结:乙醇的氧化反应
乙醇在人体中是怎样消化的呢?
为什么饮酒后醉酒的人常常会脸红、头疼、呕吐甚至出现生命危险呢?
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2 + H2O
乙醛脱氢酶
(ALDH)
人饮酒后大部分在肝内氧化分解。乙醇先经醇脱氢酶的氧化,被氧化为乙醛,然后在醛脱氢酶的作用下氧化为乙酸,参加体内正常的乙酸代谢,最后生成CO2和H2O,释放出能量。乙醛氧化为乙酸的速度较快,因此在一般饮酒量不多的情况下,乙醛不致于在体内积蓄,但如果大量饮酒,即可发生乙醛积蓄,乙醛的毒性是乙醇的三十倍以上,肝细胞内乙醛浓度增加会导致肝脏受损伤,所以常喝酒会伤肝,也会给人带来其他疾病。
生活中的乙醇
③用作酒精灯、火锅、内燃机等的燃料
④用作重要的有机化工原料和溶剂
②医疗上常用体积分数为75%的乙醇溶液作消毒剂
①用于生产饮品
乙醇的用途
1. 下列说法中正确的是( )
A. 乙醇分子中有—OH基团,所以乙醇溶于水后溶液显碱性
B. 乙醇与钠反应可以产生氢气,所以乙醇溶于水后溶液显酸性
C. 乙醇在空气中燃烧生成二氧化碳和水,说明乙醇分子中含有C、H、O
三种元素
D. 乙醇羟基中的氢原子比乙烷中的氢原子活泼
D
2. 将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加
的是( )
A. 硝酸 B. 无水乙醇 C. 石灰水 D. 盐酸
C
3. 能证明乙醇分子中含有一个羟基的事实是( )
A. 乙醇完全燃烧生成水
B. 0.1 mol乙醇与足量的钠反应生成 0.05 mol氢气
C. 乙醇能与水以任意比例互溶
D. 乙醇容易挥发
B
4. 乙醇、乙二醇( )、丙三醇( )分别与足量
金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为( )
A. 6∶3∶2 B. 1∶2∶3 C. 3∶2∶1 D. 4∶3∶2
A
CH2OHCH2OH
CH2OHCHOHCH2OH
5. 乙醇分子中有5种化学键,如图所示 ,在不同的反应中会有不同形式
的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1) 和金属钠反应,断裂的化学键为________(填断键序号,下同)。
①
(2) 乙醇在空气中充分燃烧,反应时断裂的化学键为_____________。
①②③④⑤
(3) 将弯成螺旋状的铜丝灼烧,铜丝变黑,然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,在此过程中,乙醇分子中断裂的化学键为 。
①③
二、乙醇的分子结构
一、乙醇的物理性质
三、乙醇的化学性质
1. 与活泼金属(K、Ca、Na)反应
2. 氧化反应(燃烧、催化氧化、与强氧化剂)
四、乙醇的用途
H H
│ │
H─ C ─ C─ O─ H
│ │
H H
第一课时 乙醇
1
2
知道乙醇的组成、结构、官能团、物理性质及用途。
了解烃的衍生物的概念及官能团与性质的关系,认识羟基与其性质的关系。
会运用乙醇的结构分析其化学性质。
3
核心素养
1
微观探析:从官能团的角度认识乙醇的组成、结构、性质和变化,形成
“结构决定性质”的观念。
2
科学探究:设计实验探究乙醇的结构与性质。
含酒精:3% - 5%
含酒精:75%
含酒精:38% - 65%
酒文化博大精深,源远流长,早在几千年前,人类就掌握了发酵法酿酒的技术,
酒精在生活中也很常见。
生活中的乙醇
啤酒
白酒
消毒液
乙醇(俗称酒精)
颜色:
状态:
气味:
沸点:
密度:
溶解度:
无色透明
特殊香味
液体
比水小 20℃时,密度是0.7893g/ml
跟水以任意比互溶,能够溶解多种有机物,是重要的有机溶剂。
78.5℃(易挥发)
乙醇的物理性质
乙醇的分子结构
C2H6O
CH3CH2OH
或C2H5OH
乙 醇
-OH(羟基)
H-C-C-O-H
H
H
H
H
官
能
团
结构简式
结构式
分子式
填充模型
烃的衍生物:从结构上看,烃分子中的氢原子被其他原子或原子团所取代而生成的一系列
化合物称为烃的衍生物。
判断:以下这些物质是否为烃的衍生物
判断方法:
是否含有除碳氢元素外的其它元素。
—O—H
?
CH3OH
CH3-C-H
O
-CH2-CH2-
[ ]
n
乙基
烃基概念:烃分子失去1个氢原子后所剩余的部分叫烃基,可以用-R表示。
如-CH3 叫甲基,-CH2CH3 叫乙基。
—O—H
乙烷中的氢原子被氧氢原子团替代后,
性质上会有什么不同呢?
实验7-4:乙醇与钠反应
资料
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验现象
实验结论
点燃生成的气体,产生淡蓝色火焰,烧杯
内壁有水雾,澄清石灰水不变浑浊。
钠表面有气泡产生,随后逐渐浮到水面上,
慢慢消失
钠先沉入液体底部
钠的密度比乙醇的大
反应缓慢,产生气体
有氢气生成
实验7-4:乙醇与钠反应
1. 与活泼金属(如Na)反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
H H
│ │
H─ C ─ C─ O─ H
│ │
H H
乙醇钠
思考1:根据钠与乙醇、水反应的现象,比较氧氢键中氢的活泼性。
钠与水反应比钠与乙醇反应更剧烈。
所以乙醇氧氢键中的氢原子不如水分子中的氢原子活泼
乙醇的性质
官能团:决定有机化合物的化学特性的原子或原子团
碳碳双键
碳碳三键
H—C≡C—H
羟基,写作-OH
氧 氢
羟 qiǎng
—O—H
C C
H
H
H
H
(1)乙醇的燃烧
点燃
CH3CH2OH + 3O2 2CO2 + 3H2O
产物检验:
点燃酒精灯,将一个干燥烧杯罩在火焰上,烧杯内壁有水珠,燃烧产物有水。
将一个用澄清石灰水润湿内壁的烧杯罩在火焰上,内壁附着的石灰水变浑浊,
说明有二氧化碳生成。
写出乙醇燃烧的化学方程式,如何检验燃烧产物?
固态酒精
乙醇的化学性质
2. 乙醇的氧化反应
焊接银器、铜器时,表面会生成发黑的氧化膜,如果马上蘸一下酒精,铜银会光亮如初!这是何原理?
乙醇的化学性质
实验7-5:乙醇的催化氧化实验
资料
操作
现象
转化
将下端绕成螺旋状的铜丝在酒精灯上灼烧
将表面变黑的铜丝灼热后立即插入盛有无水乙醇的试管中,反复操作几次
铜丝由红色变为黑色
乙醇沸腾,铜丝表面恢复红亮,闻到刺激性气味
Cu→CuO
CuO→Cu
CH3CH2OH → CH3CHO
乙醛
实验7-5:乙醇的催化氧化实验
① 2Cu + O2 2CuO
Δ
总反应式(① + ②×2)
Cu/Ag
2 CH3CH2OH + O2 2 CH3CHO + 2 H2O
Δ
思考:反应整个过程铜的作用是什么?
催化剂
乙醇的化学性质
2. 乙醇的氧化反应
(2)乙醇的催化氧化
②
CH3 C H
H
OH
+ CuO
Δ
+ H2O + Cu
CH3 CH
O
( 乙醛 )
2 CH3CH2OH + O2 2 CH3CHO + 2 H2O
Cu/Δ
C2H6O C2H4O
去氢,被氧化
乙醛
乙醇
H H
│ │
H─ C ─ C─ O─ H
│ │
H H
H H
│ │
H─ C ─ C= O
│
H
乙醛是无色、有刺激性气味的液体,结构简式为CH3CHO,官能团为醛基-CHO)
乙醇的化学性质
2. 乙醇的氧化反应
(2)乙醇的催化氧化
CH3CH2OH
CH3CHO
Cu/O2
Δ
CH3COOH
O2
一定条件
CO2
O2
点燃
O2点燃
还原剂
氧化剂
乙醛加氧
乙醇去氢
不同条件,氧化产物不同
KMnO4 / H+
K2Cr2O7 / H+
不同氧化剂,氧化产物不同
小 结:乙醇的氧化反应
乙醇在人体中是怎样消化的呢?
为什么饮酒后醉酒的人常常会脸红、头疼、呕吐甚至出现生命危险呢?
乙醇
乙醛
乙酸
乙醇脱氢酶
CO2 + H2O
乙醛脱氢酶
(ALDH)
人饮酒后大部分在肝内氧化分解。乙醇先经醇脱氢酶的氧化,被氧化为乙醛,然后在醛脱氢酶的作用下氧化为乙酸,参加体内正常的乙酸代谢,最后生成CO2和H2O,释放出能量。乙醛氧化为乙酸的速度较快,因此在一般饮酒量不多的情况下,乙醛不致于在体内积蓄,但如果大量饮酒,即可发生乙醛积蓄,乙醛的毒性是乙醇的三十倍以上,肝细胞内乙醛浓度增加会导致肝脏受损伤,所以常喝酒会伤肝,也会给人带来其他疾病。
生活中的乙醇
③用作酒精灯、火锅、内燃机等的燃料
④用作重要的有机化工原料和溶剂
②医疗上常用体积分数为75%的乙醇溶液作消毒剂
①用于生产饮品
乙醇的用途
1. 下列说法中正确的是( )
A. 乙醇分子中有—OH基团,所以乙醇溶于水后溶液显碱性
B. 乙醇与钠反应可以产生氢气,所以乙醇溶于水后溶液显酸性
C. 乙醇在空气中燃烧生成二氧化碳和水,说明乙醇分子中含有C、H、O
三种元素
D. 乙醇羟基中的氢原子比乙烷中的氢原子活泼
D
2. 将等质量的铜片在酒精灯上加热后,分别插入下列溶液中,放置片刻,铜片质量增加
的是( )
A. 硝酸 B. 无水乙醇 C. 石灰水 D. 盐酸
C
3. 能证明乙醇分子中含有一个羟基的事实是( )
A. 乙醇完全燃烧生成水
B. 0.1 mol乙醇与足量的钠反应生成 0.05 mol氢气
C. 乙醇能与水以任意比例互溶
D. 乙醇容易挥发
B
4. 乙醇、乙二醇( )、丙三醇( )分别与足量
金属钠作用,产生等量的氢气。则这三种醇的物质的量之比为( )
A. 6∶3∶2 B. 1∶2∶3 C. 3∶2∶1 D. 4∶3∶2
A
CH2OHCH2OH
CH2OHCHOHCH2OH
5. 乙醇分子中有5种化学键,如图所示 ,在不同的反应中会有不同形式
的化学键断裂,根据下列不同反应,按要求回答相关问题。
(1) 和金属钠反应,断裂的化学键为________(填断键序号,下同)。
①
(2) 乙醇在空气中充分燃烧,反应时断裂的化学键为_____________。
①②③④⑤
(3) 将弯成螺旋状的铜丝灼烧,铜丝变黑,然后将灼热的铜丝插入乙醇中,铜丝表面由黑变红,在此过程中,乙醇分子中断裂的化学键为 。
①③
二、乙醇的分子结构
一、乙醇的物理性质
三、乙醇的化学性质
1. 与活泼金属(K、Ca、Na)反应
2. 氧化反应(燃烧、催化氧化、与强氧化剂)
四、乙醇的用途
H H
│ │
H─ C ─ C─ O─ H
│ │
H H
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
