北京市第二中学教育集团2023-2024学年高三下学期2月月考测试化学试卷(PDF版含答案)
文档属性
| 名称 | 北京市第二中学教育集团2023-2024学年高三下学期2月月考测试化学试卷(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-25 20:21:32 | ||
图片预览


文档简介
2023-2024学年第二学期高三2月月考测试
化 学
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56
一、选择题(每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。)
1.下列化学用语或图示表达不.正.确.的是
A.NaCl的电子式: B.基态 Cr 原子的价层电子排布式:3d4 4s2
C.乙醇的分子式:C2H6O D.乙炔的分子空间填充模型:
2.下列说法不.正.确.的是
A.葡萄糖、蔗糖、纤维素都是糖类物质,都可发生水解反应
B.天然植物油中不饱和脂肪酸甘油酯含量高,常温下呈液态
C.氨基酸、二肽、蛋白质均既能与强酸又能与强碱反应
D.淀粉水解液加足量碱后,再加新制氢氧化铜浊液,加热,产生砖红色沉淀
3.下列说法正确的是
A.HCl 和 Cl2 分子中均含有 s-p σ 键
B.NH3和 NH4+的 VSEPR模型和空间结构均一致
C.熔点:金刚石>碳化硅>晶体硅
D.酸性:CH3COOH > CH2ClCOOH > CCl3COOH
4.用 NA表示阿伏伽德罗常数,下列说法正确的是
A.23g NO2与足量水反应,转移的电子数约为 NA
B.标准状况下,22.4L 15NH3含有的质子数约为 10 NA
C 1.常温下,1L0.1mol L NH NO +4 3溶液中含有的 NH4 数约为 0.1 NA
D.0.1 mol 环氧乙烷( )中含有共价键的总数约为 0.3 NA
5.下列用于解释事实的离子方程式不.正.确.的是
A.向 AgCl 悬浊液中加入 Na2S 溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)
B.向酸性 KMnO4溶液中加入 NaHSO3固体,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向 NaHCO3溶液中加入过量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
行政班 教学班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
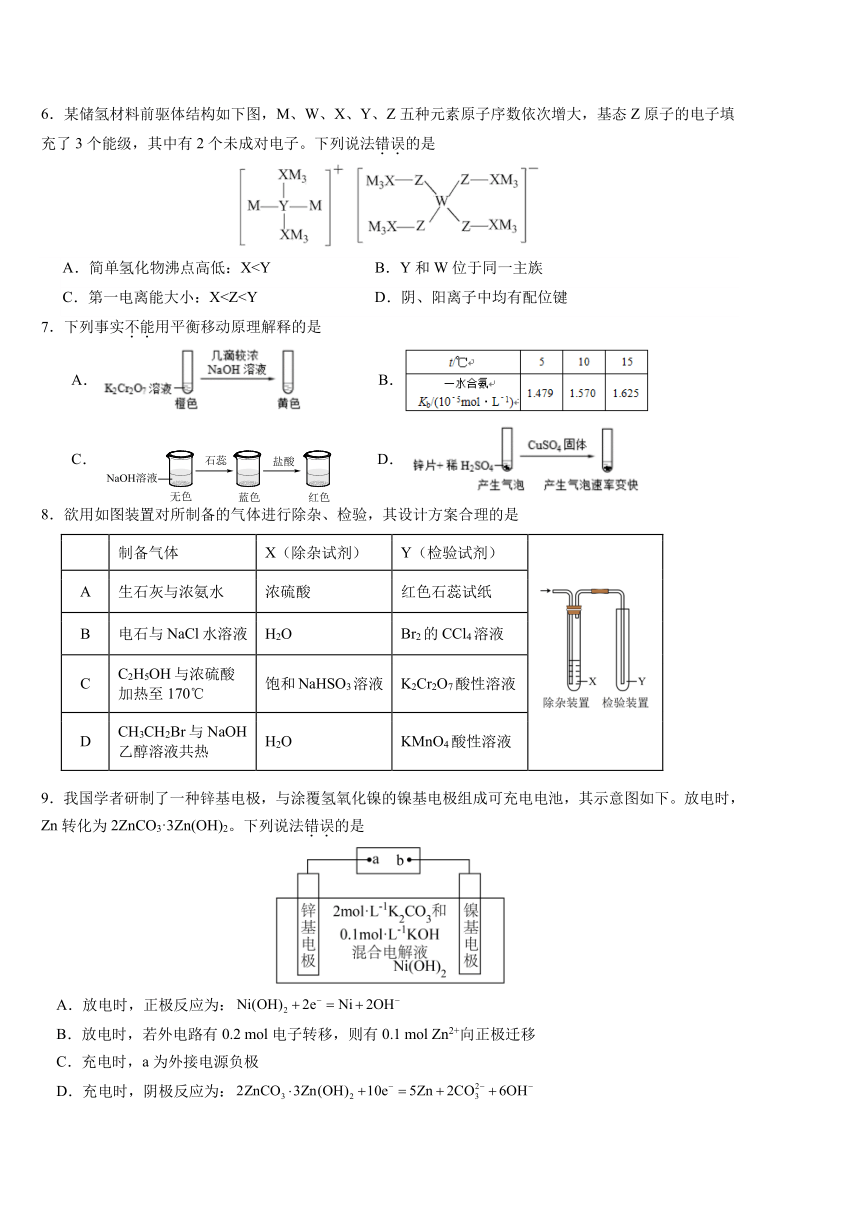
6.某储氢材料前驱体结构如下图,M、W、X、Y、Z 五种元素原子序数依次增大,基态 Z 原子的电子填
充了 3 个能级,其中有 2 个未成对电子。下列说法错.误.的是
A.简单氢化物沸点高低:XC.第一电离能大小:X7.下列事实不.能.用平衡移动原理解释的是
A. B.
C. 石 蕊 盐 酸 D.
NaOH溶液
无色 蓝色 红色
8.欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是
制备气体 X(除杂试剂) Y(检验试剂)
A 生石灰与浓氨水 浓硫酸 红色石蕊试纸
B 电石与 NaCl 水溶液 H2O Br2的 CCl4溶液
C C2H5OH 与浓硫酸170 饱和NaHSO3溶液 K2Cr2O7酸性溶液 加热至 ℃
D CH3CH2Br 与 NaOH H2O KMnO4酸性溶液 乙醇溶液共热
9.我国学者研制了一种锌基电极,与涂覆氢氧化镍的镍基电极组成可充电电池,其示意图如下。放电时,
Zn 转化为 2ZnCO3·3Zn(OH)2。下列说法错.误.的是
A.放电时,正极反应为:Ni(OH) + 2e 2 = Ni + 2OH
B.放电时,若外电路有 0.2 mol 电子转移,则有 0.1 mol Zn2+向正极迁移
C.充电时,a 为外接电源负极
D 2 .充电时,阴极反应为: 2ZnCO3 3Zn(OH)2 +10e = 5Zn + 2CO3 + 6OH
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
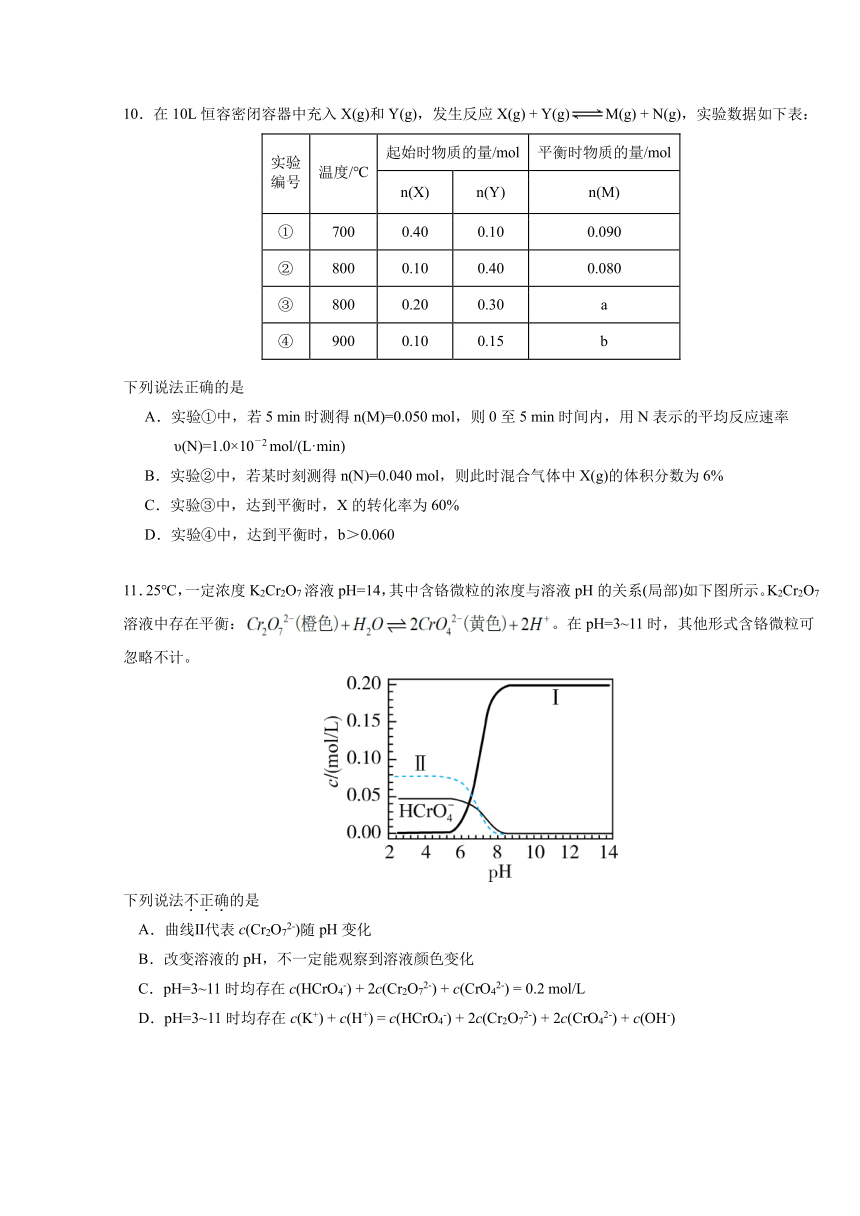
10.在 10L 恒容密闭容器中充入 X(g)和 Y(g),发生反应 X(g) + Y(g) M(g) + N(g),实验数据如下表:
起始时物质的量/mol 平衡时物质的量/mol 实验
编号 温度
/℃
n(X) n(Y) n(M)
① 700 0.40 0.10 0.090
② 800 0.10 0.40 0.080
③ 800 0.20 0.30 a
④ 900 0.10 0.15 b
下列说法正确的是
A.实验①中,若 5 min 时测得 n(M)=0.050 mol,则 0 至 5 min 时间内,用 N 表示的平均反应速率
υ(N)=1.0×10-2 mol/(L·min)
B.实验②中,若某时刻测得 n(N)=0.040 mol,则此时混合气体中 X(g)的体积分数为 6%
C.实验③中,达到平衡时,X 的转化率为 60%
D.实验④中,达到平衡时,b>0.060
11.25℃,一定浓度 K2Cr2O7 溶液 pH=14,其中含铬微粒的浓度与溶液 pH 的关系(局部)如下图所示。K2Cr2O7
溶液中存在平衡: 。在 pH=3~11 时,其他形式含铬微粒可
忽略不计。
下列说法不.正.确.的是
A.曲线Ⅱ代表 c(Cr2O72-)随 pH 变化
B.改变溶液的 pH,不一定能观察到溶液颜色变化
C.pH=3~11 时均存在 c(HCrO4-) + 2c(Cr2O72-) + c(CrO42-) = 0.2 mol/L
D.pH=3~11 时均存在 c(K+) + c(H+) = c(HCrO4-) + 2c(Cr2O72-) + 2c(CrO42-) + c(OH-)
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
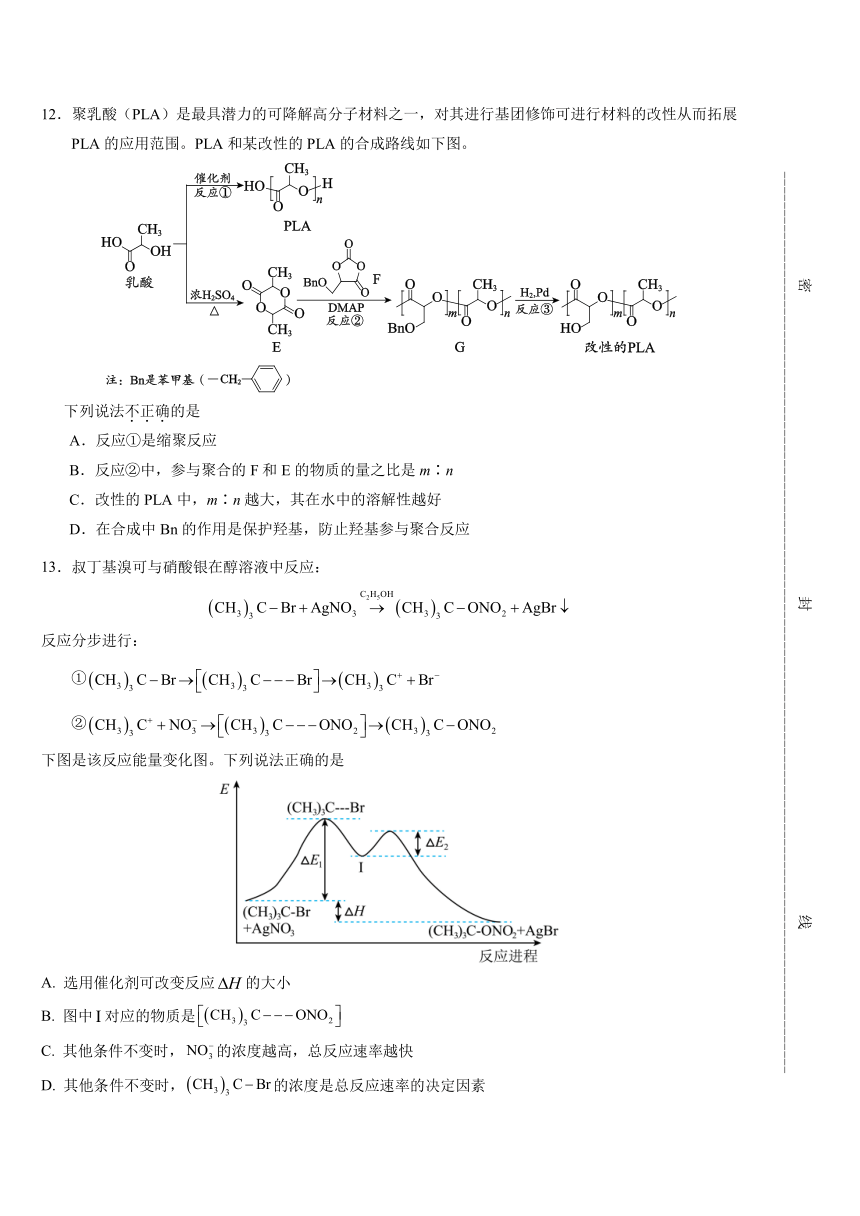
12.聚乳酸(PLA)是最具潜力的可降解高分子材料之一,对其进行基团修饰可进行材料的改性从而拓展
PLA 的应用范围。PLA 和某改性的 PLA 的合成路线如下图。
下列说法不.正.确.的是
A.反应①是缩聚反应
B.反应②中,参与聚合的 F 和 E 的物质的量之比是 m∶n
C.改性的 PLA 中,m∶n 越大,其在水中的溶解性越好
D.在合成中 Bn 的作用是保护羟基,防止羟基参与聚合反应
13.叔丁基溴可与硝酸银在醇溶液中反应:
C2H5OH
(CH3 ) C Br +AgNO3 → (CH3 ) C ONO2 +AgBr ↓ 3 3
反应分步进行:
① (CH3 ) C Br→ (CH3 ) C Br →(CH
+
3 ) C +Br 3 3 3
② (CH3 ) C+ + NO 3 → (CH3 ) C ONO2 →(CH3 ) C ONO 3 3 3 2
下图是该反应能量变化图。下列说法正确的是
A. 选用催化剂可改变反应 H 的大小
B. 图中 I 对应的物质是 (CH3 ) C ONO3 2
C. NO 其他条件不变时, 3 的浓度越高,总反应速率越快
D. 其他条件不变时, (CH3 ) C Br3 的浓度是总反应速率的决定因素
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
14.小组同学探究 Cu 和物质 A 的反应,实验如下。
装置 序号 物质 A 实验现象
-1 ( ) 铜粉溶解,溶液变为深棕色[经检验含① 0.6mol L Fe NO3 3溶液(调pH =1) Fe(NO)2+ ]
-1
② 0.6mol L FeCl3 溶液 铜粉溶解,溶液变为蓝绿色
③ 1.8mol L-1NaNO3 溶液(调pH=1) 无明显变化
下列分析不.正.确.的是
A.②中铜粉溶解的原因:Cu+2Fe3+ =Cu2+ +2Fe2+
B.①中产生 NO 的原因:pH=1 NO-时直接将 3 还原为 NO
C.若向③中加入FeSO4 固体,推测铜粉会溶解
D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
行政班 教学班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
二、填空题(共 58 分,将.答.案.填.写.在.答.题.纸.的.指.定.位.置.)
15.(9 分)超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共
价键相结合。冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,
图为常见的三种冠醚结构。
已知:K+与冠醚 b 结合能力强,使钾盐在该液体冠醚中溶解性好.
(1)下列冠醚中 O 原子的基态或激发态价电子中,能量由低到高排列的正确顺序为 。
(2)KMnO4 具有强氧化性。Mn 在元素周期表中的位置是 ,其水溶液对环己烯的氧化效果很差,
若将环己烯溶于冠醚 b 再加入 KMnO4,氧化效果大幅度提升,原因是 。
(3)分子 A(结构如下图所示)能与冠醚 c 形成一种分子梭结构,其中 N 原子的杂化方式为 。该
分子梭可以通过加入酸或碱使冠醚 c 在位点 1 和位点 2 之间来回移动,加酸冠醚 c 移动到位点 2,冠醚 c
与位点 2 之间的相互作用有 。 a.静电相互作用 b.离子键 c.共价键 d.氢键
(4)Co2+与冠醚 a 结合能力强,KCoF3 有独特的电性、磁性和光致发光性能。
①Co2+ 的价电子排布式为 。
②KCoF3晶体结构如图所示,每个小正八面体的顶点均为 F原子,该立方晶胞中 Co2+的配位数为 ,
该晶体密度为 ρ g/cm3,则该晶胞的棱长为 pm。[已知 M(KCoF3) = 155 g/mol]
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
16.(8 分)丙烯腈(CH2=CH-CN)是重要的化工原料,其合成分两步进行。
Ⅰ.丙烷脱氢制丙烯
丙烷脱氢过程中发生如下反应:
ⅰ. C3H8(g) C3H6(g) + H2(g) ΔH= +125 kJ·mol-1
ⅱ.C3H8(g) C2H4(g) + CH4(g) ΔH= +81 kJ·mol-1
(1)升温时,测得丙烯平衡产率降低。
①升温时,丙烷的平衡转化率______(填“提高”“降低”或“不变”)。
②丙烯平衡产率降低的可能原因是______。
(2)工业上,常在恒压条件下充入高温水蒸气使反应器再热。请分析充入高温水蒸气
的作用:______。
(3)已知:ⅰ. H2(g) +CO2(g) CO(g)+H2O(g) ΔH = -41 kJ·mol-1
ⅱ. C3H8 在高温下脱氢时碳碳键易断裂,产生积炭后,催化剂活性降低
工业上,常在 C3H8 中加入一定量的 CO2,目的是______。
Ⅱ.丙烯氨氧化制丙烯腈
丙烯在一定条件下生成丙烯腈(CH2=CHCN),副产物为丙烯醛(CH2=CHCHO),反应如下:
ⅰ. C3H6(g) +NH3(g) +3/2O2 (g) CH2=CHCN(g) +3H2O(g) ΔH= -515 kJ·mol-1
ⅱ.C3H6(g) +O2 (g) CH2=CHCHO(g) +H2O(g) ΔH= -353 kJ·mol-1
(4)原料气中 NH3和丙烯的比例对产物收率的影响如图所示。
已知:CH2 =CHCN 碱性条件下容易分解。
① n(NH3)/n(C3H6)<0.3 时产物主要为丙烯醛(CH2=CHCHO),原因是______。
② n(NH3)/n(C3H6)>1 时,冷却吸收后丙烯腈收率略有降低,原因是______。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
17.(15 分)抗溃疡药奥美拉唑合成路线如下。
已知: 的某些性质和 相似,都能与R-NH2发生加成。
(1)写出 A 的结构简式 。
(2)B →C的反应试剂及条件是 ;C 中所含官能团名称为:硝基、 。
(3)C →D的化学方程式是: 。
(4)D →E 过程中,氧化剂与还原剂的物质的量之比为 。
(5)一定条件下,E 与过量 反应形成高分子 ,
每形成 1 mol 该高分子的同时,还会产生某种小分子产物,其物质的量为 mol。 与 E 的
比值越大,则高分子的分子量越 。(填“大”或“小”)。
(6)I 的结构简式是 。
(7)下列有关 J 的说法正确的是 (填序号)。
a.分子式是C9H12NO2 b.能使酸性KMnO4 溶液褪色
c.核磁共振氢谱有 6 组峰 d.具有碱性 e.能与Na2CO3溶液反应
(8)E 经三步反应形成 F,请写出中间体 1 和中间体 2 的结构简式 、 。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
18.(14 分)利用蛇纹石提镁后的中和渣(主要成分为 Fe2O3 及 SiO2、Al2O3、Cr2O3、CoO、NiCO3、PbCO3
等杂质)提取高附加值的铁红(Fe2O3)的一种工艺流程如下图所示。
已知:① Ksp (CoS) = 3.0×10 26 ,Ksp (NiS) = 2.8×10 21
② 溶液中离子浓度 c≤1.0×10 5 mol L 1时可认为完全沉淀
请回答下列问题:
(1)滤渣 1 的成分为 (填化学式),滤液 2 中主要的金属阳离子为 。
(2)还原过程中发生反应的离子方程式为 ,可用试剂 检验还原是否完全。
(3)欲制备高纯铁红,净化过程溶液中各离子的去除率与pH 的关系如下图,则应控制pH 为 。
(4)沉钴镍时,若溶液中Co2+、Ni2+浓度均为0.01mol L 1逐渐加入Na2S,则先沉淀的离子为 ,
结合计算说明两种离子能否彻底先后分离 。
(5)煅烧过程中发生的化学方程式为 。
(6)一种测定铁红产品纯度的方法如下:称取 m g 铁红,溶于一定量的硫酸之中,配成 500.00 mL 溶液。
从其中量取 20.00 mL 溶液,加入过量的 KI,充分反应后,用 c mol/L 硫代硫酸钠(Na2S2O3)标准液滴定至
2- 2-
终点,发生反应:I +2S O =S O +2I-2 2 3 4 6 。平行滴定三次,硫代硫酸钠平均消耗体积为 V mL。则铁红产
品的纯度为 (用 c、V、m 表示)。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
行政班 教学班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
19.(12 分)某研究小组探究酸碱性对 FeSO4和 H2O2反应的影响。
资料:Fe(OH)SO4 为黄色固体,难溶于水,可溶于酸。
Ⅰ. 无外加酸碱时,实验如下。
(1)为了证明实验ⅰ中红褐色液体为胶体,可以补充操作,根据 进行证实。
(2)已知黄褐色沉淀中有 Fe(OH)3,还可能存在 Fe(OH)SO4,设计实验证实 。(填操作和现象)
(3)结合化学用语,解释无外加酸碱时反应结束后 pH 降低的原因 。
Ⅱ. 外加酸碱条件下,实验如下。
实验编号 实验操作 现象
取 3mL 30%H2O2溶液于试管中,滴加 液体变为红褐色,立即产生大量气体,
ⅲ 1mL 2mol·L-1NaOH 溶液,再滴加 0.5 有液体喷出试管,最终产生大量红褐色
mL 0.5mol·L-1FeSO4 溶液 沉淀
取 3mL 30%H2O2溶液于试管中,滴加溶液呈黄色,有少量气泡产生,静置无
ⅳ 1mL 1mol·L-1 稀硫酸,再滴加 0.5 mL 沉淀产生
0.5mol·L-1FeSO4 溶液
(4)根据实验 iii,推测立即产生大量气体的原因。
-
猜想一:OH 催化 H2O2 分解。
猜想二: 。
设计实验 ,证实猜想一不是立即产生大量气体的主要原因。
(5)HO2 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因 。
主要反应机理:
①Fe2+ + H 3+ 2O2→Fe + OH + OH- ②Fe3+ + H2O→FeOH2+ + H+ (Fe3+的水解)
③Fe3+ + H O →FeⅢ(HO )2+ + H+ ④FeⅢ(HO )2+→Fe2+ 2 2 2 2 + HO2
⑤FeOH2+ + H Ⅲ2O2→Fe (OH)(HO )+ +H+2 ⑥FeⅢ(OH) (HO + 2+ -2) →Fe + HO2 + OH
注:FeⅢ代表 Fe 的化合价为+3
(6)已知 Fe2+/H2O2 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 OH 有强
氧化性,根据以上实验探究,配制该体系最好控制在 条件下。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
2023-2024学年高三下学期2月月考测试参考答案
1 2 3 4 5 6 7
B A C B C B D
8 9 10 11 12 13 14
D B C D B D B
15、(9 分) (1) ii<i<iii
(2) 第四周期第 VIIB 族 烯烃与水互不相溶,高锰酸钾与烯烃不易接触,加入冠
醚后,烯烃在冠醚中溶解度更好,同时 MnO4-随 K+进入冠醚溶液,MnO4-不与冠醚结合,
-
游离的MnO4与烯烃充分接触,反应活性高,反应速率快
(3) sp2、sp3
155
ad (4) 3d7 6 3 ×1010
ρNA
16、(8 分)
(1)①提高
②升温对副反应ⅱ的影响更大(或升温后,C2H4 的增量大于 C3H6 的增量,合理即可)
(2)输入热量,维持吸热反应进行;升温,提高/维持反应ⅰ的速率;降低各物质浓度,提高
C3H6 的平衡产率(合理即可,1 点 1 分,2 个点或以上计 2 分)
(3)消耗 H2,增加 C3H6的平衡产率;与积碳反应,防止催化剂失活(1 点 1 分,共 2 分)
(4)①NH3 是ⅰ中的反应物,NH3 不足时主要发生反应ⅱ
②过量的 NH3在吸收后可能产生碱性环境,使 CH2 =CHCN 分解
17、(15 分)(1) (2) 浓硫酸、浓硝酸;加热 醚键、酰胺基
(3)
(4) 1:3 (5) n+2 小 (6) (7) bcd
(8) (或与另一个氨基加成)
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
18、(14 分)(1) Al(OH)3和Cr(OH)3 Fe2+、Na+
2 3+ 2+ 2 +( )SO2 + 2Fe + 2H2O = 2Fe +SO4 + 4H KSCN溶液或苯酚
(3)4.5
(4 2+)Co2+ 当CoS恰好沉淀完全时,c (Co ) = 1.0×10 5mol L 1,根据
Ksp (CoS) = 3.0×10 26 2 21 1,此时c (S ) = 3.0×10 mol L ,
Q (NiS) = 3.0×10 23 < Ksp (NiS) = 2.8×10 21,不生成NiS沉淀,故可以将Co2+和Ni2+ 彻底先
后分离。
高温
(5)4FeCO3 +O2 2Fe2O3 + 4CO2
2cV
(6)
m
19.(12 分)
(1)丁达尔效应(1 分)
(2)分离出黄褐色沉淀,多次洗涤后置于试管中,加入过量盐酸,固体溶解,加入 BaCl2溶
液,出现白色沉淀。
(3)体系中发生反应①2Fe2++4H2O+H2O2 =2Fe(OH)3+4H+
②2Fe2++H2O2+2SO42-=2Fe(OH)SO4,反应①导致 pH 降低。
(4)Fe(OH)3催化 H2O2分解
取 3 mL 30%H2O2溶液于试管中,滴加 1 mL 2 mol·L-1NaOH 溶液,再滴加 0.5 mL 水,
产生气泡速率比实验ⅲ中慢得多。
(5)c(H+)升高,抑制反应②、③、⑤进行,使得④、⑥的反应物浓度降低,产生的 HO2·浓
度小,导致氧气少。
(6)酸性(1 分)
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
化 学
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56
一、选择题(每题 3 分,共 42 分。在每题列出的四个选项中,选出最符合题目要求的一项。)
1.下列化学用语或图示表达不.正.确.的是
A.NaCl的电子式: B.基态 Cr 原子的价层电子排布式:3d4 4s2
C.乙醇的分子式:C2H6O D.乙炔的分子空间填充模型:
2.下列说法不.正.确.的是
A.葡萄糖、蔗糖、纤维素都是糖类物质,都可发生水解反应
B.天然植物油中不饱和脂肪酸甘油酯含量高,常温下呈液态
C.氨基酸、二肽、蛋白质均既能与强酸又能与强碱反应
D.淀粉水解液加足量碱后,再加新制氢氧化铜浊液,加热,产生砖红色沉淀
3.下列说法正确的是
A.HCl 和 Cl2 分子中均含有 s-p σ 键
B.NH3和 NH4+的 VSEPR模型和空间结构均一致
C.熔点:金刚石>碳化硅>晶体硅
D.酸性:CH3COOH > CH2ClCOOH > CCl3COOH
4.用 NA表示阿伏伽德罗常数,下列说法正确的是
A.23g NO2与足量水反应,转移的电子数约为 NA
B.标准状况下,22.4L 15NH3含有的质子数约为 10 NA
C 1.常温下,1L0.1mol L NH NO +4 3溶液中含有的 NH4 数约为 0.1 NA
D.0.1 mol 环氧乙烷( )中含有共价键的总数约为 0.3 NA
5.下列用于解释事实的离子方程式不.正.确.的是
A.向 AgCl 悬浊液中加入 Na2S 溶液,有黑色难溶物生成:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq)
B.向酸性 KMnO4溶液中加入 NaHSO3固体,溶液紫色褪去:2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O
C.向 NaHCO3溶液中加入过量澄清石灰水,有白色沉淀生成:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向稀硝酸中加入铜粉,溶液变蓝色:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
行政班 教学班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
6.某储氢材料前驱体结构如下图,M、W、X、Y、Z 五种元素原子序数依次增大,基态 Z 原子的电子填
充了 3 个能级,其中有 2 个未成对电子。下列说法错.误.的是
A.简单氢化物沸点高低:X
A. B.
C. 石 蕊 盐 酸 D.
NaOH溶液
无色 蓝色 红色
8.欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是
制备气体 X(除杂试剂) Y(检验试剂)
A 生石灰与浓氨水 浓硫酸 红色石蕊试纸
B 电石与 NaCl 水溶液 H2O Br2的 CCl4溶液
C C2H5OH 与浓硫酸170 饱和NaHSO3溶液 K2Cr2O7酸性溶液 加热至 ℃
D CH3CH2Br 与 NaOH H2O KMnO4酸性溶液 乙醇溶液共热
9.我国学者研制了一种锌基电极,与涂覆氢氧化镍的镍基电极组成可充电电池,其示意图如下。放电时,
Zn 转化为 2ZnCO3·3Zn(OH)2。下列说法错.误.的是
A.放电时,正极反应为:Ni(OH) + 2e 2 = Ni + 2OH
B.放电时,若外电路有 0.2 mol 电子转移,则有 0.1 mol Zn2+向正极迁移
C.充电时,a 为外接电源负极
D 2 .充电时,阴极反应为: 2ZnCO3 3Zn(OH)2 +10e = 5Zn + 2CO3 + 6OH
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
10.在 10L 恒容密闭容器中充入 X(g)和 Y(g),发生反应 X(g) + Y(g) M(g) + N(g),实验数据如下表:
起始时物质的量/mol 平衡时物质的量/mol 实验
编号 温度
/℃
n(X) n(Y) n(M)
① 700 0.40 0.10 0.090
② 800 0.10 0.40 0.080
③ 800 0.20 0.30 a
④ 900 0.10 0.15 b
下列说法正确的是
A.实验①中,若 5 min 时测得 n(M)=0.050 mol,则 0 至 5 min 时间内,用 N 表示的平均反应速率
υ(N)=1.0×10-2 mol/(L·min)
B.实验②中,若某时刻测得 n(N)=0.040 mol,则此时混合气体中 X(g)的体积分数为 6%
C.实验③中,达到平衡时,X 的转化率为 60%
D.实验④中,达到平衡时,b>0.060
11.25℃,一定浓度 K2Cr2O7 溶液 pH=14,其中含铬微粒的浓度与溶液 pH 的关系(局部)如下图所示。K2Cr2O7
溶液中存在平衡: 。在 pH=3~11 时,其他形式含铬微粒可
忽略不计。
下列说法不.正.确.的是
A.曲线Ⅱ代表 c(Cr2O72-)随 pH 变化
B.改变溶液的 pH,不一定能观察到溶液颜色变化
C.pH=3~11 时均存在 c(HCrO4-) + 2c(Cr2O72-) + c(CrO42-) = 0.2 mol/L
D.pH=3~11 时均存在 c(K+) + c(H+) = c(HCrO4-) + 2c(Cr2O72-) + 2c(CrO42-) + c(OH-)
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
12.聚乳酸(PLA)是最具潜力的可降解高分子材料之一,对其进行基团修饰可进行材料的改性从而拓展
PLA 的应用范围。PLA 和某改性的 PLA 的合成路线如下图。
下列说法不.正.确.的是
A.反应①是缩聚反应
B.反应②中,参与聚合的 F 和 E 的物质的量之比是 m∶n
C.改性的 PLA 中,m∶n 越大,其在水中的溶解性越好
D.在合成中 Bn 的作用是保护羟基,防止羟基参与聚合反应
13.叔丁基溴可与硝酸银在醇溶液中反应:
C2H5OH
(CH3 ) C Br +AgNO3 → (CH3 ) C ONO2 +AgBr ↓ 3 3
反应分步进行:
① (CH3 ) C Br→ (CH3 ) C Br →(CH
+
3 ) C +Br 3 3 3
② (CH3 ) C+ + NO 3 → (CH3 ) C ONO2 →(CH3 ) C ONO 3 3 3 2
下图是该反应能量变化图。下列说法正确的是
A. 选用催化剂可改变反应 H 的大小
B. 图中 I 对应的物质是 (CH3 ) C ONO3 2
C. NO 其他条件不变时, 3 的浓度越高,总反应速率越快
D. 其他条件不变时, (CH3 ) C Br3 的浓度是总反应速率的决定因素
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
14.小组同学探究 Cu 和物质 A 的反应,实验如下。
装置 序号 物质 A 实验现象
-1 ( ) 铜粉溶解,溶液变为深棕色[经检验含① 0.6mol L Fe NO3 3溶液(调pH =1) Fe(NO)2+ ]
-1
② 0.6mol L FeCl3 溶液 铜粉溶解,溶液变为蓝绿色
③ 1.8mol L-1NaNO3 溶液(调pH=1) 无明显变化
下列分析不.正.确.的是
A.②中铜粉溶解的原因:Cu+2Fe3+ =Cu2+ +2Fe2+
B.①中产生 NO 的原因:pH=1 NO-时直接将 3 还原为 NO
C.若向③中加入FeSO4 固体,推测铜粉会溶解
D.①②③现象的差异不仅与物质氧化性(或还原性)强弱有关,也与反应速率有关
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
行政班 教学班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
二、填空题(共 58 分,将.答.案.填.写.在.答.题.纸.的.指.定.位.置.)
15.(9 分)超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共
价键相结合。冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,
图为常见的三种冠醚结构。
已知:K+与冠醚 b 结合能力强,使钾盐在该液体冠醚中溶解性好.
(1)下列冠醚中 O 原子的基态或激发态价电子中,能量由低到高排列的正确顺序为 。
(2)KMnO4 具有强氧化性。Mn 在元素周期表中的位置是 ,其水溶液对环己烯的氧化效果很差,
若将环己烯溶于冠醚 b 再加入 KMnO4,氧化效果大幅度提升,原因是 。
(3)分子 A(结构如下图所示)能与冠醚 c 形成一种分子梭结构,其中 N 原子的杂化方式为 。该
分子梭可以通过加入酸或碱使冠醚 c 在位点 1 和位点 2 之间来回移动,加酸冠醚 c 移动到位点 2,冠醚 c
与位点 2 之间的相互作用有 。 a.静电相互作用 b.离子键 c.共价键 d.氢键
(4)Co2+与冠醚 a 结合能力强,KCoF3 有独特的电性、磁性和光致发光性能。
①Co2+ 的价电子排布式为 。
②KCoF3晶体结构如图所示,每个小正八面体的顶点均为 F原子,该立方晶胞中 Co2+的配位数为 ,
该晶体密度为 ρ g/cm3,则该晶胞的棱长为 pm。[已知 M(KCoF3) = 155 g/mol]
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
16.(8 分)丙烯腈(CH2=CH-CN)是重要的化工原料,其合成分两步进行。
Ⅰ.丙烷脱氢制丙烯
丙烷脱氢过程中发生如下反应:
ⅰ. C3H8(g) C3H6(g) + H2(g) ΔH= +125 kJ·mol-1
ⅱ.C3H8(g) C2H4(g) + CH4(g) ΔH= +81 kJ·mol-1
(1)升温时,测得丙烯平衡产率降低。
①升温时,丙烷的平衡转化率______(填“提高”“降低”或“不变”)。
②丙烯平衡产率降低的可能原因是______。
(2)工业上,常在恒压条件下充入高温水蒸气使反应器再热。请分析充入高温水蒸气
的作用:______。
(3)已知:ⅰ. H2(g) +CO2(g) CO(g)+H2O(g) ΔH = -41 kJ·mol-1
ⅱ. C3H8 在高温下脱氢时碳碳键易断裂,产生积炭后,催化剂活性降低
工业上,常在 C3H8 中加入一定量的 CO2,目的是______。
Ⅱ.丙烯氨氧化制丙烯腈
丙烯在一定条件下生成丙烯腈(CH2=CHCN),副产物为丙烯醛(CH2=CHCHO),反应如下:
ⅰ. C3H6(g) +NH3(g) +3/2O2 (g) CH2=CHCN(g) +3H2O(g) ΔH= -515 kJ·mol-1
ⅱ.C3H6(g) +O2 (g) CH2=CHCHO(g) +H2O(g) ΔH= -353 kJ·mol-1
(4)原料气中 NH3和丙烯的比例对产物收率的影响如图所示。
已知:CH2 =CHCN 碱性条件下容易分解。
① n(NH3)/n(C3H6)<0.3 时产物主要为丙烯醛(CH2=CHCHO),原因是______。
② n(NH3)/n(C3H6)>1 时,冷却吸收后丙烯腈收率略有降低,原因是______。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
17.(15 分)抗溃疡药奥美拉唑合成路线如下。
已知: 的某些性质和 相似,都能与R-NH2发生加成。
(1)写出 A 的结构简式 。
(2)B →C的反应试剂及条件是 ;C 中所含官能团名称为:硝基、 。
(3)C →D的化学方程式是: 。
(4)D →E 过程中,氧化剂与还原剂的物质的量之比为 。
(5)一定条件下,E 与过量 反应形成高分子 ,
每形成 1 mol 该高分子的同时,还会产生某种小分子产物,其物质的量为 mol。 与 E 的
比值越大,则高分子的分子量越 。(填“大”或“小”)。
(6)I 的结构简式是 。
(7)下列有关 J 的说法正确的是 (填序号)。
a.分子式是C9H12NO2 b.能使酸性KMnO4 溶液褪色
c.核磁共振氢谱有 6 组峰 d.具有碱性 e.能与Na2CO3溶液反应
(8)E 经三步反应形成 F,请写出中间体 1 和中间体 2 的结构简式 、 。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
密 封 线
-----------------------------------------------------------------------------------------------------------------------
18.(14 分)利用蛇纹石提镁后的中和渣(主要成分为 Fe2O3 及 SiO2、Al2O3、Cr2O3、CoO、NiCO3、PbCO3
等杂质)提取高附加值的铁红(Fe2O3)的一种工艺流程如下图所示。
已知:① Ksp (CoS) = 3.0×10 26 ,Ksp (NiS) = 2.8×10 21
② 溶液中离子浓度 c≤1.0×10 5 mol L 1时可认为完全沉淀
请回答下列问题:
(1)滤渣 1 的成分为 (填化学式),滤液 2 中主要的金属阳离子为 。
(2)还原过程中发生反应的离子方程式为 ,可用试剂 检验还原是否完全。
(3)欲制备高纯铁红,净化过程溶液中各离子的去除率与pH 的关系如下图,则应控制pH 为 。
(4)沉钴镍时,若溶液中Co2+、Ni2+浓度均为0.01mol L 1逐渐加入Na2S,则先沉淀的离子为 ,
结合计算说明两种离子能否彻底先后分离 。
(5)煅烧过程中发生的化学方程式为 。
(6)一种测定铁红产品纯度的方法如下:称取 m g 铁红,溶于一定量的硫酸之中,配成 500.00 mL 溶液。
从其中量取 20.00 mL 溶液,加入过量的 KI,充分反应后,用 c mol/L 硫代硫酸钠(Na2S2O3)标准液滴定至
2- 2-
终点,发生反应:I +2S O =S O +2I-2 2 3 4 6 。平行滴定三次,硫代硫酸钠平均消耗体积为 V mL。则铁红产
品的纯度为 (用 c、V、m 表示)。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
行政班 教学班 学号 姓名
密 封 线
-----------------------------------------------------------------------------------------------------------------------
19.(12 分)某研究小组探究酸碱性对 FeSO4和 H2O2反应的影响。
资料:Fe(OH)SO4 为黄色固体,难溶于水,可溶于酸。
Ⅰ. 无外加酸碱时,实验如下。
(1)为了证明实验ⅰ中红褐色液体为胶体,可以补充操作,根据 进行证实。
(2)已知黄褐色沉淀中有 Fe(OH)3,还可能存在 Fe(OH)SO4,设计实验证实 。(填操作和现象)
(3)结合化学用语,解释无外加酸碱时反应结束后 pH 降低的原因 。
Ⅱ. 外加酸碱条件下,实验如下。
实验编号 实验操作 现象
取 3mL 30%H2O2溶液于试管中,滴加 液体变为红褐色,立即产生大量气体,
ⅲ 1mL 2mol·L-1NaOH 溶液,再滴加 0.5 有液体喷出试管,最终产生大量红褐色
mL 0.5mol·L-1FeSO4 溶液 沉淀
取 3mL 30%H2O2溶液于试管中,滴加溶液呈黄色,有少量气泡产生,静置无
ⅳ 1mL 1mol·L-1 稀硫酸,再滴加 0.5 mL 沉淀产生
0.5mol·L-1FeSO4 溶液
(4)根据实验 iii,推测立即产生大量气体的原因。
-
猜想一:OH 催化 H2O2 分解。
猜想二: 。
设计实验 ,证实猜想一不是立即产生大量气体的主要原因。
(5)HO2 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因 。
主要反应机理:
①Fe2+ + H 3+ 2O2→Fe + OH + OH- ②Fe3+ + H2O→FeOH2+ + H+ (Fe3+的水解)
③Fe3+ + H O →FeⅢ(HO )2+ + H+ ④FeⅢ(HO )2+→Fe2+ 2 2 2 2 + HO2
⑤FeOH2+ + H Ⅲ2O2→Fe (OH)(HO )+ +H+2 ⑥FeⅢ(OH) (HO + 2+ -2) →Fe + HO2 + OH
注:FeⅢ代表 Fe 的化合价为+3
(6)已知 Fe2+/H2O2 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 OH 有强
氧化性,根据以上实验探究,配制该体系最好控制在 条件下。
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
2023-2024学年高三下学期2月月考测试参考答案
1 2 3 4 5 6 7
B A C B C B D
8 9 10 11 12 13 14
D B C D B D B
15、(9 分) (1) ii<i<iii
(2) 第四周期第 VIIB 族 烯烃与水互不相溶,高锰酸钾与烯烃不易接触,加入冠
醚后,烯烃在冠醚中溶解度更好,同时 MnO4-随 K+进入冠醚溶液,MnO4-不与冠醚结合,
-
游离的MnO4与烯烃充分接触,反应活性高,反应速率快
(3) sp2、sp3
155
ad (4) 3d7 6 3 ×1010
ρNA
16、(8 分)
(1)①提高
②升温对副反应ⅱ的影响更大(或升温后,C2H4 的增量大于 C3H6 的增量,合理即可)
(2)输入热量,维持吸热反应进行;升温,提高/维持反应ⅰ的速率;降低各物质浓度,提高
C3H6 的平衡产率(合理即可,1 点 1 分,2 个点或以上计 2 分)
(3)消耗 H2,增加 C3H6的平衡产率;与积碳反应,防止催化剂失活(1 点 1 分,共 2 分)
(4)①NH3 是ⅰ中的反应物,NH3 不足时主要发生反应ⅱ
②过量的 NH3在吸收后可能产生碱性环境,使 CH2 =CHCN 分解
17、(15 分)(1) (2) 浓硫酸、浓硝酸;加热 醚键、酰胺基
(3)
(4) 1:3 (5) n+2 小 (6) (7) bcd
(8) (或与另一个氨基加成)
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
18、(14 分)(1) Al(OH)3和Cr(OH)3 Fe2+、Na+
2 3+ 2+ 2 +( )SO2 + 2Fe + 2H2O = 2Fe +SO4 + 4H KSCN溶液或苯酚
(3)4.5
(4 2+)Co2+ 当CoS恰好沉淀完全时,c (Co ) = 1.0×10 5mol L 1,根据
Ksp (CoS) = 3.0×10 26 2 21 1,此时c (S ) = 3.0×10 mol L ,
Q (NiS) = 3.0×10 23 < Ksp (NiS) = 2.8×10 21,不生成NiS沉淀,故可以将Co2+和Ni2+ 彻底先
后分离。
高温
(5)4FeCO3 +O2 2Fe2O3 + 4CO2
2cV
(6)
m
19.(12 分)
(1)丁达尔效应(1 分)
(2)分离出黄褐色沉淀,多次洗涤后置于试管中,加入过量盐酸,固体溶解,加入 BaCl2溶
液,出现白色沉淀。
(3)体系中发生反应①2Fe2++4H2O+H2O2 =2Fe(OH)3+4H+
②2Fe2++H2O2+2SO42-=2Fe(OH)SO4,反应①导致 pH 降低。
(4)Fe(OH)3催化 H2O2分解
取 3 mL 30%H2O2溶液于试管中,滴加 1 mL 2 mol·L-1NaOH 溶液,再滴加 0.5 mL 水,
产生气泡速率比实验ⅲ中慢得多。
(5)c(H+)升高,抑制反应②、③、⑤进行,使得④、⑥的反应物浓度降低,产生的 HO2·浓
度小,导致氧气少。
(6)酸性(1 分)
{#{QQABIYgAogAAAhAAAQgCQwWYCAIQkBAAAAoOwBAAMAIByRFABAA=}#}
同课章节目录
