江西省宜春市丰城中学2023-2024学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 江西省宜春市丰城中学2023-2024学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 983.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-25 20:07:19 | ||
图片预览


文档简介
丰城中学2023-2024学年高二上学期期末考试
化学
考试时间:2024.01.28 时长:75分钟 试卷总分:100分
考试范围:选择性必修1 选择性必修2
可能用到的相对原子质量:Mo:96 O:16 N:14 Mn:55 S:32 Cu:64 Al:27
第Ⅰ卷(选择题)
一、单选题(每小题3分,共42分。每小题只有一个选项符合题意。)
1.化学与生产、生活和科技息息相关,下列说法错误的是( )
A.杭州亚运会的火炬燃烧时,,
B.汽油燃油车上的三元催化器中的催化剂能提高反应物中活化分子百分数,加快反应速率
C.溶液呈酸性,可用于除铁锈
D.工业一般选择400~500℃合成氨,原因之一是铁触媒在500℃左右时活性最大
2.工业上可用石灰乳消除的污染,反应的原理为。下列说法正确的是( )
A.的电子式为
B.的结构示意图为
C.用电子式表示CaS的形成过程为
D.硫化氢的球棍模型为
3.下列说法中正确的是( )(的绝对值均正确)
A.燃烧热指在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,单位是kJ/mol
B.已知稀溶液中, kJ/mol,则稀醋酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ/mol
C.的燃烧热 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
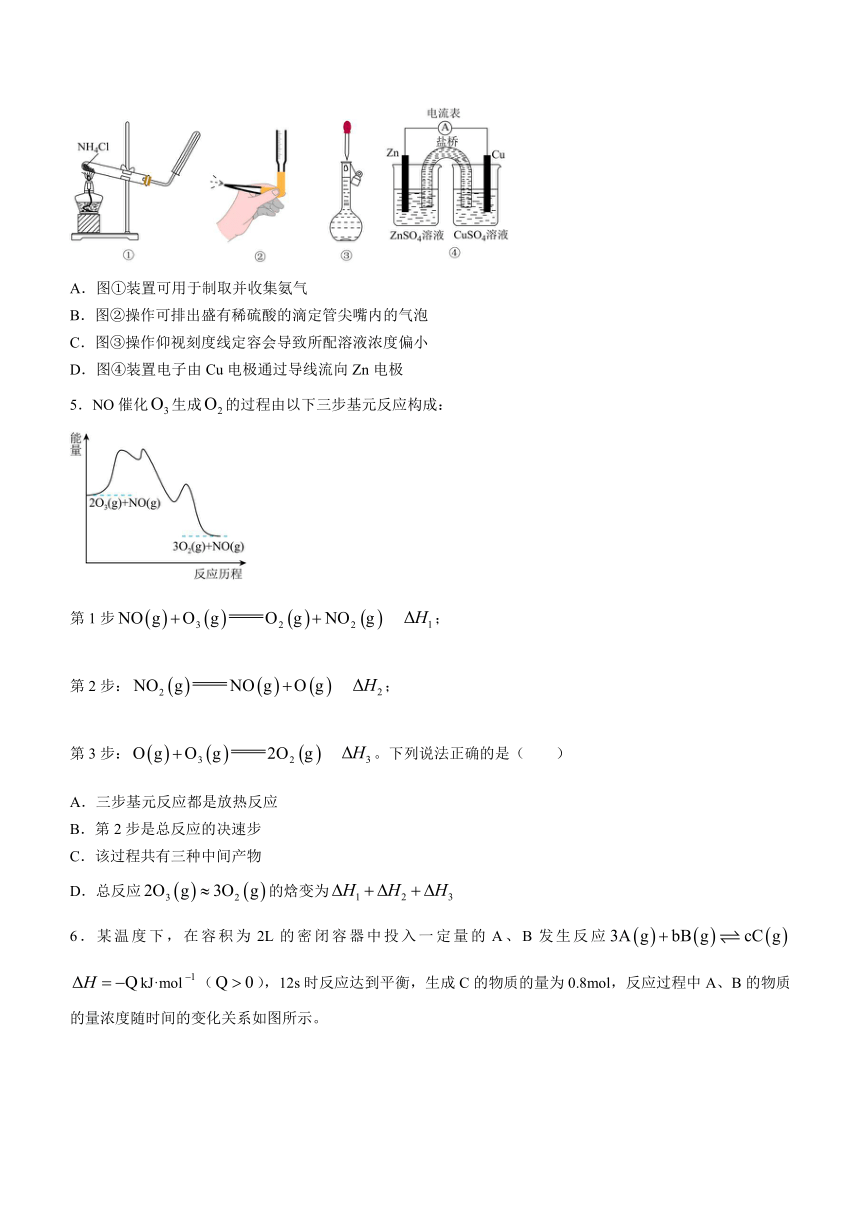
4.下列说法正确的是( )
A.图①装置可用于制取并收集氨气
B.图②操作可排出盛有稀硫酸的滴定管尖嘴内的气泡
C.图③操作仰视刻度线定容会导致所配溶液浓度偏小
D.图④装置电子由Cu电极通过导线流向Zn电极
5.NO催化生成的过程由以下三步基元反应构成:
第1步 ;
第2步: ;
第3步: 。下列说法正确的是( )
A.三步基元反应都是放热反应
B.第2步是总反应的决速步
C.该过程共有三种中间产物
D.总反应的焓变为
6.某温度下,在容积为2L的密闭容器中投入一定量的A、B发生反应 kJ·mol(),12s时反应达到平衡,生成C的物质的量为0.8mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。
下列说法正确的是( )
A.前12s内,A的平均反应速率为0.025 mol L s
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比
D.12s内,A和B反应放出的热量为0.4QkJ
7.下列有关说法正确的是( )
A.某可逆反应若平衡朝正向移动,则平衡常数一定增大
B.反应常温下可自发进行,该反应为吸热反应
C.保持温度不变,将图中的活塞快速推至20mL处,新平衡时气体颜色变浅
D.向0.1 mol L溶液中加入少量水,溶液中与的比值增大
8.下列实验能得出相关结论的是( )
实验操作 实验结论
A 向0.1 mol·LNaHA溶液中滴加酚酞溶液,溶液变为浅红色
B 常温下将铝片投入浓硝酸中,无明显现象 铝与浓硝酸不反应
C 向5 mL 0.1 mol·L溶液中加入2滴0.1mol·LKSCN溶液,溶液显红色,再滴加2滴0.2 mol·LKSCN溶液,红色加深 和的反应是可逆反应
D 室温下,用pH计测定浓度均为0.1 mol·L的溶液和溶液的pH,溶液pH大 比的酸性弱
A.A B.B C.C D.D
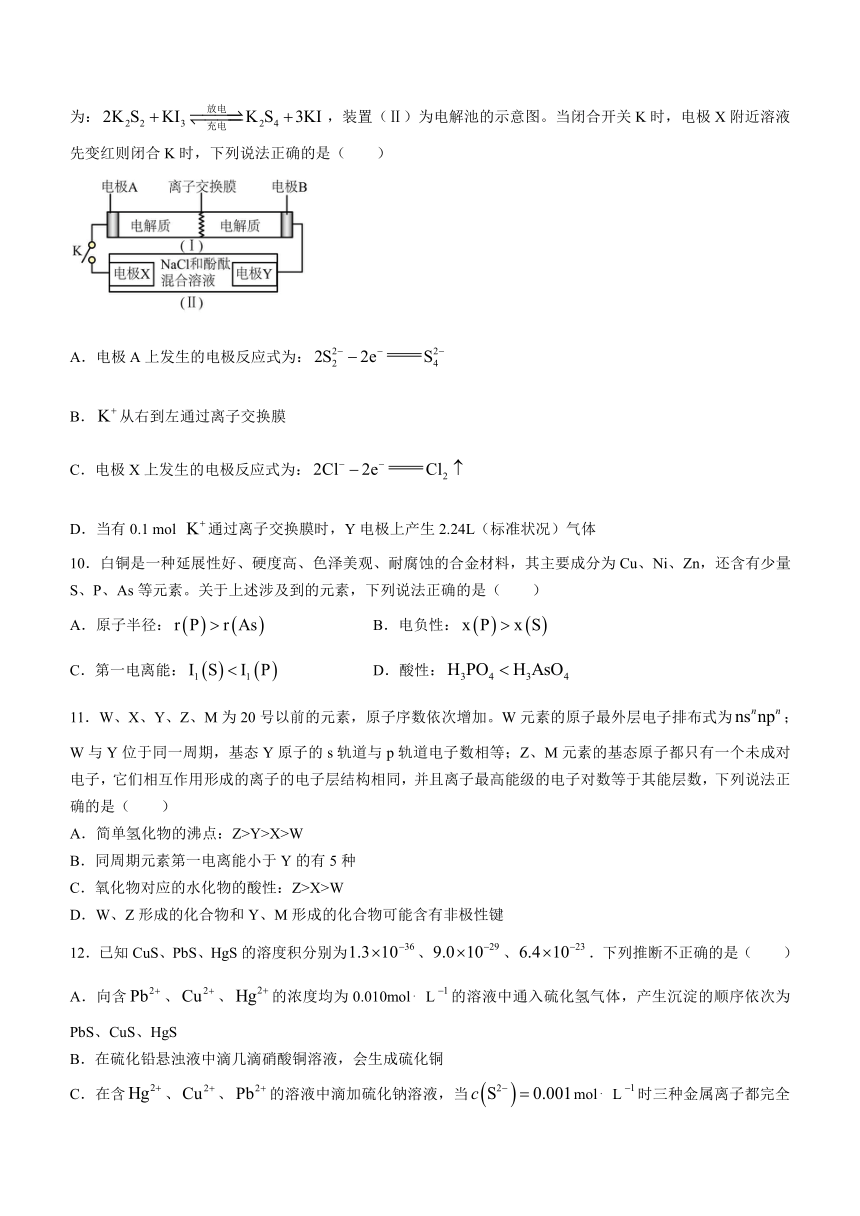
9.如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许通过,该电池工作的化学方程式为:,装置(Ⅱ)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
A.电极A上发生的电极反应式为:
B.从右到左通过离子交换膜
C.电极X上发生的电极反应式为:
D.当有0.1 mol 通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
10.白铜是一种延展性好、硬度高、色泽美观、耐腐蚀的合金材料,其主要成分为Cu、Ni、Zn,还含有少量S、P、As等元素。关于上述涉及到的元素,下列说法正确的是( )
A.原子半径: B.电负性:
C.第一电离能: D.酸性:
11.W、X、Y、Z、M为20号以前的元素,原子序数依次增加。W元素的原子最外层电子排布式为;W与Y位于同一周期,基态Y原子的s轨道与p轨道电子数相等;Z、M元素的基态原子都只有一个未成对电子,它们相互作用形成的离子的电子层结构相同,并且离子最高能级的电子对数等于其能层数,下列说法正确的是( )
A.简单氢化物的沸点:Z>Y>X>W
B.同周期元素第一电离能小于Y的有5种
C.氧化物对应的水化物的酸性:Z>X>W
D.W、Z形成的化合物和Y、M形成的化合物可能含有非极性键
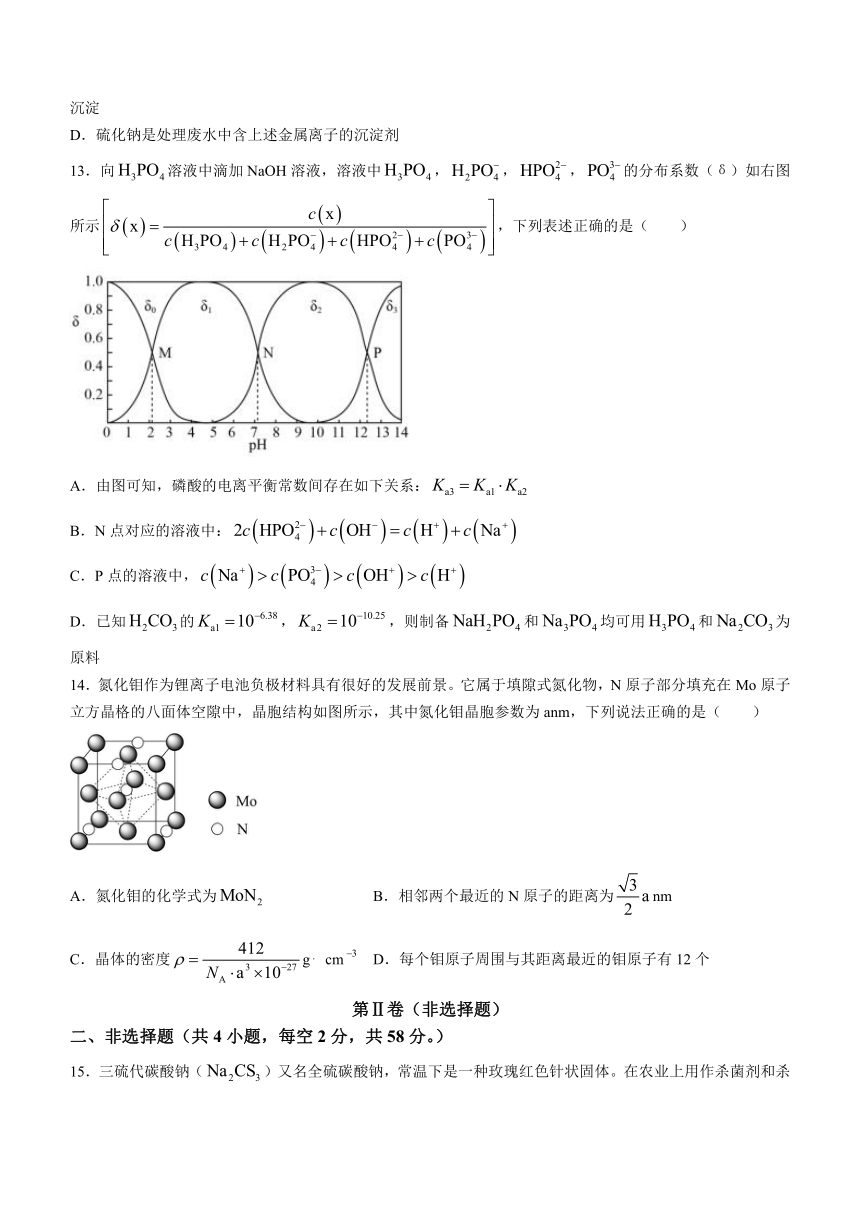
12.已知CuS、PbS、HgS的溶度积分别为、、.下列推断不正确的是( )
A.向含、、的浓度均为0.010mol L的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS
B.在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜
C.在含、、的溶液中滴加硫化钠溶液,当mol L时三种金属离子都完全沉淀
D.硫化钠是处理废水中含上述金属离子的沉淀剂
13.向溶液中滴加NaOH溶液,溶液中,,,的分布系数(δ)如右图所示,下列表述正确的是( )
A.由图可知,磷酸的电离平衡常数间存在如下关系:
B.N点对应的溶液中:
C.P点的溶液中,
D.已知的,,则制备和均可用和为原料
14.氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为anm,下列说法正确的是( )
A.氮化钼的化学式为 B.相邻两个最近的N原子的距离为nm
C.晶体的密度g cm D.每个钼原子周围与其距离最近的钼原子有12个
第Ⅱ卷(非选择题)
二、非选择题(共4小题,每空2分,共58分。)
15.三硫代碳酸钠()又名全硫碳酸钠,常温下是一种玫瑰红色针状固体。在农业上用作杀菌剂和杀虫剂,在工业上用于处理废水中的重金属离子和黄铁矿浮选中的捕获剂。某课外兴趣小组对的一些性质进行了探究性实验。
已知:
和均有毒,且不溶于水,沸点46℃,与某些性质相似。
实验1.探究的性质:
步骤操作及现象
①取一定量固体溶于蒸馏水,配成100mL溶液
②取①中配置的溶液少许于试管中,滴加几滴酚酞溶液,溶液变成红色
③取①中配置的溶液少许于另一只试管,滴加用硫酸酸化的溶液,紫色褪去
(1)用离子方程式表示步骤②中溶液变红色的原因__________________。
(2)由以上操作及现象,下列关于说法正确的是__________________。
A.易溶于水 B.溶液保存时用玻璃塞
C.应密封保存 D.有还原性
实验2.测定溶液的浓度:
实验步骤如下:
Ⅰ.取实验1中配置的溶液50.0mL置于仪器中,打开K,通入一段时间氮气;
Ⅱ.关闭K,打开分液漏斗活塞,滴入足量2.0mol/L稀硫酸,关闭活塞;
Ⅲ.反应结束后,再打开K,通入一段时间的热氮气;
Ⅳ.将B中沉淀进行过滤、洗涤、干燥、称量,得到4.8g固体。
(3)仪器M的名称是______,滴入稀硫酸后,仪器M中的现象是____________。
(4)B中发生反应的离子方程式为______,过滤后洗涤沉淀的操作是____________。
(5)反应结束后通入一段时间的热氮气的作用是____________。
(6)根据实验数据计算,该溶液的物质的量浓度为______。
16.将转化为CO、等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
(1)t℃时,还原的热化学方程式如下:
Ⅰ: kJ mol
Ⅱ: kJ mol
已知反应I、Ⅱ的平衡常数分别为、。由盖斯定律可知,与2mol反应生成的热化学方程式为__________________,______(用、表示)。
(2)若反应Ⅰ的正反应活化能表示为E kJ mol,则E______41(填“>”“<”或“=”)。
(3)t℃,向10L密闭容器中充入1 mol和2.5 mol,发生反应Ⅰ,5min达到平衡时,测得CO的物质的量为0.5mol。
①平衡时CO的体积分数=______
②下列措施既能加快反应速率又能提高的平衡转化率的是______。
A.升高反应温度 B.增大的浓度 C.分离出CO D.缩小容器容积
③t℃,向10L密闭容器中充入2mol和一定量的,发生反应Ⅰ,两种气体的平衡转化率(a),与起始反应物的物质的量之比的关系如图所示:
能表示平衡转化率曲线的是______(填或),(4)在t℃,压强为P时,______。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
17.氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效无污染的制氢方法。其反应过程如图所示:
(1)已知:
kJ/mo1
kJ/mol
kJ/mol
反应Ⅰ的热化学方程式:____________。
(2)反应Ⅰ所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是______。
(3)研究发现,通过电解方法实现反应Ⅰ,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应Ⅰ时,阳极的电极反应式:____________。
(4)碘硫循环过程中反应Ⅰ所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如右图所示,初始时阳极液和阴极液相同,溶液组成均为。
①电渗析过程中,阳极液中的浓度会______(填“增大”或“减小”)。
②结合化学用语,解释阴极区进行HI浓缩的原理____________。
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如图所示。
已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到和。
①X极是______(填“阳极”或“阴极”)。
②电解后,______室获得较浓的氢碘酸(填“a”、“b”或“c”)。
18.铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
回答下列问题:
(1)基态铝原子的核外电子排布式为______。
(2)基态氮原子的价层电子排布图为______(填编号)。
A. B. C. D.
(3)化合物Ⅰ中碳原子的杂化轨道类型为______。
(4)化合物Ⅲ中O、F、S电负性由大到小的顺序为______。
(5)铝离子电池的其中一种正极材料为AlMn O ,其晶胞中铝原子的骨架如图所示。
①晶体中与Al距离最近的Al的个数为______。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子
分数坐标,如图中原子1的坐标为,原子2的坐标为,则原子3的坐标为______。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为,则晶体的密度为______g·cm((列出计算式)。
化学参考答案
1-14ADACDDDAACDACD
15.(1)
(2)ACD
(3)三颈烧瓶 有油状液体生成(或者液体分层),有气泡产生
(4) 沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,待水自然流尽,重复操作二至三次
(5)将反应产生的气体全部赶入溶液的吸收瓶吸收完全
(6)1mol L
16.(1) kJ·mol
(2)>
(3)1/7或14.3% AB
(4)0.25
17.(1) kJ/mol
(2)分液
(3)
(4)增大阴极:,通过质子交换膜由阳极区进入阴极区,阴极区HI的浓度增大
(5)阴 c
18.(1)
(2)C
(3)、
(4)F>O>S
(5)4
化学
考试时间:2024.01.28 时长:75分钟 试卷总分:100分
考试范围:选择性必修1 选择性必修2
可能用到的相对原子质量:Mo:96 O:16 N:14 Mn:55 S:32 Cu:64 Al:27
第Ⅰ卷(选择题)
一、单选题(每小题3分,共42分。每小题只有一个选项符合题意。)
1.化学与生产、生活和科技息息相关,下列说法错误的是( )
A.杭州亚运会的火炬燃烧时,,
B.汽油燃油车上的三元催化器中的催化剂能提高反应物中活化分子百分数,加快反应速率
C.溶液呈酸性,可用于除铁锈
D.工业一般选择400~500℃合成氨,原因之一是铁触媒在500℃左右时活性最大
2.工业上可用石灰乳消除的污染,反应的原理为。下列说法正确的是( )
A.的电子式为
B.的结构示意图为
C.用电子式表示CaS的形成过程为
D.硫化氢的球棍模型为
3.下列说法中正确的是( )(的绝对值均正确)
A.燃烧热指在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,单位是kJ/mol
B.已知稀溶液中, kJ/mol,则稀醋酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ/mol
C.的燃烧热 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
4.下列说法正确的是( )
A.图①装置可用于制取并收集氨气
B.图②操作可排出盛有稀硫酸的滴定管尖嘴内的气泡
C.图③操作仰视刻度线定容会导致所配溶液浓度偏小
D.图④装置电子由Cu电极通过导线流向Zn电极
5.NO催化生成的过程由以下三步基元反应构成:
第1步 ;
第2步: ;
第3步: 。下列说法正确的是( )
A.三步基元反应都是放热反应
B.第2步是总反应的决速步
C.该过程共有三种中间产物
D.总反应的焓变为
6.某温度下,在容积为2L的密闭容器中投入一定量的A、B发生反应 kJ·mol(),12s时反应达到平衡,生成C的物质的量为0.8mol,反应过程中A、B的物质的量浓度随时间的变化关系如图所示。
下列说法正确的是( )
A.前12s内,A的平均反应速率为0.025 mol L s
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比
D.12s内,A和B反应放出的热量为0.4QkJ
7.下列有关说法正确的是( )
A.某可逆反应若平衡朝正向移动,则平衡常数一定增大
B.反应常温下可自发进行,该反应为吸热反应
C.保持温度不变,将图中的活塞快速推至20mL处,新平衡时气体颜色变浅
D.向0.1 mol L溶液中加入少量水,溶液中与的比值增大
8.下列实验能得出相关结论的是( )
实验操作 实验结论
A 向0.1 mol·LNaHA溶液中滴加酚酞溶液,溶液变为浅红色
B 常温下将铝片投入浓硝酸中,无明显现象 铝与浓硝酸不反应
C 向5 mL 0.1 mol·L溶液中加入2滴0.1mol·LKSCN溶液,溶液显红色,再滴加2滴0.2 mol·LKSCN溶液,红色加深 和的反应是可逆反应
D 室温下,用pH计测定浓度均为0.1 mol·L的溶液和溶液的pH,溶液pH大 比的酸性弱
A.A B.B C.C D.D
9.如图装置(I)为一种可充电电池的示意图,其中的离子交换膜只允许通过,该电池工作的化学方程式为:,装置(Ⅱ)为电解池的示意图。当闭合开关K时,电极X附近溶液先变红则闭合K时,下列说法正确的是( )
A.电极A上发生的电极反应式为:
B.从右到左通过离子交换膜
C.电极X上发生的电极反应式为:
D.当有0.1 mol 通过离子交换膜时,Y电极上产生2.24L(标准状况)气体
10.白铜是一种延展性好、硬度高、色泽美观、耐腐蚀的合金材料,其主要成分为Cu、Ni、Zn,还含有少量S、P、As等元素。关于上述涉及到的元素,下列说法正确的是( )
A.原子半径: B.电负性:
C.第一电离能: D.酸性:
11.W、X、Y、Z、M为20号以前的元素,原子序数依次增加。W元素的原子最外层电子排布式为;W与Y位于同一周期,基态Y原子的s轨道与p轨道电子数相等;Z、M元素的基态原子都只有一个未成对电子,它们相互作用形成的离子的电子层结构相同,并且离子最高能级的电子对数等于其能层数,下列说法正确的是( )
A.简单氢化物的沸点:Z>Y>X>W
B.同周期元素第一电离能小于Y的有5种
C.氧化物对应的水化物的酸性:Z>X>W
D.W、Z形成的化合物和Y、M形成的化合物可能含有非极性键
12.已知CuS、PbS、HgS的溶度积分别为、、.下列推断不正确的是( )
A.向含、、的浓度均为0.010mol L的溶液中通入硫化氢气体,产生沉淀的顺序依次为PbS、CuS、HgS
B.在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜
C.在含、、的溶液中滴加硫化钠溶液,当mol L时三种金属离子都完全沉淀
D.硫化钠是处理废水中含上述金属离子的沉淀剂
13.向溶液中滴加NaOH溶液,溶液中,,,的分布系数(δ)如右图所示,下列表述正确的是( )
A.由图可知,磷酸的电离平衡常数间存在如下关系:
B.N点对应的溶液中:
C.P点的溶液中,
D.已知的,,则制备和均可用和为原料
14.氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为anm,下列说法正确的是( )
A.氮化钼的化学式为 B.相邻两个最近的N原子的距离为nm
C.晶体的密度g cm D.每个钼原子周围与其距离最近的钼原子有12个
第Ⅱ卷(非选择题)
二、非选择题(共4小题,每空2分,共58分。)
15.三硫代碳酸钠()又名全硫碳酸钠,常温下是一种玫瑰红色针状固体。在农业上用作杀菌剂和杀虫剂,在工业上用于处理废水中的重金属离子和黄铁矿浮选中的捕获剂。某课外兴趣小组对的一些性质进行了探究性实验。
已知:
和均有毒,且不溶于水,沸点46℃,与某些性质相似。
实验1.探究的性质:
步骤操作及现象
①取一定量固体溶于蒸馏水,配成100mL溶液
②取①中配置的溶液少许于试管中,滴加几滴酚酞溶液,溶液变成红色
③取①中配置的溶液少许于另一只试管,滴加用硫酸酸化的溶液,紫色褪去
(1)用离子方程式表示步骤②中溶液变红色的原因__________________。
(2)由以上操作及现象,下列关于说法正确的是__________________。
A.易溶于水 B.溶液保存时用玻璃塞
C.应密封保存 D.有还原性
实验2.测定溶液的浓度:
实验步骤如下:
Ⅰ.取实验1中配置的溶液50.0mL置于仪器中,打开K,通入一段时间氮气;
Ⅱ.关闭K,打开分液漏斗活塞,滴入足量2.0mol/L稀硫酸,关闭活塞;
Ⅲ.反应结束后,再打开K,通入一段时间的热氮气;
Ⅳ.将B中沉淀进行过滤、洗涤、干燥、称量,得到4.8g固体。
(3)仪器M的名称是______,滴入稀硫酸后,仪器M中的现象是____________。
(4)B中发生反应的离子方程式为______,过滤后洗涤沉淀的操作是____________。
(5)反应结束后通入一段时间的热氮气的作用是____________。
(6)根据实验数据计算,该溶液的物质的量浓度为______。
16.将转化为CO、等燃料,可以有效的缓解能源危机,同时可以减少温室气体,实现“双碳目标”。
(1)t℃时,还原的热化学方程式如下:
Ⅰ: kJ mol
Ⅱ: kJ mol
已知反应I、Ⅱ的平衡常数分别为、。由盖斯定律可知,与2mol反应生成的热化学方程式为__________________,______(用、表示)。
(2)若反应Ⅰ的正反应活化能表示为E kJ mol,则E______41(填“>”“<”或“=”)。
(3)t℃,向10L密闭容器中充入1 mol和2.5 mol,发生反应Ⅰ,5min达到平衡时,测得CO的物质的量为0.5mol。
①平衡时CO的体积分数=______
②下列措施既能加快反应速率又能提高的平衡转化率的是______。
A.升高反应温度 B.增大的浓度 C.分离出CO D.缩小容器容积
③t℃,向10L密闭容器中充入2mol和一定量的,发生反应Ⅰ,两种气体的平衡转化率(a),与起始反应物的物质的量之比的关系如图所示:
能表示平衡转化率曲线的是______(填或),(4)在t℃,压强为P时,______。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
17.氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效无污染的制氢方法。其反应过程如图所示:
(1)已知:
kJ/mo1
kJ/mol
kJ/mol
反应Ⅰ的热化学方程式:____________。
(2)反应Ⅰ所得产物的溶液在碘过量时会自发分成两层。分离两层溶液的实验操作是______。
(3)研究发现,通过电解方法实现反应Ⅰ,既可减少碘的加入量,也可减少溶液后续纯化过程的能耗。写出通过电解法实现反应Ⅰ时,阳极的电极反应式:____________。
(4)碘硫循环过程中反应Ⅰ所制备出的HI浓度较低,必须对HI溶液进行浓缩。电解电渗析浓缩HI溶液的原理如右图所示,初始时阳极液和阴极液相同,溶液组成均为。
①电渗析过程中,阳极液中的浓度会______(填“增大”或“减小”)。
②结合化学用语,解释阴极区进行HI浓缩的原理____________。
(5)某科研小组采用双极膜电渗析法制备高浓度氢碘酸,工作原理如图所示。
已知:双极膜在直流电场作用下可将水解离,在双极膜的两侧分别得到和。
①X极是______(填“阳极”或“阴极”)。
②电解后,______室获得较浓的氢碘酸(填“a”、“b”或“c”)。
18.铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
回答下列问题:
(1)基态铝原子的核外电子排布式为______。
(2)基态氮原子的价层电子排布图为______(填编号)。
A. B. C. D.
(3)化合物Ⅰ中碳原子的杂化轨道类型为______。
(4)化合物Ⅲ中O、F、S电负性由大到小的顺序为______。
(5)铝离子电池的其中一种正极材料为AlMn O ,其晶胞中铝原子的骨架如图所示。
①晶体中与Al距离最近的Al的个数为______。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子
分数坐标,如图中原子1的坐标为,原子2的坐标为,则原子3的坐标为______。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为,则晶体的密度为______g·cm((列出计算式)。
化学参考答案
1-14ADACDDDAACDACD
15.(1)
(2)ACD
(3)三颈烧瓶 有油状液体生成(或者液体分层),有气泡产生
(4) 沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,待水自然流尽,重复操作二至三次
(5)将反应产生的气体全部赶入溶液的吸收瓶吸收完全
(6)1mol L
16.(1) kJ·mol
(2)>
(3)1/7或14.3% AB
(4)0.25
17.(1) kJ/mol
(2)分液
(3)
(4)增大阴极:,通过质子交换膜由阳极区进入阴极区,阴极区HI的浓度增大
(5)阴 c
18.(1)
(2)C
(3)、
(4)F>O>S
(5)4
同课章节目录
