福建省福州第三中学2023-2024学年高二上学期期末考试化学试题(含答案)
文档属性
| 名称 | 福建省福州第三中学2023-2024学年高二上学期期末考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-26 09:42:24 | ||
图片预览



文档简介
福州第三中学2023-2024学年高二上学期期末考试
化学
可能用到的原子量:
一、选择题(每题只有一个正确答案,共45分)
1.化学与生活息息相关。下列叙述错误的是( )。
A.热的碳酸钠溶液可用于去除餐具的油污
B.明矾作净水剂,可用于自来水的杀菌消毒
C.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”
D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
2.下列事实能用勒夏特列原理来解释的是( )。
A.增大压强,有利于和反应生成
B.锌粒粉碎后与稀硫酸反应产生氢气速度更快
C.、、平衡混合气加压后颜色变深
D.温度设置为400~500℃比室温更有利于氨的合成
3.设为阿伏加德罗常数的值。下列说法正确的是( )。
A.电解饱和食盐水,当电路中转移电子时,制得金属钠
B.的溶液中所含阳离子的总数目大于
C.电解精炼铜时,阳极质量每减少,电路中转移64g电子
D.将通入水中,溶液中、、粒子数之和为
4.X、Y、Z、M四种元素原子序数依次增大。X核外未成对电子数为3,Z是周期表中电负性最大的元素,M是地壳中含量最多的金属元素。下列说法不正确的是( )。
A.简单氢化物的稳定性:Y>Z B.第一电离能:X>Y
C.简单离子半径:Y>M D.M位于元素周期表的p区
5.常温下,下列各组离子一定能大量共存的是( )。
A.的溶液中:、、、
B.含有的溶液中:、、、
C.的溶液中:、、、
D.水电离产生的的溶液中:、、、
6.利用下列装置中,所用仪器或相关操作合理的是( )。
A.图甲加热制取无水
B.图乙在铁制钥匙上镀铜
C.图丙用标准溶液滴定锥形瓶中的醋酸的操作
D.图丁定量测定锌粒与硫酸反应的化学反应速率
7.下列方案设计、现象或结论均正确且能达到实验目的的是( )。
选项 实验目的 方案设计 现象或结论
A 探究压强对化学反应速率的影响 在容积不变的密闭容器中发生反应:,向其中通入氩气 反应速率增大,说明其他条件相同时,压强越大,化学反应速率越快
B 探究浓度对化学反应速率的影响 向2支盛有浓度分别为、溶液的试管中同时加入(酸性)溶液,观察并比较实验现象 其他条件相同时,浓度越大,单位体积活化分子数越多,化学反应速率越快
C 探究温度对化学反应速率的影响 取溶液和溶液混合后,分别放入冷水和热水中,观察并比较实验现象 热水中先出现浑浊,说明其他条件相同时,温度越高,化学反应速率越快
D 探究沉淀转化 向溶液中滴入2滴溶液,再滴加2滴溶液 先产生白色沉淀后再产生红褐色沉淀,得出结论
8.常温下溶液,下列说法正确的是( )。
A.加入少量固体,减小
B.加入少量固体,减小
C.稀释溶液,溶液的pH减小
D.加入适量醋酸得到的酸性混合溶液:
9.已知液氨的性质与水相似,25℃时,,的平衡浓度为,下列说法正确的是( )。
A.在液氨中加入可使氨的离子积变大
B.在液氨中加入可使液氨的离子积减小
C.在此温度下液氨的离子积为
D.在液氨中放入金属钠,可生成
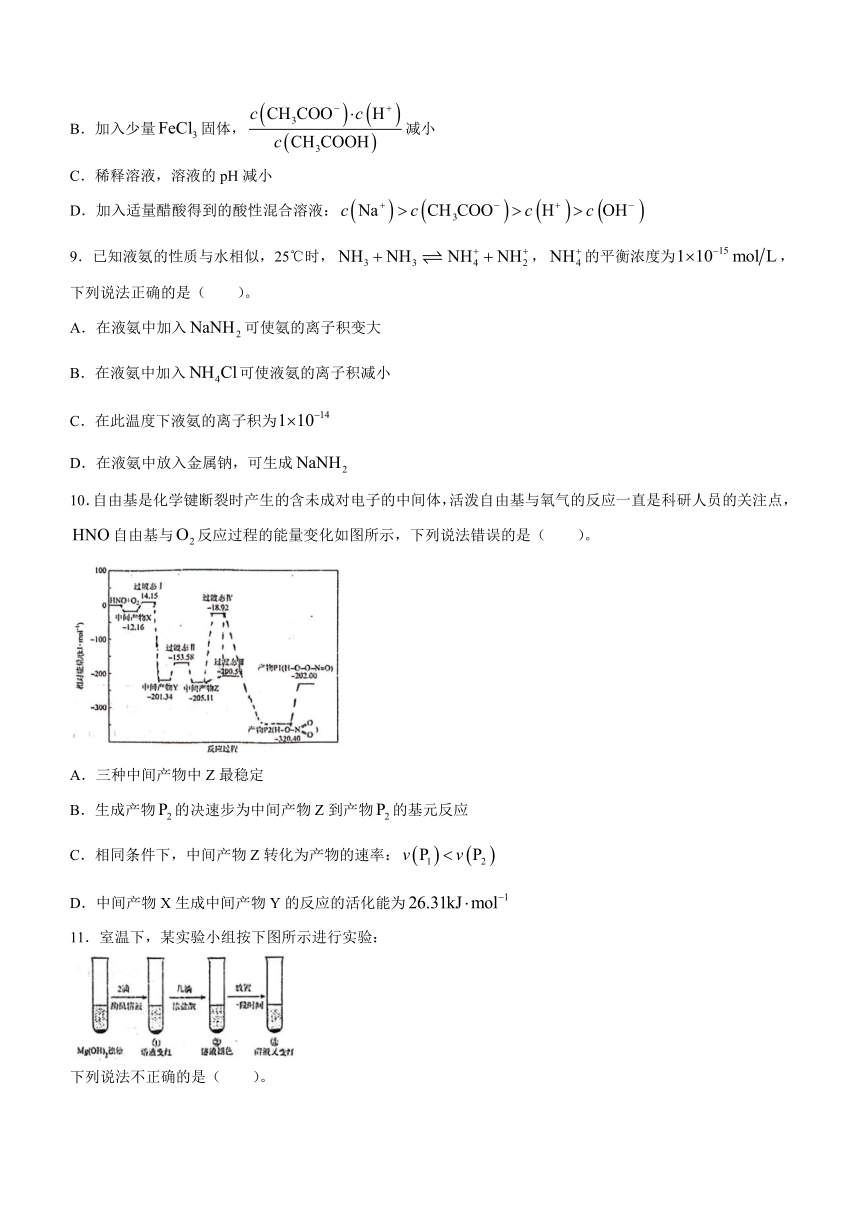
10.自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点,自由基与反应过程的能量变化如图所示,下列说法错误的是( )。
A.三种中间产物中Z最稳定
B.生成产物的决速步为中间产物Z到产物的基元反应
C.相同条件下,中间产物Z转化为产物的速率:
D.中间产物X生成中间产物Y的反应的活化能为
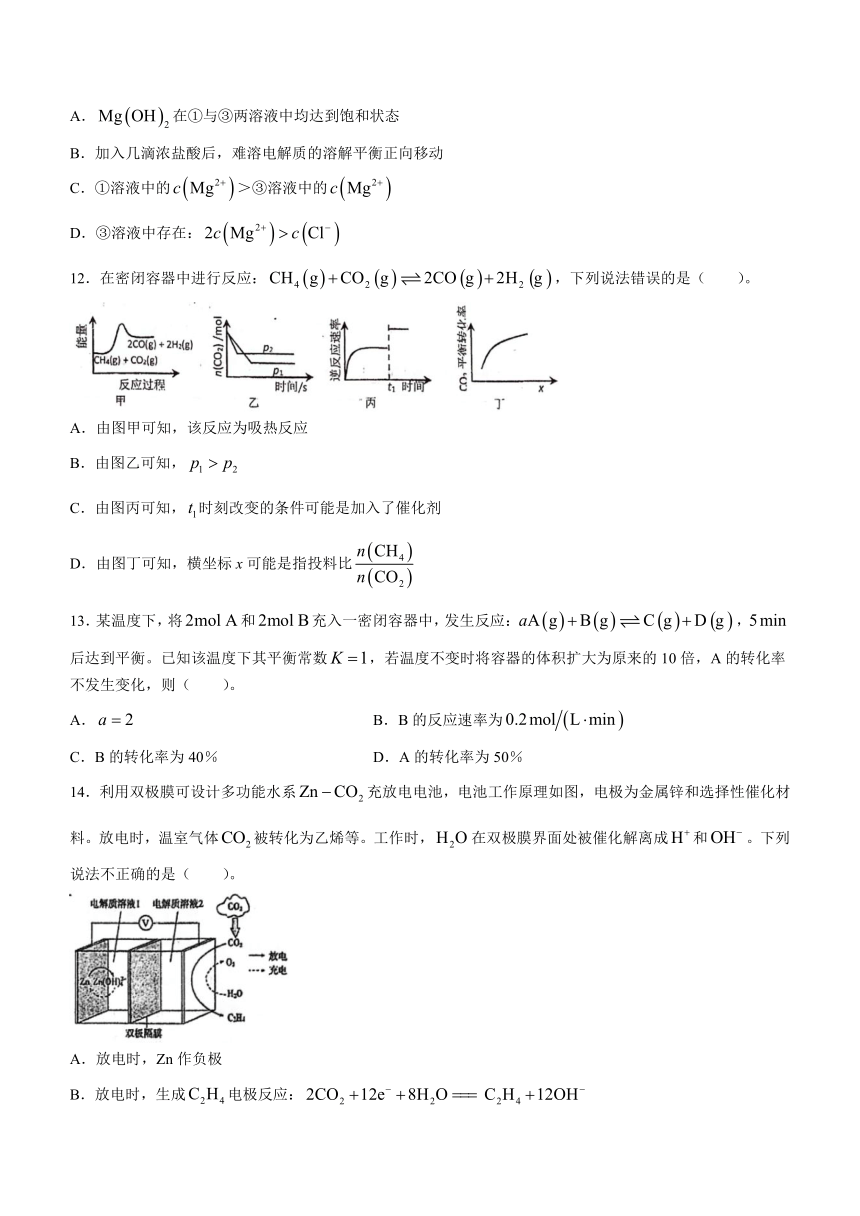
11.室温下,某实验小组按下图所示进行实验:
下列说法不正确的是( )。
A.在①与③两溶液中均达到饱和状态
B.加入几滴浓盐酸后,难溶电解质的溶解平衡正向移动
C.①溶液中的>③溶液中的
D.③溶液中存在:
12.在密闭容器中进行反应:,下列说法错误的是( )。
A.由图甲可知,该反应为吸热反应
B.由图乙可知,
C.由图丙可知,时刻改变的条件可能是加入了催化剂
D.由图丁可知,横坐标x可能是指投料比
13.某温度下,将和充入一密闭容器中,发生反应:,后达到平衡。已知该温度下其平衡常数,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )。
A. B.B的反应速率为
C.B的转化率为40% D.A的转化率为50%
14.利用双极膜可设计多功能水系充放电电池,电池工作原理如图,电极为金属锌和选择性催化材料。放电时,温室气体被转化为乙烯等。工作时,在双极膜界面处被催化解离成和。下列说法不正确的是( )。
A.放电时,Zn作负极
B.放电时,生成电极反应:
C.充电时,右池中的向左移动
D.充电时,每转移,生成(标准状况)
15.以酚酞为指示剂,用的溶液滴定未知浓度的二元酸溶液。溶液中,pH、分布系数随滴加溶液体积的变化关系如图所示。[比如的分布系数:]
下列叙述正确的是( )。
A.曲线①代表,曲线②代表
B.溶液的浓度为
C.的电离常数
D.滴定终点时,溶液中
二、非选择题(共55分)
16.(12分)硫及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态S原子的价层电子轨道表示式为__________,其原子核外电子共有__________种空间运动状态。
(2)已知:25℃时的电离常数:,,则的水解常数__________,溶液的pH______7(填“>”“<”或“=”)。
(3)锅炉水垢既会降低燃料的利用率,义会影响锅炉的使用寿命。为了除去水垢中的可先用溶液处理,写出该反应的离子方程式:__________。
(4)溶液中各种离子浓度由大到小的顺序是__________。
17.(16分)在实验室中以含镍废料(主要成分为,含少量、、,和)为原料制备和的工艺流程如图。
图1 图2
请回答下列有关问题:
(1)“滤渣1”主要成分是__________,“酸浸”过程中镍的浸出率与温度和时间的关系如图1所示,酸浸的最佳温度和时间是__________。
(2)“氧化”时发生反应的离子方程式为__________。
(3)“沉钴”时,若,为了防止沉钴时生成,常温下应控制溶液pH的最大值是__________(已知)。
(4)晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为__________。
(5)医学上常用酸性溶液和草酸溶液的反应来测定血钙的含量。测血钙的含量时,进行如下实验:
①可将血液用蒸馏水稀释后,向其中加入足量草酸铵晶体,反应生成沉淀,将沉淀用稀硫酸处理得溶液。
②将①得到的溶液,再用酸性溶液滴定,氧化产物为,还原产物为。
③终点时用去的溶液。
Ⅰ.滴定终点的现象是__________。
Ⅱ.下列操作会导致测定结果偏低的是___________。
A.锥形瓶用待测草酸溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
Ⅲ.计算:血液中含钙离子的浓度为__________。
18.(13分)遇水极易发生水解。某化学兴趣小组设计实验制备并探究其性质。
Ⅰ.氯化铁的制备:
图1 图2
(1)图1为湿法制备的装置,仪器A的名称为__________。
(2)图2为干法制备的装置。反应前后都要鼓入氮气,目的是__________。
Ⅱ.氯化铁的性质探究:
(3)查阅资料:氯化铁在水溶液中分多步水解,生成净水性能更好的聚合氯化铁。写出氯化铁水解生成聚合氯化铁的总化学方程式__________。
(4)为了探究外界条件对氯化铁水解平衡的影响,该兴趣小组设计实验方案(忽略溶液体积的变化,的浓度为),获得以下数据:
实验 温度/℃ pH
1 10.00 90.00 0 0 25 1.62
2 10.00 90.00 0 0 35 1.47
3 10.00 0 0 0 25 0.74
4 10.00 90.00 a 0 25 x
5 10.00 90.00 0 b 25 y
①实验1和实验2说明的水解是__________(填“吸热”或“放热”)反应。
②由实验1和3可知,稀释溶液,水解平衡__________(填“正”或“逆”)向移动;结合表中数据,给出判断理由:
③查阅资料,加入强电解质后,由于溶液中离子总浓度增大,离子间的相互牵制作用增强,水解离子的活性会改变。该兴趣小组同学求助老师,利用计算机手持技术得到实验4和实验5的结果分别如图3和图4所示。
图3 图4
ⅰ.根据上述实验数据和结果,下列说法不正确的是__________(填标号)。
A.实验过程中量取溶液时应选用酸式滴定管
B.实验4和实验5中a与b的关系式为
C.根据图3与图4结果可知,离子的水解活性强弱还受离子种类的影响
ⅱ.有同学猜想图3结果是因为氯离子促进了的水解,请你设计其他简单实验证明该猜想成立:__________(写出实验操作、现象或结果)。
19.(14分)党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
Ⅰ.工业上用和在一定条件下可以合成乙烯:
已知:①
②
③
(1)__________(用、、表示)。
(2)恒温恒容下,向密闭容器按投料比通入原料气,能判断该反应处于平衡状态的是__________(填标号)。
A. B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.保持不变
(3)向密闭容器按投料比通入原料气(,不同温度对的平衡转化率和催化剂催化效率的影响如图所示,则压强__________,原因是:__________。
Ⅱ.催化加氢可以直接合成二甲醚。涉及以下主要反应:
①
②
恒压条件下,、起始量相等时,的平衡转化率和的选择性随温度变化如图所示。
已知:的选择性%
(4)300℃时,通入、各,平衡时的选择性、的平衡转化率均为30%,则此温度下反应①的平衡常数__________(保留2位有效数字)。
(5)温度高于300℃,的平衡转化率随温度升高而增大的原因可能是__________。
Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如图所示。
(6)该电池的阴极电极反应式为:__________。
福州第三中学2023-2024学年高二上学期期末考试
化学答案
1.B 2.A 3.B 4.A 5.B 6.D 7.C 8.C 9.D 10.C
11.C 12.B 13.D 14.B 15.C
16.(12分)
(1) 9
(2) >
(3)
(4)
17.(16分)
(1)和 70℃和
(2)
(3)7.5
(4)
(5)当滴入最后一滴酸性溶液后,溶液由无色变为浅紫色,且半分钟内不褪色
BC
18.(13分)
(1)分液漏斗(1分)
(2)反应前排尽装置中的空气,反应后将装置中残留的有毒赶走(2分,前后各1分)
(3)(2分)
(4)①吸热(1分) ②正(1分)
实验1相较于实验3,溶液稀释了10倍,而实验1的pH增大值小于1(2分,其他合理答案也得分)
③B(2分)在25℃下,向的溶液中加入一定量的氯化钠固体,若pH减小,说明假设a正确(2分,实验方法得1分,实验现象或结果得1分,其他合理答案也得分)
19.(14分)
(1)
(2)CD
(3)< 反应为气体体积减小的放热反应,M点转化率高,气体的总物质的量小,且此时温度低,所以M点压强小于N点压强
(4)0.20
(5)升高温度,反应①正向移动,的平衡转化率增大,反应②逆向移动,的平衡转化率减小,300℃后升温,反应①中的平衡转化率增大的幅度大于反应②的减小幅度
(6)
化学
可能用到的原子量:
一、选择题(每题只有一个正确答案,共45分)
1.化学与生活息息相关。下列叙述错误的是( )。
A.热的碳酸钠溶液可用于去除餐具的油污
B.明矾作净水剂,可用于自来水的杀菌消毒
C.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”
D.电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极保护法
2.下列事实能用勒夏特列原理来解释的是( )。
A.增大压强,有利于和反应生成
B.锌粒粉碎后与稀硫酸反应产生氢气速度更快
C.、、平衡混合气加压后颜色变深
D.温度设置为400~500℃比室温更有利于氨的合成
3.设为阿伏加德罗常数的值。下列说法正确的是( )。
A.电解饱和食盐水,当电路中转移电子时,制得金属钠
B.的溶液中所含阳离子的总数目大于
C.电解精炼铜时,阳极质量每减少,电路中转移64g电子
D.将通入水中,溶液中、、粒子数之和为
4.X、Y、Z、M四种元素原子序数依次增大。X核外未成对电子数为3,Z是周期表中电负性最大的元素,M是地壳中含量最多的金属元素。下列说法不正确的是( )。
A.简单氢化物的稳定性:Y>Z B.第一电离能:X>Y
C.简单离子半径:Y>M D.M位于元素周期表的p区
5.常温下,下列各组离子一定能大量共存的是( )。
A.的溶液中:、、、
B.含有的溶液中:、、、
C.的溶液中:、、、
D.水电离产生的的溶液中:、、、
6.利用下列装置中,所用仪器或相关操作合理的是( )。
A.图甲加热制取无水
B.图乙在铁制钥匙上镀铜
C.图丙用标准溶液滴定锥形瓶中的醋酸的操作
D.图丁定量测定锌粒与硫酸反应的化学反应速率
7.下列方案设计、现象或结论均正确且能达到实验目的的是( )。
选项 实验目的 方案设计 现象或结论
A 探究压强对化学反应速率的影响 在容积不变的密闭容器中发生反应:,向其中通入氩气 反应速率增大,说明其他条件相同时,压强越大,化学反应速率越快
B 探究浓度对化学反应速率的影响 向2支盛有浓度分别为、溶液的试管中同时加入(酸性)溶液,观察并比较实验现象 其他条件相同时,浓度越大,单位体积活化分子数越多,化学反应速率越快
C 探究温度对化学反应速率的影响 取溶液和溶液混合后,分别放入冷水和热水中,观察并比较实验现象 热水中先出现浑浊,说明其他条件相同时,温度越高,化学反应速率越快
D 探究沉淀转化 向溶液中滴入2滴溶液,再滴加2滴溶液 先产生白色沉淀后再产生红褐色沉淀,得出结论
8.常温下溶液,下列说法正确的是( )。
A.加入少量固体,减小
B.加入少量固体,减小
C.稀释溶液,溶液的pH减小
D.加入适量醋酸得到的酸性混合溶液:
9.已知液氨的性质与水相似,25℃时,,的平衡浓度为,下列说法正确的是( )。
A.在液氨中加入可使氨的离子积变大
B.在液氨中加入可使液氨的离子积减小
C.在此温度下液氨的离子积为
D.在液氨中放入金属钠,可生成
10.自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点,自由基与反应过程的能量变化如图所示,下列说法错误的是( )。
A.三种中间产物中Z最稳定
B.生成产物的决速步为中间产物Z到产物的基元反应
C.相同条件下,中间产物Z转化为产物的速率:
D.中间产物X生成中间产物Y的反应的活化能为
11.室温下,某实验小组按下图所示进行实验:
下列说法不正确的是( )。
A.在①与③两溶液中均达到饱和状态
B.加入几滴浓盐酸后,难溶电解质的溶解平衡正向移动
C.①溶液中的>③溶液中的
D.③溶液中存在:
12.在密闭容器中进行反应:,下列说法错误的是( )。
A.由图甲可知,该反应为吸热反应
B.由图乙可知,
C.由图丙可知,时刻改变的条件可能是加入了催化剂
D.由图丁可知,横坐标x可能是指投料比
13.某温度下,将和充入一密闭容器中,发生反应:,后达到平衡。已知该温度下其平衡常数,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )。
A. B.B的反应速率为
C.B的转化率为40% D.A的转化率为50%
14.利用双极膜可设计多功能水系充放电电池,电池工作原理如图,电极为金属锌和选择性催化材料。放电时,温室气体被转化为乙烯等。工作时,在双极膜界面处被催化解离成和。下列说法不正确的是( )。
A.放电时,Zn作负极
B.放电时,生成电极反应:
C.充电时,右池中的向左移动
D.充电时,每转移,生成(标准状况)
15.以酚酞为指示剂,用的溶液滴定未知浓度的二元酸溶液。溶液中,pH、分布系数随滴加溶液体积的变化关系如图所示。[比如的分布系数:]
下列叙述正确的是( )。
A.曲线①代表,曲线②代表
B.溶液的浓度为
C.的电离常数
D.滴定终点时,溶液中
二、非选择题(共55分)
16.(12分)硫及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态S原子的价层电子轨道表示式为__________,其原子核外电子共有__________种空间运动状态。
(2)已知:25℃时的电离常数:,,则的水解常数__________,溶液的pH______7(填“>”“<”或“=”)。
(3)锅炉水垢既会降低燃料的利用率,义会影响锅炉的使用寿命。为了除去水垢中的可先用溶液处理,写出该反应的离子方程式:__________。
(4)溶液中各种离子浓度由大到小的顺序是__________。
17.(16分)在实验室中以含镍废料(主要成分为,含少量、、,和)为原料制备和的工艺流程如图。
图1 图2
请回答下列有关问题:
(1)“滤渣1”主要成分是__________,“酸浸”过程中镍的浸出率与温度和时间的关系如图1所示,酸浸的最佳温度和时间是__________。
(2)“氧化”时发生反应的离子方程式为__________。
(3)“沉钴”时,若,为了防止沉钴时生成,常温下应控制溶液pH的最大值是__________(已知)。
(4)晶体煅烧时剩余固体质量与温度变化曲线如图2,该曲线中B段所表示氧化物的化学式为__________。
(5)医学上常用酸性溶液和草酸溶液的反应来测定血钙的含量。测血钙的含量时,进行如下实验:
①可将血液用蒸馏水稀释后,向其中加入足量草酸铵晶体,反应生成沉淀,将沉淀用稀硫酸处理得溶液。
②将①得到的溶液,再用酸性溶液滴定,氧化产物为,还原产物为。
③终点时用去的溶液。
Ⅰ.滴定终点的现象是__________。
Ⅱ.下列操作会导致测定结果偏低的是___________。
A.锥形瓶用待测草酸溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
Ⅲ.计算:血液中含钙离子的浓度为__________。
18.(13分)遇水极易发生水解。某化学兴趣小组设计实验制备并探究其性质。
Ⅰ.氯化铁的制备:
图1 图2
(1)图1为湿法制备的装置,仪器A的名称为__________。
(2)图2为干法制备的装置。反应前后都要鼓入氮气,目的是__________。
Ⅱ.氯化铁的性质探究:
(3)查阅资料:氯化铁在水溶液中分多步水解,生成净水性能更好的聚合氯化铁。写出氯化铁水解生成聚合氯化铁的总化学方程式__________。
(4)为了探究外界条件对氯化铁水解平衡的影响,该兴趣小组设计实验方案(忽略溶液体积的变化,的浓度为),获得以下数据:
实验 温度/℃ pH
1 10.00 90.00 0 0 25 1.62
2 10.00 90.00 0 0 35 1.47
3 10.00 0 0 0 25 0.74
4 10.00 90.00 a 0 25 x
5 10.00 90.00 0 b 25 y
①实验1和实验2说明的水解是__________(填“吸热”或“放热”)反应。
②由实验1和3可知,稀释溶液,水解平衡__________(填“正”或“逆”)向移动;结合表中数据,给出判断理由:
③查阅资料,加入强电解质后,由于溶液中离子总浓度增大,离子间的相互牵制作用增强,水解离子的活性会改变。该兴趣小组同学求助老师,利用计算机手持技术得到实验4和实验5的结果分别如图3和图4所示。
图3 图4
ⅰ.根据上述实验数据和结果,下列说法不正确的是__________(填标号)。
A.实验过程中量取溶液时应选用酸式滴定管
B.实验4和实验5中a与b的关系式为
C.根据图3与图4结果可知,离子的水解活性强弱还受离子种类的影响
ⅱ.有同学猜想图3结果是因为氯离子促进了的水解,请你设计其他简单实验证明该猜想成立:__________(写出实验操作、现象或结果)。
19.(14分)党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
Ⅰ.工业上用和在一定条件下可以合成乙烯:
已知:①
②
③
(1)__________(用、、表示)。
(2)恒温恒容下,向密闭容器按投料比通入原料气,能判断该反应处于平衡状态的是__________(填标号)。
A. B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.保持不变
(3)向密闭容器按投料比通入原料气(,不同温度对的平衡转化率和催化剂催化效率的影响如图所示,则压强__________,原因是:__________。
Ⅱ.催化加氢可以直接合成二甲醚。涉及以下主要反应:
①
②
恒压条件下,、起始量相等时,的平衡转化率和的选择性随温度变化如图所示。
已知:的选择性%
(4)300℃时,通入、各,平衡时的选择性、的平衡转化率均为30%,则此温度下反应①的平衡常数__________(保留2位有效数字)。
(5)温度高于300℃,的平衡转化率随温度升高而增大的原因可能是__________。
Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如图所示。
(6)该电池的阴极电极反应式为:__________。
福州第三中学2023-2024学年高二上学期期末考试
化学答案
1.B 2.A 3.B 4.A 5.B 6.D 7.C 8.C 9.D 10.C
11.C 12.B 13.D 14.B 15.C
16.(12分)
(1) 9
(2) >
(3)
(4)
17.(16分)
(1)和 70℃和
(2)
(3)7.5
(4)
(5)当滴入最后一滴酸性溶液后,溶液由无色变为浅紫色,且半分钟内不褪色
BC
18.(13分)
(1)分液漏斗(1分)
(2)反应前排尽装置中的空气,反应后将装置中残留的有毒赶走(2分,前后各1分)
(3)(2分)
(4)①吸热(1分) ②正(1分)
实验1相较于实验3,溶液稀释了10倍,而实验1的pH增大值小于1(2分,其他合理答案也得分)
③B(2分)在25℃下,向的溶液中加入一定量的氯化钠固体,若pH减小,说明假设a正确(2分,实验方法得1分,实验现象或结果得1分,其他合理答案也得分)
19.(14分)
(1)
(2)CD
(3)< 反应为气体体积减小的放热反应,M点转化率高,气体的总物质的量小,且此时温度低,所以M点压强小于N点压强
(4)0.20
(5)升高温度,反应①正向移动,的平衡转化率增大,反应②逆向移动,的平衡转化率减小,300℃后升温,反应①中的平衡转化率增大的幅度大于反应②的减小幅度
(6)
同课章节目录
