7.3溶液浓稀的表示同步练习(含答案)科粤版(2012)化学九年级下册
文档属性
| 名称 | 7.3溶液浓稀的表示同步练习(含答案)科粤版(2012)化学九年级下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 693.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-27 09:00:41 | ||
图片预览


文档简介
7.3溶液浓稀的表示同步练习科粤版(2012)化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.下列有关溶液的说法中正确的是
A.饱和溶液转化为不饱和溶液,溶液中溶质的质量分数一定减小
B.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液
C.将5g某物质放入95 g水中,所得溶液中溶质的质量分数不一定是5%
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量分数一定减小
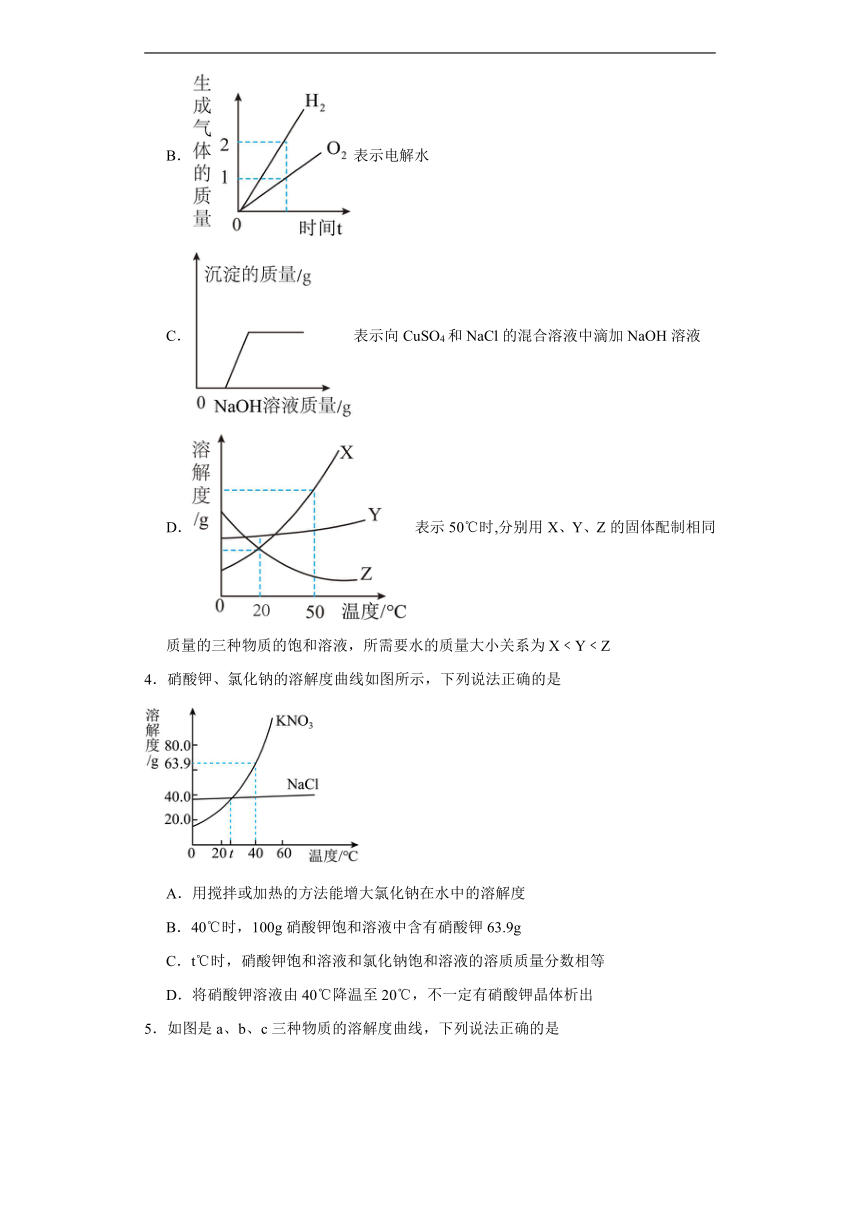
2.如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是
A.t1℃时a、c两物质溶液中溶质的质量分数相等
B.t2℃时,物质a的100g饱和溶液中含有25g物质a
C.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a>c
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g
3.下列图像能正确反映其对应关系的是
A.表示等质量的X、Y两种金属分别和足量的同浓度的盐酸反应,t3min时,消耗金属的质量:X=Y
B.表示电解水
C.表示向CuSO4和NaCl的混合溶液中滴加NaOH溶液
D. 表示50℃时,分别用X、Y、Z的固体配制相同质量的三种物质的饱和溶液,所需要水的质量大小关系为X﹤Y﹤Z
4.硝酸钾、氯化钠的溶解度曲线如图所示,下列说法正确的是
A.用搅拌或加热的方法能增大氯化钠在水中的溶解度
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9g
C.t℃时,硝酸钾饱和溶液和氯化钠饱和溶液的溶质质量分数相等
D.将硝酸钾溶液由40℃降温至20℃,不一定有硝酸钾晶体析出
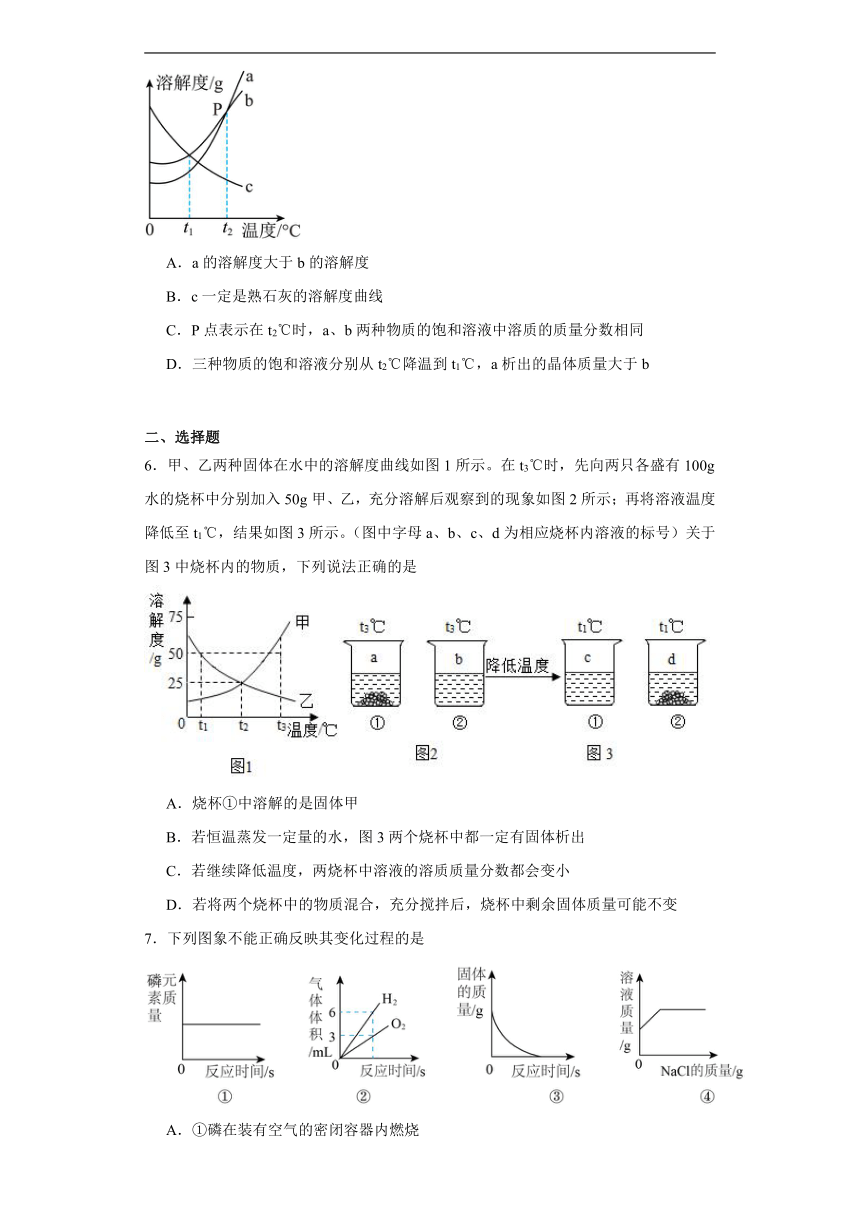
5.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.a的溶解度大于b的溶解度
B.c一定是熟石灰的溶解度曲线
C.P点表示在t2℃时,a、b两种物质的饱和溶液中溶质的质量分数相同
D.三种物质的饱和溶液分别从t2℃降温到t1℃,a析出的晶体质量大于b
二、选择题
6.甲、乙两种固体在水中的溶解度曲线如图1所示。在t3℃时,先向两只各盛有100g水的烧杯中分别加入50g甲、乙,充分溶解后观察到的现象如图2所示;再将溶液温度降低至t1℃,结果如图3所示。(图中字母a、b、c、d为相应烧杯内溶液的标号)关于图3中烧杯内的物质,下列说法正确的是
A.烧杯①中溶解的是固体甲
B.若恒温蒸发一定量的水,图3两个烧杯中都一定有固体析出
C.若继续降低温度,两烧杯中溶液的溶质质量分数都会变小
D.若将两个烧杯中的物质混合,充分搅拌后,烧杯中剩余固体质量可能不变
7.下列图象不能正确反映其变化过程的是
A.①磷在装有空气的密闭容器内燃烧
B.②电解水生成气体的体积
C.③向一定量的生铁中加入足量稀盐酸
D.④向一定质量接近饱和的NaCl溶液中加入固体NaCl
8.测得某葡萄糖溶液中氢元素的质量分数为11%,则该溶液中葡萄糖的质量分数为
A.2.5% B.5% C.25% D.50%
9.时,在饱和硫酸铜溶液中加入少量白色硫酸铜粉末,溶液保持,下列叙述正确的是:
①有蓝色晶体析出
②饱和溶液总质量不变
③饱和溶液中溶质质量减少
④饱和溶液中溶剂质量减少
⑤饱和溶液的溶质质量分数减小
⑥饱和溶液的溶质质量分数不变
A.①③④⑥ B.①③④⑤ C.①②⑥ D.①⑤
10.20℃时,某物质的溶解度为40g,下列有关说法正确的是
A.20℃时,100g该物质的饱和溶液中含有40g该物质
B.20℃时,该物质的饱和溶液中溶质与溶剂的质量比是2:5
C.20℃时,该物质的饱和溶液中溶质的质量分数是40%
D.将该物质的饱和溶液降温,一定会有晶体析出
11.a、b两物质的溶解曲线如图,有关叙述正确的是
A.a的溶解度大于b的溶解度
B.10℃时a、b的饱和溶液,升温到t℃时仍是饱和溶液
C.10℃时,用相同质量的a、b分别配成饱和溶液,所需水的质量a>b
D.t℃时a、b的饱和溶液,升温到30℃所得溶液中溶质的质量分数a>b
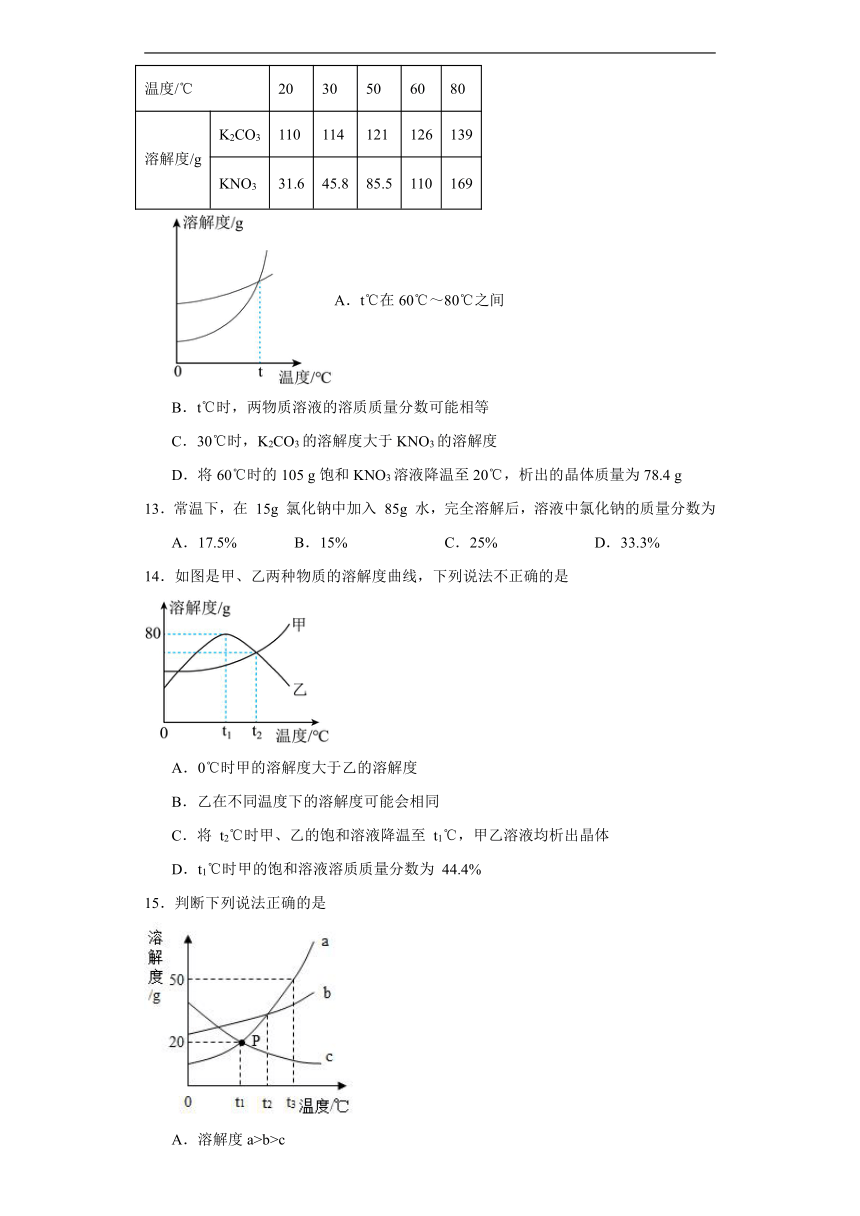
12.K2CO3和KNO3在不同温度时的溶解度及溶解度曲线如图所示。下列说法错误的是( )
温度/℃ 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
A.t℃在60℃~80℃之间
B.t℃时,两物质溶液的溶质质量分数可能相等
C.30℃时,K2CO3的溶解度大于KNO3的溶解度
D.将60℃时的105 g饱和KNO3溶液降温至20℃,析出的晶体质量为78.4 g
13.常温下,在 15g 氯化钠中加入 85g 水,完全溶解后,溶液中氯化钠的质量分数为
A.17.5% B.15% C.25% D.33.3%
14.如图是甲、乙两种物质的溶解度曲线,下列说法不正确的是
A.0℃时甲的溶解度大于乙的溶解度
B.乙在不同温度下的溶解度可能会相同
C.将 t2℃时甲、乙的饱和溶液降温至 t1℃,甲乙溶液均析出晶体
D.t1℃时甲的饱和溶液溶质质量分数为 44.4%
15.判断下列说法正确的是
A.溶解度a>b>c
B.t3℃时将30克a物质溶于50克水中,得a溶液80克
C.将c的饱和溶液从t3℃降温到t1℃,其溶质质量分数变大
D.将t3℃时,a、b、c物质的饱和溶液降温至t1℃后三种溶液中溶质质量分数大小是b>a>c
三、综合应用题
16.碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ 以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧 煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊。煅烧时反应的化学方程式为 。
(2)转化 向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O。温度升高,说明该反应 热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(产率=×100%)的影响分别如图所示。则最佳的煅烧温度为 ℃,煅烧时间为 小时。
(3)测定 假设产品中仅混有少量MnO。某小组设计下列装置,通过测定生成O2的体积, 计算MgO2的质量分数。
已知:①MnO2与稀盐酸不反应、②MgO2+2HCl=MgCl2+H2O2、③ 2MgO22MnO+O2↑、④. MgO+CMg+CO↑
①仪器M的名称是 。MnO2的作用是 。
②相同条件下, 能使测定结果更准确。(填“装置A”或“装置B”)
③实验室用溶质质量分数为37%、密度是1.18g·mL-1的浓盐酸配制10%的稀盐酸110g,需要水 mL。(水的密度是1g·mL-1,计算结果保留一位小数)
④经讨论,该小组又设计了下列3种方案。分别取5.0g产品进行实验,能确定MgO2质量分数的是 。(填序号)
A.加热,使MgO2完全分解,测出剩余固体的质量
B.与足量炭粉在高温下充分反应,测出生成Mg的质量
C.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
Ⅱ MgCl2是制备Mg2(OH)2CO3的原料。现用含碳酸镁84%的菱镁矿制备MgCl2,反应如下:
MgCO3+Cl2+COMgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程) 。
17.金属及其制品是现代生活中不可缺少的材料和工具。
①某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2。
I.配制稀盐酸需要市售37%的浓盐酸稀释。“37%”的含义是 ;配制中需要用到的仪器除烧杯、胶头滴管、试剂瓶外,还需要 。
Ⅱ.6.5g粗锌完全反应共产生H20.08mol,该粗锌中锌的质量分数为 (根据化学方程式计算)
②在“探究金属的性质”实验时,将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。若将所得滤渣放入稀盐酸中,有气泡产生,则滤液中可能含有的溶质是 ,滤渣中一定含有的金属是 。
18.甲同学用如图装置完成过氧化氢制取氧气的实验,乙同学观察到甲同学先在圆底烧瓶中加入了水和二氧化锰的混合物,产生了疑问,他提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓
猜想2:加水可以……
并根据猜想进行了实验:每次取15mL15%的过氧化氢溶液,稀释成不同溶质质量分数,在其他条件相同的情况下进行实验,记录数据如下:
实验 1 2 3 4 5
过氧化氢溶液溶质质量分数 1% 3% 5% 10% 15%
MnO2粉末用量/g 1.0 1.0 1.0 x 1.0
收集到100mL气体时所用时间/秒 112 38 21 7 3
反应后液体温度/℃ 26 38 43 59 71
(1)实验4中x的数值为 。
(2)通过实验数据,过氧化氢溶液的溶质质量分数对反应速率有怎样的影响?
(3)根据表中数据推测,该同学的猜想2是:加水可以 。
(4)若选用10%的过氧化氢溶液和二氧化锰制取氧气,充分反应后得到0.01mol氧气,请问至少需要该过氧化氢溶液多少g?(根据化学方程式例式计算) 。
参考答案:
1.CD
2.CD
3.AD
4.CD
5.CD
6.B
7.C
8.A
9.A
10.B
11.C
12.D
13.B
14.C
15.D
16.(1)Mg2(OH)2CO32MgO+CO2↑+H2O
(2) 放出 650 2
(3) 分液漏斗 催化 A 80.3 a
答:需要这样的菱镁矿20吨。
17. 每100g浓盐酸中含溶质的质量为37g 玻璃棒、量筒 80% Fe(NO3)2 Ag、Fe
18.(1)1.0
(2)H2O2溶液的溶质质量分数越大反应速率越快
(3)给溶液降温
(4)6.8g
解:0.01mol氧气的质量为0.01mol×32g/ mol=0.32g;设至少需要该过氧化氢溶液质量为x,
答:至少需要该过氧化氢溶液质量为6.8g。
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.下列有关溶液的说法中正确的是
A.饱和溶液转化为不饱和溶液,溶液中溶质的质量分数一定减小
B.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液
C.将5g某物质放入95 g水中,所得溶液中溶质的质量分数不一定是5%
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量分数一定减小
2.如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是
A.t1℃时a、c两物质溶液中溶质的质量分数相等
B.t2℃时,物质a的100g饱和溶液中含有25g物质a
C.t2℃时,分别将a、b、c的饱和溶液降温至t1℃,溶质质量分数关系是b>a>c
D.t2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g
3.下列图像能正确反映其对应关系的是
A.表示等质量的X、Y两种金属分别和足量的同浓度的盐酸反应,t3min时,消耗金属的质量:X=Y
B.表示电解水
C.表示向CuSO4和NaCl的混合溶液中滴加NaOH溶液
D. 表示50℃时,分别用X、Y、Z的固体配制相同质量的三种物质的饱和溶液,所需要水的质量大小关系为X﹤Y﹤Z
4.硝酸钾、氯化钠的溶解度曲线如图所示,下列说法正确的是
A.用搅拌或加热的方法能增大氯化钠在水中的溶解度
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9g
C.t℃时,硝酸钾饱和溶液和氯化钠饱和溶液的溶质质量分数相等
D.将硝酸钾溶液由40℃降温至20℃,不一定有硝酸钾晶体析出
5.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.a的溶解度大于b的溶解度
B.c一定是熟石灰的溶解度曲线
C.P点表示在t2℃时,a、b两种物质的饱和溶液中溶质的质量分数相同
D.三种物质的饱和溶液分别从t2℃降温到t1℃,a析出的晶体质量大于b
二、选择题
6.甲、乙两种固体在水中的溶解度曲线如图1所示。在t3℃时,先向两只各盛有100g水的烧杯中分别加入50g甲、乙,充分溶解后观察到的现象如图2所示;再将溶液温度降低至t1℃,结果如图3所示。(图中字母a、b、c、d为相应烧杯内溶液的标号)关于图3中烧杯内的物质,下列说法正确的是
A.烧杯①中溶解的是固体甲
B.若恒温蒸发一定量的水,图3两个烧杯中都一定有固体析出
C.若继续降低温度,两烧杯中溶液的溶质质量分数都会变小
D.若将两个烧杯中的物质混合,充分搅拌后,烧杯中剩余固体质量可能不变
7.下列图象不能正确反映其变化过程的是
A.①磷在装有空气的密闭容器内燃烧
B.②电解水生成气体的体积
C.③向一定量的生铁中加入足量稀盐酸
D.④向一定质量接近饱和的NaCl溶液中加入固体NaCl
8.测得某葡萄糖溶液中氢元素的质量分数为11%,则该溶液中葡萄糖的质量分数为
A.2.5% B.5% C.25% D.50%
9.时,在饱和硫酸铜溶液中加入少量白色硫酸铜粉末,溶液保持,下列叙述正确的是:
①有蓝色晶体析出
②饱和溶液总质量不变
③饱和溶液中溶质质量减少
④饱和溶液中溶剂质量减少
⑤饱和溶液的溶质质量分数减小
⑥饱和溶液的溶质质量分数不变
A.①③④⑥ B.①③④⑤ C.①②⑥ D.①⑤
10.20℃时,某物质的溶解度为40g,下列有关说法正确的是
A.20℃时,100g该物质的饱和溶液中含有40g该物质
B.20℃时,该物质的饱和溶液中溶质与溶剂的质量比是2:5
C.20℃时,该物质的饱和溶液中溶质的质量分数是40%
D.将该物质的饱和溶液降温,一定会有晶体析出
11.a、b两物质的溶解曲线如图,有关叙述正确的是
A.a的溶解度大于b的溶解度
B.10℃时a、b的饱和溶液,升温到t℃时仍是饱和溶液
C.10℃时,用相同质量的a、b分别配成饱和溶液,所需水的质量a>b
D.t℃时a、b的饱和溶液,升温到30℃所得溶液中溶质的质量分数a>b
12.K2CO3和KNO3在不同温度时的溶解度及溶解度曲线如图所示。下列说法错误的是( )
温度/℃ 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
A.t℃在60℃~80℃之间
B.t℃时,两物质溶液的溶质质量分数可能相等
C.30℃时,K2CO3的溶解度大于KNO3的溶解度
D.将60℃时的105 g饱和KNO3溶液降温至20℃,析出的晶体质量为78.4 g
13.常温下,在 15g 氯化钠中加入 85g 水,完全溶解后,溶液中氯化钠的质量分数为
A.17.5% B.15% C.25% D.33.3%
14.如图是甲、乙两种物质的溶解度曲线,下列说法不正确的是
A.0℃时甲的溶解度大于乙的溶解度
B.乙在不同温度下的溶解度可能会相同
C.将 t2℃时甲、乙的饱和溶液降温至 t1℃,甲乙溶液均析出晶体
D.t1℃时甲的饱和溶液溶质质量分数为 44.4%
15.判断下列说法正确的是
A.溶解度a>b>c
B.t3℃时将30克a物质溶于50克水中,得a溶液80克
C.将c的饱和溶液从t3℃降温到t1℃,其溶质质量分数变大
D.将t3℃时,a、b、c物质的饱和溶液降温至t1℃后三种溶液中溶质质量分数大小是b>a>c
三、综合应用题
16.碱式碳酸镁[Mg2(OH)2CO3]和过氧化镁(MgO2)都是重要化工原料。
Ⅰ 以Mg2(OH)2CO3为原料,制备产品MgO2的步骤如下:
(1)煅烧 煅烧Mg2(OH)2CO3得到三种氧化物,其中一种常温下是气体,且能使澄清石灰水变浑浊。煅烧时反应的化学方程式为 。
(2)转化 向所得固体中加双氧水充分搅拌,发生反应MgO+H2O2=MgO2+H2O。温度升高,说明该反应 热量(填“放出”或“吸收”)。其他条件相同,煅烧温度、煅烧时间不同,所得MgO对MgO2产率(产率=×100%)的影响分别如图所示。则最佳的煅烧温度为 ℃,煅烧时间为 小时。
(3)测定 假设产品中仅混有少量MnO。某小组设计下列装置,通过测定生成O2的体积, 计算MgO2的质量分数。
已知:①MnO2与稀盐酸不反应、②MgO2+2HCl=MgCl2+H2O2、③ 2MgO22MnO+O2↑、④. MgO+CMg+CO↑
①仪器M的名称是 。MnO2的作用是 。
②相同条件下, 能使测定结果更准确。(填“装置A”或“装置B”)
③实验室用溶质质量分数为37%、密度是1.18g·mL-1的浓盐酸配制10%的稀盐酸110g,需要水 mL。(水的密度是1g·mL-1,计算结果保留一位小数)
④经讨论,该小组又设计了下列3种方案。分别取5.0g产品进行实验,能确定MgO2质量分数的是 。(填序号)
A.加热,使MgO2完全分解,测出剩余固体的质量
B.与足量炭粉在高温下充分反应,测出生成Mg的质量
C.先加足量稀盐酸,再加足量NaOH溶液,充分反应,测出Mg(OH)2质量
Ⅱ MgCl2是制备Mg2(OH)2CO3的原料。现用含碳酸镁84%的菱镁矿制备MgCl2,反应如下:
MgCO3+Cl2+COMgCl2+2CO2(设杂质不参加反应)。生产19吨MgCl2需要这样的菱镁矿多少吨?(写出计算过程) 。
17.金属及其制品是现代生活中不可缺少的材料和工具。
①某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2。
I.配制稀盐酸需要市售37%的浓盐酸稀释。“37%”的含义是 ;配制中需要用到的仪器除烧杯、胶头滴管、试剂瓶外,还需要 。
Ⅱ.6.5g粗锌完全反应共产生H20.08mol,该粗锌中锌的质量分数为 (根据化学方程式计算)
②在“探究金属的性质”实验时,将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。若将所得滤渣放入稀盐酸中,有气泡产生,则滤液中可能含有的溶质是 ,滤渣中一定含有的金属是 。
18.甲同学用如图装置完成过氧化氢制取氧气的实验,乙同学观察到甲同学先在圆底烧瓶中加入了水和二氧化锰的混合物,产生了疑问,他提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓
猜想2:加水可以……
并根据猜想进行了实验:每次取15mL15%的过氧化氢溶液,稀释成不同溶质质量分数,在其他条件相同的情况下进行实验,记录数据如下:
实验 1 2 3 4 5
过氧化氢溶液溶质质量分数 1% 3% 5% 10% 15%
MnO2粉末用量/g 1.0 1.0 1.0 x 1.0
收集到100mL气体时所用时间/秒 112 38 21 7 3
反应后液体温度/℃ 26 38 43 59 71
(1)实验4中x的数值为 。
(2)通过实验数据,过氧化氢溶液的溶质质量分数对反应速率有怎样的影响?
(3)根据表中数据推测,该同学的猜想2是:加水可以 。
(4)若选用10%的过氧化氢溶液和二氧化锰制取氧气,充分反应后得到0.01mol氧气,请问至少需要该过氧化氢溶液多少g?(根据化学方程式例式计算) 。
参考答案:
1.CD
2.CD
3.AD
4.CD
5.CD
6.B
7.C
8.A
9.A
10.B
11.C
12.D
13.B
14.C
15.D
16.(1)Mg2(OH)2CO32MgO+CO2↑+H2O
(2) 放出 650 2
(3) 分液漏斗 催化 A 80.3 a
答:需要这样的菱镁矿20吨。
17. 每100g浓盐酸中含溶质的质量为37g 玻璃棒、量筒 80% Fe(NO3)2 Ag、Fe
18.(1)1.0
(2)H2O2溶液的溶质质量分数越大反应速率越快
(3)给溶液降温
(4)6.8g
解:0.01mol氧气的质量为0.01mol×32g/ mol=0.32g;设至少需要该过氧化氢溶液质量为x,
答:至少需要该过氧化氢溶液质量为6.8g。
