8.1溶液的酸碱性同步练习(含答案) 科粤版(2012)化学九年级下册
文档属性
| 名称 | 8.1溶液的酸碱性同步练习(含答案) 科粤版(2012)化学九年级下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 457.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-27 09:05:16 | ||
图片预览



文档简介
8.1溶液的酸碱性同步练习科粤版(2012)化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、多选题
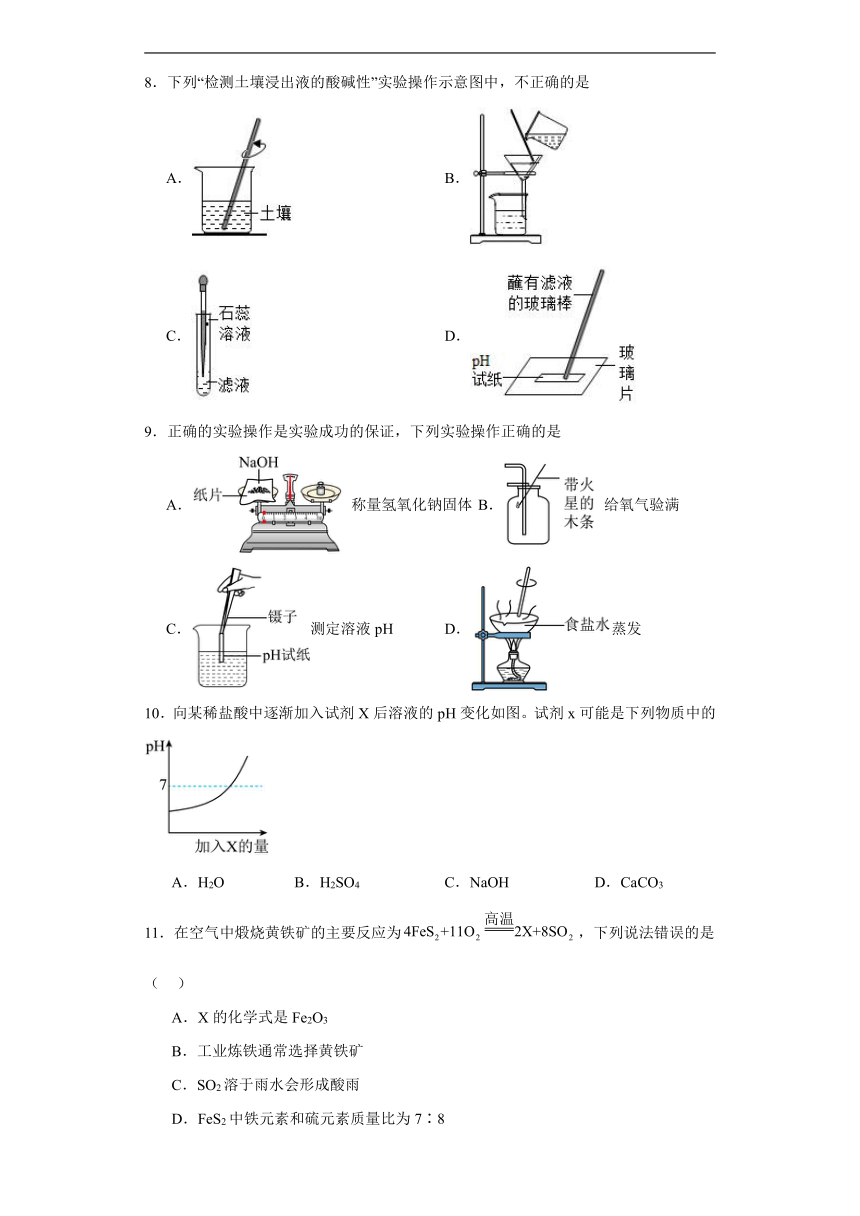
1.下列图示的实验操作不正确的是 ( )
A.给液体加热 B.测溶液的pH C.检验氧气是否集满 D.检查装置气密性
2.归纳推理是化学学习中常用的思维方法,下列推理正确的是
A.活泼金属与稀盐酸反应产生气泡,但与稀盐酸反应产生气泡的物质不一定是活泼金属
B.同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
C.常温下,pH<7的溶液显酸性,因此pH<7的雨水一定都是酸雨
D.溶液是均一、稳定的,所以均一、稳定的液体一定是溶液
3.下列实验操作,能达到预期目的的是
A.用普通pH试纸测定某溶液的pH为5.5
B.用托盘天平称取5.6g铁粉
C.用10mL量筒量取8.8mL水
D.将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸
4.常温下,四种水果及两种饮料的pH如下。下列说法正确的是
A.纯净水显中性 B.苏打水中滴入酚酞试液,溶液变红
C.番茄汁显碱性 D.水果中酸性最强的物质是西瓜汁
5.溶液甲是100g20%的硫酸,对其进行如下图所示的操作,得到溶质质量分数为10%的溶液乙。有关溶液乙的说法正确的是
A.溶液的pH:乙<甲 B.溶液质量:200g
C.溶质与溶剂的质量比: D.溶质物质的量的计算式:
二、选择题
6.小轩同学在一场大雨后,想测定土壤的pH来判断当地空气质量,下列说法不正确的是
A.需要取少量土壤于试管中,加入水浸泡,静置后,取上层澄清液测定pH
B.测定pH主要仪器和用品有玻璃棒、白瓷板、pH试纸
C.若溶液pH小于5.6是由于空气中二氧化碳与水反应导致
D.若测出的pH小于5.6,可以说明当地空气质量较差
7.用数轴表示某些化学知识直观、简明、易记。下列用数轴表示的化学知识,不正确的是
A.生活中常见物质的pH:
B.地壳中部分元素的含量:
C.空气中部分成分的含量:
D.部分金属的活动性顺序:
8.下列“检测土壤浸出液的酸碱性”实验操作示意图中,不正确的是
A. B.
C. D.
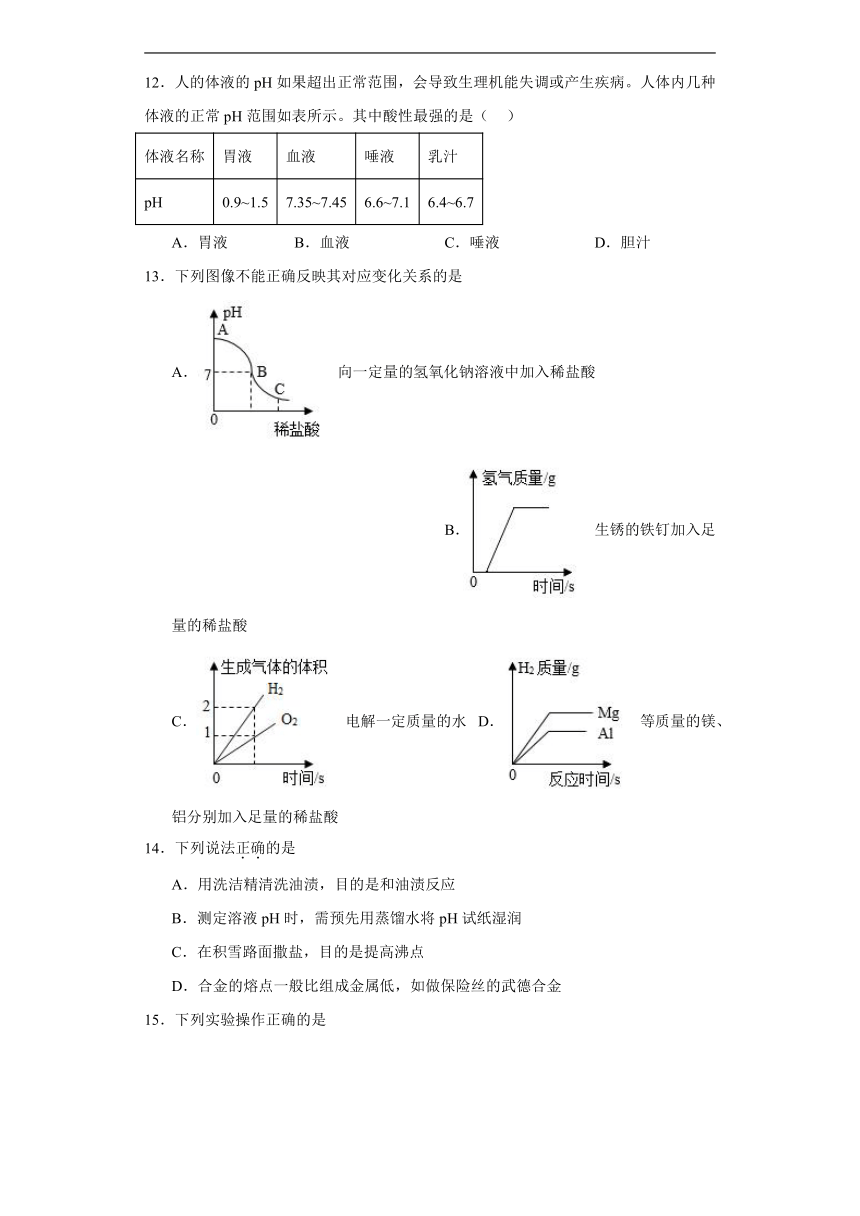
9.正确的实验操作是实验成功的保证,下列实验操作正确的是
A. 称量氢氧化钠固体 B. 给氧气验满
C.测定溶液pH D.蒸发
10.向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂x可能是下列物质中的
A.H2O B.H2SO4 C.NaOH D.CaCO3
11.在空气中煅烧黄铁矿的主要反应为,下列说法错误的是( )
A.X的化学式是Fe2O3
B.工业炼铁通常选择黄铁矿
C.SO2溶于雨水会形成酸雨
D.FeS2中铁元素和硫元素质量比为7∶8
12.人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示。其中酸性最强的是( )
体液名称 胃液 血液 唾液 乳汁
pH 0.9~1.5 7.35~7.45 6.6~7.1 6.4~6.7
A.胃液 B.血液 C.唾液 D.胆汁
13.下列图像不能正确反映其对应变化关系的是
A. 向一定量的氢氧化钠溶液中加入稀盐酸 B. 生锈的铁钉加入足量的稀盐酸
C. 电解一定质量的水 D. 等质量的镁、铝分别加入足量的稀盐酸
14.下列说法正确的是
A.用洗洁精清洗油渍,目的是和油渍反应
B.测定溶液pH时,需预先用蒸馏水将pH试纸湿润
C.在积雪路面撒盐,目的是提高沸点
D.合金的熔点一般比组成金属低,如做保险丝的武德合金
15.下列实验操作正确的是
A.收集CO2 B.检查装置气密性
C.测定溶液pH D.引燃酒精灯
三、综合应用题
16.小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数为 20%的氢氧化钠溶液
步骤二:向 40 g 待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用 pH 计记录溶液的 pH 变化情况,绘制图像如图所示。
(1)在往稀盐酸中逐滴滴入氢氧化钠溶液的过程中,当溶液的 pH 达到 12时,溶液中的溶质为 (用化学式表示)。
(2)已知发生反应的化学方程式为,请结合图示判断:
①当两者恰好完全反应时,滴加溶质质量分数为 20%的氢氧化钠溶液的质量为 g,
②计算 40g 稀盐酸的溶质质量分数为多少? (写出计算过程)
化学是研究物质的组成、结构、性质及变化规律的科学。
(1)①铜、②干冰、③氯化钠三种物质中,由离子构成的是 17 (填写序号,下同),可用于人工降雨的是 18 。
(2)食醋中含有醋酸(CH3COOH),醋酸由 19 种元素组成,其分子中氢、氧原子个数比为 20 。
(3)气体A和气体B接触可发生反应,生成固体C和液体D,其微观过程如下所示。
①该反应过程中,属于氧化物的是 21 (填名称)。
②将等体积的两只集气瓶中分别盛满A、B,如图2所示进行实验。已知相同条件下,气体的体积比等于分子个数比,则充分反应后,剩余的气体是 22 (填化学式)。
(4)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
①用pH试纸检测废水呈碱性,则pH 23 7。
②若某造纸厂废水中含NaOH的质量分数为l.6%,现有废硫酸9.8t(H2SO4的质量分数为20%),可以处理的废水质量是多少?(写出计算过程)
24
25.下表是我国颁布的生活饮用水水质标准的部分内容。
项目 标准
感官指标 无异味、异臭等
化学指标 pH 6.5~8.5,铜<1.0mg L-1,氟化物<1.0mg L-1,游离氯≥0.3mg L-1等
(1)感官指标表现的是自来水的 性质(填“物理”或“化学”);若化学指标中的pH=8时,表明自来水呈 (填“酸性”、“碱性”或“中性”)。
(2)天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是 。
(3)硬水给生活和生产带来很多麻烦,生活中可用 来区分硬水和软水,常用 的方法来降低水的硬度。
(4)液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为 ;从能量变化角度看,该反应中将 能转化为化学能。
(5)饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是 。NH2Cl中氯元素与氢元素的质量比是 。
(6)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
(其中,表示钠原子,表示氯原子,表示氧原子)
该反应的化学方程式是 。
参考答案:
1.AB
2.AB
3.BC
4.AB
5.BD
6.C
7.D
8.C
9.D
10.C
11.B
12.A
13.D
14.D
15.B
16.(1)NaCl和NaOH
(2) 16 设稀盐酸的溶质质量分数为x
答:40g 稀盐酸的溶质质量分数为7.3%。
17.③ 18.② 19.三/3 20.2:1 21.二氧化硫、水 22.SO2 23.> 24.解:设氢氧化钠的质量为x
答:可以处理废水100t。
25. 物理 碱性 蒸馏 肥皂水 煮沸 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 电能 0 71:4 2NaClO2+Cl2=2NaCl+2ClO2
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.下列图示的实验操作不正确的是 ( )
A.给液体加热 B.测溶液的pH C.检验氧气是否集满 D.检查装置气密性
2.归纳推理是化学学习中常用的思维方法,下列推理正确的是
A.活泼金属与稀盐酸反应产生气泡,但与稀盐酸反应产生气泡的物质不一定是活泼金属
B.同种元素的原子质子数相同,则质子数相同的原子一定是同种元素
C.常温下,pH<7的溶液显酸性,因此pH<7的雨水一定都是酸雨
D.溶液是均一、稳定的,所以均一、稳定的液体一定是溶液
3.下列实验操作,能达到预期目的的是
A.用普通pH试纸测定某溶液的pH为5.5
B.用托盘天平称取5.6g铁粉
C.用10mL量筒量取8.8mL水
D.将50g溶质质量分数为10%的稀盐酸加热蒸发掉25g水,得到溶质质量分数为20%的盐酸
4.常温下,四种水果及两种饮料的pH如下。下列说法正确的是
A.纯净水显中性 B.苏打水中滴入酚酞试液,溶液变红
C.番茄汁显碱性 D.水果中酸性最强的物质是西瓜汁
5.溶液甲是100g20%的硫酸,对其进行如下图所示的操作,得到溶质质量分数为10%的溶液乙。有关溶液乙的说法正确的是
A.溶液的pH:乙<甲 B.溶液质量:200g
C.溶质与溶剂的质量比: D.溶质物质的量的计算式:
二、选择题
6.小轩同学在一场大雨后,想测定土壤的pH来判断当地空气质量,下列说法不正确的是
A.需要取少量土壤于试管中,加入水浸泡,静置后,取上层澄清液测定pH
B.测定pH主要仪器和用品有玻璃棒、白瓷板、pH试纸
C.若溶液pH小于5.6是由于空气中二氧化碳与水反应导致
D.若测出的pH小于5.6,可以说明当地空气质量较差
7.用数轴表示某些化学知识直观、简明、易记。下列用数轴表示的化学知识,不正确的是
A.生活中常见物质的pH:
B.地壳中部分元素的含量:
C.空气中部分成分的含量:
D.部分金属的活动性顺序:
8.下列“检测土壤浸出液的酸碱性”实验操作示意图中,不正确的是
A. B.
C. D.
9.正确的实验操作是实验成功的保证,下列实验操作正确的是
A. 称量氢氧化钠固体 B. 给氧气验满
C.测定溶液pH D.蒸发
10.向某稀盐酸中逐渐加入试剂X后溶液的pH变化如图。试剂x可能是下列物质中的
A.H2O B.H2SO4 C.NaOH D.CaCO3
11.在空气中煅烧黄铁矿的主要反应为,下列说法错误的是( )
A.X的化学式是Fe2O3
B.工业炼铁通常选择黄铁矿
C.SO2溶于雨水会形成酸雨
D.FeS2中铁元素和硫元素质量比为7∶8
12.人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示。其中酸性最强的是( )
体液名称 胃液 血液 唾液 乳汁
pH 0.9~1.5 7.35~7.45 6.6~7.1 6.4~6.7
A.胃液 B.血液 C.唾液 D.胆汁
13.下列图像不能正确反映其对应变化关系的是
A. 向一定量的氢氧化钠溶液中加入稀盐酸 B. 生锈的铁钉加入足量的稀盐酸
C. 电解一定质量的水 D. 等质量的镁、铝分别加入足量的稀盐酸
14.下列说法正确的是
A.用洗洁精清洗油渍,目的是和油渍反应
B.测定溶液pH时,需预先用蒸馏水将pH试纸湿润
C.在积雪路面撒盐,目的是提高沸点
D.合金的熔点一般比组成金属低,如做保险丝的武德合金
15.下列实验操作正确的是
A.收集CO2 B.检查装置气密性
C.测定溶液pH D.引燃酒精灯
三、综合应用题
16.小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数为 20%的氢氧化钠溶液
步骤二:向 40 g 待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用 pH 计记录溶液的 pH 变化情况,绘制图像如图所示。
(1)在往稀盐酸中逐滴滴入氢氧化钠溶液的过程中,当溶液的 pH 达到 12时,溶液中的溶质为 (用化学式表示)。
(2)已知发生反应的化学方程式为,请结合图示判断:
①当两者恰好完全反应时,滴加溶质质量分数为 20%的氢氧化钠溶液的质量为 g,
②计算 40g 稀盐酸的溶质质量分数为多少? (写出计算过程)
化学是研究物质的组成、结构、性质及变化规律的科学。
(1)①铜、②干冰、③氯化钠三种物质中,由离子构成的是 17 (填写序号,下同),可用于人工降雨的是 18 。
(2)食醋中含有醋酸(CH3COOH),醋酸由 19 种元素组成,其分子中氢、氧原子个数比为 20 。
(3)气体A和气体B接触可发生反应,生成固体C和液体D,其微观过程如下所示。
①该反应过程中,属于氧化物的是 21 (填名称)。
②将等体积的两只集气瓶中分别盛满A、B,如图2所示进行实验。已知相同条件下,气体的体积比等于分子个数比,则充分反应后,剩余的气体是 22 (填化学式)。
(4)造纸会产生大量含NaOH的碱性废水,需经处理呈中性后排放。
①用pH试纸检测废水呈碱性,则pH 23 7。
②若某造纸厂废水中含NaOH的质量分数为l.6%,现有废硫酸9.8t(H2SO4的质量分数为20%),可以处理的废水质量是多少?(写出计算过程)
24
25.下表是我国颁布的生活饮用水水质标准的部分内容。
项目 标准
感官指标 无异味、异臭等
化学指标 pH 6.5~8.5,铜<1.0mg L-1,氟化物<1.0mg L-1,游离氯≥0.3mg L-1等
(1)感官指标表现的是自来水的 性质(填“物理”或“化学”);若化学指标中的pH=8时,表明自来水呈 (填“酸性”、“碱性”或“中性”)。
(2)天然水中含有许多杂质,可利用吸附、沉淀、过滤和蒸馏等方法净化,其中净化程度最高的方法是 。
(3)硬水给生活和生产带来很多麻烦,生活中可用 来区分硬水和软水,常用 的方法来降低水的硬度。
(4)液氯可以作为饮用水消毒剂。下图是一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气 和氯气,该反应的化学方程式为 ;从能量变化角度看,该反应中将 能转化为化学能。
(5)饮用水消毒剂除了液氯以外,还有氯胺(NH2Cl)、臭氧(O3)等。O3中氧元素的化合价是 。NH2Cl中氯元素与氢元素的质量比是 。
(6)ClO2是新一代饮用水的消毒剂,可以用来代替Cl2进行自来水的消毒。制取ClO2的反应过程示意图如下:
(其中,表示钠原子,表示氯原子,表示氧原子)
该反应的化学方程式是 。
参考答案:
1.AB
2.AB
3.BC
4.AB
5.BD
6.C
7.D
8.C
9.D
10.C
11.B
12.A
13.D
14.D
15.B
16.(1)NaCl和NaOH
(2) 16 设稀盐酸的溶质质量分数为x
答:40g 稀盐酸的溶质质量分数为7.3%。
17.③ 18.② 19.三/3 20.2:1 21.二氧化硫、水 22.SO2 23.> 24.解:设氢氧化钠的质量为x
答:可以处理废水100t。
25. 物理 碱性 蒸馏 肥皂水 煮沸 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 电能 0 71:4 2NaClO2+Cl2=2NaCl+2ClO2
