化学人教版(2019)必修第二册6.2.2化学反应的限度(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.2化学反应的限度(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-27 15:14:42 | ||
图片预览







文档简介
(共23张PPT)
第六章 化学反应与能量
6.2.2 化学反应的限度
主要工艺设备
科学史话
科学史话
高炉炼铁原理:
C(焦炭)+ O2 === CO2(放出热量)
C(焦炭)+ CO2 === 2CO(吸收热量)
Fe2O3 + 3CO === 2Fe + 3CO2
高温
CO
Q1:我们已经增加了高炉的高度为什么排出的CO浓度还是不变呢?
科学史话
高炉炼铁原理:
C(焦炭)+ O2 === CO2(放出热量)
C(焦炭)+ CO2 2CO(吸收热量)
Fe2O3 + 3CO === 2Fe + 3CO2
高温
CO
Q1:我们已经增加了高炉的高度为什么排出的CO浓度还是不变呢?
科学史话
6.2.2 化学反应的限度
一、可逆反应与不可逆反应
可逆反应 不可逆反应
定义
举例
符号
特点
在同一条件下可逆程度很小(逆反应倾向很小)的化学反应。
在同一条件下正反应方向和逆反应方向均能进行的化学反应。
==
Cl2 + H2 ==== 2HCl
光照/点燃
Ag+ + Cl- === AgCl↓
N2 + 3H2 2NH3、
催化剂
高温高压
Cl2 + H2O HCl + HClO
双向性:反应物
正向反应
逆向反应
双同性:正逆反应在同一条件下同时进行
共存性:反应物和生成物同时存在
单向性:只能正向进行
反应进行彻底
2SO2 + O2 2SO3
催化剂
1、有两个化学反应,2H2+O2 === 2H2O、2H2O === 2H2↑+O2↑,它们属于可逆反应吗?
点燃
电解
不是。因为这两个反应分别在点燃和电解两个不同条件下进行。
再比如:NH3+HCl === NH4Cl、NH4Cl === NH3↑+HCl↑
2、二次电池的充电和放电属于可逆反应吗?
不是。因为充电和放电不能同时进行(排除人为干扰的因素下);
其次不是在同一条件下,放电无需外加条件,充电需要加外接电源。
3、CO2和H2O在植物体内通过光合作用合成糖与糖在人体内氧化生成CO2和H2O,属于可逆反应吗?
不是。因为两个反应发生场所不同、参加反应的酶不同、能量来源及转化形式不同、中间的代谢产物不同。
思 考
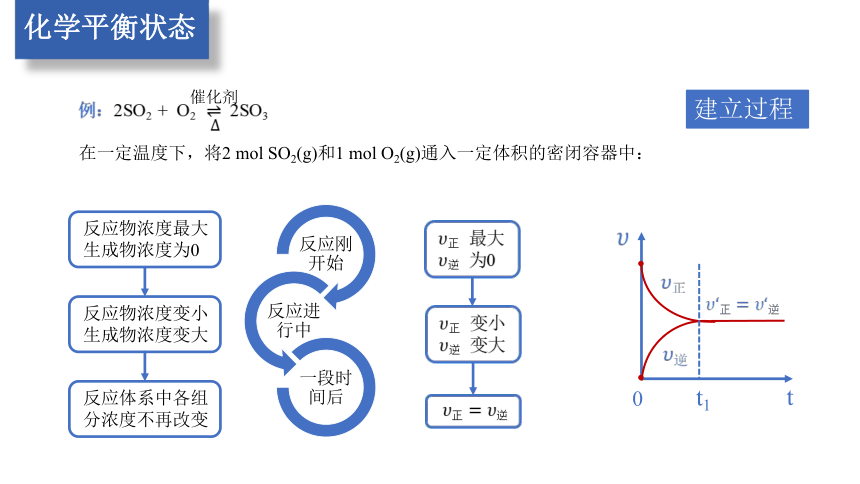
建立过程
例:2SO2 + O2 2SO3
催化剂
在一定温度下,将2 mol SO2(g)和1 mol O2(g)通入一定体积的密闭容器中:
反应刚开始
反应进行中
一段时间后
反应物浓度最大
生成物浓度为0
最大
为0
t
·
·
0
反应物浓度变小
生成物浓度变大
变小
变大
反应体系中各组
分浓度不再改变
t1
化学平衡状态
6.2.2 化学反应的限度
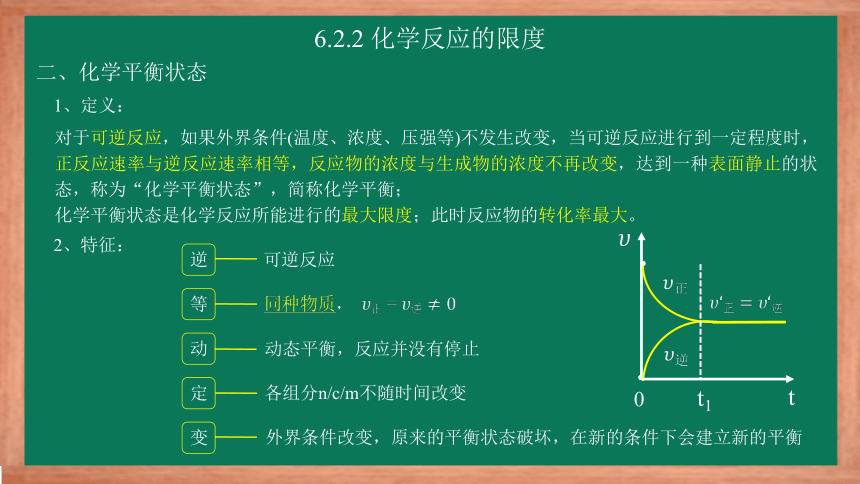
二、化学平衡状态
1、定义:
对于可逆反应,如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡;
化学平衡状态是化学反应所能进行的最大限度;此时反应物的转化率最大。
2、特征:
逆
可逆反应
同种物质, =
动态平衡,反应并没有停止
各组分n/c/m不随时间改变
外界条件改变,原来的平衡状态破坏,在新的条件下会建立新的平衡
变
定
动
等
·
t
·
0
t1
判断Ⅰ
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
2、若在相同时间内消耗 a mol O2同时消耗 2a mol NO,是否达到了化学平衡状态?
能
不能
逆反应
逆反应
速率特征:等
=
讨论:2NO2 2NO+O2
1、若在相同时间内消耗 2a mol NO2同时生成 2a mol NO2,是否达到了化学平衡状态?
正反应
逆反应
=
化学平衡状态
判断Ⅰ
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
2、若在相同时间内消耗 a mol O2同时生成 2a mol NO,是否达到了化学平衡状态?
能
4、若1个O=O键断裂的同时,4个N=O键断裂,是否达到了化学平衡状态?
能
3、若2每生成a molO2同时生成2a molNO2,是否达到了化学平衡状态?
能
逆反应
正反应
速率特征:等
=
2个NO2消耗
1个O2分子被消耗
逆反应
正反应
=
=
=
=
=
=
讨论:2NO2 2NO+O2
1、若在相同时间内消耗 2a mol NO2同时生成 2a mol NO2,是否达到了化学平衡状态?
正反应
逆反应
=
能
=
=
化学平衡状态
判断Ⅰ
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
2、若在相同时间内消耗 a mol O2同时生成 2a mol NO,是否达到了化学平衡状态?
能
4、若1个O=O键断裂的同时,4个N=O键断裂,是否达到了化学平衡状态?
能
3、若2每生成a molO2同时生成2a molNO2,是否达到了化学平衡状态?
能
逆反应
正反应
速率特征:等
=
2个NO2生成
1个O2分子被消耗
逆反应
正反应
=
=
=
=
=
=
讨论:2NO2 2NO+O2
1、若在相同时间内消耗 2a mol NO2同时生成 2a mol NO2,是否达到了化学平衡状态?
正反应
逆反应
=
能
=
=
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
5、若NO2是否达到了化学平衡状态?
能
判断Ⅱ
含量特征:定
6、若NO2是否达到了化学平衡状态?
能
讨论:2NO2 2NO+O2
c =
n =
n =
PV = nRT
体积分数 =
=
7、若c(NO2) = 2c(O2)是否达到了化学平衡状态?
c不再改变不代表c之比等于计量数之比(之比)。
不能
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 Ⅱ 含量特征 各组分的n、c、m、V、P保持不变 各组分的(质量分数)、体积分数保持不变(物质的量分数要看具体情况) 在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
9、若反应体系内是否达到了化学平衡状态?
能
10、若反应体系是否达到了化学平衡状态?
判断Ⅲ
间接特征
讨论:2NO2 2NO+O2
8、若NO2转化率保持不变/O2、NO的产率保持不变,是否达到了平衡状态?
若,颜色变浅;若, 颜色变深;当, 颜色恒定不变。
能
能
正向反应吸热,逆向反应放热。
若,吸热,温度↓;若, 放热,温度↑;当, 体系温度恒定不变。
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 Ⅱ 含量特征 各组分的n、c、m、V、P保持不变 各组分的(质量分数)、体积分数保持不变(物质的量分数要看具体情况) 间接特征 Ⅲ 反应物的转化率保持不变;产物的产率保持不变;含有色物质的平衡体系颜色保持不变; 绝热体系温度保持不变。 在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
11、若容器内是否达到了化学平衡状态?
m总不变,V总不变,ρ永远不变。
13、若容器内混合气体是否达到了化学平衡状态?
不能
能
判断Ⅳ
间接特征
若,P总↑;若, P总↓;当, P总恒定不变。
若,n总↑;若, n总↓;当, n总恒定不变。
讨论:2NO2 2NO+O2
能
能
14、若容器内混合气体是否达到了化学平衡状态?
12、若容器内混合气体是否达到了化学平衡状态?
M
若,n总↑, ↓;若, n总↓, ↑;当, n总和恒定不变。
PV = nRT
—
—
—
—
化学平衡状态
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
11、若容器内是否达到了化学平衡状态?
m总不变,V总不变,ρ永远不变。
13、若容器内混合气体是否达到了化学平衡状态?
不能
不能
判断Ⅳ
间接特征
P总永远恒定不变。
n总永远恒定不变。
不能
不能
14、若容器内混合气体是否达到了化学平衡状态?
12、若容器内混合气体是否达到了化学平衡状态?
M
讨论: H2(g)+I2(g)2HI(g)
永远恒定不变。
—
—
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 Ⅱ 含量特征 各组分的n、c、m、V、P保持不变 各组分的(质量分数)、体积分数保持不变(物质的量分数要看具体情况) 间接特征 Ⅲ 反应物的转化率保持不变;产物的产率保持不变;含有色物质的平衡体系颜色保持不变; 绝热体系温度保持不变。 变值/定值 m + n p + q P总行、n总行、m总不行、V总不行、ρ不行、M行 = m总/n总 m + n p + q P总不行、n总不行、m总不行、V总不行、ρ不行、M不行 Ⅳ 一个反应体系中,若某个量是个变值,它恒定不变时可以判定;若是个定值,则不能判定。 —
—
课堂练习
1、下列反应中可判断为可逆反应的是( )
A.氢气在氯气中燃烧生成氯化氢,氯化氢受热分解生成氢气和氯气
B.氮气与氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气
C.单质溴可以置换出碘,氯气又可以置换出溴
D.氯气和水反应生成盐酸和次氯酸,次氯酸在光照条件下可分解为盐酸和氧气
B
Cl2 + H2 ==== 2HCl
光照/点燃
2HCl ==== H2 +Cl2
N2 + 3H2 2NH3、
催化剂
高温高压
2HClO ==== 2HCl +O2↑
光照
Cl2 + H2O HCl + HClO
Br2 + 2I- ==== I2 +2Br-
Cl2 + 2Br - ==== Br2 +2Cl-
课堂练习
2、可逆反应: 在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol N2的同时生成2n mol NH3
②单位时间内生成n mol N2的同时生成3n mol H2
③用N2、NH3、H2表示的反应速率的比为1∶2∶3的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
(N2) =(NH3)
(N2) =(H2)
×
×
×
无论达到平衡与否,物质的反应速率之比等于化学方程式中物质的化学计量数之比。
√
A
若,P总↓;若, P总↑;当, P总恒定不变。
若,n总↓, ↑;若, n总↑, ↓;当, n总和恒定不变。
√
×
√
颜色永远恒定不变。
N2 + 3H2 2NH3
催化剂
高温高压
感谢聆听!
CHEMISTRY
第六章 化学反应与能量
6.2.2 化学反应的限度
主要工艺设备
科学史话
科学史话
高炉炼铁原理:
C(焦炭)+ O2 === CO2(放出热量)
C(焦炭)+ CO2 === 2CO(吸收热量)
Fe2O3 + 3CO === 2Fe + 3CO2
高温
CO
Q1:我们已经增加了高炉的高度为什么排出的CO浓度还是不变呢?
科学史话
高炉炼铁原理:
C(焦炭)+ O2 === CO2(放出热量)
C(焦炭)+ CO2 2CO(吸收热量)
Fe2O3 + 3CO === 2Fe + 3CO2
高温
CO
Q1:我们已经增加了高炉的高度为什么排出的CO浓度还是不变呢?
科学史话
6.2.2 化学反应的限度
一、可逆反应与不可逆反应
可逆反应 不可逆反应
定义
举例
符号
特点
在同一条件下可逆程度很小(逆反应倾向很小)的化学反应。
在同一条件下正反应方向和逆反应方向均能进行的化学反应。
==
Cl2 + H2 ==== 2HCl
光照/点燃
Ag+ + Cl- === AgCl↓
N2 + 3H2 2NH3、
催化剂
高温高压
Cl2 + H2O HCl + HClO
双向性:反应物
正向反应
逆向反应
双同性:正逆反应在同一条件下同时进行
共存性:反应物和生成物同时存在
单向性:只能正向进行
反应进行彻底
2SO2 + O2 2SO3
催化剂
1、有两个化学反应,2H2+O2 === 2H2O、2H2O === 2H2↑+O2↑,它们属于可逆反应吗?
点燃
电解
不是。因为这两个反应分别在点燃和电解两个不同条件下进行。
再比如:NH3+HCl === NH4Cl、NH4Cl === NH3↑+HCl↑
2、二次电池的充电和放电属于可逆反应吗?
不是。因为充电和放电不能同时进行(排除人为干扰的因素下);
其次不是在同一条件下,放电无需外加条件,充电需要加外接电源。
3、CO2和H2O在植物体内通过光合作用合成糖与糖在人体内氧化生成CO2和H2O,属于可逆反应吗?
不是。因为两个反应发生场所不同、参加反应的酶不同、能量来源及转化形式不同、中间的代谢产物不同。
思 考
建立过程
例:2SO2 + O2 2SO3
催化剂
在一定温度下,将2 mol SO2(g)和1 mol O2(g)通入一定体积的密闭容器中:
反应刚开始
反应进行中
一段时间后
反应物浓度最大
生成物浓度为0
最大
为0
t
·
·
0
反应物浓度变小
生成物浓度变大
变小
变大
反应体系中各组
分浓度不再改变
t1
化学平衡状态
6.2.2 化学反应的限度
二、化学平衡状态
1、定义:
对于可逆反应,如果外界条件(温度、浓度、压强等)不发生改变,当可逆反应进行到一定程度时,正反应速率与逆反应速率相等,反应物的浓度与生成物的浓度不再改变,达到一种表面静止的状态,称为“化学平衡状态”,简称化学平衡;
化学平衡状态是化学反应所能进行的最大限度;此时反应物的转化率最大。
2、特征:
逆
可逆反应
同种物质, =
动态平衡,反应并没有停止
各组分n/c/m不随时间改变
外界条件改变,原来的平衡状态破坏,在新的条件下会建立新的平衡
变
定
动
等
·
t
·
0
t1
判断Ⅰ
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
2、若在相同时间内消耗 a mol O2同时消耗 2a mol NO,是否达到了化学平衡状态?
能
不能
逆反应
逆反应
速率特征:等
=
讨论:2NO2 2NO+O2
1、若在相同时间内消耗 2a mol NO2同时生成 2a mol NO2,是否达到了化学平衡状态?
正反应
逆反应
=
化学平衡状态
判断Ⅰ
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
2、若在相同时间内消耗 a mol O2同时生成 2a mol NO,是否达到了化学平衡状态?
能
4、若1个O=O键断裂的同时,4个N=O键断裂,是否达到了化学平衡状态?
能
3、若2每生成a molO2同时生成2a molNO2,是否达到了化学平衡状态?
能
逆反应
正反应
速率特征:等
=
2个NO2消耗
1个O2分子被消耗
逆反应
正反应
=
=
=
=
=
=
讨论:2NO2 2NO+O2
1、若在相同时间内消耗 2a mol NO2同时生成 2a mol NO2,是否达到了化学平衡状态?
正反应
逆反应
=
能
=
=
化学平衡状态
判断Ⅰ
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
2、若在相同时间内消耗 a mol O2同时生成 2a mol NO,是否达到了化学平衡状态?
能
4、若1个O=O键断裂的同时,4个N=O键断裂,是否达到了化学平衡状态?
能
3、若2每生成a molO2同时生成2a molNO2,是否达到了化学平衡状态?
能
逆反应
正反应
速率特征:等
=
2个NO2生成
1个O2分子被消耗
逆反应
正反应
=
=
=
=
=
=
讨论:2NO2 2NO+O2
1、若在相同时间内消耗 2a mol NO2同时生成 2a mol NO2,是否达到了化学平衡状态?
正反应
逆反应
=
能
=
=
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
5、若NO2是否达到了化学平衡状态?
能
判断Ⅱ
含量特征:定
6、若NO2是否达到了化学平衡状态?
能
讨论:2NO2 2NO+O2
c =
n =
n =
PV = nRT
体积分数 =
=
7、若c(NO2) = 2c(O2)是否达到了化学平衡状态?
c不再改变不代表c之比等于计量数之比(之比)。
不能
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 Ⅱ 含量特征 各组分的n、c、m、V、P保持不变 各组分的(质量分数)、体积分数保持不变(物质的量分数要看具体情况) 在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
9、若反应体系内是否达到了化学平衡状态?
能
10、若反应体系是否达到了化学平衡状态?
判断Ⅲ
间接特征
讨论:2NO2 2NO+O2
8、若NO2转化率保持不变/O2、NO的产率保持不变,是否达到了平衡状态?
若,颜色变浅;若, 颜色变深;当, 颜色恒定不变。
能
能
正向反应吸热,逆向反应放热。
若,吸热,温度↓;若, 放热,温度↑;当, 体系温度恒定不变。
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 Ⅱ 含量特征 各组分的n、c、m、V、P保持不变 各组分的(质量分数)、体积分数保持不变(物质的量分数要看具体情况) 间接特征 Ⅲ 反应物的转化率保持不变;产物的产率保持不变;含有色物质的平衡体系颜色保持不变; 绝热体系温度保持不变。 在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
11、若容器内是否达到了化学平衡状态?
m总不变,V总不变,ρ永远不变。
13、若容器内混合气体是否达到了化学平衡状态?
不能
能
判断Ⅳ
间接特征
若,P总↑;若, P总↓;当, P总恒定不变。
若,n总↑;若, n总↓;当, n总恒定不变。
讨论:2NO2 2NO+O2
能
能
14、若容器内混合气体是否达到了化学平衡状态?
12、若容器内混合气体是否达到了化学平衡状态?
M
若,n总↑, ↓;若, n总↓, ↑;当, n总和恒定不变。
PV = nRT
—
—
—
—
化学平衡状态
在容积不变的密闭绝热容器中发生以上反应,探究判断可逆反应达到平衡状态的方法:
11、若容器内是否达到了化学平衡状态?
m总不变,V总不变,ρ永远不变。
13、若容器内混合气体是否达到了化学平衡状态?
不能
不能
判断Ⅳ
间接特征
P总永远恒定不变。
n总永远恒定不变。
不能
不能
14、若容器内混合气体是否达到了化学平衡状态?
12、若容器内混合气体是否达到了化学平衡状态?
M
讨论: H2(g)+I2(g)2HI(g)
永远恒定不变。
—
—
化学平衡状态
6.2.2 化学反应的限度
3、判断:
化学平衡状态的判断 m A(g) + n B(g) p C(g) + q D(g),V恒定 直接 标志 Ⅰ 速率特征: = 同一种物质的生成速率等于消耗速率 (A) = (A) 在化学方程式同一边的不同物质生成速率与消耗速率之比等于化学计量数之比 = q(C) = p(D)
在化学方程式两边的不同物质生成(或消耗)速率之比等于化学计量数之比 = q(B) = (D)
单位时间内同一物质断裂的化学键与生成的化学键的物质的量相等 Ⅱ 含量特征 各组分的n、c、m、V、P保持不变 各组分的(质量分数)、体积分数保持不变(物质的量分数要看具体情况) 间接特征 Ⅲ 反应物的转化率保持不变;产物的产率保持不变;含有色物质的平衡体系颜色保持不变; 绝热体系温度保持不变。 变值/定值 m + n p + q P总行、n总行、m总不行、V总不行、ρ不行、M行 = m总/n总 m + n p + q P总不行、n总不行、m总不行、V总不行、ρ不行、M不行 Ⅳ 一个反应体系中,若某个量是个变值,它恒定不变时可以判定;若是个定值,则不能判定。 —
—
课堂练习
1、下列反应中可判断为可逆反应的是( )
A.氢气在氯气中燃烧生成氯化氢,氯化氢受热分解生成氢气和氯气
B.氮气与氢气在高温、高压、催化剂作用下可以生成氨气,同时氨气又分解为氮气和氢气
C.单质溴可以置换出碘,氯气又可以置换出溴
D.氯气和水反应生成盐酸和次氯酸,次氯酸在光照条件下可分解为盐酸和氧气
B
Cl2 + H2 ==== 2HCl
光照/点燃
2HCl ==== H2 +Cl2
N2 + 3H2 2NH3、
催化剂
高温高压
2HClO ==== 2HCl +O2↑
光照
Cl2 + H2O HCl + HClO
Br2 + 2I- ==== I2 +2Br-
Cl2 + 2Br - ==== Br2 +2Cl-
课堂练习
2、可逆反应: 在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol N2的同时生成2n mol NH3
②单位时间内生成n mol N2的同时生成3n mol H2
③用N2、NH3、H2表示的反应速率的比为1∶2∶3的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
(N2) =(NH3)
(N2) =(H2)
×
×
×
无论达到平衡与否,物质的反应速率之比等于化学方程式中物质的化学计量数之比。
√
A
若,P总↓;若, P总↑;当, P总恒定不变。
若,n总↓, ↑;若, n总↑, ↓;当, n总和恒定不变。
√
×
√
颜色永远恒定不变。
N2 + 3H2 2NH3
催化剂
高温高压
感谢聆听!
CHEMISTRY
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
