10.2 酸和碱的中和反应课件(共42张PPT)2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 10.2 酸和碱的中和反应课件(共42张PPT)2023-2024学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 35.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-29 23:11:59 | ||
图片预览











文档简介
(共42张PPT)
第1课时 中和反应
第十单元 酸和碱
课题2 酸和碱的中和反应
中和反应
知识点 1
实验 10 – 8
1. 在氢氧化钠溶液中,滴
入几滴酚酞溶液。
2. 然后用滴管慢慢滴入稀
盐酸,并不断搅拌溶液。
红色
红色逐渐消失
无色
无色酚酞
滴加盐酸
滴加
盐酸
盐酸与碱反应,使溶液不再显碱性
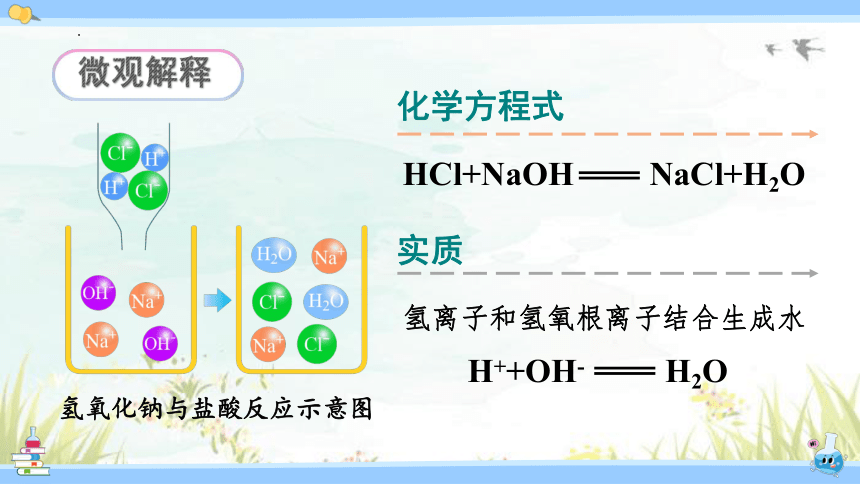
HCl+NaOH NaCl+H2O
氢离子和氢氧根离子结合生成水
H++OH- H2O
氢氧化钠与盐酸反应示意图
微观解释
实质
化学方程式
上面的反应都是中和反应。
酸跟碱作用生成盐和水的反应,叫做中和反应。
中和反应的实质:
H+ + OH – = H2O
有盐和水生成的反应都是中和反应吗?
有盐和水生成的反应,不一定是中和反应。
如酸+金属氧化物→盐+水的反应不是中和反应。
碱的化学性质
知识点 2
在酸性土壤中加入熟石灰
中性土壤
酸性土壤
熟石灰
Ca(OH)2
改良土壤的酸碱性
用熟石灰处理硫酸厂的污水:
H2SO4+Ca(OH)2=CaSO4+2H2O
印染厂的废水呈碱性,可加入硫酸进行中和。
处理工业废水
(1)中和胃酸过多
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
用于医药
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
可不可以用NaOH来中和胃酸、蚁酸?为什么?
不可以。因为NaOH具有强的腐蚀性。
(2) 中和蚁酸
蚊虫叮咬后可涂肥皂水,减轻痛痒。
蚊虫在人的皮肤内分泌出蚁酸,碱性物质可中和蚁酸
1. 在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸
至过量,溶液颜色的变化是( )
A.红色——蓝色 B.蓝色——红色
C.红色——无色 D.无色——红色
C
2. 下列属于中和反应的是( )
A.CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
B.H2SO4+2NaOH═Na2SO4+2H2O
C.CaCO3+2HCl═CaCl2+H2O+CO2↑
D.AgNO3+HCl═AgCl↓+HNO3
B
3. 下列说法正确的是( )
A. 紫色的石蕊试液可使盐酸变红
B. 中和反应一定生成盐和水
C. 生成盐和水的反应一定是中和反应
D. 氧化钙与稀盐酸能发生中和反应
B
4. 下列实际应用中,利用中和反应原理的是( )
①用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒;
②用碳酸氢钠治疗胃酸过多;
③用熟石灰改良酸性土壤。
A. ①② B. ①③
C. ②③ D. ①②③
B
5. 下列方法可以解决生活中的一些问题:
①服用含氢氧化铝〔Al(OH)3〕的药物可以治疗胃酸过多症,反应的化学方 程式为 。
②热水瓶用久后,瓶胆内壁常附着一层水垢〔主要成分是CaCO3和Mg(OH)2 〕,可以用_________来洗涤。写出其与Mg(OH)2反应的化学方程式:___________________________________。
Al(OH)3+3HCl=AlCl3+3H2O
稀盐酸
Mg(OH)2 + 2HCl=MgCl2 + 2H2O
③实验室中含有盐酸的废水直接倒入下水道会造成铸铁管道腐蚀,所以,需将废液处理后再排放。你的处理方法是 ___________________________________________。
以上三个问题的解决方法应用的共同原理是: __________与________发生__________反应。
加入适量的碱性物质发生中和反应,如加入熟石灰[Ca(OH)2],生成氯化钙和水
酸
碱
中和
概念
中和反应
应用
酸和碱作用生成盐和水的反应。
实质
(1)改良土壤酸碱性
(2)处理工厂废水
(3)用于医药
H+ + OH – = H2O
酸具有酸性,碱具有碱性。酸碱指示剂只能检验溶液的酸碱性,但如果都是酸性(或碱性)的溶液,怎么判断谁的酸性(或碱性)更强呢?
新知导入
这时候就需要精确地知道溶液的酸碱性强弱程度。
溶液的酸碱度
溶液的酸碱度
(1)溶液的酸碱度是指溶液的酸碱性强弱程度,通常用pH表示。
知识点1 溶液酸碱度的表示法——pH
新知探究
(2)pH与溶液酸碱性的关系:
pH的范围通常为0 ~14,
pH < 7,溶液呈酸性;
pH > 7,溶液呈碱性。
pH < 7 溶液呈酸性 pH越小,酸性越强
pH = 7 溶液呈中性
pH > 7 溶液呈碱性 pH越大,碱性越强
酸碱性溶液稀释过程中的pH变化情况
向一定量的某酸性或碱性溶液中加水,随着水的加入酸(碱)性不断减弱,pH不断增大(减小),但pH可以无限接近7,不能大于(小于)或等于7。
中和反应过程中溶液pH的变化情况
1.向碱溶液中加入酸溶液(以向氢氧化钠溶液中加入稀盐酸为例)。
分析:起始时pH>7,随着酸的加入pH逐渐减小,当酸和碱恰好完全反应时溶液呈中性(b点),pH=7;酸溶液过量时pH<7。
溶质:NaCl、NaOH
溶质:NaCl
溶质:NaCl、HCl
2.向酸溶液中加入碱溶液(以向稀盐酸溶液中加入氢氧化钠溶液为例)。
分析:起始时pH<7,随着碱的加入pH逐渐增大,当酸和碱恰好完全反应时溶液呈中性(b点),pH=7;碱溶液过量时pH>7。
溶质:NaCl、NaOH
溶质:NaCl
溶质:NaCl、HCl
pH计
pH试纸
pH的测定方法
用pH试纸测定溶液的pH
①在洁净的玻璃片或白瓷板上放一小片pH试纸;
②用玻璃棒蘸取溶液滴到pH试纸上;
③把试纸显示的颜色与标准比色卡比较,读出该溶液的pH。
pH试纸不可直接浸入待测液
pH试纸使用方法巧记见化学RJ九下
《教材帮》第十单元课题2巧学妙记
读数为整数
1.不能用蒸馏水将pH试纸润湿后再进行测定,因为润湿试纸相当于稀释待测液。酸性溶液被稀释,酸性减弱,pH偏大;碱性溶液被稀释,碱性减弱,pH偏小;测中性溶液时无影响。
2.pH试纸测量的是溶液的pH,它不能测量固体或气体的pH,不能测量浓硫酸的pH。
特别提醒
这些物质的酸碱度是多少呢?
生活中一些物质的pH
B
A.偏高 B.偏低 C.相等 D.无法确定
水湿润后
典例1 用pH试纸测定石灰水的pH,如图所示,则测得的结果与实际值相比( )
化工生产中许多反应必须控制在一定pH范围内。
知识点2 了解溶液酸碱性的重要意义
新知探究
农作物一般适宜在pH为7或接近7的土壤中生长,测定土壤的pH可以知道土壤是否适于种植。
正常雨水的pH≈5.6,pH<5.6的雨水称为酸雨。测定雨水的pH,可以了解空气的污染情况。
血浆 7.35~7.45
唾液 6.6~7.1
胃液 0.9~1.5
乳汁 6.6~7.6
胆汁 7.1~7.3
测定这些pH,可以帮助人们了解人体的健康状况。
人体内的一些液体和排泄物的正常pH范围
A.水稻和薄荷生长都适宜酸性土壤
B.草莓生长只适宜酸性土壤
C.马铃薯生长不适宜碱性土壤
D.以上作物生长都不适宜碱性土壤
典例2 一些重要作物最适宜生长的土壤的pH范围如表所示,下列说法中正确的是( )
作物 水稻 马铃薯 草莓 薄荷
pH 6~7 4.8~5.5 5~7.5 7~8
C
适宜碱性土壤
溶液酸碱度的表示法:
pH
pH的测定——pH试纸的正确使用
pH的应用
课堂小结
1. 如表是人体部分体液的正常pH范围,其中酸性最强的是( )
课堂达标
A.唾液 B.胃液
C.胰液 D.胆汁
体液 唾液 胃液 胰液 胆汁
pH 6.6~7.1 0.9~1.5 7.5~8.0 7.1~7.3
B
2.下列有关测定氢氧化钠溶液pH的实验操作或描述,正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的pH=12.6
C
污染待测液
导致pH测量值偏小
pH试纸只能测得整数
3.稀盐酸和氢氧化钾溶液反应时,溶液pH的变化如图所示。下列说法不正确的是( )
D
A.A点溶液能使酚酞溶液变红
B.B点到C点之间没有发生酸碱中和反应
C.该图对应的操作是将稀盐酸滴入氢氧化钾溶液中
D.等质量等质量分数的稀盐酸和氢氧化钾溶液充分反应后,溶液所含溶质与B点一致
解析:由图像可知,pH开始时大于7,后来逐渐减小,说明是把稀盐酸滴加到氢氧化钾溶液中,B点到C点之间,是完全反应后滴加稀盐酸,没有发生酸碱中和反应;反应中每36.5份质量的氯化氢与56份质量的氢氧化钾恰好完全反应,则等质量等质量分数的稀盐酸和氢氧化钾溶液充分反应后,稀盐酸有剩余,溶液中所含溶质与C点一致。
4.已知生活用品中厕所清洁剂的pH=1,厨房清洁剂的pH=12。下列说法不正确的是( )
A.厕所清洁剂加水稀释,溶液pH增大
B.厨房清洁剂可能含有氢氧化钠
C.两者混合使用能提高清洁效果
D.厕所清洁剂可能腐蚀铁制下水道
C
解析:厕所清洁剂与厨房清洁剂混合后,会发生中和反应,使各自的酸性或碱性变弱,降低清洁效果。
第1课时 中和反应
第十单元 酸和碱
课题2 酸和碱的中和反应
中和反应
知识点 1
实验 10 – 8
1. 在氢氧化钠溶液中,滴
入几滴酚酞溶液。
2. 然后用滴管慢慢滴入稀
盐酸,并不断搅拌溶液。
红色
红色逐渐消失
无色
无色酚酞
滴加盐酸
滴加
盐酸
盐酸与碱反应,使溶液不再显碱性
HCl+NaOH NaCl+H2O
氢离子和氢氧根离子结合生成水
H++OH- H2O
氢氧化钠与盐酸反应示意图
微观解释
实质
化学方程式
上面的反应都是中和反应。
酸跟碱作用生成盐和水的反应,叫做中和反应。
中和反应的实质:
H+ + OH – = H2O
有盐和水生成的反应都是中和反应吗?
有盐和水生成的反应,不一定是中和反应。
如酸+金属氧化物→盐+水的反应不是中和反应。
碱的化学性质
知识点 2
在酸性土壤中加入熟石灰
中性土壤
酸性土壤
熟石灰
Ca(OH)2
改良土壤的酸碱性
用熟石灰处理硫酸厂的污水:
H2SO4+Ca(OH)2=CaSO4+2H2O
印染厂的废水呈碱性,可加入硫酸进行中和。
处理工业废水
(1)中和胃酸过多
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
用于医药
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
可不可以用NaOH来中和胃酸、蚁酸?为什么?
不可以。因为NaOH具有强的腐蚀性。
(2) 中和蚁酸
蚊虫叮咬后可涂肥皂水,减轻痛痒。
蚊虫在人的皮肤内分泌出蚁酸,碱性物质可中和蚁酸
1. 在滴加了酚酞的氢氧化钠溶液中,逐滴加入稀盐酸
至过量,溶液颜色的变化是( )
A.红色——蓝色 B.蓝色——红色
C.红色——无色 D.无色——红色
C
2. 下列属于中和反应的是( )
A.CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
B.H2SO4+2NaOH═Na2SO4+2H2O
C.CaCO3+2HCl═CaCl2+H2O+CO2↑
D.AgNO3+HCl═AgCl↓+HNO3
B
3. 下列说法正确的是( )
A. 紫色的石蕊试液可使盐酸变红
B. 中和反应一定生成盐和水
C. 生成盐和水的反应一定是中和反应
D. 氧化钙与稀盐酸能发生中和反应
B
4. 下列实际应用中,利用中和反应原理的是( )
①用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒;
②用碳酸氢钠治疗胃酸过多;
③用熟石灰改良酸性土壤。
A. ①② B. ①③
C. ②③ D. ①②③
B
5. 下列方法可以解决生活中的一些问题:
①服用含氢氧化铝〔Al(OH)3〕的药物可以治疗胃酸过多症,反应的化学方 程式为 。
②热水瓶用久后,瓶胆内壁常附着一层水垢〔主要成分是CaCO3和Mg(OH)2 〕,可以用_________来洗涤。写出其与Mg(OH)2反应的化学方程式:___________________________________。
Al(OH)3+3HCl=AlCl3+3H2O
稀盐酸
Mg(OH)2 + 2HCl=MgCl2 + 2H2O
③实验室中含有盐酸的废水直接倒入下水道会造成铸铁管道腐蚀,所以,需将废液处理后再排放。你的处理方法是 ___________________________________________。
以上三个问题的解决方法应用的共同原理是: __________与________发生__________反应。
加入适量的碱性物质发生中和反应,如加入熟石灰[Ca(OH)2],生成氯化钙和水
酸
碱
中和
概念
中和反应
应用
酸和碱作用生成盐和水的反应。
实质
(1)改良土壤酸碱性
(2)处理工厂废水
(3)用于医药
H+ + OH – = H2O
酸具有酸性,碱具有碱性。酸碱指示剂只能检验溶液的酸碱性,但如果都是酸性(或碱性)的溶液,怎么判断谁的酸性(或碱性)更强呢?
新知导入
这时候就需要精确地知道溶液的酸碱性强弱程度。
溶液的酸碱度
溶液的酸碱度
(1)溶液的酸碱度是指溶液的酸碱性强弱程度,通常用pH表示。
知识点1 溶液酸碱度的表示法——pH
新知探究
(2)pH与溶液酸碱性的关系:
pH的范围通常为0 ~14,
pH < 7,溶液呈酸性;
pH > 7,溶液呈碱性。
pH < 7 溶液呈酸性 pH越小,酸性越强
pH = 7 溶液呈中性
pH > 7 溶液呈碱性 pH越大,碱性越强
酸碱性溶液稀释过程中的pH变化情况
向一定量的某酸性或碱性溶液中加水,随着水的加入酸(碱)性不断减弱,pH不断增大(减小),但pH可以无限接近7,不能大于(小于)或等于7。
中和反应过程中溶液pH的变化情况
1.向碱溶液中加入酸溶液(以向氢氧化钠溶液中加入稀盐酸为例)。
分析:起始时pH>7,随着酸的加入pH逐渐减小,当酸和碱恰好完全反应时溶液呈中性(b点),pH=7;酸溶液过量时pH<7。
溶质:NaCl、NaOH
溶质:NaCl
溶质:NaCl、HCl
2.向酸溶液中加入碱溶液(以向稀盐酸溶液中加入氢氧化钠溶液为例)。
分析:起始时pH<7,随着碱的加入pH逐渐增大,当酸和碱恰好完全反应时溶液呈中性(b点),pH=7;碱溶液过量时pH>7。
溶质:NaCl、NaOH
溶质:NaCl
溶质:NaCl、HCl
pH计
pH试纸
pH的测定方法
用pH试纸测定溶液的pH
①在洁净的玻璃片或白瓷板上放一小片pH试纸;
②用玻璃棒蘸取溶液滴到pH试纸上;
③把试纸显示的颜色与标准比色卡比较,读出该溶液的pH。
pH试纸不可直接浸入待测液
pH试纸使用方法巧记见化学RJ九下
《教材帮》第十单元课题2巧学妙记
读数为整数
1.不能用蒸馏水将pH试纸润湿后再进行测定,因为润湿试纸相当于稀释待测液。酸性溶液被稀释,酸性减弱,pH偏大;碱性溶液被稀释,碱性减弱,pH偏小;测中性溶液时无影响。
2.pH试纸测量的是溶液的pH,它不能测量固体或气体的pH,不能测量浓硫酸的pH。
特别提醒
这些物质的酸碱度是多少呢?
生活中一些物质的pH
B
A.偏高 B.偏低 C.相等 D.无法确定
水湿润后
典例1 用pH试纸测定石灰水的pH,如图所示,则测得的结果与实际值相比( )
化工生产中许多反应必须控制在一定pH范围内。
知识点2 了解溶液酸碱性的重要意义
新知探究
农作物一般适宜在pH为7或接近7的土壤中生长,测定土壤的pH可以知道土壤是否适于种植。
正常雨水的pH≈5.6,pH<5.6的雨水称为酸雨。测定雨水的pH,可以了解空气的污染情况。
血浆 7.35~7.45
唾液 6.6~7.1
胃液 0.9~1.5
乳汁 6.6~7.6
胆汁 7.1~7.3
测定这些pH,可以帮助人们了解人体的健康状况。
人体内的一些液体和排泄物的正常pH范围
A.水稻和薄荷生长都适宜酸性土壤
B.草莓生长只适宜酸性土壤
C.马铃薯生长不适宜碱性土壤
D.以上作物生长都不适宜碱性土壤
典例2 一些重要作物最适宜生长的土壤的pH范围如表所示,下列说法中正确的是( )
作物 水稻 马铃薯 草莓 薄荷
pH 6~7 4.8~5.5 5~7.5 7~8
C
适宜碱性土壤
溶液酸碱度的表示法:
pH
pH的测定——pH试纸的正确使用
pH的应用
课堂小结
1. 如表是人体部分体液的正常pH范围,其中酸性最强的是( )
课堂达标
A.唾液 B.胃液
C.胰液 D.胆汁
体液 唾液 胃液 胰液 胆汁
pH 6.6~7.1 0.9~1.5 7.5~8.0 7.1~7.3
B
2.下列有关测定氢氧化钠溶液pH的实验操作或描述,正确的是( )
A.用镊子夹取pH试纸直接伸入氢氧化钠溶液中测量
B.先用蒸馏水将pH试纸润湿,再用滴管吸取氢氧化钠溶液滴到pH试纸上测量
C.用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到pH试纸上,再与标准比色卡对照
D.用pH试纸测得该氢氧化钠溶液的pH=12.6
C
污染待测液
导致pH测量值偏小
pH试纸只能测得整数
3.稀盐酸和氢氧化钾溶液反应时,溶液pH的变化如图所示。下列说法不正确的是( )
D
A.A点溶液能使酚酞溶液变红
B.B点到C点之间没有发生酸碱中和反应
C.该图对应的操作是将稀盐酸滴入氢氧化钾溶液中
D.等质量等质量分数的稀盐酸和氢氧化钾溶液充分反应后,溶液所含溶质与B点一致
解析:由图像可知,pH开始时大于7,后来逐渐减小,说明是把稀盐酸滴加到氢氧化钾溶液中,B点到C点之间,是完全反应后滴加稀盐酸,没有发生酸碱中和反应;反应中每36.5份质量的氯化氢与56份质量的氢氧化钾恰好完全反应,则等质量等质量分数的稀盐酸和氢氧化钾溶液充分反应后,稀盐酸有剩余,溶液中所含溶质与C点一致。
4.已知生活用品中厕所清洁剂的pH=1,厨房清洁剂的pH=12。下列说法不正确的是( )
A.厕所清洁剂加水稀释,溶液pH增大
B.厨房清洁剂可能含有氢氧化钠
C.两者混合使用能提高清洁效果
D.厕所清洁剂可能腐蚀铁制下水道
C
解析:厕所清洁剂与厨房清洁剂混合后,会发生中和反应,使各自的酸性或碱性变弱,降低清洁效果。
同课章节目录
