第2节金属的化学性质(金属与酸反应复习)
文档属性
| 名称 | 第2节金属的化学性质(金属与酸反应复习) |  | |
| 格式 | zip | ||
| 文件大小 | 124.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2015-08-17 08:40:22 | ||
图片预览






文档简介
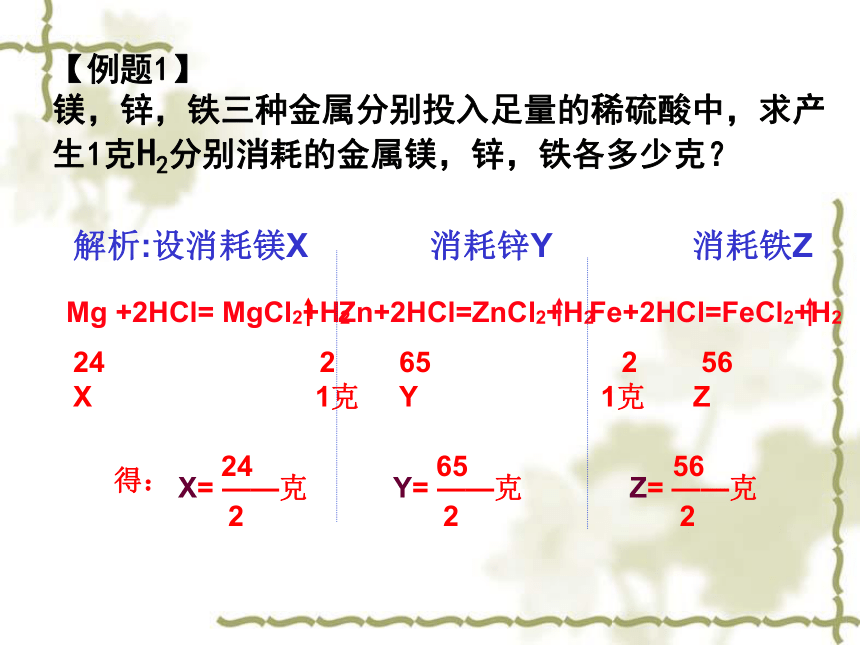
课件15张PPT。金属与酸反应 复习知识回顾金属与酸发生置换反应的条件K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au思考:金属活动性顺序表中越前面的金属与酸反应越剧烈,那么生成的氢气是否也越多呢?【例题1】
镁,锌,铁三种金属分别投入足量的稀硫酸中,求产生1克H2分别消耗的金属镁,锌,铁各多少克?通式:设金属R相对原子量为A,化合价为 +m,与足量盐酸反 应,产生1克氢气消耗的金属质量为X;则: 2A 2m
X 1克以此比值做为基础,进行判断。Na 、Mg 、Al三种金属,分别与足量的稀硫酸反应,如果制取等体积的氢气,则消耗金属质量由多到少的顺序如何?mNa > mMg >m Al结论: 不同的金属与足量的酸反应,产生等量的H2,【例题2】
镁、锌、铁、铝各1克,分别与足量的盐酸反应,生成氢气的质量由多到少的顺序是
。结论:等质量的不同金属与足量的同种酸完全反应,产生氢气的量1、等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是( )C应用2、将质量相同的A、B、C三种金属,同时放入三份完全相同且足量的稀盐酸中,反应生成氢气的质量与反应时间的关系如图所示(已知:A、B、C三种金属在生成物中均显+2价),根据图中所提供的信息,得出的结论正确的是( )
A、放出氢气的质量是B>A>C
B、金属活动性顺序是A>B>C
C、反应速率最大的是C
D、相对原子质量是C>B>A D应用4、相同质量的铝、镁、铁、锌四种金属分别投入到足量的相同质量及质量分数的稀硫酸溶液中,待充分反应后,所得溶液的质量最小的是( )
?A.铝??? ????B.镁??????C.锌??????D.铁A应用3、分别用Al、Fe与足量的稀硫酸反应,制得相同质量的氢气,则消耗Al、Fe的质量比为(? )?????
A.?9:28????B.?27:56?????C.?9:56????D.?27:112?A5、某不纯的镁2.4g与足量的稀盐酸反应生成氢气0.22g,则其中可能混有( )
A.铁 B.铝 C.锌 D.铜B【例题3】
足量的镁、铁、锌三种金属分别与一定量的稀硫酸充分反应后,生成氢气的质量关系为(?? )
?A.镁产生氢氢多????? B.铁产生氢气多????
C.锌产生氢气多???? D.三种金属一样多D结论:足量的不同金属与一定量的同种酸完全反应,产生的氢气的质量相等6、用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系图所示。则下列说法不正确的是 ( )
A.曲线a、b分别表示锌、铁的反应情况
B.盐酸均反应完,
锌、铁有剩余
C.盐酸均反应完,锌恰好完全
反应,铁有剩余
D.锌铁都反应完,盐酸有剩余应用D应用7、 将Mg,Al,Zn分别放入相同溶质质量分数的盐酸中,反应完成后,放出的氢气质量相同,其可能原因是 .
?A.放入的三种金属质量相同,盐酸足量
?B.放入的Mg、Al、Zn的质量比为12:9:32.5,盐酸足量
?C.盐酸的质量相同,放入足量的三种金属
?D.放入的盐酸质量比为3:2:1,反应后盐酸无剩余?B 、C1、等质量的镁和锌分别放置在两只烧杯中,向其中分别逐滴加入质量分数相同的稀硫酸至过量,下图正确的是( ) 挑战C2、在两只烧杯中分别盛有等量的等质量分数的稀盐酸,
分别加入的镁和锌,生成氢气的质量与加入金属的质量
关系图正确的是( )DA、Mg , Al B、 Cu , Zn
C、Zn , Fe D、 Na , Mg3、将6克某些金属的混合物与足量的盐酸反应,
得0.2克氢气,则该混合物的可能组成是( )C4、一块不纯的铁质量为5.6克,与足量的稀硫酸反应放出0.2克氢气,已知所含杂质是碳、铝、铜、锌、镁中的三种.下列各组杂质中不符合事实的是( )
A.碳、铝、铜 B.铝、铜、锌
C.铜、镁、锌 D.碳、铜、锌D继续挑战
镁,锌,铁三种金属分别投入足量的稀硫酸中,求产生1克H2分别消耗的金属镁,锌,铁各多少克?通式:设金属R相对原子量为A,化合价为 +m,与足量盐酸反 应,产生1克氢气消耗的金属质量为X;则: 2A 2m
X 1克以此比值做为基础,进行判断。Na 、Mg 、Al三种金属,分别与足量的稀硫酸反应,如果制取等体积的氢气,则消耗金属质量由多到少的顺序如何?mNa > mMg >m Al结论: 不同的金属与足量的酸反应,产生等量的H2,【例题2】
镁、锌、铁、铝各1克,分别与足量的盐酸反应,生成氢气的质量由多到少的顺序是
。结论:等质量的不同金属与足量的同种酸完全反应,产生氢气的量1、等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是( )C应用2、将质量相同的A、B、C三种金属,同时放入三份完全相同且足量的稀盐酸中,反应生成氢气的质量与反应时间的关系如图所示(已知:A、B、C三种金属在生成物中均显+2价),根据图中所提供的信息,得出的结论正确的是( )
A、放出氢气的质量是B>A>C
B、金属活动性顺序是A>B>C
C、反应速率最大的是C
D、相对原子质量是C>B>A D应用4、相同质量的铝、镁、铁、锌四种金属分别投入到足量的相同质量及质量分数的稀硫酸溶液中,待充分反应后,所得溶液的质量最小的是( )
?A.铝??? ????B.镁??????C.锌??????D.铁A应用3、分别用Al、Fe与足量的稀硫酸反应,制得相同质量的氢气,则消耗Al、Fe的质量比为(? )?????
A.?9:28????B.?27:56?????C.?9:56????D.?27:112?A5、某不纯的镁2.4g与足量的稀盐酸反应生成氢气0.22g,则其中可能混有( )
A.铁 B.铝 C.锌 D.铜B【例题3】
足量的镁、铁、锌三种金属分别与一定量的稀硫酸充分反应后,生成氢气的质量关系为(?? )
?A.镁产生氢氢多????? B.铁产生氢气多????
C.锌产生氢气多???? D.三种金属一样多D结论:足量的不同金属与一定量的同种酸完全反应,产生的氢气的质量相等6、用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系图所示。则下列说法不正确的是 ( )
A.曲线a、b分别表示锌、铁的反应情况
B.盐酸均反应完,
锌、铁有剩余
C.盐酸均反应完,锌恰好完全
反应,铁有剩余
D.锌铁都反应完,盐酸有剩余应用D应用7、 将Mg,Al,Zn分别放入相同溶质质量分数的盐酸中,反应完成后,放出的氢气质量相同,其可能原因是 .
?A.放入的三种金属质量相同,盐酸足量
?B.放入的Mg、Al、Zn的质量比为12:9:32.5,盐酸足量
?C.盐酸的质量相同,放入足量的三种金属
?D.放入的盐酸质量比为3:2:1,反应后盐酸无剩余?B 、C1、等质量的镁和锌分别放置在两只烧杯中,向其中分别逐滴加入质量分数相同的稀硫酸至过量,下图正确的是( ) 挑战C2、在两只烧杯中分别盛有等量的等质量分数的稀盐酸,
分别加入的镁和锌,生成氢气的质量与加入金属的质量
关系图正确的是( )DA、Mg , Al B、 Cu , Zn
C、Zn , Fe D、 Na , Mg3、将6克某些金属的混合物与足量的盐酸反应,
得0.2克氢气,则该混合物的可能组成是( )C4、一块不纯的铁质量为5.6克,与足量的稀硫酸反应放出0.2克氢气,已知所含杂质是碳、铝、铜、锌、镁中的三种.下列各组杂质中不符合事实的是( )
A.碳、铝、铜 B.铝、铜、锌
C.铜、镁、锌 D.碳、铜、锌D继续挑战
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
