9.2金属的化学性质同步练习(含答案)鲁教版化学九年级下册
文档属性
| 名称 | 9.2金属的化学性质同步练习(含答案)鲁教版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 591.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-28 14:21:44 | ||
图片预览



文档简介
9.2金属的化学性质同步练习鲁教版化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.向MgCl2和CuCl2的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液。下列说法正确的是
A.若滤液为蓝色,则滤渣中一定含有Cu和Zn
B.若滤液不为蓝色,则滤液中一定不含CuCl2
C.若往滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有Mg
D.所得滤液的质量一定比原溶液的质量大
2.向一定质量的 Mg(NO3)2和 Cu(NO3)2的混合溶液中加入 a 克锌粉和铁粉的混合物, 充分反应后过滤,将滤渣洗涤干燥后称量得到 a 克,下列分析合理的是
A.滤渣中可能有铜
B.向滤渣中加稀盐酸,可能有气泡产生
C.滤液中一定有 Mg(NO3)2 、Zn(NO3)2和 Fe(NO3)2,可能有 Cu(NO3)2
D.充分反应后,滤液中溶质的质量一定大于原混合溶液溶质的质量
3.现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质。存在如图所示的相互反应和转化关系。图中“﹣﹣”表示两端的物质间可以发生化学反应。“→”表示物质问存在相应的转化关系。下列判断合理的是( )
A.X一定是碳酸钠溶液
B.Y一定是稀盐酸
C.N转化为铁的反应都属于置换反应
D.X、Y、M两两之间都可以发生复分解反应
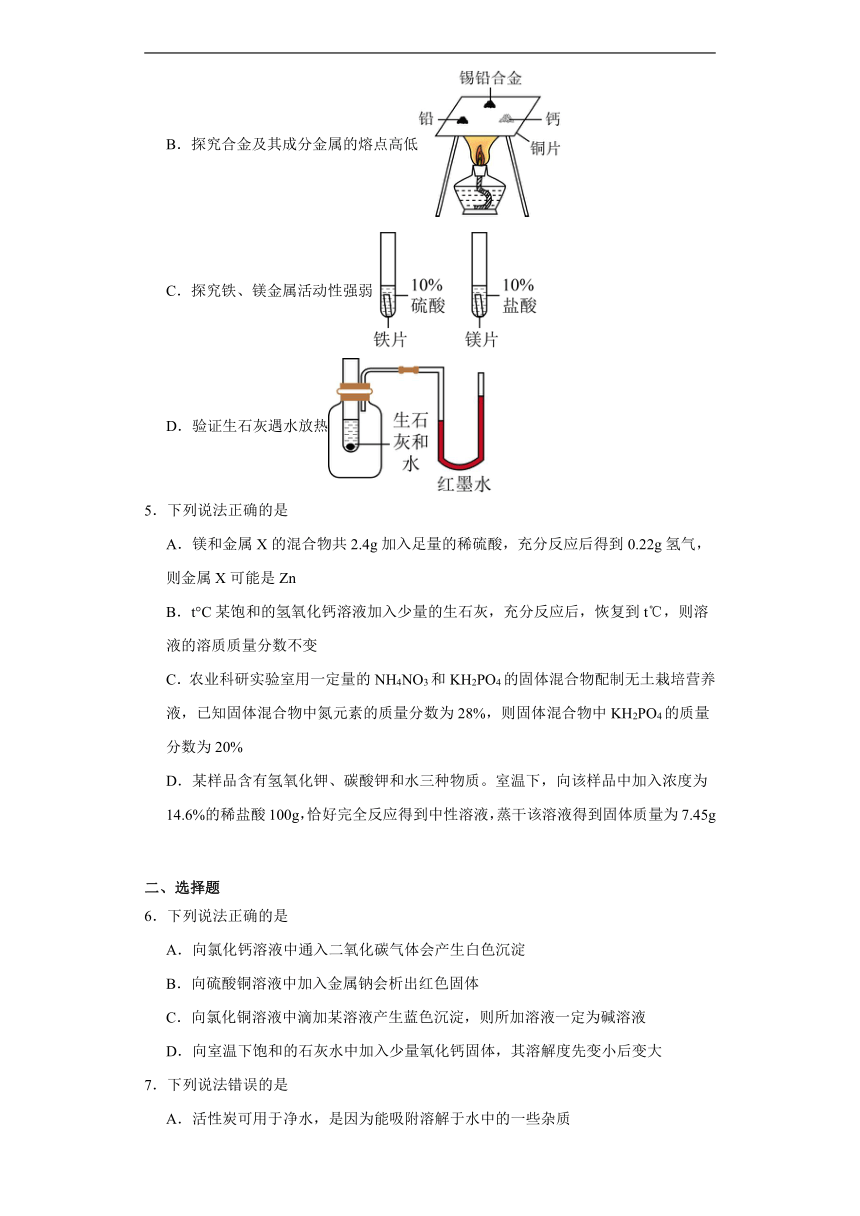
4.实验设计的严谨性会直接影响实验结论的准确性。下列设计不能达到实验目的的是
A.验证溶液中是否含有
B.探究合金及其成分金属的熔点高低
C.探究铁、镁金属活动性强弱
D.验证生石灰遇水放热
5.下列说法正确的是
A.镁和金属X的混合物共2.4g加入足量的稀硫酸,充分反应后得到0.22g氢气,则金属X可能是Zn
B.t°C某饱和的氢氧化钙溶液加入少量的生石灰,充分反应后,恢复到t℃,则溶液的溶质质量分数不变
C.农业科研实验室用一定量的NH4NO3和KH2PO4的固体混合物配制无土栽培营养液,已知固体混合物中氮元素的质量分数为28%,则固体混合物中KH2PO4的质量分数为20%
D.某样品含有氢氧化钾、碳酸钾和水三种物质。室温下,向该样品中加入浓度为14.6%的稀盐酸100g,恰好完全反应得到中性溶液,蒸干该溶液得到固体质量为7.45g
二、选择题
6.下列说法正确的是
A.向氯化钙溶液中通入二氧化碳气体会产生白色沉淀
B.向硫酸铜溶液中加入金属钠会析出红色固体
C.向氯化铜溶液中滴加某溶液产生蓝色沉淀,则所加溶液一定为碱溶液
D.向室温下饱和的石灰水中加入少量氧化钙固体,其溶解度先变小后变大
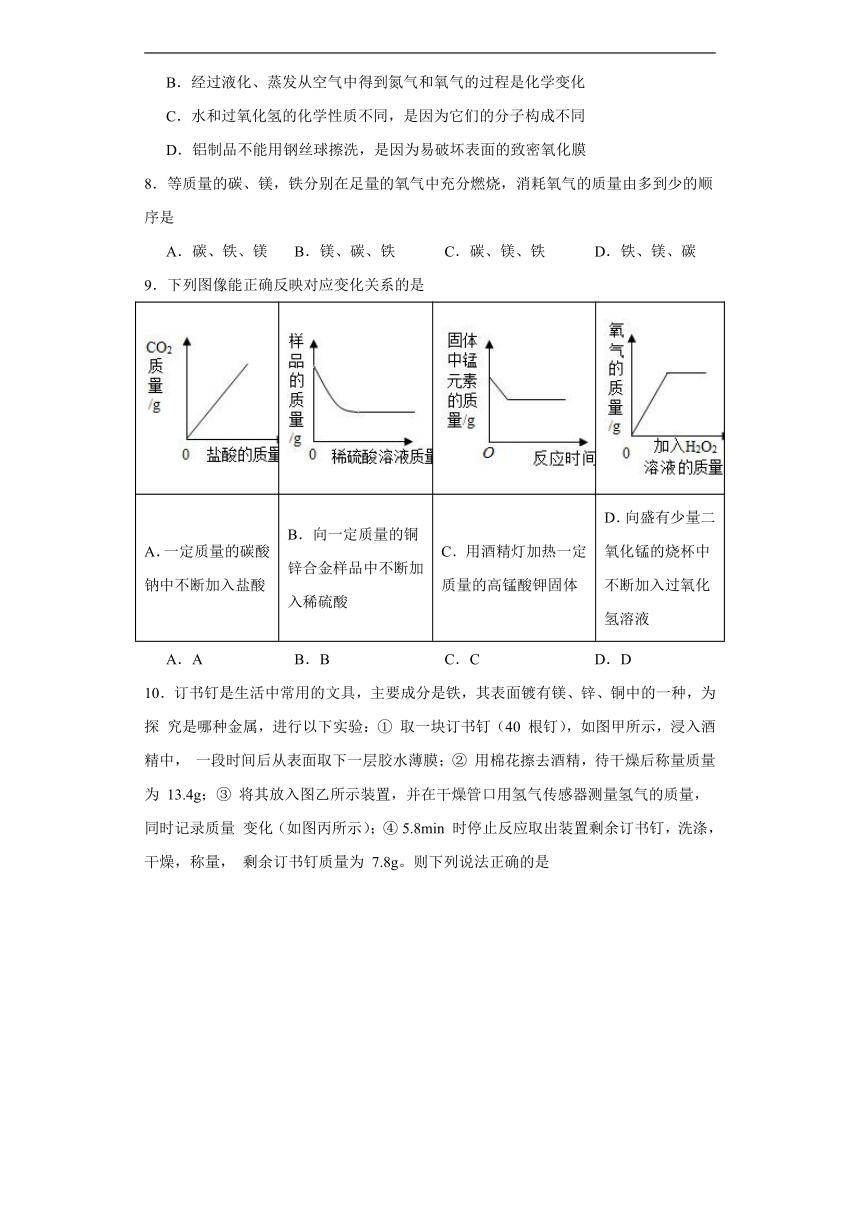
7.下列说法错误的是
A.活性炭可用于净水,是因为能吸附溶解于水中的一些杂质
B.经过液化、蒸发从空气中得到氮气和氧气的过程是化学变化
C.水和过氧化氢的化学性质不同,是因为它们的分子构成不同
D.铝制品不能用钢丝球擦洗,是因为易破坏表面的致密氧化膜
8.等质量的碳、镁,铁分别在足量的氧气中充分燃烧,消耗氧气的质量由多到少的顺序是
A.碳、铁、镁 B.镁、碳、铁 C.碳、镁、铁 D.铁、镁、碳
9.下列图像能正确反映对应变化关系的是
A.一定质量的碳酸钠中不断加入盐酸 B.向一定质量的铜锌合金样品中不断加入稀硫酸 C.用酒精灯加热一定质量的高锰酸钾固体 D.向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液
A.A B.B C.C D.D
10.订书钉是生活中常用的文具,主要成分是铁,其表面镀有镁、锌、铜中的一种,为探 究是哪种金属,进行以下实验:① 取一块订书钉(40 根钉),如图甲所示,浸入酒精中, 一段时间后从表面取下一层胶水薄膜;② 用棉花擦去酒精,待干燥后称量质量为 13.4g;③ 将其放入图乙所示装置,并在干燥管口用氢气传感器测量氢气的质量,同时记录质量 变化(如图丙所示);④ 5.8min 时停止反应取出装置剩余订书钉,洗涤,干燥,称量, 剩余订书钉质量为 7.8g。则下列说法正确的是
A.图丙中 P 点纵坐标 X 值为 0.36
B.通过所给数据分析,表面所镀金属是锌
C.1.7min 后溶液颜色为无色
D.0~0.2min 不产生氢气是因为表面所镀金属不能与酸反应
11.对于有单质和化合物生成的反应,有下列几种说法: ①、一定是置换反应; ②、一定是分解反应; ③、可能是分解反应; ④、可能是化合反应;⑤、一定不是化合反应。其中正确的说法是
A.③⑤ B.③④ C.②③ D.②④
12.下列图象分别与选项中的操作相对应,合理的是( )
A.一定条件下,一定质量的碳和氧气在密闭容器中反应
B.向一定质量的稀盐酸中加水
C.一定温度下,向一定质量的饱和石灰水中加入氧化钙
D.等质量的镁和铁分别与足量的稀硫酸反应
13.下列化学方程式书写完全正确的是
A. B.
C. D.
14.归纳、推理是学习化学的重要方法,下列说法正确的是
A.不同种元素可以组成不同的物质,同一种元素也可以组成不同的物质
B.不同种元素最本质的区别是核外电子数不同,最外层电子数决定元素的化学性质
C.置换反应一定有单质生成,所以有单质生成的反应一定是置换反应
D.用汽油、酒精和洗洁精都能除去油污,原理各不相同
15.概念之间存在交叉、并列或包含关系。下列选项中的概念符合图中所示关系的是( )
A B C D
M 碱 氧化物 化合物 置换反应
N 酸 单质 纯净物 化合反应
Q 盐 金属 单质 燃烧
A.A B.B C.C D.D
三、综合应用题
16.日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为"碳包"。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液和淀粉等组成的糊状物。废旧干电池随意丢弃会造成环境污染。学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:
(1)干电池使用时将化学能转化成 能。
(2)上述操作中灼烧的目的是 ;
(3)同学们将过滤后得到的滤渣干燥后称得质量为25克,充分灼烧后冷却称得剩余固体质量为20克,则滤渣中二氧化锰与碳粉的质量比为 。经分析,此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是 。
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现 的现象,说明为二氧化锰。反应的化学方程式为 。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。③将滤液加热浓缩、 、过滤,得到ZnSO4·7H2O晶体。
(5)步骤①中反应方程式为 ,将锌皮剪碎的目的是 。
(6)步骤②需要的仪器有铁架台、烧杯、 和玻璃棒,玻璃棒的作用是 。
(7)步骤③缺少的操作是 。
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器内50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为350毫升。已知实验条件下氢气的密度为0.09g/L。
(8)计算该锌皮中锌的质量分数 。(写出计算过程,结果保留两位小数)
(9)上述方法测得的锌的质量分数偏大,不可能的原因是
A.没等装置冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
17.金属与合金
I.人类很早就开始使用金属,下列记载均与金属有关,请按要求填空。
①“金(即钢)柔锡柔,合两柔则刚。”
②何意百炼钢,化为绕指柔(“百炼钢”指生铁经过高温煅烧,反复锤炼成为钢)
③东晋《抱朴子》中记载:“以曾青涂铁,铁赤色如铜”(“曾青”即CuSO4溶液)。
④美人首饰侯王印,尽是沙中浪底来。(“首饰”、“印”指金制品)
(1)①~④划线部分,发生了化学变化的是 (填编号),其中发生置换反应的化学方程式为 。该反应中发生有效的相互作用而促使变化发生的微粒是(写出微粒符号) 。
(2)①说明合金与组成它的纯金属相比,具有的优点是 。
(3)②中“百炼钢”指将生铁转化为钢,关于生铁和钢的说法正确的是 。
A 生铁、钢都是混合物
B 钢可以完全溶解在足量稀盐酸中
C 在钢中加入玻璃纤维可得到既有玻璃般透明或半透明性,又有钢铁般强度的材料﹣玻璃钢
D 用赤铁矿冶炼生铁时,矿石中的氧化铁发生了还原反应
(4)④说明金在自然界中以单质形式存在,其原因是 。现在,人们常用银、钯、铂三种金属制作首饰,如图,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化,通过该实验判断银、铂、钯的金属活动性由强到弱顺序为 (用符号表示)。
II.金属在现代社会有着更广泛的应用。我国自行研发的大型客机C919(图丙)于今年5月成功试飞,其中就应用了很多金属材料。
(5)铁比铝的强度大,但制造大飞机机身却用铝合金而不用铁合金,主要原因是铝比铁具有更好的抗腐蚀性和 的优良性质。铁易锈蚀是铁与空气中的 作用的结果,铝比铁具有更好的抗腐蚀性。原因是 (用文字叙述)。
(6)金属锂和钛均不在初中学到的金属活动性顺序表中,某小组想通过金属与稀盐酸的反应比较锂、铝的活动性,进行实验时应控制的变量有 。钛的活动性位于铜、铝之间,预测钛可能与 、 (写出两种不同类别物质的化学式)等物质反应。
18.化学是以实验为基础的科学,是实验室进行科学探究的重要手段。
(1)如图1已知各装置中的试剂:A中是燃着的香烟B、E中澄清的石灰水C中氢氧化钠溶液(氢氧化钠可以与二氧化碳反应),回答下列问题:
①能说明吸烟时产生CO2的现象是 ;
②能说明吸烟时产生CO的现象是 ;
③D装置中发生的化学反应方程式: ;
(2)如图2是实验室制取气体的部分装置。
①写出一个实验室用A装置制取氧气的化学反应方程式: ;
②实验室用固体醋酸钠和熟石灰加热制取甲烷应该选取的发生装置是 ,如果用D装置收集甲烷时,气体应该从 端(填a或b进入)。
(3)小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末39g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。求合金中铜的质量分数 。
参考答案:
1.BD
2.BC
3.BD
4.AC
5.BC
6.D
7.B
8.C
9.B
10.B
11.A
12.A
13.C
14.C
15.B
16. 电 除去碳粉(或者将碳粉变成二氧化碳除去,合理即可) 4:1 洗涤 有气泡产生 2H2O22H2O + O2↑ 冷却结晶 Zn + H2SO4 = ZnSO4 + H2↑ 增大接触面积,使反应更快更充分 漏斗 引流 降温结晶(或冷却结晶) 解:氢气的质量=(350-50)x10-3L ×0.09g/L = 0.027g
设锌的质量为x
Zn + H2SO4 == ZnSO4 + H2↑
65 2
X 0.027g
x =0.8775g
锌皮中锌的质量分数 = ×100% = 87.75% C D
17. ②③ Fe、Cu2+ 硬度大 AD 金的化学性质稳定 Ag>Pd>Pt 密度小 氧气、水 常温下,铝能与氧气反应生成致密的氧化铝保护膜 盐酸的体积和浓度,温度,金属的颗粒大小
18.(1) B中澄清水变浑浊 D中黑色粉末变红,E中澄清石灰水变浑浊
(2) A b
(3)解:设锌的质量为x。
答:铜的质量分数为75%。
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.向MgCl2和CuCl2的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和滤液。下列说法正确的是
A.若滤液为蓝色,则滤渣中一定含有Cu和Zn
B.若滤液不为蓝色,则滤液中一定不含CuCl2
C.若往滤渣中加入稀盐酸,有气泡产生,则滤渣中一定含有Mg
D.所得滤液的质量一定比原溶液的质量大
2.向一定质量的 Mg(NO3)2和 Cu(NO3)2的混合溶液中加入 a 克锌粉和铁粉的混合物, 充分反应后过滤,将滤渣洗涤干燥后称量得到 a 克,下列分析合理的是
A.滤渣中可能有铜
B.向滤渣中加稀盐酸,可能有气泡产生
C.滤液中一定有 Mg(NO3)2 、Zn(NO3)2和 Fe(NO3)2,可能有 Cu(NO3)2
D.充分反应后,滤液中溶质的质量一定大于原混合溶液溶质的质量
3.现有铁、氧化铁、稀盐酸、氢氧化钙溶液、碳酸钠溶液五种物质。存在如图所示的相互反应和转化关系。图中“﹣﹣”表示两端的物质间可以发生化学反应。“→”表示物质问存在相应的转化关系。下列判断合理的是( )
A.X一定是碳酸钠溶液
B.Y一定是稀盐酸
C.N转化为铁的反应都属于置换反应
D.X、Y、M两两之间都可以发生复分解反应
4.实验设计的严谨性会直接影响实验结论的准确性。下列设计不能达到实验目的的是
A.验证溶液中是否含有
B.探究合金及其成分金属的熔点高低
C.探究铁、镁金属活动性强弱
D.验证生石灰遇水放热
5.下列说法正确的是
A.镁和金属X的混合物共2.4g加入足量的稀硫酸,充分反应后得到0.22g氢气,则金属X可能是Zn
B.t°C某饱和的氢氧化钙溶液加入少量的生石灰,充分反应后,恢复到t℃,则溶液的溶质质量分数不变
C.农业科研实验室用一定量的NH4NO3和KH2PO4的固体混合物配制无土栽培营养液,已知固体混合物中氮元素的质量分数为28%,则固体混合物中KH2PO4的质量分数为20%
D.某样品含有氢氧化钾、碳酸钾和水三种物质。室温下,向该样品中加入浓度为14.6%的稀盐酸100g,恰好完全反应得到中性溶液,蒸干该溶液得到固体质量为7.45g
二、选择题
6.下列说法正确的是
A.向氯化钙溶液中通入二氧化碳气体会产生白色沉淀
B.向硫酸铜溶液中加入金属钠会析出红色固体
C.向氯化铜溶液中滴加某溶液产生蓝色沉淀,则所加溶液一定为碱溶液
D.向室温下饱和的石灰水中加入少量氧化钙固体,其溶解度先变小后变大
7.下列说法错误的是
A.活性炭可用于净水,是因为能吸附溶解于水中的一些杂质
B.经过液化、蒸发从空气中得到氮气和氧气的过程是化学变化
C.水和过氧化氢的化学性质不同,是因为它们的分子构成不同
D.铝制品不能用钢丝球擦洗,是因为易破坏表面的致密氧化膜
8.等质量的碳、镁,铁分别在足量的氧气中充分燃烧,消耗氧气的质量由多到少的顺序是
A.碳、铁、镁 B.镁、碳、铁 C.碳、镁、铁 D.铁、镁、碳
9.下列图像能正确反映对应变化关系的是
A.一定质量的碳酸钠中不断加入盐酸 B.向一定质量的铜锌合金样品中不断加入稀硫酸 C.用酒精灯加热一定质量的高锰酸钾固体 D.向盛有少量二氧化锰的烧杯中不断加入过氧化氢溶液
A.A B.B C.C D.D
10.订书钉是生活中常用的文具,主要成分是铁,其表面镀有镁、锌、铜中的一种,为探 究是哪种金属,进行以下实验:① 取一块订书钉(40 根钉),如图甲所示,浸入酒精中, 一段时间后从表面取下一层胶水薄膜;② 用棉花擦去酒精,待干燥后称量质量为 13.4g;③ 将其放入图乙所示装置,并在干燥管口用氢气传感器测量氢气的质量,同时记录质量 变化(如图丙所示);④ 5.8min 时停止反应取出装置剩余订书钉,洗涤,干燥,称量, 剩余订书钉质量为 7.8g。则下列说法正确的是
A.图丙中 P 点纵坐标 X 值为 0.36
B.通过所给数据分析,表面所镀金属是锌
C.1.7min 后溶液颜色为无色
D.0~0.2min 不产生氢气是因为表面所镀金属不能与酸反应
11.对于有单质和化合物生成的反应,有下列几种说法: ①、一定是置换反应; ②、一定是分解反应; ③、可能是分解反应; ④、可能是化合反应;⑤、一定不是化合反应。其中正确的说法是
A.③⑤ B.③④ C.②③ D.②④
12.下列图象分别与选项中的操作相对应,合理的是( )
A.一定条件下,一定质量的碳和氧气在密闭容器中反应
B.向一定质量的稀盐酸中加水
C.一定温度下,向一定质量的饱和石灰水中加入氧化钙
D.等质量的镁和铁分别与足量的稀硫酸反应
13.下列化学方程式书写完全正确的是
A. B.
C. D.
14.归纳、推理是学习化学的重要方法,下列说法正确的是
A.不同种元素可以组成不同的物质,同一种元素也可以组成不同的物质
B.不同种元素最本质的区别是核外电子数不同,最外层电子数决定元素的化学性质
C.置换反应一定有单质生成,所以有单质生成的反应一定是置换反应
D.用汽油、酒精和洗洁精都能除去油污,原理各不相同
15.概念之间存在交叉、并列或包含关系。下列选项中的概念符合图中所示关系的是( )
A B C D
M 碱 氧化物 化合物 置换反应
N 酸 单质 纯净物 化合反应
Q 盐 金属 单质 燃烧
A.A B.B C.C D.D
三、综合应用题
16.日常使用的干电池是一种锌锰电池,它的构造是:负极为锌做的圆筒,正极是一根碳棒,它的周围被二氧化锰,碳粉和氯化铵的混合剂所包围,总称为"碳包"。碳包和锌筒之间填充着氯化铵、氯化锌的水溶液和淀粉等组成的糊状物。废旧干电池随意丢弃会造成环境污染。学校兴趣小组同学准备对废旧的干电池进行探究。
(一)拆解干电池,得到铜帽、锌皮、碳棒、黑色粉末等物质。
(二)回收二氧化锰并测定碳粉与二氧化锰的质量比:
(1)干电池使用时将化学能转化成 能。
(2)上述操作中灼烧的目的是 ;
(3)同学们将过滤后得到的滤渣干燥后称得质量为25克,充分灼烧后冷却称得剩余固体质量为20克,则滤渣中二氧化锰与碳粉的质量比为 。经分析,此结果偏大,老师指出同学们在实验中缺少一步操作,该操作是 。
(4)为验证二氧化锰,同学们用A、B两支洁净试管,分别取5毫升3%的过氧化氢溶液,往A试管中加入少量上述实验灼烧后得到的固体,如果出现 的现象,说明为二氧化锰。反应的化学方程式为 。
(三)用拆解得到的锌皮(含杂质)制取硫酸锌晶体。
实验步骤:①将剪碎后的锌皮放入烧杯中,加入足量的稀硫酸,充分反应;②将上述反应后的混合物过滤。③将滤液加热浓缩、 、过滤,得到ZnSO4·7H2O晶体。
(5)步骤①中反应方程式为 ,将锌皮剪碎的目的是 。
(6)步骤②需要的仪器有铁架台、烧杯、 和玻璃棒,玻璃棒的作用是 。
(7)步骤③缺少的操作是 。
(四)测定锌皮中锌的质量分数。同学们设计了如下实验装置,取1克锌皮放于试管中,实验中将注射器内50毫升稀硫酸(足量)完全注入试管中。当试管中不再产生气泡时立刻读数得到量筒中水的体积为350毫升。已知实验条件下氢气的密度为0.09g/L。
(8)计算该锌皮中锌的质量分数 。(写出计算过程,结果保留两位小数)
(9)上述方法测得的锌的质量分数偏大,不可能的原因是
A.没等装置冷却就读数
B.锌皮中含有少量铁
C.试管中有气体没有排出
D.将注射器中稀硫酸全部注入试管中后忘掉夹紧弹簧夹
17.金属与合金
I.人类很早就开始使用金属,下列记载均与金属有关,请按要求填空。
①“金(即钢)柔锡柔,合两柔则刚。”
②何意百炼钢,化为绕指柔(“百炼钢”指生铁经过高温煅烧,反复锤炼成为钢)
③东晋《抱朴子》中记载:“以曾青涂铁,铁赤色如铜”(“曾青”即CuSO4溶液)。
④美人首饰侯王印,尽是沙中浪底来。(“首饰”、“印”指金制品)
(1)①~④划线部分,发生了化学变化的是 (填编号),其中发生置换反应的化学方程式为 。该反应中发生有效的相互作用而促使变化发生的微粒是(写出微粒符号) 。
(2)①说明合金与组成它的纯金属相比,具有的优点是 。
(3)②中“百炼钢”指将生铁转化为钢,关于生铁和钢的说法正确的是 。
A 生铁、钢都是混合物
B 钢可以完全溶解在足量稀盐酸中
C 在钢中加入玻璃纤维可得到既有玻璃般透明或半透明性,又有钢铁般强度的材料﹣玻璃钢
D 用赤铁矿冶炼生铁时,矿石中的氧化铁发生了还原反应
(4)④说明金在自然界中以单质形式存在,其原因是 。现在,人们常用银、钯、铂三种金属制作首饰,如图,将银、铂戒指分别放入甲、乙两烧杯中,一段时间后取出,发现只有银戒指表面有明显变化,通过该实验判断银、铂、钯的金属活动性由强到弱顺序为 (用符号表示)。
II.金属在现代社会有着更广泛的应用。我国自行研发的大型客机C919(图丙)于今年5月成功试飞,其中就应用了很多金属材料。
(5)铁比铝的强度大,但制造大飞机机身却用铝合金而不用铁合金,主要原因是铝比铁具有更好的抗腐蚀性和 的优良性质。铁易锈蚀是铁与空气中的 作用的结果,铝比铁具有更好的抗腐蚀性。原因是 (用文字叙述)。
(6)金属锂和钛均不在初中学到的金属活动性顺序表中,某小组想通过金属与稀盐酸的反应比较锂、铝的活动性,进行实验时应控制的变量有 。钛的活动性位于铜、铝之间,预测钛可能与 、 (写出两种不同类别物质的化学式)等物质反应。
18.化学是以实验为基础的科学,是实验室进行科学探究的重要手段。
(1)如图1已知各装置中的试剂:A中是燃着的香烟B、E中澄清的石灰水C中氢氧化钠溶液(氢氧化钠可以与二氧化碳反应),回答下列问题:
①能说明吸烟时产生CO2的现象是 ;
②能说明吸烟时产生CO的现象是 ;
③D装置中发生的化学反应方程式: ;
(2)如图2是实验室制取气体的部分装置。
①写出一个实验室用A装置制取氧气的化学反应方程式: ;
②实验室用固体醋酸钠和熟石灰加热制取甲烷应该选取的发生装置是 ,如果用D装置收集甲烷时,气体应该从 端(填a或b进入)。
(3)小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末39g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。求合金中铜的质量分数 。
参考答案:
1.BD
2.BC
3.BD
4.AC
5.BC
6.D
7.B
8.C
9.B
10.B
11.A
12.A
13.C
14.C
15.B
16. 电 除去碳粉(或者将碳粉变成二氧化碳除去,合理即可) 4:1 洗涤 有气泡产生 2H2O22H2O + O2↑ 冷却结晶 Zn + H2SO4 = ZnSO4 + H2↑ 增大接触面积,使反应更快更充分 漏斗 引流 降温结晶(或冷却结晶) 解:氢气的质量=(350-50)x10-3L ×0.09g/L = 0.027g
设锌的质量为x
Zn + H2SO4 == ZnSO4 + H2↑
65 2
X 0.027g
x =0.8775g
锌皮中锌的质量分数 = ×100% = 87.75% C D
17. ②③ Fe、Cu2+ 硬度大 AD 金的化学性质稳定 Ag>Pd>Pt 密度小 氧气、水 常温下,铝能与氧气反应生成致密的氧化铝保护膜 盐酸的体积和浓度,温度,金属的颗粒大小
18.(1) B中澄清水变浑浊 D中黑色粉末变红,E中澄清石灰水变浑浊
(2) A b
(3)解:设锌的质量为x。
答:铜的质量分数为75%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
