第八单元金属和金属材料达标训练题---2023-2024学年九年级化学人教版(含答案)
文档属性
| 名称 | 第八单元金属和金属材料达标训练题---2023-2024学年九年级化学人教版(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 148.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-28 00:00:00 | ||
图片预览




文档简介
第八单元金属和金属材料达标训练题---2023-2024学年九年级化学人教版
一、单选题
1.日常生活中的一些铁制品经常被锈蚀。下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁器表面的铁锈做保护层
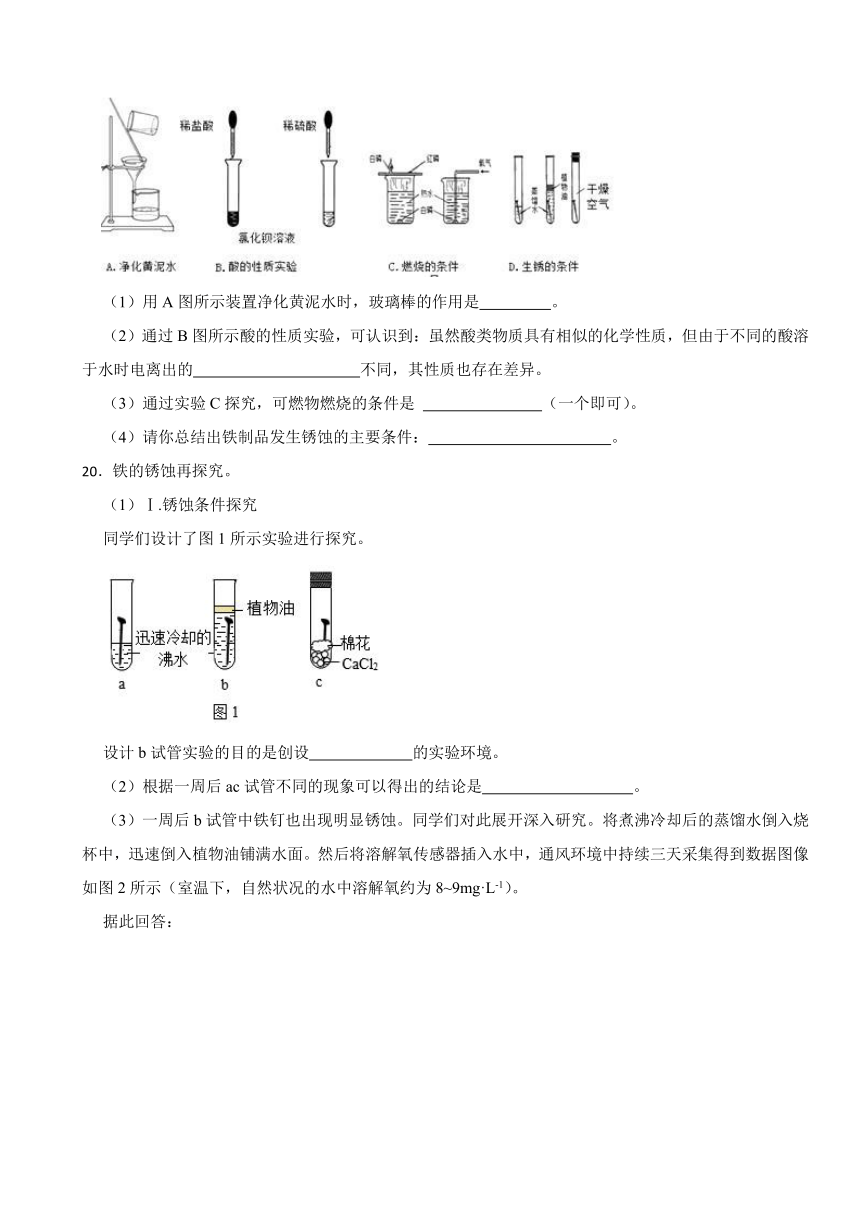
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥ C.①③⑦ D.②⑥⑦
2.下列有关“化学之最”的叙述中错误的是( )
A.相同条件下密度最小的气体是氢气
B.地壳中含量最多的金属元素是铁
C.天然存在的最硬的物质是金刚石
D.空气中含量最多的气体是氮气
3.焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是( )
A.增加强度 B.降低熔点
C.增加延展性 D.增强抗腐蚀性
4.如图为地壳中元素含量分布图,其中能代表氧元素的是()
A.1 B.2 C.3 D.4
5.假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )
A.硫酸亚铁溶液 B.稀盐酸
C.浓硝酸和浓盐酸的混合物 D.稀硫酸
6.我国早在西汉时期,在《淮南万毕术》一书中就写到“曾青得铁则化为铜”,这是湿法冶金的先驱。反应原理为:Fe+CuSO4=Cu+FeSO4,下列说法正确的是( )
A.该反应无明显现象
B.该反应能证明铜的金属活动性比铁强
C.该反应属于置换反应
D.该反应前后溶液质量增大
7.在硝酸铜、硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤。下列说法正确的是( )
A.若滤液为无色,则滤渣中一定有银和锌,可能有铜
B.若滤液为蓝色,则滤液中一定有Cu2+、Zn2+,可能有Ag+
C.若往滤渣中加入稀盐酸有气泡产生,则滤液中一定有Zn2+、Ag+,可能有Cu2+
D.若往滤液中加入稀盐酸有白色沉淀产生,则滤渣中一定有银和铜,可能有锌
8.将 2.4g 含镁的混合物与足量盐酸反应,生成氢气质量为 0.18g,则混入的另一种物质不可能是( )
A.Al B.Fe C.Cu D.Zn
9.柳州市被称为“桥梁博物馆”,刚建成的凤凰岭大桥成为“桥梁博物馆”的新成员,大桥的桥体使用了大量的金属材料。下列对桥梁中使用的金属材料保护措施错误的是( )
A.经常用浓盐酸清洗金属材料
B.在金属材料表面刷油漆
C.在金属材料表面镀保护层
D.改变金属内部结构制成防腐合金
10.搅拌作用下,向200.0gCuSO4的溶液中先逐渐加入一定量的锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属的质量关系如下图所示。下列说法正确的是( )
A.a点对应的溶液为无色
B.n=6.5,m=16
C.ac段发生的反应能产生FeCl3
D.d点对应的固体中加稀盐酸,无气泡产生
11.下列描述与事实相符合的是( )
A.细铁丝伸入盛有氧气的集气瓶中剧烈燃烧
B.电解水实验,电源正极产生的气体燃烧时会发出淡蓝色火焰
C.镁带在空气中燃烧,发出耀眼的白光,生成白色固体
D.铜丝插入硫酸铝溶液中,溶液由无色变为蓝色
12.下列关于金属的说法中,错误的是( )
A.铜有良好的导电性,常用作导线
B.所有的金属都能与稀盐酸发生反应
C.铁制品在干燥的空气中不易生锈
D.铁制器皿比铝制器皿更容易被腐蚀
13.向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如右下图所示,下列说法正确的是( )
A.a点溶液中的溶质有2种
B.取c点的固体,加入稀盐酸,有气泡产生
C.d点溶液中溶质为Zn(NO3)2
D.取b~c段溶液,滴加稀盐酸,有白色沉淀产生
14.某小组把一定量的铁粉加入到 AgNO3、Cu(NO3)2的混合溶液中,过滤后,向滤渣中加入稀盐酸产生气泡。下列判断正确的是( )
A.滤渣中可能含有铜和铁
B.滤渣中一定含有铜、银和铁
C.滤液中一定没有Fe(NO3)2
D.滤液中可能有 Fe(NO3)2和 Cu(NO3)2
二、填空题
15.某同学用如图所示实验来验证铜与银的金属活动性强弱,则X、Y分别是 、 溶液,其反应的化学方程式是 。
16.重庆火锅,天下闻名。如图是一种传统的铜火锅。用铜火锅来煮熟食物,主要是利用金属的 性;吃火锅时,可用漏勺捞火锅中的菜,这和化学实验中的 操作类似(填操作名称);使用完铜火锅后,人们常用灭火盖盖灭火焰,其灭火原理是使可燃物与 隔绝。
三、计算题
17.请回答下列问题。
(1)人类文明与金属材料的发展应用关系十分密切。
①三星堆遗址的重大考古发现,向世界展示了中华传统文化所蕴含的丰富宝藏和巨大魅力。三星堆遗址现己出土了青铜面具、青铜神树、象牙等重要文物。青铜的硬度比纯铜要 (选填“大”或“小”)。
②西汉刘安所著《淮南万毕术》中有关于“曾青(硫酸铜溶液)得铁则化为铜”的记载,湿法炼铜这类化学反应属于 反应。(选填“分解“化合“置换“复分解”之一)
③近现代,钢铁工业的发展状况是世界各国工业化水平的重要标志之一,利用一氧化碳和氧化铁在高温条件下发生反应,是目前工业炼铁的主要原理,请你写出该反应的化学方程式: 。
(2)为测定某赤铁矿石中所含氧化铁的质量分数,实验小组的同学称取10.0g赤铁矿石样品倒入烧杯中,然后向其中逐滴加入溶质质量分数为10.95%的稀盐酸。加入稀盐酸的质量与反应后剩余固体的质量关系如下图所示(赤铁矿石中所含杂质不溶于水,也不与稀盐酸反应),试回答:
①当滴入稀盐酸200g时(即图中。B点时),烧杯内溶液中的溶质是 (填化学式)。
②请读取图中信息,计算该赤铁矿石中含氧化铁的质量分数 。
③若要处理实验后B点的废液,应向废液中加入 g氢氧化钠。
18.已知锌、镁与稀硫酸反应的化学方程式为: , ,相同质量的锌和镁分别与足量的稀硫酸反应,产生的氢气的质量之比是多少?
四、实验探究题
19.实验是进行科学探究的重要方式,请根据下图回答问题:
(1)用A图所示装置净化黄泥水时,玻璃棒的作用是 。
(2)通过B图所示酸的性质实验,可认识到:虽然酸类物质具有相似的化学性质,但由于不同的酸溶于水时电离出的 不同,其性质也存在差异。
(3)通过实验C探究,可燃物燃烧的条件是 (一个即可)。
(4)请你总结出铁制品发生锈蚀的主要条件: 。
20.铁的锈蚀再探究。
(1)Ⅰ.锈蚀条件探究
同学们设计了图1所示实验进行探究。
设计b试管实验的目的是创设 的实验环境。
(2)根据一周后ac试管不同的现象可以得出的结论是 。
(3)一周后b试管中铁钉也出现明显锈蚀。同学们对此展开深入研究。将煮沸冷却后的蒸馏水倒入烧杯中,迅速倒入植物油铺满水面。然后将溶解氧传感器插入水中,通风环境中持续三天采集得到数据图像如图2所示(室温下,自然状况的水中溶解氧约为8~9mg·L-1)。
据此回答:
①b试管中出现锈蚀的原因是 。
②欲达到原实验目的,写出一种b试管实验的改进设计: 。
③在铁制品表面涂植物油能防锈的原因是 。
(4)Ⅱ.锈蚀成分探究
【查阅资料】铁锈成分复杂,化学式可简单表示为Fe2O3·nH2O。Fe2O3·nH2O加热后容易分解产生水蒸气。
【设计方案】甲同学设计了图3(夹持仪器已省略)所示实验方案,同学们讨论后认为该方案设计有明显缺陷,你对方案修改完善的建议是
【进行实验】将ab试管中的生锈铁钉取出晾干,刮下部分铁锈放入玻璃管中。按完善后的装置进行实验(每步反应和吸收均完全)。实验过程测得以下数据:
装置A的总质量m1(不包括酒精喷灯) 装置B的总质量m2 装置C和装置D的总质量m3
加热前 516.20g 463.00g 252.60g
加热后 513.44g 464.80g 255.29g
【实验分析】
①根据以上数据可得,该铁锈的化学式可简单表示为 。
②实验过程中,以下操作会导致n的测量数值偏大的是 。
A.停止加热后马上敞口称量装置A总质量
B.加热前没有排空气就称量装置B总质量
C.m3仅仅称量了加热前后的装置C总质量
D.A中反应刚结束就称量装置C、D总质量
五、综合题
21.分类、类比是学习化学的常用方法,请回答:
(1)金属材料在人类生活和社会发展中起到了重要作用,但金属矿物储量有限,而且不能再生。下面是一些常见保护金属资源的事例:
①把某些金属制成合金
②铁制品表面镀上铬、镍等金属
③用塑料管来替代金属管
④禁止不顾国家利益乱采矿
⑤把喝完饮料的易拉罐卖给废品收购站
⑥回收废旧电池
请你从保护金属资源有效途径的角度,选择一种分类标准把上述事例进行分类:
分类标准 ;包括事例(不能只含一种) (填序号)。
(2)在金属活动性顺序中,很活泼的金属投入CuSO4溶液中不发生置换反应,而发生如下反应:
以钾为例:2K+2H2O=2KOH+H2↑;2KOH+CuSO4=Cu(OH)2↓+K2SO4,最后总反应的化学方程式可写为:
2K+2H2O+CuSO4=Cu(OH)2↓+K2SO4+H2↑,经过类比,请你写出很活泼的金属钠与CuSO4溶液反应的总反应的化学方程式 ;请你分析推测,金属钾加入稀盐酸溶液中 (填“是”或“否”)发生置换反应。
22.下图是初中化学常见的实验。
(1)实验一测定空气中氧气的含量。实验时取用红磷需过量的目的是 ,红磷燃烧的化学方程式为 ,打开止水夹观察到 ,证明空气中氧气约占1/5体积。
(2)实验二探究铁锈蚀的条件。通过上述对比实验只能得出铁生锈需与 接触,要证明铁锈蚀的条件,还需补充一个实验,写出补充实验的具体操作 。
答案解析部分
1.【答案】B
2.【答案】B
3.【答案】B
4.【答案】A
5.【答案】C
6.【答案】C
7.【答案】B
8.【答案】A
9.【答案】A
10.【答案】B
11.【答案】C
12.【答案】B
13.【答案】C
14.【答案】B
15.【答案】Cu(或硝酸银);AgNO3(或铜);
16.【答案】导热;过滤;氧气或空气
17.【答案】(1)大;置换;
(2)FeCl3、HCl;80%;12
18.【答案】解:设质量均为m的锌和镁分别与足量的稀硫酸反应,产生氢气的质量分别为x和y
产生的氢气质量为:
产生的氢气质量为:
产生的氢气的质量比为:
答:锌和镁与足量的稀硫酸反应产生的氢气的质量之比是24:65。
19.【答案】(1)引流
(2)阴离子或酸根离子
(3)与氧气接触
(4)铁与水氧气同时接触
20.【答案】(1)隔绝氧气
(2)铁的锈蚀需要水
(3)水中溶解氧气浓度增加;试管b赛一个橡胶塞;隔绝水和氧气
(4)Fe2O3·5H2O;AB
21.【答案】(1)防止金属腐蚀(或回收废旧金属);①②(或⑤⑥)
(2)2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑;是
22.【答案】(1)使瓶中氧气完全反应,测定更准确;;水沿导管倒吸入集气瓶中,约占集气瓶中气体体积的1/5
(2)氧气;将干燥洁净的铁钉放入干燥的试管中,放入棉花包裹的干燥剂,塞紧橡皮塞
一、单选题
1.日常生活中的一些铁制品经常被锈蚀。下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁器表面的铁锈做保护层
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥ C.①③⑦ D.②⑥⑦
2.下列有关“化学之最”的叙述中错误的是( )
A.相同条件下密度最小的气体是氢气
B.地壳中含量最多的金属元素是铁
C.天然存在的最硬的物质是金刚石
D.空气中含量最多的气体是氮气
3.焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是( )
A.增加强度 B.降低熔点
C.增加延展性 D.增强抗腐蚀性
4.如图为地壳中元素含量分布图,其中能代表氧元素的是()
A.1 B.2 C.3 D.4
5.假设与排除是探索未知物的一种方法。《本草纲目拾遗》中记载:“强水性最烈,能蚀五金(金、银、铜、铅、铁)”,下列物质最可能是“强水”的是( )
A.硫酸亚铁溶液 B.稀盐酸
C.浓硝酸和浓盐酸的混合物 D.稀硫酸
6.我国早在西汉时期,在《淮南万毕术》一书中就写到“曾青得铁则化为铜”,这是湿法冶金的先驱。反应原理为:Fe+CuSO4=Cu+FeSO4,下列说法正确的是( )
A.该反应无明显现象
B.该反应能证明铜的金属活动性比铁强
C.该反应属于置换反应
D.该反应前后溶液质量增大
7.在硝酸铜、硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤。下列说法正确的是( )
A.若滤液为无色,则滤渣中一定有银和锌,可能有铜
B.若滤液为蓝色,则滤液中一定有Cu2+、Zn2+,可能有Ag+
C.若往滤渣中加入稀盐酸有气泡产生,则滤液中一定有Zn2+、Ag+,可能有Cu2+
D.若往滤液中加入稀盐酸有白色沉淀产生,则滤渣中一定有银和铜,可能有锌
8.将 2.4g 含镁的混合物与足量盐酸反应,生成氢气质量为 0.18g,则混入的另一种物质不可能是( )
A.Al B.Fe C.Cu D.Zn
9.柳州市被称为“桥梁博物馆”,刚建成的凤凰岭大桥成为“桥梁博物馆”的新成员,大桥的桥体使用了大量的金属材料。下列对桥梁中使用的金属材料保护措施错误的是( )
A.经常用浓盐酸清洗金属材料
B.在金属材料表面刷油漆
C.在金属材料表面镀保护层
D.改变金属内部结构制成防腐合金
10.搅拌作用下,向200.0gCuSO4的溶液中先逐渐加入一定量的锌粉,再逐渐加入铁粉,测得剩余固体质量与加入金属的质量关系如下图所示。下列说法正确的是( )
A.a点对应的溶液为无色
B.n=6.5,m=16
C.ac段发生的反应能产生FeCl3
D.d点对应的固体中加稀盐酸,无气泡产生
11.下列描述与事实相符合的是( )
A.细铁丝伸入盛有氧气的集气瓶中剧烈燃烧
B.电解水实验,电源正极产生的气体燃烧时会发出淡蓝色火焰
C.镁带在空气中燃烧,发出耀眼的白光,生成白色固体
D.铜丝插入硫酸铝溶液中,溶液由无色变为蓝色
12.下列关于金属的说法中,错误的是( )
A.铜有良好的导电性,常用作导线
B.所有的金属都能与稀盐酸发生反应
C.铁制品在干燥的空气中不易生锈
D.铁制器皿比铝制器皿更容易被腐蚀
13.向一定量的硝酸银和硝酸铜的混合溶液中加入锌粉,所得溶液的质量与加入锌粉质量关系如右下图所示,下列说法正确的是( )
A.a点溶液中的溶质有2种
B.取c点的固体,加入稀盐酸,有气泡产生
C.d点溶液中溶质为Zn(NO3)2
D.取b~c段溶液,滴加稀盐酸,有白色沉淀产生
14.某小组把一定量的铁粉加入到 AgNO3、Cu(NO3)2的混合溶液中,过滤后,向滤渣中加入稀盐酸产生气泡。下列判断正确的是( )
A.滤渣中可能含有铜和铁
B.滤渣中一定含有铜、银和铁
C.滤液中一定没有Fe(NO3)2
D.滤液中可能有 Fe(NO3)2和 Cu(NO3)2
二、填空题
15.某同学用如图所示实验来验证铜与银的金属活动性强弱,则X、Y分别是 、 溶液,其反应的化学方程式是 。
16.重庆火锅,天下闻名。如图是一种传统的铜火锅。用铜火锅来煮熟食物,主要是利用金属的 性;吃火锅时,可用漏勺捞火锅中的菜,这和化学实验中的 操作类似(填操作名称);使用完铜火锅后,人们常用灭火盖盖灭火焰,其灭火原理是使可燃物与 隔绝。
三、计算题
17.请回答下列问题。
(1)人类文明与金属材料的发展应用关系十分密切。
①三星堆遗址的重大考古发现,向世界展示了中华传统文化所蕴含的丰富宝藏和巨大魅力。三星堆遗址现己出土了青铜面具、青铜神树、象牙等重要文物。青铜的硬度比纯铜要 (选填“大”或“小”)。
②西汉刘安所著《淮南万毕术》中有关于“曾青(硫酸铜溶液)得铁则化为铜”的记载,湿法炼铜这类化学反应属于 反应。(选填“分解“化合“置换“复分解”之一)
③近现代,钢铁工业的发展状况是世界各国工业化水平的重要标志之一,利用一氧化碳和氧化铁在高温条件下发生反应,是目前工业炼铁的主要原理,请你写出该反应的化学方程式: 。
(2)为测定某赤铁矿石中所含氧化铁的质量分数,实验小组的同学称取10.0g赤铁矿石样品倒入烧杯中,然后向其中逐滴加入溶质质量分数为10.95%的稀盐酸。加入稀盐酸的质量与反应后剩余固体的质量关系如下图所示(赤铁矿石中所含杂质不溶于水,也不与稀盐酸反应),试回答:
①当滴入稀盐酸200g时(即图中。B点时),烧杯内溶液中的溶质是 (填化学式)。
②请读取图中信息,计算该赤铁矿石中含氧化铁的质量分数 。
③若要处理实验后B点的废液,应向废液中加入 g氢氧化钠。
18.已知锌、镁与稀硫酸反应的化学方程式为: , ,相同质量的锌和镁分别与足量的稀硫酸反应,产生的氢气的质量之比是多少?
四、实验探究题
19.实验是进行科学探究的重要方式,请根据下图回答问题:
(1)用A图所示装置净化黄泥水时,玻璃棒的作用是 。
(2)通过B图所示酸的性质实验,可认识到:虽然酸类物质具有相似的化学性质,但由于不同的酸溶于水时电离出的 不同,其性质也存在差异。
(3)通过实验C探究,可燃物燃烧的条件是 (一个即可)。
(4)请你总结出铁制品发生锈蚀的主要条件: 。
20.铁的锈蚀再探究。
(1)Ⅰ.锈蚀条件探究
同学们设计了图1所示实验进行探究。
设计b试管实验的目的是创设 的实验环境。
(2)根据一周后ac试管不同的现象可以得出的结论是 。
(3)一周后b试管中铁钉也出现明显锈蚀。同学们对此展开深入研究。将煮沸冷却后的蒸馏水倒入烧杯中,迅速倒入植物油铺满水面。然后将溶解氧传感器插入水中,通风环境中持续三天采集得到数据图像如图2所示(室温下,自然状况的水中溶解氧约为8~9mg·L-1)。
据此回答:
①b试管中出现锈蚀的原因是 。
②欲达到原实验目的,写出一种b试管实验的改进设计: 。
③在铁制品表面涂植物油能防锈的原因是 。
(4)Ⅱ.锈蚀成分探究
【查阅资料】铁锈成分复杂,化学式可简单表示为Fe2O3·nH2O。Fe2O3·nH2O加热后容易分解产生水蒸气。
【设计方案】甲同学设计了图3(夹持仪器已省略)所示实验方案,同学们讨论后认为该方案设计有明显缺陷,你对方案修改完善的建议是
【进行实验】将ab试管中的生锈铁钉取出晾干,刮下部分铁锈放入玻璃管中。按完善后的装置进行实验(每步反应和吸收均完全)。实验过程测得以下数据:
装置A的总质量m1(不包括酒精喷灯) 装置B的总质量m2 装置C和装置D的总质量m3
加热前 516.20g 463.00g 252.60g
加热后 513.44g 464.80g 255.29g
【实验分析】
①根据以上数据可得,该铁锈的化学式可简单表示为 。
②实验过程中,以下操作会导致n的测量数值偏大的是 。
A.停止加热后马上敞口称量装置A总质量
B.加热前没有排空气就称量装置B总质量
C.m3仅仅称量了加热前后的装置C总质量
D.A中反应刚结束就称量装置C、D总质量
五、综合题
21.分类、类比是学习化学的常用方法,请回答:
(1)金属材料在人类生活和社会发展中起到了重要作用,但金属矿物储量有限,而且不能再生。下面是一些常见保护金属资源的事例:
①把某些金属制成合金
②铁制品表面镀上铬、镍等金属
③用塑料管来替代金属管
④禁止不顾国家利益乱采矿
⑤把喝完饮料的易拉罐卖给废品收购站
⑥回收废旧电池
请你从保护金属资源有效途径的角度,选择一种分类标准把上述事例进行分类:
分类标准 ;包括事例(不能只含一种) (填序号)。
(2)在金属活动性顺序中,很活泼的金属投入CuSO4溶液中不发生置换反应,而发生如下反应:
以钾为例:2K+2H2O=2KOH+H2↑;2KOH+CuSO4=Cu(OH)2↓+K2SO4,最后总反应的化学方程式可写为:
2K+2H2O+CuSO4=Cu(OH)2↓+K2SO4+H2↑,经过类比,请你写出很活泼的金属钠与CuSO4溶液反应的总反应的化学方程式 ;请你分析推测,金属钾加入稀盐酸溶液中 (填“是”或“否”)发生置换反应。
22.下图是初中化学常见的实验。
(1)实验一测定空气中氧气的含量。实验时取用红磷需过量的目的是 ,红磷燃烧的化学方程式为 ,打开止水夹观察到 ,证明空气中氧气约占1/5体积。
(2)实验二探究铁锈蚀的条件。通过上述对比实验只能得出铁生锈需与 接触,要证明铁锈蚀的条件,还需补充一个实验,写出补充实验的具体操作 。
答案解析部分
1.【答案】B
2.【答案】B
3.【答案】B
4.【答案】A
5.【答案】C
6.【答案】C
7.【答案】B
8.【答案】A
9.【答案】A
10.【答案】B
11.【答案】C
12.【答案】B
13.【答案】C
14.【答案】B
15.【答案】Cu(或硝酸银);AgNO3(或铜);
16.【答案】导热;过滤;氧气或空气
17.【答案】(1)大;置换;
(2)FeCl3、HCl;80%;12
18.【答案】解:设质量均为m的锌和镁分别与足量的稀硫酸反应,产生氢气的质量分别为x和y
产生的氢气质量为:
产生的氢气质量为:
产生的氢气的质量比为:
答:锌和镁与足量的稀硫酸反应产生的氢气的质量之比是24:65。
19.【答案】(1)引流
(2)阴离子或酸根离子
(3)与氧气接触
(4)铁与水氧气同时接触
20.【答案】(1)隔绝氧气
(2)铁的锈蚀需要水
(3)水中溶解氧气浓度增加;试管b赛一个橡胶塞;隔绝水和氧气
(4)Fe2O3·5H2O;AB
21.【答案】(1)防止金属腐蚀(或回收废旧金属);①②(或⑤⑥)
(2)2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑;是
22.【答案】(1)使瓶中氧气完全反应,测定更准确;;水沿导管倒吸入集气瓶中,约占集气瓶中气体体积的1/5
(2)氧气;将干燥洁净的铁钉放入干燥的试管中,放入棉花包裹的干燥剂,塞紧橡皮塞
同课章节目录
