第2章微粒间相互作用与物质性质综合复习训练(含解析)2023——2024学年鲁科版(2019)高中化学选择性必修2
文档属性
| 名称 | 第2章微粒间相互作用与物质性质综合复习训练(含解析)2023——2024学年鲁科版(2019)高中化学选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-28 00:00:00 | ||
图片预览


文档简介
第2章微粒间相互作用与物质性质综合复习训练
姓名()班级()学号()
一、选择题
1.下列反应的离子方程式正确的是
A.硝酸钡溶液中通入SO2:Ba2++SO2+H2O=BaSO3↓+2H+
B.Ca(HCO3)2溶液中加少量NaOH溶液:Ca2+++OH-=CaCO3↓+H2O
C.饱和Na2CO3溶液中通入过量CO2:+CO2+H2O=2
D.硫酸铜溶液中加过量浓氨水:Cu2++2NH3 H2O=Cu(OH)2↓+2
2.下列化学用语的表达错误的是
A.用电子式表示K2S的形成:
B.基态硫原子价电子排布图(轨道表示式)为
C.用电子云轮廓图表示H-H的s-sσ键形成的示意图:
D.化合物中铁的化合价为+2价
3.某种食品膨松剂由原子序数依次增大的、、、五种主族元素组成。五种元素分别处于三个短周期,、同主族,、、的原子序数之和与的原子序数相等,原子的最外层电子数是原子的一半。下列说法正确的是
A.最高正价:YB.原子半径的大小关系为:
C.、、只能形成共价化合物
D.工业上常用热还原法制取Y的单质
4.下列有关物质结构与性质的说法中,错误的是
A.在中的溶解性:
B.沸点:
C.酸性:
D.利用超分子特征,“杯酚”可将和分离
5.是一种优良的蚀刻气体。均可用于制备,用制备的反应为:。已知。下列说法正确的是
A.第一电离能: B.的电子式:
C.的空间构型为平面正三角形 D.水溶液呈弱碱性
6.二氯化二硫是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用浸润)中通入。已知:常温下遇水易水解,并产生能使品红裉色的气体。下列说法错误的是
A.分子中所有原子均满足8电子结构
B.中原子的杂化类型为杂化
C.用浸润可加快反应速率,体现相似相溶原理
D.与反应的化学方程式可能为:
7.一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是
A.非金属性:Z>Y>Q
B.简单氢化物的沸点:Q>Z
C.WZX与WXQ均是强电解质,水溶液之间可以发生复分解反应
D.原子序数为82的元素与Q位于同一主族
8.氢键对生命活动具有重要意义,DNA中四种碱基通过氢键配对方式如下图(~代表糖苷键)。下列说法错误的是
A.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
B.鸟嘌呤分子中2号N原子的杂化类型为sp3
C.氢键的作用能较小,在DNA解旋和复制时容易破坏和形成
D.羊毛织品水洗后变形与氢键有关
9.W、X、Z、Q、Y为原子序数依次增大的短周期主族元素,期内层电子数之和为18,最外层电子数之和为28,它们所形成的阴离子具有很高的亲水性,可以作为能源材料中的电解质,该离子结构如图所示。下列说法正确的是
A.Y离子的VSEPR模型为四面体 B.原子半径:Y>Z>W
C.电负性:X10.化合物甲(H3BNH3)可由无机苯(分子式为B3N3H6,结构与苯类似,也有大π键,结构式为(),通过反应制得:3CH4+2B3N3H6+6H2O=3CO2+6H3BNH3。下列叙述正确的是
A.基态原子未成对电子数:BB.无机苯中的大π键是由三个N原子和三个B原子各提供一个电子形成的
C.分子中B和N的杂化方式相同且为sp2杂化
D.B原子由时,形成发射光谱
11.下列化学用语表达正确的是
A.NH3的VSEPR模型:
B.As原子的简化电子排布式:[Ar]4s24p3
C.p-p σ键电子云轮廓图:
D.基态Mn原子价电子轨道表示式:
12.同一周期主族元素W、Z、X、Y原子序数依次增大,X原子的最外层电子数是W原子的次外层电子数的3倍,由四种元素原子形成的阴离子结构如图,下列说法正确的是
A.Z位于元素周期表第2周期ⅥA族 B.以W为中心原子形成的VSEPR模型为平面三角形
C.该阴离子中含有配位键 D.最高价氧化物对应水化物的酸性:Y>Z>W
13.石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,破坏平面结构转化为如图所示的氧化石墨烯。下列说法正确的是
A.石墨烯是一种新型化合物
B.石墨烯中,碳原子与键数目之比为1:3
C.键角大小:
D.在水中的溶解度:石墨烯>氧化石墨烯
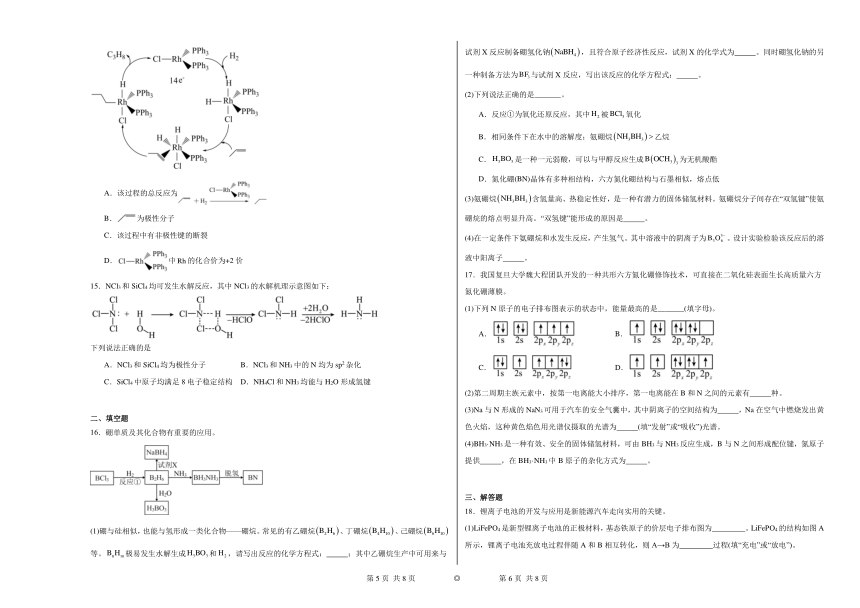
14.1965年,科学家合成出了一种(铑)的配合物作为催化剂,实现了温和条件下烯烃加氢,该反应的催化机理如图所示,其中Ph代表苯基,表示中心体的价电子数与配体提供的孤电子数共有14个电子。已知:Rh(铑)与Co(钻)同族,下列说法错误的是
A.该过程的总反应为
B.为极性分子
C.该过程中有非极性键的断裂
D.中的化合价为+2价
15.NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是
A.NCl3和SiCl4均为极性分子 B.NCl3和NH3中的N均为sp2杂化
C.SiCl4中原子均满足8电子稳定结构 D.NH4Cl和NH3均能与H2O形成氢键
二、填空题
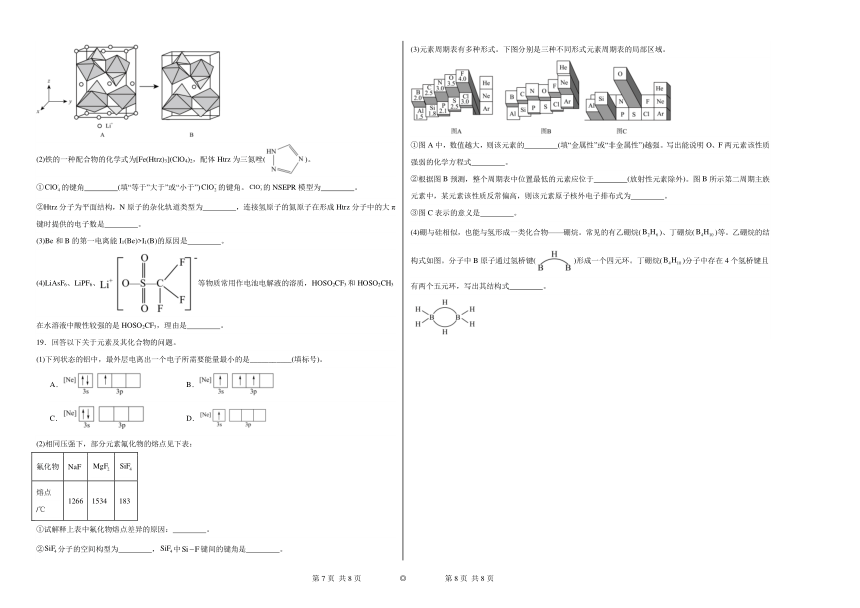
16.硼单质及其化合物有重要的应用。
(1)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷、丁硼烷、己硼烷等。极易发生水解生成和,请写出反应的化学方程式: ;其中乙硼烷生产中可用来与试剂X反应制备硼氢化钠,且符合原子经济性反应,试剂X的化学式为 。同时硼氢化钠的另一种制备方法为与试剂X反应,写出该反应的化学方程式: 。
(2)下列说法正确的是_______。
A.反应①为氧化还原反应,其中被氧化
B.相同条件下在水中的溶解度:氨硼烷乙烷
C.是一种一元弱酸,可以与甲醇反应生成为无机酸酯
D.氮化硼(BN)晶体有多种相结构,六方氮化硼结构与石墨相似,熔点低
(3)氨硼烷含氢量高、热稳定性好,是一种有潜力的固体储氢材料。氨硼烷分子间存在“双氢键”使氨硼烷的熔点明显升高。“双氢键”能形成的原因是 。
(4)在一定条件下氨硼烷和水发生反应,产生氢气。其中溶液中的阴离子为。设计实验检验该反应后的溶液中阳离子 。
17.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有 种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为 ,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为 (填“发射”或“吸收”)光谱。
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供 ,在BH3·NH3中B原子的杂化方式为 。
三、解答题
18.锂离子电池的开发与应用是新能源汽车走向实用的关键。
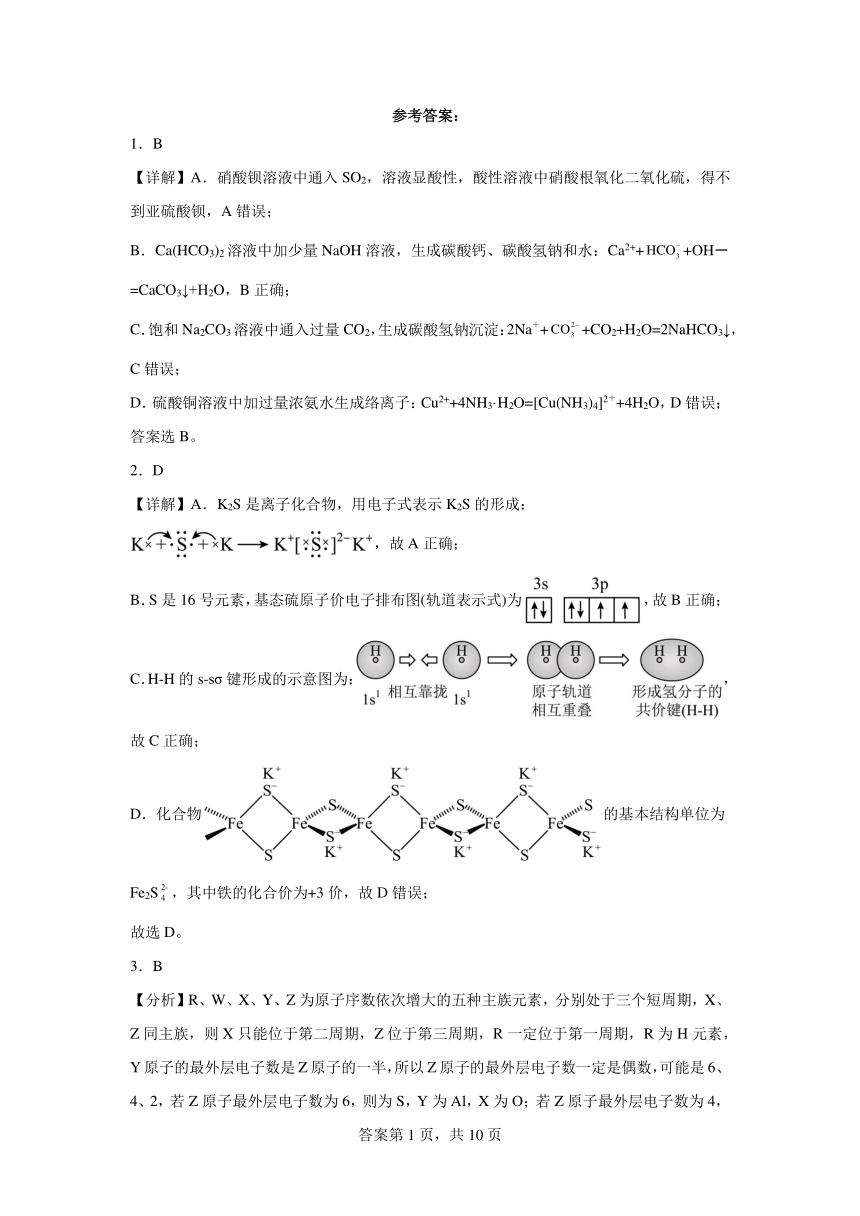
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为 。LiFePO4的结构如图A所示,锂离子电池充放电过程伴随A和B相互转化,则A→B为 过程(填“充电”或“放电”)。
(2)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,配体Htrz为三氮唑()。
①的键角 (填“等于”大于”或“小于”)的键角。的NSEPR模型为 。
②Htrz分子为平面结构,N原子的杂化轨道类型为 ,连接氢原子的氮原子在形成Htrz分子中的大π键时提供的电子数是 。
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是 。
(4)LiAsF6、LiPF6、等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是 。
19.回答以下关于元素及其化合物的问题。
(1)下列状态的铝中,最外层电离出一个电子所需要能量最小的是___________(填标号)。
A. B.
C. D.
(2)相同压强下,部分元素氟化物的熔点见下表:
氟化物 NaF
熔点/℃ 1266 1534 183
①试解释上表中氟化物熔点差异的原因: 。
②分子的空间构型为 ,中键间的键角是 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。
①图A中,数值越大,则该元素的 (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式 。
②根据图B预测,整个周期表中位置最低的元素应位于 (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为 。
③图C表示的意义是 。
(4)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷()、丁硼烷()等。乙硼烷的结构式如图。分子中B原子通过氢桥键()形成一个四元环。丁硼烷()分子中存在4个氢桥键且有两个五元环,写出其结构式 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.硝酸钡溶液中通入SO2,溶液显酸性,酸性溶液中硝酸根氧化二氧化硫,得不到亚硫酸钡,A错误;
B.Ca(HCO3)2溶液中加少量NaOH溶液,生成碳酸钙、碳酸氢钠和水:Ca2+++OH-=CaCO3↓+H2O,B正确;
C.饱和Na2CO3溶液中通入过量CO2,生成碳酸氢钠沉淀:2Na+++CO2+H2O=2NaHCO3↓,C错误;
D.硫酸铜溶液中加过量浓氨水生成络离子:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,D错误;
答案选B。
2.D
【详解】A.K2S是离子化合物,用电子式表示K2S的形成:,故A正确;
B.S是16号元素,基态硫原子价电子排布图(轨道表示式)为,故B正确;
C.H-H的s-sσ键形成的示意图为:,故C正确;
D.化合物的基本结构单位为Fe2S,其中铁的化合价为+3价,故D错误;
故选D。
3.B
【分析】R、W、X、Y、Z为原子序数依次增大的五种主族元素,分别处于三个短周期,X、Z同主族,则X只能位于第二周期,Z位于第三周期,R一定位于第一周期,R为H元素,Y原子的最外层电子数是Z原子的一半,所以Z原子的最外层电子数一定是偶数,可能是6、4、2,若Z原子最外层电子数为6,则为S,Y为Al,X为O;若Z原子最外层电子数为4,则Z为Si、Y为Mg、X为C;若Y原子最外层电子数为2,则Z为Mg、Y为Na、X为Be ,又R、W、X的原子序数之和与Z的原子序数相等,且原子序数依次增大可知,只有Z为S,Y为Al,X为O,符合题意,根据以上分析,R为H,W为N,X为O,Y为Al,Z为S。
【详解】A.W为N,X为O,Y为Al,O无最高正价,故A错误;
B.R为H,W为N,X为O,Y为Al,Z为S,原子半径的大小关系为:,故B正确;
C.、、既能形成离子化合物,如硝酸铵,也能形成共价化合物,如硝酸,故C错误;
D.工业上常用电解法制取Al,故D错误;
故答案为:B。
4.B
【详解】A.为非极性分子,为极性分子,故在中的溶解性:,A正确;
B.可形成分子内氢键,可形成分子间氢键,故沸点,B错误;
C.吸电子能力F>Cl>H,故酸性,C正确;
D.将和的混合物加入一种空腔大小适配C60的“杯酚”中可以分离出C60,D正确;
故选B。
5.A
【详解】A.F、N、O位于第二周期,同一周期主族元素从左往右,第一电离能呈增大趋势,但N的2p轨道处于半满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能,故A正确;
B.HF为共价化合物,F、H原子间共用一对电子,HF中F原子最外层电子数为8,其电子式为,故B错误;
C.NF3中氮原子价成电子对数为,VSEPR模型为四面体,含一对孤电子对,其空间构型为三角锥形,故C错误;
D.水解常数,F-水解常数,即水解程度大于F-水解程度,则NH4F水溶液呈弱酸性,故D错误;
故答案为:A。
6.B
【详解】A.分子中S原子连接2个共价键,Cl原子连接1个共价键,分子中所有原子均满足8电子结构,故A正确;
B.S2Cl2分子中每个S原子价层电子对数=2+2=4,所以采取sp3杂化,故B错误;
C.S单质和是非极性分子,由相似相溶原理可知S在中的溶解度较大,故C正确;
D.常温下,遇水易水解,并产生能使品红褪色的气体为二氧化硫,在反应过程中硫元素由+1价一部分升高到+4价(生成SO2),中Cl元素化合价为 1价,不能再得电子,只能是一部分S元素化合价降低到0价(生成S),所以反应的化学方程式可能为,故D正确;
故选B。
7.C
【分析】X、Y、Z、Q、W为1~ 20号元素且原子序数依次增大,Z与Q同主族,由结构可知:Z、Q的最外层有6个电子, Z为O元素,Q为S元素;Q和W的简单离子具有相同的电子层结构,W的原子序数最大,形成+1价阳离子,则W为K元素;Y形成4个共价键,X只能形成1个共价键,结合原子序数可知X为H元素,Y为C元素,然后根据元素周期律及物质的性质加以分析。
【详解】根据上述分析可知:X是H,Y是C,Z是O,Q是S,W是K元素。
A.O、S是同一主族元素,原子序数越大元素的非金属性就越弱,所以非金属性:Z>Q;元素的非金属性越强,其对应的最高价氧化物对应的水化物的酸性就越强。由于酸性:H2SO4>H2CO3,所以非金属性:Q >Y,故三种元素的非金属性:Z(O)>Q(S)>Y(C),A错误;
B.Z是O,Q是S,二者是同一主族元素,二者形成的简单氢化物分别是H2O、H2S,由于H2O分子之间除存在分子间作用力,还存在氢键,增加了分子之间的吸引作用,而H2S分子之间只存在分子间作用力,故简单氢化物的沸点:Z(H2O)>Q(H2S),B错误;
C.WZX是KOH,KOH是一元强碱;WXO是KHS是酸式盐,也是强电解质,二者在溶液中发生反应:KOH+KHS=K2S+H2O,二者发生的是复分解反应,C正确;
D.原子序数为82的元素是Pb元素,属于第ⅣA元素,而S是第ⅥA元素,因此82号元素与Q不是位于同一主族的元素,D错误;
故合理选项是C。
8.B
【详解】A.鸟嘌呤与胞嘧啶之间有三个氢键,腺嘌呤与胸腺嘧啶之间有两个个氢键,鸟嘌呤与胞嘧啶之间的相互作用更强,故A正确;
B.由鸟嘌呤结构可知,2号N原子有2个键和1个孤电子对,所以杂化方式为sp2,故B错误;
C.氢键的强度小,在DNA解旋和复制时断裂和形成,故C正确;
D.羊毛织品中主要成分为蛋白质,蛋白质中含有大量氢键,水洗时会破坏其中部分氢键,使得织品变形,故D正确;
故选B。
9.A
【分析】W、X、Z、Q、Y为原子序数依次增大的短周期主族元素,其内层电子数之和为18,最外层电子数之和为28。从图中可以看出,W元素的化合价为4价,表明其最外层有4个电子,则W为碳;Q形成1个共价键,则Q应为氟;Y形成6个共价键,则最外层有6个电子,其为S;Z形成2个共价键,则Z为氧;X形成2个共价键,又获得1个电子,所以X的最外层电子数为5,其为氮元素。从而得出W、X、Z、Q、Y分别为C、N、O、F、S。
【详解】A.根据该离子结构可知,S的价层电子对数为4,则其VSEPR模型为四面体,A正确;
B.由分析可知,W、Z、Y分别为C、O、S,电子层越多半径越大,同周期越靠左半径越大,则原子半径:Y>W>Z,B错误;
C.由分析可知,X、Q、Y分别为N、F、S,其中N的电负性大于S,C错误;
D.该阴离子中,S-N-S的中心N原子最外层存在孤电子对,对成键电子有排斥作用,所以∠S-N-S小于180°,D错误;
故选A。
10.C
【详解】A.B、C、N、O原子价电子排布式依次为2s22p1、2s22p2、2s22p3、2s22p4,未成对电子数依次是1、2、3、2,基态原子未成对电子数:B<C=O<N,故A错误;
B.B的价层电子对个数是3,B核外三个电子全部成键,则形成大π键的电子全部由N提供,故B错误;
C.B3N3H6(无机苯)的结构与苯类似,B、N原子杂化方式都为sp2,故C正确;
D.已知2px和2py是兼并轨道,能量相同,故B原子由时,仍然处于基态,并未形成激发态,也不能形成发射光谱,故D错误。
答案选C。
11.D
【详解】A.氨气的中心N原子有1对孤电子对、价层电子对数为4,发生sp3杂化,则其VSEPR模型为 ,A错误;
B.As的原子序数为33,属于主族元素,由构造原理可知电子排布为1s22s22p63s23p63d104s24p3,所以As原子的简化电子排布式为:[Ar]3d104s24p3,B错误;
C.由于p轨道的电子云轮廓是哑铃形,故p-pσ键电子云轮廓图应为 ,C错误;
D.锰为25号元素,基态原子价层电子轨道表示式:,D正确;
故选D。
12.C
【分析】同一周期主族元素W、Z、X、Y原子序数依次增大,由阴离子的结构可知,阴离子中W、Z、X、Y形成共价键的数目分别为4、2、4、1,X原子的最外层电子数是W原子的次外层电子数的3倍,则W为B元素、Z为C元素、X为O元素、Y为F元素。
【详解】A.碳元素位于元素周期表第2周期ⅣA族,故A错误;
B.由阴离子的结构可知,阴离子中硼原子的价层电子对数为4,分子的VSEPR模型为四面体形,故B错误;
C.由阴离子的结构可知,阴离子中具有空轨道的硼原子与具有孤对电子的氟离子形成配位键,故C正确;
D.氟元素的非金属性强,只有正化合价,不存在最高价氧化物对应水化物,故D错误;
故选C。
13.C
【详解】A.石墨烯是一种由单层碳原子构成的单质,不是化合物,故A错误;
B.石墨烯是碳原子单层片状新材料,其中每个C周围形成3个C-C键,每个C-C键被2个C原子共用,所以碳原子与键数目之比为2:3,故B错误;
C.石墨烯中的碳原子与相邻碳原子的键角为,氧化石墨烯中1个碳原子连4个碳原子且形成四面体结构,键角接近,所以键角大小:α>β,故C正确;
D.氧化石墨烯中的氧原子与水中的氢原子、氧化石墨烯中的氢原子与水中的氧原子都可以形成氢键,所以在水中的溶解度:石墨烯<氧化石墨烯,故D错误;
故答案为:C。
14.D
【详解】A.根据图示,该过程为丙烯和氢气在催化剂作用下发生加成反应生成丙烷,故A正确;
B.丙烯分子结构不对称,丙烯为极性分子,故B正确;
C.该过程中有非极性键H-H键断裂,故C正确;
D.中的价电子数与配体提供的孤电子数共有14个电子,配体提供4个电子,则的价电子数为10,所以化合价为+1价,故D错误;
选D。
15.C
【详解】A.NCl3的价电子对数为3+=4,孤电子对数为1,为三角锥形,属于极性分子,SiCl4为正四面体形,为非极性分子,故A错误;
B.NCl3和NH3中心原子的价电子对数均为3+=4,因此NCl3和NH3中的N均为sp3杂化,故B错误;
C.四氯化硅为共价化合物, SiCl4的电子式为:,氯原子和硅原子都达到8个电子,故C正确;
D.NH4Cl不能与水形成氢键,故D错误。
答案选C。
16.(1)
(2)BC
(3)与N相连的H带正电,与B相连的H带负电,两种H之间存在相互作用
(4)取少量反应后的溶液于试管,加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸
【详解】(1)极易发生水解生成和,反应的化学方程式:;乙硼烷与试剂X反应制备硼氢化钠,且符合原子经济性反应,发生的化学方程式为:试剂X的化学式为; 与反应制备硼氢化钠的化学方程式:。
答案为:;;。
(2)A. 反应①中氢气的化合价发生变化为氧化还原反应,其中被还原,故错误;
B. 氨硼烷与水分子间形成氢键,溶解度增大相同条件下在水中的溶解度:氨硼烷乙烷,故正确;
C. 是一种一元弱酸,可以与甲醇反应酯化反应H3BO3+3CH3OH→B(OCH3)3+3H2O,生成为无机酸酯,故正确;
D. 氮化硼(BN)晶体有多种相结构,六方氮化硼结构与石墨相似,熔点高,故错误。
答案为:BC。
(3)氮氢键中电子对偏向氮,H带正电,硼氢键中电子对偏向氢,H带负电,两种H之间存在相互作用
答案为:与N相连的H带正电,与B相连的H带负电,两种H之间存在相互作用。
(4)氨硼烷和水发生反应,产生氢气,发生的反应为:,检验该反应后的溶液中阳离子的方法为:取少量反应后的溶液于试管,加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸。
答案为:取少量反应后的溶液于试管,加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸。
17.(1)D
(2)3
(3) 直线形 发射
(4) 孤电子对 sp3
【详解】(1)基态氮原子的能量最低,能量越高的轨道中电子个数越多,原子能量越高,依据图示可知,A为基态氮原子,能量最低,B、C、D为激发态原子,而D中能量较高的轨道中电子数最多,所以能量最高的是D;
(2)同一周期主族元素从左向右第一电离能呈增大趋势,第IIA、VA族元素的第一电离能比同周期相邻元素第一电离能大,因此第二周期主族元素中,第一电离能在B和N之间的元素有Be、C、O三种元素;
(3)NaN3的阴离子为,其中心原子价层电子对数为,无孤电子对,采取sp杂化,空间构型为直线形;电子从激发态跃迁到低能级的激发态或基态,以光的形式释放能量,Na在空气中燃烧发出黄色火焰用光谱仪摄取的光谱为发射光谱;
(4)B原子形成3个B-H键,B原子有空轨道,氨分子中N原子有1对孤电子对,B与N之间形成配位键,氮原子提供孤电子对,硼原子提供空轨道;在BH3 NH3中B原子形成3个B-H键,还形成1个配位键,杂化轨道数目为4,采取sp3杂化。
18.(1) 充电
(2) 大于 四面体形 sp2 2
(3)B失去2p能级的电子,该能级电子的能量比Be失去的2s能级电子的能量高
(4)F的电负性强于H,HOSO2CF3中羟基的极性大于HOSO2CH3
【详解】(1)已知Fe是26号元素,结合能级构造原理可知,基态铁原子的价层电子排布图为。LiFePO4的结构如图A所示,锂离子电池充放电过程伴随A和B相互转化,则A→B即LiFePO4-e-=FePO4+Li+的过程,发生氧化反应,且LiFePO4是新型锂离子电池的正极材料,则A→B为充电过程。故答案为:;充电;
(2)①中中心原子所含孤电子对数为0,中心原子所含孤电子对数为=2,孤电子对之间的斥力大于成键电子对之间斥力,的键角大于的键角。原子价层电子对数为3+=4,中心原子为sp3杂化,的NSEPR模型为四面体形。故答案为:大于;四面体形;
②Htrz分子为平面结构,N原子的杂化轨道类型为sp2,连接氢原子的氮原子在形成Htrz分子中的大π键时提供的电子数是2。故答案为:sp2;2;
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是B失去2p能级的电子,该能级电子的能量比Be失去的2s能级电子的能量高。故答案为:B失去2p能级的电子,该能级电子的能量比Be失去的2s能级电子的能量高;
(4)HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是F的电负性强于H,HOSO2CF3中羟基的极性大于HOSO2CH3。故答案为:F的电负性强于H,HOSO2CF3中羟基的极性大于HOSO2CH3。
19.(1)B
(2) NaF与为离子晶体,为分子晶体,故的熔点低,的半径比的半径小,中离子键更强,熔点更高 正四面体
(3) 非金属性 第六周期IA族 元素在地壳中含量
(4)
【详解】(1)各微粒失去1个电子,A为基态Al原子第一电离能,B为激发态Al原子第一电离能,而C为Al的第二电离能,D为第三电离能,Al的第三电离能>第二电离能>第一电离能,基态的第一电离能大于激发态的第一电离能,故最外层电离出一个电子所需能量最小的是B,故选:B;
(2)①NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,MgF2中离子键更强,熔点更高;
②SiF4分子中Si原子成4个Si-F键,没有孤对电子,杂化方式为sp3,故SiF4分子空间结构为正四面体,键角为109°28′;
(3)①图A中数值表示电负性,数值越大,则该元素的非金属性越强,非金属性强的单质可以将非金属性弱的单质置换出来,说明O、F两元素该性质强弱的化学方程式为:2F2+2H2O=4HF+O2;
②由图B结构可知,元素第一电离能越低,元素位置越低,整个周期表中位置最低的元素应位于第六周期IA族(放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,为N元素,则该元素原子核外电子排布式为1s22s22p3;
③图C表示的意义是元素在地壳中含量;
(4)由乙硼烷分子中氢桥键()及四元环结构可知,一个B形成4个共价键,丁硼烷()分子中存在4个氢桥键且有两个五元环,则在2个B之间会存在1个B-B键,3个B、2个氢形成五元环,结构为:。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、选择题
1.下列反应的离子方程式正确的是
A.硝酸钡溶液中通入SO2:Ba2++SO2+H2O=BaSO3↓+2H+
B.Ca(HCO3)2溶液中加少量NaOH溶液:Ca2+++OH-=CaCO3↓+H2O
C.饱和Na2CO3溶液中通入过量CO2:+CO2+H2O=2
D.硫酸铜溶液中加过量浓氨水:Cu2++2NH3 H2O=Cu(OH)2↓+2
2.下列化学用语的表达错误的是
A.用电子式表示K2S的形成:
B.基态硫原子价电子排布图(轨道表示式)为
C.用电子云轮廓图表示H-H的s-sσ键形成的示意图:
D.化合物中铁的化合价为+2价
3.某种食品膨松剂由原子序数依次增大的、、、五种主族元素组成。五种元素分别处于三个短周期,、同主族,、、的原子序数之和与的原子序数相等,原子的最外层电子数是原子的一半。下列说法正确的是
A.最高正价:Y
C.、、只能形成共价化合物
D.工业上常用热还原法制取Y的单质
4.下列有关物质结构与性质的说法中,错误的是
A.在中的溶解性:
B.沸点:
C.酸性:
D.利用超分子特征,“杯酚”可将和分离
5.是一种优良的蚀刻气体。均可用于制备,用制备的反应为:。已知。下列说法正确的是
A.第一电离能: B.的电子式:
C.的空间构型为平面正三角形 D.水溶液呈弱碱性
6.二氯化二硫是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用浸润)中通入。已知:常温下遇水易水解,并产生能使品红裉色的气体。下列说法错误的是
A.分子中所有原子均满足8电子结构
B.中原子的杂化类型为杂化
C.用浸润可加快反应速率,体现相似相溶原理
D.与反应的化学方程式可能为:
7.一种用于合成治疗免疫疾病药的物质,其结构如图所示,其中X、Y、Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是
A.非金属性:Z>Y>Q
B.简单氢化物的沸点:Q>Z
C.WZX与WXQ均是强电解质,水溶液之间可以发生复分解反应
D.原子序数为82的元素与Q位于同一主族
8.氢键对生命活动具有重要意义,DNA中四种碱基通过氢键配对方式如下图(~代表糖苷键)。下列说法错误的是
A.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
B.鸟嘌呤分子中2号N原子的杂化类型为sp3
C.氢键的作用能较小,在DNA解旋和复制时容易破坏和形成
D.羊毛织品水洗后变形与氢键有关
9.W、X、Z、Q、Y为原子序数依次增大的短周期主族元素,期内层电子数之和为18,最外层电子数之和为28,它们所形成的阴离子具有很高的亲水性,可以作为能源材料中的电解质,该离子结构如图所示。下列说法正确的是
A.Y离子的VSEPR模型为四面体 B.原子半径:Y>Z>W
C.电负性:X
A.基态原子未成对电子数:B
C.分子中B和N的杂化方式相同且为sp2杂化
D.B原子由时,形成发射光谱
11.下列化学用语表达正确的是
A.NH3的VSEPR模型:
B.As原子的简化电子排布式:[Ar]4s24p3
C.p-p σ键电子云轮廓图:
D.基态Mn原子价电子轨道表示式:
12.同一周期主族元素W、Z、X、Y原子序数依次增大,X原子的最外层电子数是W原子的次外层电子数的3倍,由四种元素原子形成的阴离子结构如图,下列说法正确的是
A.Z位于元素周期表第2周期ⅥA族 B.以W为中心原子形成的VSEPR模型为平面三角形
C.该阴离子中含有配位键 D.最高价氧化物对应水化物的酸性:Y>Z>W
13.石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,破坏平面结构转化为如图所示的氧化石墨烯。下列说法正确的是
A.石墨烯是一种新型化合物
B.石墨烯中,碳原子与键数目之比为1:3
C.键角大小:
D.在水中的溶解度:石墨烯>氧化石墨烯
14.1965年,科学家合成出了一种(铑)的配合物作为催化剂,实现了温和条件下烯烃加氢,该反应的催化机理如图所示,其中Ph代表苯基,表示中心体的价电子数与配体提供的孤电子数共有14个电子。已知:Rh(铑)与Co(钻)同族,下列说法错误的是
A.该过程的总反应为
B.为极性分子
C.该过程中有非极性键的断裂
D.中的化合价为+2价
15.NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:
下列说法正确的是
A.NCl3和SiCl4均为极性分子 B.NCl3和NH3中的N均为sp2杂化
C.SiCl4中原子均满足8电子稳定结构 D.NH4Cl和NH3均能与H2O形成氢键
二、填空题
16.硼单质及其化合物有重要的应用。
(1)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷、丁硼烷、己硼烷等。极易发生水解生成和,请写出反应的化学方程式: ;其中乙硼烷生产中可用来与试剂X反应制备硼氢化钠,且符合原子经济性反应,试剂X的化学式为 。同时硼氢化钠的另一种制备方法为与试剂X反应,写出该反应的化学方程式: 。
(2)下列说法正确的是_______。
A.反应①为氧化还原反应,其中被氧化
B.相同条件下在水中的溶解度:氨硼烷乙烷
C.是一种一元弱酸,可以与甲醇反应生成为无机酸酯
D.氮化硼(BN)晶体有多种相结构,六方氮化硼结构与石墨相似,熔点低
(3)氨硼烷含氢量高、热稳定性好,是一种有潜力的固体储氢材料。氨硼烷分子间存在“双氢键”使氨硼烷的熔点明显升高。“双氢键”能形成的原因是 。
(4)在一定条件下氨硼烷和水发生反应,产生氢气。其中溶液中的阴离子为。设计实验检验该反应后的溶液中阳离子 。
17.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是_______(填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有 种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为 ,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为 (填“发射”或“吸收”)光谱。
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供 ,在BH3·NH3中B原子的杂化方式为 。
三、解答题
18.锂离子电池的开发与应用是新能源汽车走向实用的关键。
(1)LiFePO4是新型锂离子电池的正极材料,基态铁原子的价层电子排布图为 。LiFePO4的结构如图A所示,锂离子电池充放电过程伴随A和B相互转化,则A→B为 过程(填“充电”或“放电”)。
(2)铁的一种配合物的化学式为[Fe(Htrz)3](ClO4)2,配体Htrz为三氮唑()。
①的键角 (填“等于”大于”或“小于”)的键角。的NSEPR模型为 。
②Htrz分子为平面结构,N原子的杂化轨道类型为 ,连接氢原子的氮原子在形成Htrz分子中的大π键时提供的电子数是 。
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是 。
(4)LiAsF6、LiPF6、等物质常用作电池电解液的溶质,HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是 。
19.回答以下关于元素及其化合物的问题。
(1)下列状态的铝中,最外层电离出一个电子所需要能量最小的是___________(填标号)。
A. B.
C. D.
(2)相同压强下,部分元素氟化物的熔点见下表:
氟化物 NaF
熔点/℃ 1266 1534 183
①试解释上表中氟化物熔点差异的原因: 。
②分子的空间构型为 ,中键间的键角是 。
(3)元素周期表有多种形式。下图分别是三种不同形式元素周期表的局部区域。
①图A中,数值越大,则该元素的 (填“金属性”或“非金属性”)越强。写出能说明O、F两元素该性质强弱的化学方程式 。
②根据图B预测,整个周期表中位置最低的元素应位于 (放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,则该元素原子核外电子排布式为 。
③图C表示的意义是 。
(4)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷()、丁硼烷()等。乙硼烷的结构式如图。分子中B原子通过氢桥键()形成一个四元环。丁硼烷()分子中存在4个氢桥键且有两个五元环,写出其结构式 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【详解】A.硝酸钡溶液中通入SO2,溶液显酸性,酸性溶液中硝酸根氧化二氧化硫,得不到亚硫酸钡,A错误;
B.Ca(HCO3)2溶液中加少量NaOH溶液,生成碳酸钙、碳酸氢钠和水:Ca2+++OH-=CaCO3↓+H2O,B正确;
C.饱和Na2CO3溶液中通入过量CO2,生成碳酸氢钠沉淀:2Na+++CO2+H2O=2NaHCO3↓,C错误;
D.硫酸铜溶液中加过量浓氨水生成络离子:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,D错误;
答案选B。
2.D
【详解】A.K2S是离子化合物,用电子式表示K2S的形成:,故A正确;
B.S是16号元素,基态硫原子价电子排布图(轨道表示式)为,故B正确;
C.H-H的s-sσ键形成的示意图为:,故C正确;
D.化合物的基本结构单位为Fe2S,其中铁的化合价为+3价,故D错误;
故选D。
3.B
【分析】R、W、X、Y、Z为原子序数依次增大的五种主族元素,分别处于三个短周期,X、Z同主族,则X只能位于第二周期,Z位于第三周期,R一定位于第一周期,R为H元素,Y原子的最外层电子数是Z原子的一半,所以Z原子的最外层电子数一定是偶数,可能是6、4、2,若Z原子最外层电子数为6,则为S,Y为Al,X为O;若Z原子最外层电子数为4,则Z为Si、Y为Mg、X为C;若Y原子最外层电子数为2,则Z为Mg、Y为Na、X为Be ,又R、W、X的原子序数之和与Z的原子序数相等,且原子序数依次增大可知,只有Z为S,Y为Al,X为O,符合题意,根据以上分析,R为H,W为N,X为O,Y为Al,Z为S。
【详解】A.W为N,X为O,Y为Al,O无最高正价,故A错误;
B.R为H,W为N,X为O,Y为Al,Z为S,原子半径的大小关系为:,故B正确;
C.、、既能形成离子化合物,如硝酸铵,也能形成共价化合物,如硝酸,故C错误;
D.工业上常用电解法制取Al,故D错误;
故答案为:B。
4.B
【详解】A.为非极性分子,为极性分子,故在中的溶解性:,A正确;
B.可形成分子内氢键,可形成分子间氢键,故沸点,B错误;
C.吸电子能力F>Cl>H,故酸性,C正确;
D.将和的混合物加入一种空腔大小适配C60的“杯酚”中可以分离出C60,D正确;
故选B。
5.A
【详解】A.F、N、O位于第二周期,同一周期主族元素从左往右,第一电离能呈增大趋势,但N的2p轨道处于半满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能,故A正确;
B.HF为共价化合物,F、H原子间共用一对电子,HF中F原子最外层电子数为8,其电子式为,故B错误;
C.NF3中氮原子价成电子对数为,VSEPR模型为四面体,含一对孤电子对,其空间构型为三角锥形,故C错误;
D.水解常数,F-水解常数,即水解程度大于F-水解程度,则NH4F水溶液呈弱酸性,故D错误;
故答案为:A。
6.B
【详解】A.分子中S原子连接2个共价键,Cl原子连接1个共价键,分子中所有原子均满足8电子结构,故A正确;
B.S2Cl2分子中每个S原子价层电子对数=2+2=4,所以采取sp3杂化,故B错误;
C.S单质和是非极性分子,由相似相溶原理可知S在中的溶解度较大,故C正确;
D.常温下,遇水易水解,并产生能使品红褪色的气体为二氧化硫,在反应过程中硫元素由+1价一部分升高到+4价(生成SO2),中Cl元素化合价为 1价,不能再得电子,只能是一部分S元素化合价降低到0价(生成S),所以反应的化学方程式可能为,故D正确;
故选B。
7.C
【分析】X、Y、Z、Q、W为1~ 20号元素且原子序数依次增大,Z与Q同主族,由结构可知:Z、Q的最外层有6个电子, Z为O元素,Q为S元素;Q和W的简单离子具有相同的电子层结构,W的原子序数最大,形成+1价阳离子,则W为K元素;Y形成4个共价键,X只能形成1个共价键,结合原子序数可知X为H元素,Y为C元素,然后根据元素周期律及物质的性质加以分析。
【详解】根据上述分析可知:X是H,Y是C,Z是O,Q是S,W是K元素。
A.O、S是同一主族元素,原子序数越大元素的非金属性就越弱,所以非金属性:Z>Q;元素的非金属性越强,其对应的最高价氧化物对应的水化物的酸性就越强。由于酸性:H2SO4>H2CO3,所以非金属性:Q >Y,故三种元素的非金属性:Z(O)>Q(S)>Y(C),A错误;
B.Z是O,Q是S,二者是同一主族元素,二者形成的简单氢化物分别是H2O、H2S,由于H2O分子之间除存在分子间作用力,还存在氢键,增加了分子之间的吸引作用,而H2S分子之间只存在分子间作用力,故简单氢化物的沸点:Z(H2O)>Q(H2S),B错误;
C.WZX是KOH,KOH是一元强碱;WXO是KHS是酸式盐,也是强电解质,二者在溶液中发生反应:KOH+KHS=K2S+H2O,二者发生的是复分解反应,C正确;
D.原子序数为82的元素是Pb元素,属于第ⅣA元素,而S是第ⅥA元素,因此82号元素与Q不是位于同一主族的元素,D错误;
故合理选项是C。
8.B
【详解】A.鸟嘌呤与胞嘧啶之间有三个氢键,腺嘌呤与胸腺嘧啶之间有两个个氢键,鸟嘌呤与胞嘧啶之间的相互作用更强,故A正确;
B.由鸟嘌呤结构可知,2号N原子有2个键和1个孤电子对,所以杂化方式为sp2,故B错误;
C.氢键的强度小,在DNA解旋和复制时断裂和形成,故C正确;
D.羊毛织品中主要成分为蛋白质,蛋白质中含有大量氢键,水洗时会破坏其中部分氢键,使得织品变形,故D正确;
故选B。
9.A
【分析】W、X、Z、Q、Y为原子序数依次增大的短周期主族元素,其内层电子数之和为18,最外层电子数之和为28。从图中可以看出,W元素的化合价为4价,表明其最外层有4个电子,则W为碳;Q形成1个共价键,则Q应为氟;Y形成6个共价键,则最外层有6个电子,其为S;Z形成2个共价键,则Z为氧;X形成2个共价键,又获得1个电子,所以X的最外层电子数为5,其为氮元素。从而得出W、X、Z、Q、Y分别为C、N、O、F、S。
【详解】A.根据该离子结构可知,S的价层电子对数为4,则其VSEPR模型为四面体,A正确;
B.由分析可知,W、Z、Y分别为C、O、S,电子层越多半径越大,同周期越靠左半径越大,则原子半径:Y>W>Z,B错误;
C.由分析可知,X、Q、Y分别为N、F、S,其中N的电负性大于S,C错误;
D.该阴离子中,S-N-S的中心N原子最外层存在孤电子对,对成键电子有排斥作用,所以∠S-N-S小于180°,D错误;
故选A。
10.C
【详解】A.B、C、N、O原子价电子排布式依次为2s22p1、2s22p2、2s22p3、2s22p4,未成对电子数依次是1、2、3、2,基态原子未成对电子数:B<C=O<N,故A错误;
B.B的价层电子对个数是3,B核外三个电子全部成键,则形成大π键的电子全部由N提供,故B错误;
C.B3N3H6(无机苯)的结构与苯类似,B、N原子杂化方式都为sp2,故C正确;
D.已知2px和2py是兼并轨道,能量相同,故B原子由时,仍然处于基态,并未形成激发态,也不能形成发射光谱,故D错误。
答案选C。
11.D
【详解】A.氨气的中心N原子有1对孤电子对、价层电子对数为4,发生sp3杂化,则其VSEPR模型为 ,A错误;
B.As的原子序数为33,属于主族元素,由构造原理可知电子排布为1s22s22p63s23p63d104s24p3,所以As原子的简化电子排布式为:[Ar]3d104s24p3,B错误;
C.由于p轨道的电子云轮廓是哑铃形,故p-pσ键电子云轮廓图应为 ,C错误;
D.锰为25号元素,基态原子价层电子轨道表示式:,D正确;
故选D。
12.C
【分析】同一周期主族元素W、Z、X、Y原子序数依次增大,由阴离子的结构可知,阴离子中W、Z、X、Y形成共价键的数目分别为4、2、4、1,X原子的最外层电子数是W原子的次外层电子数的3倍,则W为B元素、Z为C元素、X为O元素、Y为F元素。
【详解】A.碳元素位于元素周期表第2周期ⅣA族,故A错误;
B.由阴离子的结构可知,阴离子中硼原子的价层电子对数为4,分子的VSEPR模型为四面体形,故B错误;
C.由阴离子的结构可知,阴离子中具有空轨道的硼原子与具有孤对电子的氟离子形成配位键,故C正确;
D.氟元素的非金属性强,只有正化合价,不存在最高价氧化物对应水化物,故D错误;
故选C。
13.C
【详解】A.石墨烯是一种由单层碳原子构成的单质,不是化合物,故A错误;
B.石墨烯是碳原子单层片状新材料,其中每个C周围形成3个C-C键,每个C-C键被2个C原子共用,所以碳原子与键数目之比为2:3,故B错误;
C.石墨烯中的碳原子与相邻碳原子的键角为,氧化石墨烯中1个碳原子连4个碳原子且形成四面体结构,键角接近,所以键角大小:α>β,故C正确;
D.氧化石墨烯中的氧原子与水中的氢原子、氧化石墨烯中的氢原子与水中的氧原子都可以形成氢键,所以在水中的溶解度:石墨烯<氧化石墨烯,故D错误;
故答案为:C。
14.D
【详解】A.根据图示,该过程为丙烯和氢气在催化剂作用下发生加成反应生成丙烷,故A正确;
B.丙烯分子结构不对称,丙烯为极性分子,故B正确;
C.该过程中有非极性键H-H键断裂,故C正确;
D.中的价电子数与配体提供的孤电子数共有14个电子,配体提供4个电子,则的价电子数为10,所以化合价为+1价,故D错误;
选D。
15.C
【详解】A.NCl3的价电子对数为3+=4,孤电子对数为1,为三角锥形,属于极性分子,SiCl4为正四面体形,为非极性分子,故A错误;
B.NCl3和NH3中心原子的价电子对数均为3+=4,因此NCl3和NH3中的N均为sp3杂化,故B错误;
C.四氯化硅为共价化合物, SiCl4的电子式为:,氯原子和硅原子都达到8个电子,故C正确;
D.NH4Cl不能与水形成氢键,故D错误。
答案选C。
16.(1)
(2)BC
(3)与N相连的H带正电,与B相连的H带负电,两种H之间存在相互作用
(4)取少量反应后的溶液于试管,加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸
【详解】(1)极易发生水解生成和,反应的化学方程式:;乙硼烷与试剂X反应制备硼氢化钠,且符合原子经济性反应,发生的化学方程式为:试剂X的化学式为; 与反应制备硼氢化钠的化学方程式:。
答案为:;;。
(2)A. 反应①中氢气的化合价发生变化为氧化还原反应,其中被还原,故错误;
B. 氨硼烷与水分子间形成氢键,溶解度增大相同条件下在水中的溶解度:氨硼烷乙烷,故正确;
C. 是一种一元弱酸,可以与甲醇反应酯化反应H3BO3+3CH3OH→B(OCH3)3+3H2O,生成为无机酸酯,故正确;
D. 氮化硼(BN)晶体有多种相结构,六方氮化硼结构与石墨相似,熔点高,故错误。
答案为:BC。
(3)氮氢键中电子对偏向氮,H带正电,硼氢键中电子对偏向氢,H带负电,两种H之间存在相互作用
答案为:与N相连的H带正电,与B相连的H带负电,两种H之间存在相互作用。
(4)氨硼烷和水发生反应,产生氢气,发生的反应为:,检验该反应后的溶液中阳离子的方法为:取少量反应后的溶液于试管,加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸。
答案为:取少量反应后的溶液于试管,加入浓氢氧化钠溶液,加热,用湿润的红色石蕊试纸。
17.(1)D
(2)3
(3) 直线形 发射
(4) 孤电子对 sp3
【详解】(1)基态氮原子的能量最低,能量越高的轨道中电子个数越多,原子能量越高,依据图示可知,A为基态氮原子,能量最低,B、C、D为激发态原子,而D中能量较高的轨道中电子数最多,所以能量最高的是D;
(2)同一周期主族元素从左向右第一电离能呈增大趋势,第IIA、VA族元素的第一电离能比同周期相邻元素第一电离能大,因此第二周期主族元素中,第一电离能在B和N之间的元素有Be、C、O三种元素;
(3)NaN3的阴离子为,其中心原子价层电子对数为,无孤电子对,采取sp杂化,空间构型为直线形;电子从激发态跃迁到低能级的激发态或基态,以光的形式释放能量,Na在空气中燃烧发出黄色火焰用光谱仪摄取的光谱为发射光谱;
(4)B原子形成3个B-H键,B原子有空轨道,氨分子中N原子有1对孤电子对,B与N之间形成配位键,氮原子提供孤电子对,硼原子提供空轨道;在BH3 NH3中B原子形成3个B-H键,还形成1个配位键,杂化轨道数目为4,采取sp3杂化。
18.(1) 充电
(2) 大于 四面体形 sp2 2
(3)B失去2p能级的电子,该能级电子的能量比Be失去的2s能级电子的能量高
(4)F的电负性强于H,HOSO2CF3中羟基的极性大于HOSO2CH3
【详解】(1)已知Fe是26号元素,结合能级构造原理可知,基态铁原子的价层电子排布图为。LiFePO4的结构如图A所示,锂离子电池充放电过程伴随A和B相互转化,则A→B即LiFePO4-e-=FePO4+Li+的过程,发生氧化反应,且LiFePO4是新型锂离子电池的正极材料,则A→B为充电过程。故答案为:;充电;
(2)①中中心原子所含孤电子对数为0,中心原子所含孤电子对数为=2,孤电子对之间的斥力大于成键电子对之间斥力,的键角大于的键角。原子价层电子对数为3+=4,中心原子为sp3杂化,的NSEPR模型为四面体形。故答案为:大于;四面体形;
②Htrz分子为平面结构,N原子的杂化轨道类型为sp2,连接氢原子的氮原子在形成Htrz分子中的大π键时提供的电子数是2。故答案为:sp2;2;
(3)Be和B的第一电离能I1(Be)>I1(B)的原因是B失去2p能级的电子,该能级电子的能量比Be失去的2s能级电子的能量高。故答案为:B失去2p能级的电子,该能级电子的能量比Be失去的2s能级电子的能量高;
(4)HOSO2CF3和HOSO2CH3在水溶液中酸性较强的是HOSO2CF3,理由是F的电负性强于H,HOSO2CF3中羟基的极性大于HOSO2CH3。故答案为:F的电负性强于H,HOSO2CF3中羟基的极性大于HOSO2CH3。
19.(1)B
(2) NaF与为离子晶体,为分子晶体,故的熔点低,的半径比的半径小,中离子键更强,熔点更高 正四面体
(3) 非金属性 第六周期IA族 元素在地壳中含量
(4)
【详解】(1)各微粒失去1个电子,A为基态Al原子第一电离能,B为激发态Al原子第一电离能,而C为Al的第二电离能,D为第三电离能,Al的第三电离能>第二电离能>第一电离能,基态的第一电离能大于激发态的第一电离能,故最外层电离出一个电子所需能量最小的是B,故选:B;
(2)①NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,MgF2中离子键更强,熔点更高;
②SiF4分子中Si原子成4个Si-F键,没有孤对电子,杂化方式为sp3,故SiF4分子空间结构为正四面体,键角为109°28′;
(3)①图A中数值表示电负性,数值越大,则该元素的非金属性越强,非金属性强的单质可以将非金属性弱的单质置换出来,说明O、F两元素该性质强弱的化学方程式为:2F2+2H2O=4HF+O2;
②由图B结构可知,元素第一电离能越低,元素位置越低,整个周期表中位置最低的元素应位于第六周期IA族(放射性元素除外)。图B所示第二周期主族元素中,某元素该性质反常偏高,为N元素,则该元素原子核外电子排布式为1s22s22p3;
③图C表示的意义是元素在地壳中含量;
(4)由乙硼烷分子中氢桥键()及四元环结构可知,一个B形成4个共价键,丁硼烷()分子中存在4个氢桥键且有两个五元环,则在2个B之间会存在1个B-B键,3个B、2个氢形成五元环,结构为:。
答案第1页,共2页
答案第1页,共2页
