2023-2024学年九年级化学人教版下册第九单元溶液单元检测试题(无答案)
文档属性
| 名称 | 2023-2024学年九年级化学人教版下册第九单元溶液单元检测试题(无答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 126.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-28 00:00:00 | ||
图片预览

文档简介
【单元检测】
第九单元《溶液》单元检测试题
湖北省石首市文峰初级中学 刘涛(正高级教师)
说明:1.全卷满分50分,考试时间42分钟。
2.请将答案写在答题卡上,否则不给分。
3.本卷可能用到的相对原子质量:H﹣1、C﹣12、O﹣16、S﹣32、Fe﹣56、Cu﹣64。
一、选择题(共13个题,共18分,1~8题每题1分,9~13题每题2分,在每题有四个选项,只有一项符合题目要求)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案
1.下列物质不能在水中形成溶液的是( )
A.白糖 B.食盐 C.醋酸 D.面粉
2.下列有关NaCl溶液的说法,错误的是( )
A.NaCl溶液是均一的、稳定的混合物
B .将植物油加入NaCl溶液中并搅拌,静置后会分层
C.NaCl饱和溶液中不能再溶解其它任何物质
D.NaCl溶液是由NaCl和水组成的
3.下列关于溶液的说法正确的是( )
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
4.用溶质质量分数为36%的浓盐酸配制一定浓度的稀盐酸时,不会用到的仪器是( )
5.配制50g质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.铁架台 D.玻璃棒
6.将下列固体分别放入水中,可使溶液温度明显降低的是( )
A.硝酸铵 B.熟石灰 C.烧碱 D.食盐
7.下列关于溶液说法不正确的是( )
A.溶液是具有均一性、稳定性的混合物
B.一定温度下,某固态物质的饱和溶液一定不能再溶解其他物质
C.洗涤剂去除油污利用了洗涤剂的乳化功能
D.打开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与压强有关
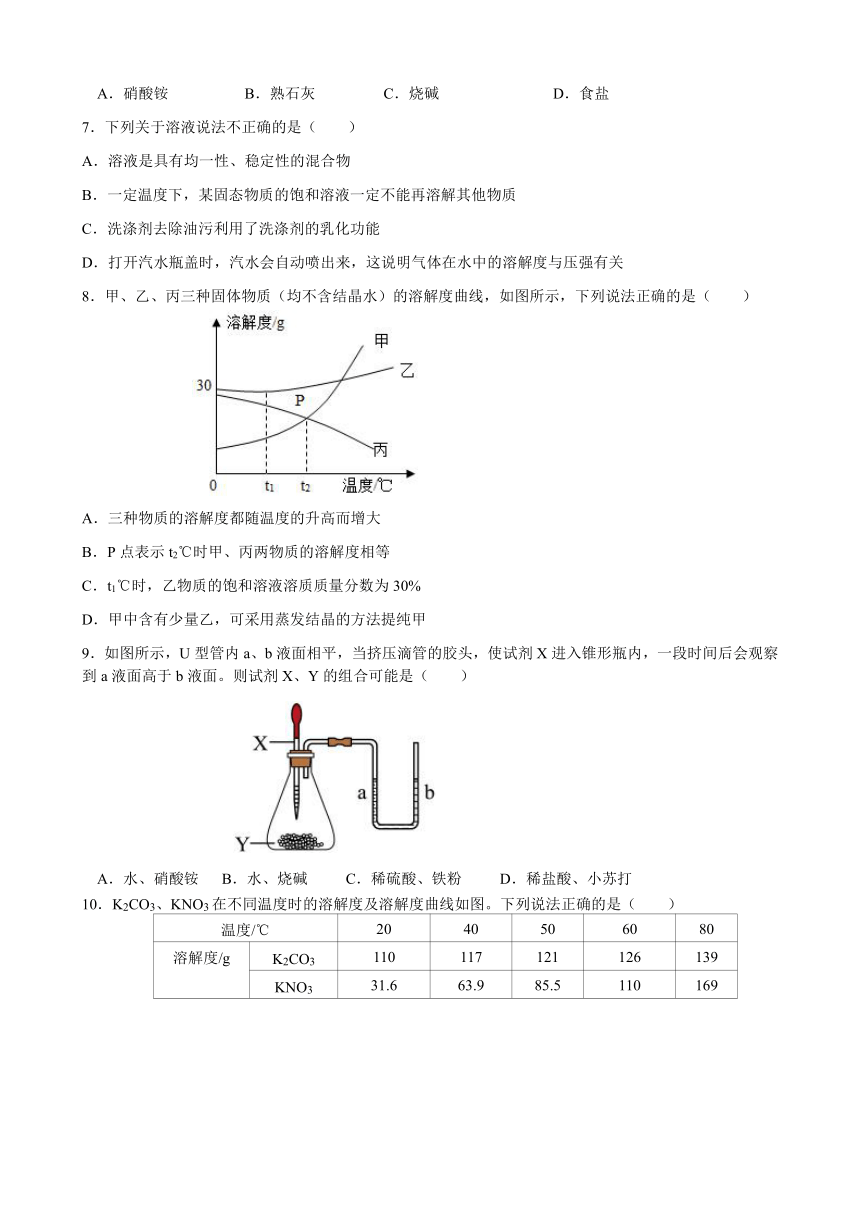
8.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,如图所示,下列说法正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.P点表示t2℃时甲、丙两物质的溶解度相等
C.t1℃时,乙物质的饱和溶液溶质质量分数为30%
D.甲中含有少量乙,可采用蒸发结晶的方法提纯甲
9.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是( )
A.水、硝酸铵 B.水、烧碱 C.稀硫酸、铁粉 D.稀盐酸、小苏打
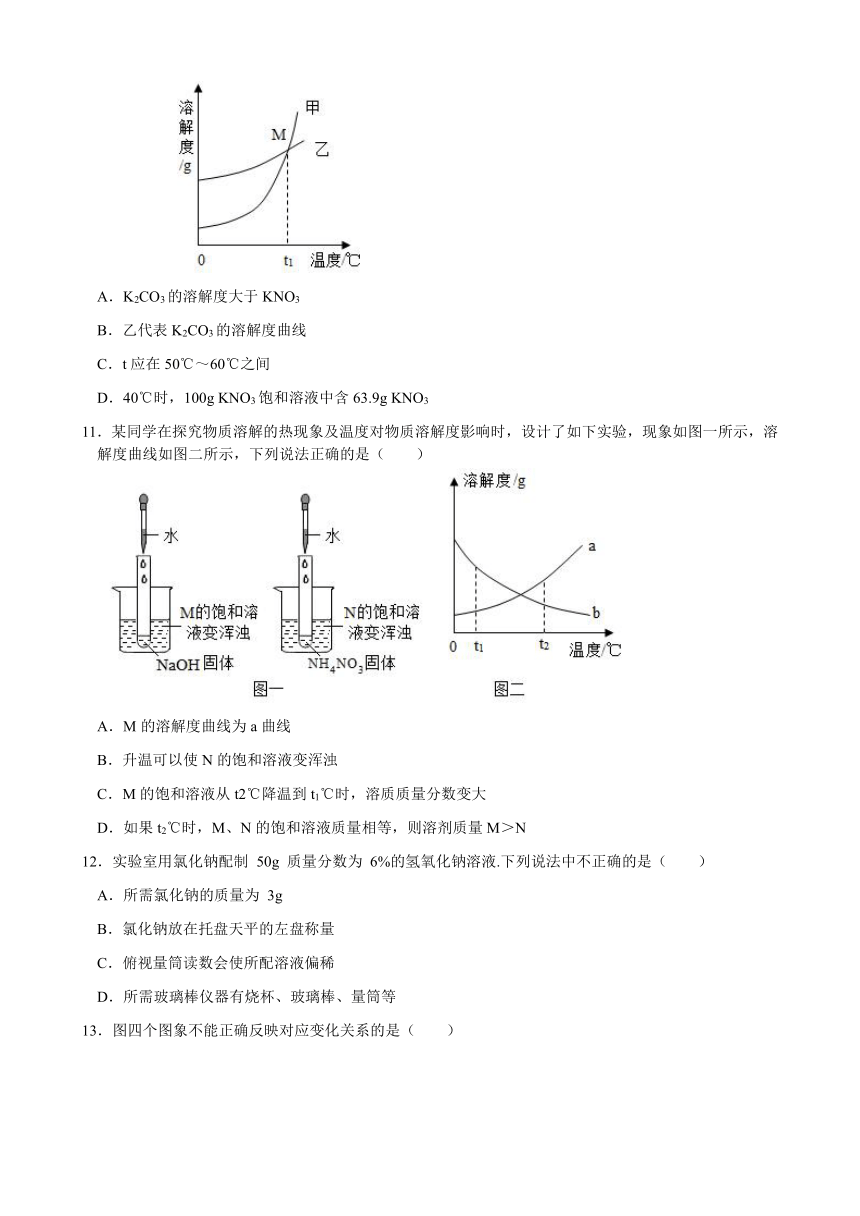
10.K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如图。下列说法正确的是( )
温度/℃ 20 40 50 60 80
溶解度/g K2CO3 110 117 121 126 139
KNO3 31.6 63.9 85.5 110 169
A.K2CO3的溶解度大于KNO3
B.乙代表K2CO3的溶解度曲线
C.t应在50℃~60℃之间
D.40℃时,100g KNO3饱和溶液中含63.9g KNO3
11.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是( )
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
12.实验室用氯化钠配制 50g 质量分数为 6%的氢氧化钠溶液.下列说法中不正确的是( )
A.所需氯化钠的质量为 3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃棒仪器有烧杯、玻璃棒、量筒等
13.图四个图象不能正确反映对应变化关系的是( )
A.把NaOH和NH4NO3固体分别溶于水中
B.分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C.向一定质量硝酸铜和硝酸银的混合溶液中逐渐加入锌粉
D.加热一定质量氯酸钾和二氧化锰的固体混合物
二、非选择题(本题共7个题,共32分)
14.(4分)化学与人类生活、生产活动息息相关,根据所学化学知识回答下列问题:
(1)我国科学家屠呦呦由于对青蒿素的研究取得巨大成就而荣获了诺贝尔奖。她用乙醚代替水成功提取出青蒿素,说明研究青蒿素在不同的 (填“溶质”或“溶剂”)中的溶解性很有价值。
(2)常温下,在密闭容器中的蔗糖溶液里,溶液下半部分的甜度与上半部分的甜度的关系是 (填“相同”或“下半部分高”)。
(3)用洗涤剂洗去餐具上的油污会产生 现象(填“溶解”或“乳化”)。
(4)打开汽水瓶盖时汽水会自动喷出来,这说明气体在水中的溶解度与 有关(填“温度”或“压强”)。
15.(4分)如图是甲、乙、丙三种固体物质的溶解度曲线,根据图示回答:
(1)0℃时,三种物质中溶解度最小的是 。
(2)将甲溶液由A点转变为B点,可采用的方法是 (填一种)。
(3)t2℃时在盛有50g水的烧杯中加入35g丙物质,充分搅拌后所得溶液的质量是 g。
(4)若将t3℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,没有晶体析出的是 物质。
16.(4分)某同学测得B物质的溶解度如表所示:
温度(℃) 0 20 40 60 80
B物质的溶解度(g) 27.6 34.0 40.0 45.5 51.1
(1)根据表中测出的溶解度数据,在答题卡上相应位置画出B物质的溶解度曲线图。
(2)根据图1可知,T= ℃时,C物质的溶解度等于A物质的溶解度。
(3)要使接近饱和的A、B、C三种溶液都变为饱和溶液,可采用的相同方法是 (一种即可)。
(4)30℃时,将C物质的饱和溶液150g,稀释成质量分数为25%的溶液,需要向其中加水 g。
(5)如图2所示:常温下分别向装有适量A、C物质的两支试管里加入等量蒸馏水,充分振荡后,两支试管底部均有未溶解的固体。再将两支试管放入盛有冰水混合物的烧杯中,看到的实验现象是:装C物质的试管中固体增多,装A物质的试管中固体减少。请你对此现象做出解释: 。
17.(5分)为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次 第2次 第3次 第4次 第5次
滴入稀硫酸的质量/g 25 25 25 25 25
生成气体的总质量/g 0.05 m 0.15 0.20 0.20
请完成下列问题:
(1)表中m的值为________;
(2)银、锌合金中银的质量分数为________;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
18.(4分)如表是KNO3、NaCl在不同温度下的溶解度:
温度/℃ 10 20 30 40 50 60 70 80 90
溶解度/g KNO3 20.9 32 45.8 64 85.5 110 138 169 202
NaCl 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39
根据上表信息,完成下列各题
(1)60℃时,KNO3的溶解度为 。
(2)溶解度受温度的影响较大的物质是 。
(3)10℃时,将KNO3和NaCl的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者 后者(填“>”“=”或“<”)。
(4)20℃时,15g NaCl加入到40g水中充分溶解所得溶液的质量为 。
19.(5分)硝酸钾和氯化钾两种物质的溶解度曲线见图1,这两种物质的溶解度见表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指 (填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用 的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t℃,析出晶体的质量关系为:KNO3 KCl(填写“>”“=”或“<”)。
(4)如图2所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是 (填序号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A.①③④ B.②⑤⑥ C.①③⑤ D.②④⑥
(5)60℃时,将45g KCl固体溶解于100g水中,降温至20℃,析出晶体的质量是 。
20.(5分)实验室里配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称 。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 盘(填“左”或“右”)。
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 (填序号)。
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
第九单元《溶液》单元检测试题
湖北省石首市文峰初级中学 刘涛(正高级教师)
说明:1.全卷满分50分,考试时间42分钟。
2.请将答案写在答题卡上,否则不给分。
3.本卷可能用到的相对原子质量:H﹣1、C﹣12、O﹣16、S﹣32、Fe﹣56、Cu﹣64。
一、选择题(共13个题,共18分,1~8题每题1分,9~13题每题2分,在每题有四个选项,只有一项符合题目要求)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案
1.下列物质不能在水中形成溶液的是( )
A.白糖 B.食盐 C.醋酸 D.面粉
2.下列有关NaCl溶液的说法,错误的是( )
A.NaCl溶液是均一的、稳定的混合物
B .将植物油加入NaCl溶液中并搅拌,静置后会分层
C.NaCl饱和溶液中不能再溶解其它任何物质
D.NaCl溶液是由NaCl和水组成的
3.下列关于溶液的说法正确的是( )
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
4.用溶质质量分数为36%的浓盐酸配制一定浓度的稀盐酸时,不会用到的仪器是( )
5.配制50g质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.铁架台 D.玻璃棒
6.将下列固体分别放入水中,可使溶液温度明显降低的是( )
A.硝酸铵 B.熟石灰 C.烧碱 D.食盐
7.下列关于溶液说法不正确的是( )
A.溶液是具有均一性、稳定性的混合物
B.一定温度下,某固态物质的饱和溶液一定不能再溶解其他物质
C.洗涤剂去除油污利用了洗涤剂的乳化功能
D.打开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与压强有关
8.甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,如图所示,下列说法正确的是( )
A.三种物质的溶解度都随温度的升高而增大
B.P点表示t2℃时甲、丙两物质的溶解度相等
C.t1℃时,乙物质的饱和溶液溶质质量分数为30%
D.甲中含有少量乙,可采用蒸发结晶的方法提纯甲
9.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是( )
A.水、硝酸铵 B.水、烧碱 C.稀硫酸、铁粉 D.稀盐酸、小苏打
10.K2CO3、KNO3在不同温度时的溶解度及溶解度曲线如图。下列说法正确的是( )
温度/℃ 20 40 50 60 80
溶解度/g K2CO3 110 117 121 126 139
KNO3 31.6 63.9 85.5 110 169
A.K2CO3的溶解度大于KNO3
B.乙代表K2CO3的溶解度曲线
C.t应在50℃~60℃之间
D.40℃时,100g KNO3饱和溶液中含63.9g KNO3
11.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是( )
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
12.实验室用氯化钠配制 50g 质量分数为 6%的氢氧化钠溶液.下列说法中不正确的是( )
A.所需氯化钠的质量为 3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃棒仪器有烧杯、玻璃棒、量筒等
13.图四个图象不能正确反映对应变化关系的是( )
A.把NaOH和NH4NO3固体分别溶于水中
B.分别向等质量镁和铁中,逐渐加入溶质质量分数相同的稀硫酸至过量
C.向一定质量硝酸铜和硝酸银的混合溶液中逐渐加入锌粉
D.加热一定质量氯酸钾和二氧化锰的固体混合物
二、非选择题(本题共7个题,共32分)
14.(4分)化学与人类生活、生产活动息息相关,根据所学化学知识回答下列问题:
(1)我国科学家屠呦呦由于对青蒿素的研究取得巨大成就而荣获了诺贝尔奖。她用乙醚代替水成功提取出青蒿素,说明研究青蒿素在不同的 (填“溶质”或“溶剂”)中的溶解性很有价值。
(2)常温下,在密闭容器中的蔗糖溶液里,溶液下半部分的甜度与上半部分的甜度的关系是 (填“相同”或“下半部分高”)。
(3)用洗涤剂洗去餐具上的油污会产生 现象(填“溶解”或“乳化”)。
(4)打开汽水瓶盖时汽水会自动喷出来,这说明气体在水中的溶解度与 有关(填“温度”或“压强”)。
15.(4分)如图是甲、乙、丙三种固体物质的溶解度曲线,根据图示回答:
(1)0℃时,三种物质中溶解度最小的是 。
(2)将甲溶液由A点转变为B点,可采用的方法是 (填一种)。
(3)t2℃时在盛有50g水的烧杯中加入35g丙物质,充分搅拌后所得溶液的质量是 g。
(4)若将t3℃时甲、乙、丙三种物质的饱和溶液降温至t1℃,没有晶体析出的是 物质。
16.(4分)某同学测得B物质的溶解度如表所示:
温度(℃) 0 20 40 60 80
B物质的溶解度(g) 27.6 34.0 40.0 45.5 51.1
(1)根据表中测出的溶解度数据,在答题卡上相应位置画出B物质的溶解度曲线图。
(2)根据图1可知,T= ℃时,C物质的溶解度等于A物质的溶解度。
(3)要使接近饱和的A、B、C三种溶液都变为饱和溶液,可采用的相同方法是 (一种即可)。
(4)30℃时,将C物质的饱和溶液150g,稀释成质量分数为25%的溶液,需要向其中加水 g。
(5)如图2所示:常温下分别向装有适量A、C物质的两支试管里加入等量蒸馏水,充分振荡后,两支试管底部均有未溶解的固体。再将两支试管放入盛有冰水混合物的烧杯中,看到的实验现象是:装C物质的试管中固体增多,装A物质的试管中固体减少。请你对此现象做出解释: 。
17.(5分)为了测定某银、锌合金(假设合金中只含银和锌)中银的质量分数,某同学称取20g银锌合金粉末进行实验,现将125g稀硫酸分五次加入合金粉末中,充分反应后测得生成气体的总质量如表所示:
第1次 第2次 第3次 第4次 第5次
滴入稀硫酸的质量/g 25 25 25 25 25
生成气体的总质量/g 0.05 m 0.15 0.20 0.20
请完成下列问题:
(1)表中m的值为________;
(2)银、锌合金中银的质量分数为________;
(3)所用稀硫酸的溶质质量分数是多少?(写出具体计算过程)
18.(4分)如表是KNO3、NaCl在不同温度下的溶解度:
温度/℃ 10 20 30 40 50 60 70 80 90
溶解度/g KNO3 20.9 32 45.8 64 85.5 110 138 169 202
NaCl 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39
根据上表信息,完成下列各题
(1)60℃时,KNO3的溶解度为 。
(2)溶解度受温度的影响较大的物质是 。
(3)10℃时,将KNO3和NaCl的饱和溶液同时升高温度到30℃,所得溶液中溶质的质量分数的大小关系是:前者 后者(填“>”“=”或“<”)。
(4)20℃时,15g NaCl加入到40g水中充分溶解所得溶液的质量为 。
19.(5分)硝酸钾和氯化钾两种物质的溶解度曲线见图1,这两种物质的溶解度见表。
温度/℃ 10 20 30 40 50 60
溶解度/g 甲 20.9 31.6 45.8 63.9 85.5 110
乙 31.0 34.0 37.0 40.0 42.6 45.5
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指 (填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用 的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t℃,析出晶体的质量关系为:KNO3 KCl(填写“>”“=”或“<”)。
(4)如图2所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是 (填序号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A.①③④ B.②⑤⑥ C.①③⑤ D.②④⑥
(5)60℃时,将45g KCl固体溶解于100g水中,降温至20℃,析出晶体的质量是 。
20.(5分)实验室里配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)写出图中标号 a 仪器的名称 。
(2)配制 50g 质量分数为 15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 盘(填“左”或“右”)。
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 (填序号)。
A.称量时,药品与砝码放反了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
同课章节目录
