第八章常见的酸、碱、盐基础检测题(含解析)2023-2024学年科粤版(2012)九年级化学下册
文档属性
| 名称 | 第八章常见的酸、碱、盐基础检测题(含解析)2023-2024学年科粤版(2012)九年级化学下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 224.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-28 00:00:00 | ||
图片预览


文档简介
第八章 常见的酸、碱、盐 基础检测题
一、选择题
1.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
物质 杂质 选用的试剂和操作方法
A CO2 CO 通入O2 ,点燃
B KNO3溶液 KOH溶液 加入适量的Cu(NO3)2溶液,过滤
C KCl溶液 CaCl2溶液 滴加碳酸钠溶液至恰好完全反应,过滤
D NaOH固体 Na2CO3固体 加入过量盐酸,蒸发
A.A B.B C.C D.D
2.推理是一种重要的学习方法。下列推理中正确的是
A.酸和碱发生中和反应生成盐和水,则生成盐和水的化学反应一定是中和反应
B.酸性溶液能使紫色石蕊溶液变成红色,则能使紫色石蕊溶液变红的一定是酸性溶液
C.饱和溶液不能继续溶解某种溶质,则其它物质也不能继续溶解在该饱和溶液中
D.同种分子构成的物质一定是纯净物,则纯净物一定都是由同种分子构成的
3.下列各组离子在水中一定能大量共存的是
A.Na+、H+、Cl-、CO32- B.Ag+、Ca2+、Cl-、NO3-
C.H+、Na+、OH-、SO42- D.Na+、K+、NO3-、Cl-
4.下列各组物质的俗称、化学式,用途不一致的是( )
序号 俗称 化学式 用途
A 生石灰 CaO 做干燥剂
B 干冰 CO2 人工降雨
C 纯碱 NaOH 治疗胃酸过多
D 小苏打 NaHCO3 发酵粉主要成分之一
A.A B.B C.C D.D
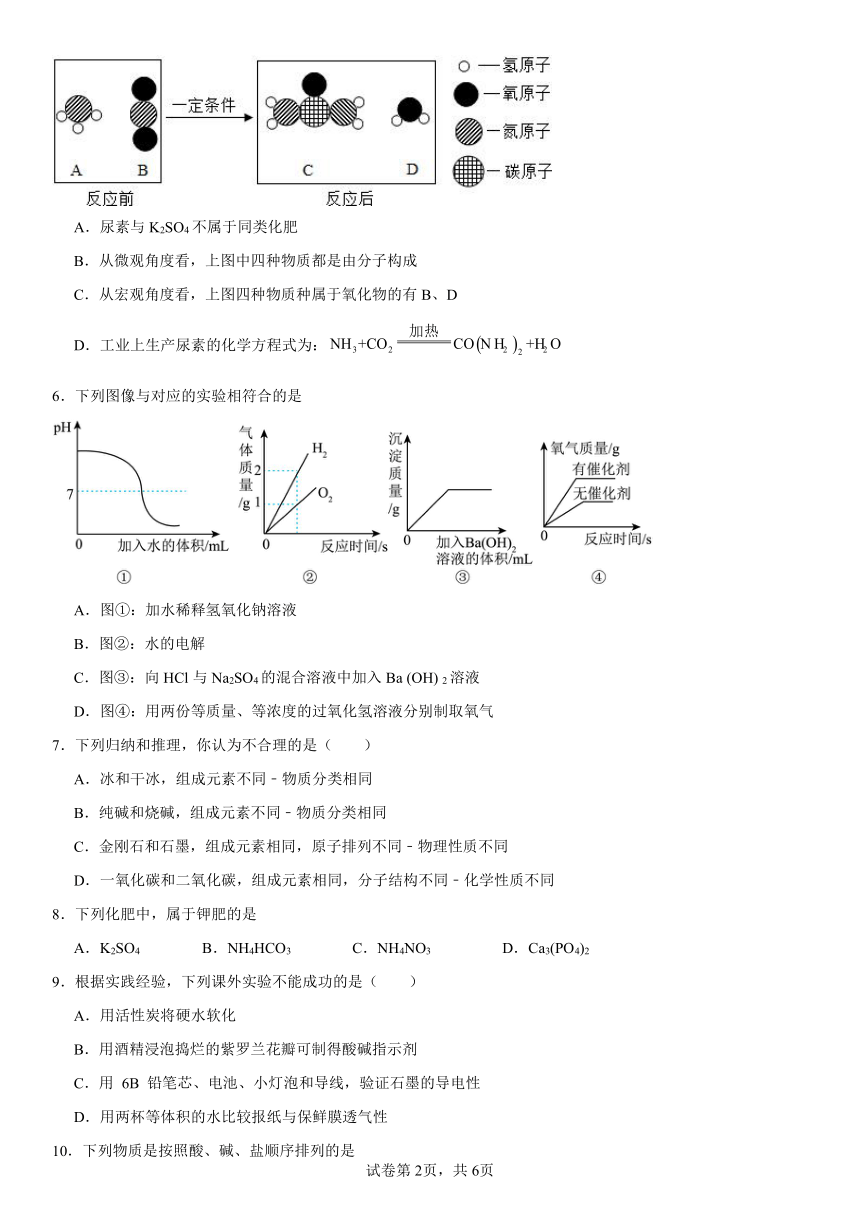
5.在“宏观一微观一符号“之间建立联系是化学学科特有的思维方式。工业上生产尿素[CO(NH2)2]的反应微观示意图如下,下列对图示信息分析不正确的是
A.尿素与K2SO4不属于同类化肥
B.从微观角度看,上图中四种物质都是由分子构成
C.从宏观角度看,上图四种物质种属于氧化物的有B、D
D.工业上生产尿素的化学方程式为:
6.下列图像与对应的实验相符合的是
A.图①:加水稀释氢氧化钠溶液
B.图②:水的电解
C.图③:向HCl与Na2SO4的混合溶液中加入Ba (OH) 2溶液
D.图④:用两份等质量、等浓度的过氧化氢溶液分别制取氧气
7.下列归纳和推理,你认为不合理的是( )
A.冰和干冰,组成元素不同﹣物质分类相同
B.纯碱和烧碱,组成元素不同﹣物质分类相同
C.金刚石和石墨,组成元素相同,原子排列不同﹣物理性质不同
D.一氧化碳和二氧化碳,组成元素相同,分子结构不同﹣化学性质不同
8.下列化肥中,属于钾肥的是
A.K2SO4 B.NH4HCO3 C.NH4NO3 D.Ca3(PO4)2
9.根据实践经验,下列课外实验不能成功的是( )
A.用活性炭将硬水软化
B.用酒精浸泡捣烂的紫罗兰花瓣可制得酸碱指示剂
C.用 6B 铅笔芯、电池、小灯泡和导线,验证石墨的导电性
D.用两杯等体积的水比较报纸与保鲜膜透气性
10.下列物质是按照酸、碱、盐顺序排列的是
A.KNO3、NaOH、HCl B.Ca(OH)2、HCl、NaCl
C.H2SO4、Na2CO3、BaSO4 D.HNO3、KOH、CuSO4
11.下列数据是相应物质的pH,其中呈碱性的是
A.液体肥皂 (9.5-10.5)
B.菠萝汁 (3.3-5.2)
C.柠檬汁 (2.0-3.0)
D.酱油 (4.0-5.0)
二、填空与简答
12.某校化学小组在利用盐酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得将一溶液逐滴滴加到烧杯中,烧杯中溶液pH的变化图像如图所示。
(1)根据图像分析实验前烧杯中盛有 溶液。
(2)向图中c点所示溶液中加入一定量的碳酸钠溶液,待完全反应后所得溶液中一定含有的溶质是 。
13.兴趣小组根据老师提供的实验装置进行如下实验,U型管左侧管内固定一小试管,右侧管内挂的是紫色石蕊试液浸泡过的滤纸条,其中一条是湿润的,一条是干燥的。
(1)将左侧胶头滴管中的稀硫酸注入装有碳酸钠粉末的小试管中,写出小试管中发生反应的化学方程式 。证明二氧化碳可与水反应的现象是 ,发生反应的化学方程式为 。
(2)将右侧胶头滴管内的药品注入U形管内,观察到气球明显变瘪,则右侧胶头滴管中的药品为 ,发生反应的化学方程式为 。
14.A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):
(1)A物质的化学式是 ,
B物质的俗称是 .
(2)B的澄清溶液可用来检验二氧化碳气体,其实验现象是 .
(3)饼干中常添加C物质,其作用是 .
(4)写出B物质与Na2CO3反应的化学方程式 .
15.请你用适合的化学符号填空:
(1)2个铵根离子 ;
(2)纯碱 ;
(3)氧化铝中氧元素显-2价 ;
(4)2个氮气分子 。
16.冶金行业中经常用到锰来制造特种钢。现有6种含锰元素的物质:
Mn、MnO、MnO2、K2MnO2、KMnO4、HMnO4。
(1)上述5种物质中锰元素的化合价一共有 种。
(2)现在,人们大量用锰钢制造滚珠轴承、推土机与掘土机的锌斗等经常受磨的构件,以及铁轨、桥梁等。其中锰钢属于 (填“合成材料”或“金属材料”);
(3)从物质的微粒构成来看,KMnO4由金属离子K+和一种酸根离子构成,则从物质分类角度来看HMnO4属于 。(填选项)
A.化合物 B.氧化物 C.碱 D.酸
(4)锰和铁的化学性质相似,锰易容于稀盐酸,生成二价锰离子,请写出锰与稀盐酸反应的化学方程式: 。
17.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验,实验过程中所加试剂均足量,实验过程及现象如下图所示。
(1)a的实验操作名称
(2)白色沉淀A的化学式为
(3)生成沉淀C的化学方程式
(4)这包白色固体是由
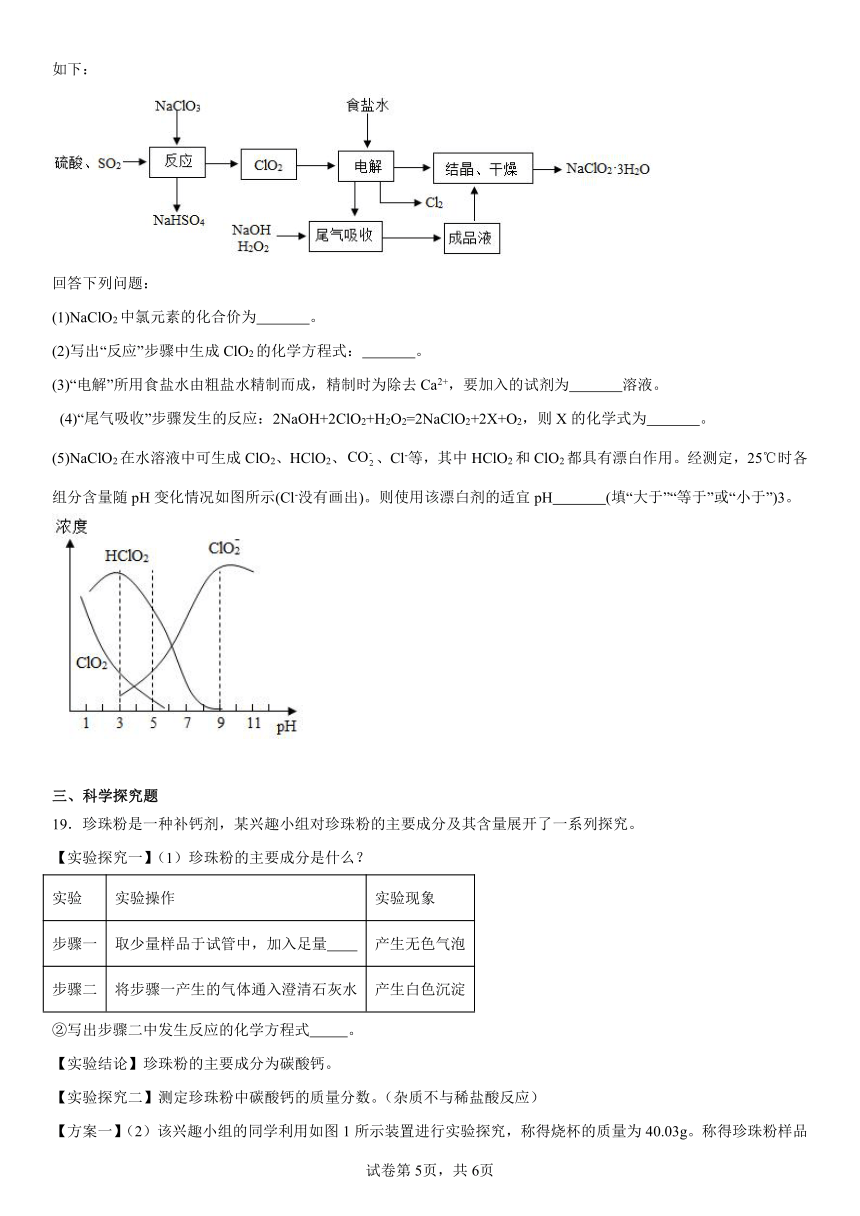
18.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:
回答下列问题:
(1)NaClO2中氯元素的化合价为 。
(2)写出“反应”步骤中生成ClO2的化学方程式: 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时为除去Ca2+,要加入的试剂为 溶液。
(4)“尾气吸收”步骤发生的反应:2NaOH+2ClO2+H2O2=2NaClO2+2X+O2,则X的化学式为 。
(5)NaClO2在水溶液中可生成ClO2、HClO2、、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH (填“大于”“等于”或“小于”)3。
三、科学探究题
19.珍珠粉是一种补钙剂,某兴趣小组对珍珠粉的主要成分及其含量展开了一系列探究。
【实验探究一】(1)珍珠粉的主要成分是什么?
实验 实验操作 实验现象
步骤一 取少量样品于试管中,加入足量 产生无色气泡
步骤二 将步骤一产生的气体通入澄清石灰水 产生白色沉淀
②写出步骤二中发生反应的化学方程式 。
【实验结论】珍珠粉的主要成分为碳酸钙。
【实验探究二】测定珍珠粉中碳酸钙的质量分数。(杂质不与稀盐酸反应)
【方案一】(2)该兴趣小组的同学利用如图1所示装置进行实验探究,称得烧杯的质量为40.03g。称得珍珠粉样品的质量为12g。加入足量的稀盐酸质量为200g,完全反应后,电子天平的示数为247.63g。请你计算珍珠粉中碳酸钙的质量分数 。(写出计算步骤:计算结果保留到0.1%)
【方案二】(3)该兴趣小组的同学认为图2所示装置也可测定珍珠粉中碳酸钙的质量分数,需要测定的数据有样品的质量和 的质量。如果没有装置B,会使测得的碳酸钙的质量分数 。(填“偏大”、“偏小”或者“不变“)
四、计算题
20.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质,故选项所采取的方法错误。
B、KOH溶液能与适量的Cu(NO3)2溶液反应生成氢氧化铜沉淀和硝酸钾,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
C、CaCl2溶液能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项所采取的方法错误。
D、Na2CO3固体和NaOH固体均能与过量盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选B。
2.B
【分析】A、根据中和反应是酸和碱反应生成盐和水的反应进行分析;B、根据酸性溶液的性质进行分析;C、根据饱和溶液的定义进行分析;D、根据纯净物的构成微粒进行分析。
【详解】A、中和反应是酸和碱反应生成盐和水,但生成盐和水的反应不一定是酸和碱的反应,例如盐酸和氧化铜是酸和氧化物的反应生成盐氯化铜和水,该反应不是中和反应,故A选项推理错误;
B、酸性溶液能使紫色石蕊溶液变红,能使紫色石蕊溶液变红的溶液一定呈酸性,故B选项推理正确;
C、饱和溶液是该温度下不能再溶解该物质的溶液,但仍然可以溶解其它的物质,故C选项推理错误;
D、纯净物的构成微粒,可能是分子、原子或离子,故D选项推理错误。
故选B。
【点睛】本题考查了常见概念间的推理,学生应能根据不同知识的特点类推,不能盲目类推,并注意知识点与方法的有机结合,做到具体问题能具体分析。
3.D
【详解】A、H+与CO32-在溶液中能结合成水和二氧化碳,不能大量共存,故选项错误。
B、Ag+、Cl-在溶液中能结合成氯化银钡沉淀,不能大量共存,故选项错误。
C、H+、OH-在溶液中能结合成水,不能大量共存,故选项错误。
D、四种离子在溶液中不能结合生成沉淀、气体、水,能大量共存,故选项正确。
故选D。
【点睛】判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水。
4.C
【详解】A、氧化钙与水反应生成氢氧化钙,能做干燥剂,故A正确;
B、干冰升华吸热,可以用作人工降雨,故B正确;
C、碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,可以治疗胃酸过多,纯碱化学式是Na2CO3,故C不正确;
D、小苏打是发酵粉主要成分之一,故D正确。故选C。
5.D
【详解】A、尿素属于氮肥,硫酸钾属于钾肥,不符合题意;
B、由图可知,四种物质都是由分子构成的,不符合题意;
C、根据氧化物的定义:有两种元素组成的化合物,其中一种元素属于氧元素,B为二氧化碳,D为水,属于氧化物,不符合题意;
D、由图可知,工业上生产尿素的化学方程式为:,符合题意。
故选D。
6.C
【详解】A、加水稀释氢氧化钠溶液,会使碱性减弱pH减小,无限制接近7但不能等于或小于7,而图像小于7;故A错误;
B、水的电解时产生的氧气与氢气的体积比是1:2;而图示中是质量比为1:2.故B错误;
C、由于生成的硫酸钡不溶于酸,所以反应没有先后,一起反应,所以开始就有沉淀生成,故C正确;
D、加入催化剂只改变反应速率而不能增加氧气的质量,应该生成氧气质量相同,故D错误。
故选:C。
7.B
【详解】试题分析:A、冰和干冰,组成元素不同,但是都属于氧化物,物质分类相同,故A正确; B、纯碱和烧碱,组成元素不同,纯碱是由钠离子和碳酸根离子构成的,属于盐;烧碱是由钠离子和氢氧根离子构成的,属于碱,物质分类不相同,故B错误; C、金刚石和石墨,组成元素相同,原子排列不同,因而物理性质不同,故C正确; D、一氧化碳和二氧化碳,组成元素相同,分子结构不同,因而化学性质不同,故D正确.由于本题选择不合理的,故选B
考点:物质的元素组成;常见的氧化物、酸、碱和盐的判别;碳元素组成的单质.
8.A
【详解】A、K2SO4中含有钾元素,属于钾肥,符合题意;
B、NH4HCO3中含有氮元素,属于氮肥,不符合题意;
C、NH4NO3中含有氮元素,属于氮肥,不符合题意;
D、Ca3(PO4)2中含有磷元素,属于磷肥,不符合题意;
故选A。
9.A
【详解】解:A、活性炭具有吸附性,但不能除去水中的可溶性钙镁化合物,不能将硬水软化,故选项课外实验不能成功,符合题意。
B、某些植物的花瓣的汁液可作酸碱指示剂,可用酒精浸泡得到溶液,故选项课外实验能成功,不符合题意。
C、6B 铅笔芯中含有石墨,用6B 铅笔芯、电池、小灯泡和导线,可验证石墨的导电性,故选项课外实验能成功,不符合题意。
D、报纸的透气性好,而保鲜膜的透气性差,用两杯等体积的水可以比较报纸与保鲜膜的透气性,故选项课外实验能成功,不符合题意。故选A。
10.D
【详解】A、硝酸钾是由钾离子和硝酸根离子构成的化合物,属于盐;氢氧化钠是电离时产生的阴离子都是氢氧根离子的化合物,属于碱,盐酸是电离时产生的阳离子都是氢离子的化合物,属于酸,不符合题意;
B、氢氧化钙是电离时产生的阴离子都是氢氧根离子的化合物,属于碱;盐酸是电离时产生的阳离子都是氢离子的化合物,属于酸,氯化钠是由钠离子和氯离子构成的化合物,属于盐,不符合题意;
C、硫酸是电离时产生的阳离子都是氢离子的化合物,属于酸,碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,硫酸钡是由钡离子和硫酸根离子构成的化合物,属于盐,不符合题意;
D、硝酸是电离时产生的阳离子都是氢离子的化合物,属于酸,氢氧化钾是电离时产生的阴离子都是氢氧根离子的化合物,属于碱,硫酸铜是由铜离子和硫酸根离子构成的化合物,属于盐,符合题意。
故选D。
11.A
【详解】A、pH>7,显碱性,符合题意;
B、pH<7,显酸性,不符合题意;
C、pH<7,显酸性,不符合题意;
D、pH<7,显酸性,不符合题意。
故选A。
12. 氢氧化钾 氯化钾、氯化钠
【详解】(1)由图像可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钾溶液中。实验前烧杯中盛有氢氧化钾溶液。
(2)c点所示溶液的pH小于7,显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和KCl,向图中c点所示溶液中加入一定量的碳酸钠溶液,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,待完全反应后所得溶液中一定含有的溶质是氯化钾、氯化钠,无法确定是否含有盐酸或碳酸钠。
13. Na2CO3++H2SO4 ===Na2SO4 +2H2O 干燥的滤纸不变色,湿润的滤纸变红 CO2+H2O===H2CO3 氢氧化钠溶液 2NaOH+CO2 ===Na2CO3 + H2O
【详解】试题分析:(1)碳酸钠与稀硫酸反应,生成硫酸钠、二氧化碳和水,干燥的滤纸不变色,湿润的滤纸变为红色,证明二氧化碳与水发生反应。
(2)气球明显变瘪,说明装置内压强减小,则胶头滴管中的药品可以使氢氧化钠溶液,氢氧化钠溶液与二氧化碳反应,生成碳酸钠和水;
考点:碱和盐的化学性质,溶液酸碱性。
14. CaO 熟石灰(或消石灰) 澄清溶液变浑浊 补钙 Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
【详解】(1)氧化钙能与水反应,故A是CaO,CaO+H2O==Ca(OH)2 ,B是氢氧化钙,俗称熟石灰。(2)检验二氧化碳用澄清石灰水,二氧化碳能使澄清石灰水变浑浊。(3)CO2 + Ca(OH)2 ==CaCO3 ↓+ H2O,故C是碳酸钙,饼干中常添加碳酸钙,其作用是补钙 。
(4) Ca(OH)2 +Na2CO3=2NaOH+CaCO3↓
点睛:熟悉物质之间的转化关系。
15.(1)2NH4+
(2)Na2CO3
(3)
(4)2N2
【详解】(1)由离子的表示方法,在表示该离子的元素符号或原子团的右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.铵根离子可表示为:NH4+,2个铵根离子在铵根离子前加2,表示为2NH4+;
(2)纯碱是碳酸钠俗名,碳酸钠化学式为Na2CO3;
(3)氧化铝中氧元素的化合价显-2价;由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化铝中氧元素的化合价显-2价可表示为:
(4)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字,则2个氮气分子可表示为:2N2。
16. 5 金属材料 D Mn+2HCl=H2↑+MnCl2
【详解】(1)分别有0、+2、+4、+6、+7五种化合价。
(2)锰钢是金属合金材料。
(3)KMnO4由K+和MnO4-构成,属于碱;所以HMnO4由H+和MnO4-构成,属于酸。
(4)Fe+2HCl=FeCl2↑+H2↑,Mn和Fe的化学性质相似,所以方程式也相似,反应方程式为Mn+2HCl=H2↑+MnCl2;
17. 过滤 BaCO3 CaCl2+Na2CO3=CaCO3↓+2NaCl BaCl2和Na2CO3
【详解】(1)固液分离操作是过滤,故填:过滤。
(2)白色固体能和稀盐酸反应生成气体一定是碳酸盐,一定不是硫酸钡,只有氯化钡和碳酸钠能生成难溶性碳酸盐碳酸钡,白色沉淀A一定是碳酸钡,一定含有氯化钡和碳酸钠,一定不含硫酸钠,故填:BaCO3。
(3)无色滤液中过量碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,白色沉淀是碳酸钙,化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl,无色滤液中加酚酞不变色,说明不含氢氧化钠,故填:CaCl2+Na2CO3=CaCO3↓+2NaCl。
(4)由以上分析可知白色固体含有氯化钡和碳酸钠,一定不含硫酸钠和氢氧化钠,故填:BaCl2和Na2CO3。
18. +3 H2SO4+SO2+2NaClO3=2NaHSO4+2ClO2 碳酸钠 H2O 小于
【详解】(1)NaClO2中钠元素化合价是+1,氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,氯元素的化合价为+3;
(2)“反应”步骤中,NaClO3、H2SO4、SO2反应生成NaHSO4、ClO2,反应的化学方程式:2NaClO3+H2SO4+SO2=2NaHSO4+2ClO2;
(3)“电解”所用食盐水由粗盐水精制而成,精制时为除去Ca2+,要加入的试剂为碳酸钠溶液,是因为碳酸根离子能和钙离子结合生成碳酸钙沉淀;
(4)反应前后钠原子都是2个,氯原子都是2个,反应前氧原子是8个,反应后应该是8个,其中2个包含在未知物质中,反应前氢原子是4个,反应后应该是4个,包含在未知物质中,则X的化学式为H2O;
(5)由图中信息可知,HClO2和ClO2的浓度达到最大值时,pH大于1,小于3,则使用该漂白剂的适宜pH小于3。
19. 稀盐酸 Ca(OH)2+CO2=CaCO3↓+H2O 83.3% 装置C 偏大
【详解】解:(1)碳酸盐和酸反应会生成二氧化碳,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以
实验 实验操作 实验现象
步骤一 取少量样品于试管中,加入足量稀盐酸 产生无色气泡
步骤二 将步骤一产生的气体通入澄清石灰水 产生白色沉淀
②步骤二中发生反应的化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)生成二氧化碳的质量为40.03g+12g+200g﹣247.63g=4.4g
设参加反应的碳酸钙的质量为x
x=10g
所以碳酸钙的质量分数为: ×100%≈83.3%;
(3)氢氧化钠和二氧化碳反应生成碳酸钠和水,所以图2所示装置也可测定珍珠粉中碳酸钙的质量分数,需要测定的数据有样品的质量和装置C的质量,如果没有装置B,二氧化碳携带的水蒸气随二氧化碳进入氢氧化钠溶液中,导致氢氧化钠溶液增加的质量偏大,所以会使测得的碳酸钙的质量分数偏大。
20.(1)9.8g (2)32%
【详解】(1)CuSO4溶液会与NaOH溶液反应生成Cu(OH)2沉淀,由实验数据可得,实验2和实验3产生沉淀的质量相等,可见50gCuSO4溶液完全反应时,所得沉淀的质量为:49.8g-40g=9.8g;
(2)设:50gCuSO4溶液中溶质质量为x。
CuSO4溶液中溶质的质量分数为:。
答:(1)50gCuSO4溶液完全反应时,所得沉淀的质量为9.8g。
(2)CuSO4溶液中溶质的质量分数为32%。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是
物质 杂质 选用的试剂和操作方法
A CO2 CO 通入O2 ,点燃
B KNO3溶液 KOH溶液 加入适量的Cu(NO3)2溶液,过滤
C KCl溶液 CaCl2溶液 滴加碳酸钠溶液至恰好完全反应,过滤
D NaOH固体 Na2CO3固体 加入过量盐酸,蒸发
A.A B.B C.C D.D
2.推理是一种重要的学习方法。下列推理中正确的是
A.酸和碱发生中和反应生成盐和水,则生成盐和水的化学反应一定是中和反应
B.酸性溶液能使紫色石蕊溶液变成红色,则能使紫色石蕊溶液变红的一定是酸性溶液
C.饱和溶液不能继续溶解某种溶质,则其它物质也不能继续溶解在该饱和溶液中
D.同种分子构成的物质一定是纯净物,则纯净物一定都是由同种分子构成的
3.下列各组离子在水中一定能大量共存的是
A.Na+、H+、Cl-、CO32- B.Ag+、Ca2+、Cl-、NO3-
C.H+、Na+、OH-、SO42- D.Na+、K+、NO3-、Cl-
4.下列各组物质的俗称、化学式,用途不一致的是( )
序号 俗称 化学式 用途
A 生石灰 CaO 做干燥剂
B 干冰 CO2 人工降雨
C 纯碱 NaOH 治疗胃酸过多
D 小苏打 NaHCO3 发酵粉主要成分之一
A.A B.B C.C D.D
5.在“宏观一微观一符号“之间建立联系是化学学科特有的思维方式。工业上生产尿素[CO(NH2)2]的反应微观示意图如下,下列对图示信息分析不正确的是
A.尿素与K2SO4不属于同类化肥
B.从微观角度看,上图中四种物质都是由分子构成
C.从宏观角度看,上图四种物质种属于氧化物的有B、D
D.工业上生产尿素的化学方程式为:
6.下列图像与对应的实验相符合的是
A.图①:加水稀释氢氧化钠溶液
B.图②:水的电解
C.图③:向HCl与Na2SO4的混合溶液中加入Ba (OH) 2溶液
D.图④:用两份等质量、等浓度的过氧化氢溶液分别制取氧气
7.下列归纳和推理,你认为不合理的是( )
A.冰和干冰,组成元素不同﹣物质分类相同
B.纯碱和烧碱,组成元素不同﹣物质分类相同
C.金刚石和石墨,组成元素相同,原子排列不同﹣物理性质不同
D.一氧化碳和二氧化碳,组成元素相同,分子结构不同﹣化学性质不同
8.下列化肥中,属于钾肥的是
A.K2SO4 B.NH4HCO3 C.NH4NO3 D.Ca3(PO4)2
9.根据实践经验,下列课外实验不能成功的是( )
A.用活性炭将硬水软化
B.用酒精浸泡捣烂的紫罗兰花瓣可制得酸碱指示剂
C.用 6B 铅笔芯、电池、小灯泡和导线,验证石墨的导电性
D.用两杯等体积的水比较报纸与保鲜膜透气性
10.下列物质是按照酸、碱、盐顺序排列的是
A.KNO3、NaOH、HCl B.Ca(OH)2、HCl、NaCl
C.H2SO4、Na2CO3、BaSO4 D.HNO3、KOH、CuSO4
11.下列数据是相应物质的pH,其中呈碱性的是
A.液体肥皂 (9.5-10.5)
B.菠萝汁 (3.3-5.2)
C.柠檬汁 (2.0-3.0)
D.酱油 (4.0-5.0)
二、填空与简答
12.某校化学小组在利用盐酸和氢氧化钾溶液探究酸碱中和反应时,利用数字化传感器测得将一溶液逐滴滴加到烧杯中,烧杯中溶液pH的变化图像如图所示。
(1)根据图像分析实验前烧杯中盛有 溶液。
(2)向图中c点所示溶液中加入一定量的碳酸钠溶液,待完全反应后所得溶液中一定含有的溶质是 。
13.兴趣小组根据老师提供的实验装置进行如下实验,U型管左侧管内固定一小试管,右侧管内挂的是紫色石蕊试液浸泡过的滤纸条,其中一条是湿润的,一条是干燥的。
(1)将左侧胶头滴管中的稀硫酸注入装有碳酸钠粉末的小试管中,写出小试管中发生反应的化学方程式 。证明二氧化碳可与水反应的现象是 ,发生反应的化学方程式为 。
(2)将右侧胶头滴管内的药品注入U形管内,观察到气球明显变瘪,则右侧胶头滴管中的药品为 ,发生反应的化学方程式为 。
14.A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):
(1)A物质的化学式是 ,
B物质的俗称是 .
(2)B的澄清溶液可用来检验二氧化碳气体,其实验现象是 .
(3)饼干中常添加C物质,其作用是 .
(4)写出B物质与Na2CO3反应的化学方程式 .
15.请你用适合的化学符号填空:
(1)2个铵根离子 ;
(2)纯碱 ;
(3)氧化铝中氧元素显-2价 ;
(4)2个氮气分子 。
16.冶金行业中经常用到锰来制造特种钢。现有6种含锰元素的物质:
Mn、MnO、MnO2、K2MnO2、KMnO4、HMnO4。
(1)上述5种物质中锰元素的化合价一共有 种。
(2)现在,人们大量用锰钢制造滚珠轴承、推土机与掘土机的锌斗等经常受磨的构件,以及铁轨、桥梁等。其中锰钢属于 (填“合成材料”或“金属材料”);
(3)从物质的微粒构成来看,KMnO4由金属离子K+和一种酸根离子构成,则从物质分类角度来看HMnO4属于 。(填选项)
A.化合物 B.氧化物 C.碱 D.酸
(4)锰和铁的化学性质相似,锰易容于稀盐酸,生成二价锰离子,请写出锰与稀盐酸反应的化学方程式: 。
17.有一包白色固体,可能由BaCl2、NaOH、Na2CO3、Na2SO4中的一种或几种组成。为确定其成分,实验小组进行实验,实验过程中所加试剂均足量,实验过程及现象如下图所示。
(1)a的实验操作名称
(2)白色沉淀A的化学式为
(3)生成沉淀C的化学方程式
(4)这包白色固体是由
18.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:
回答下列问题:
(1)NaClO2中氯元素的化合价为 。
(2)写出“反应”步骤中生成ClO2的化学方程式: 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时为除去Ca2+,要加入的试剂为 溶液。
(4)“尾气吸收”步骤发生的反应:2NaOH+2ClO2+H2O2=2NaClO2+2X+O2,则X的化学式为 。
(5)NaClO2在水溶液中可生成ClO2、HClO2、、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH (填“大于”“等于”或“小于”)3。
三、科学探究题
19.珍珠粉是一种补钙剂,某兴趣小组对珍珠粉的主要成分及其含量展开了一系列探究。
【实验探究一】(1)珍珠粉的主要成分是什么?
实验 实验操作 实验现象
步骤一 取少量样品于试管中,加入足量 产生无色气泡
步骤二 将步骤一产生的气体通入澄清石灰水 产生白色沉淀
②写出步骤二中发生反应的化学方程式 。
【实验结论】珍珠粉的主要成分为碳酸钙。
【实验探究二】测定珍珠粉中碳酸钙的质量分数。(杂质不与稀盐酸反应)
【方案一】(2)该兴趣小组的同学利用如图1所示装置进行实验探究,称得烧杯的质量为40.03g。称得珍珠粉样品的质量为12g。加入足量的稀盐酸质量为200g,完全反应后,电子天平的示数为247.63g。请你计算珍珠粉中碳酸钙的质量分数 。(写出计算步骤:计算结果保留到0.1%)
【方案二】(3)该兴趣小组的同学认为图2所示装置也可测定珍珠粉中碳酸钙的质量分数,需要测定的数据有样品的质量和 的质量。如果没有装置B,会使测得的碳酸钙的质量分数 。(填“偏大”、“偏小”或者“不变“)
四、计算题
20.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A、除去二氧化碳中的一氧化碳不能够通氧气点燃,这是因为除去气体中的气体杂质不能使用气体,否则会引入新的气体杂质,故选项所采取的方法错误。
B、KOH溶液能与适量的Cu(NO3)2溶液反应生成氢氧化铜沉淀和硝酸钾,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
C、CaCl2溶液能与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故选项所采取的方法错误。
D、Na2CO3固体和NaOH固体均能与过量盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选B。
2.B
【分析】A、根据中和反应是酸和碱反应生成盐和水的反应进行分析;B、根据酸性溶液的性质进行分析;C、根据饱和溶液的定义进行分析;D、根据纯净物的构成微粒进行分析。
【详解】A、中和反应是酸和碱反应生成盐和水,但生成盐和水的反应不一定是酸和碱的反应,例如盐酸和氧化铜是酸和氧化物的反应生成盐氯化铜和水,该反应不是中和反应,故A选项推理错误;
B、酸性溶液能使紫色石蕊溶液变红,能使紫色石蕊溶液变红的溶液一定呈酸性,故B选项推理正确;
C、饱和溶液是该温度下不能再溶解该物质的溶液,但仍然可以溶解其它的物质,故C选项推理错误;
D、纯净物的构成微粒,可能是分子、原子或离子,故D选项推理错误。
故选B。
【点睛】本题考查了常见概念间的推理,学生应能根据不同知识的特点类推,不能盲目类推,并注意知识点与方法的有机结合,做到具体问题能具体分析。
3.D
【详解】A、H+与CO32-在溶液中能结合成水和二氧化碳,不能大量共存,故选项错误。
B、Ag+、Cl-在溶液中能结合成氯化银钡沉淀,不能大量共存,故选项错误。
C、H+、OH-在溶液中能结合成水,不能大量共存,故选项错误。
D、四种离子在溶液中不能结合生成沉淀、气体、水,能大量共存,故选项正确。
故选D。
【点睛】判断各离子在溶液中能否共存,主要看溶液中的各离子之间能否发生反应生成沉淀、气体、水。
4.C
【详解】A、氧化钙与水反应生成氢氧化钙,能做干燥剂,故A正确;
B、干冰升华吸热,可以用作人工降雨,故B正确;
C、碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,可以治疗胃酸过多,纯碱化学式是Na2CO3,故C不正确;
D、小苏打是发酵粉主要成分之一,故D正确。故选C。
5.D
【详解】A、尿素属于氮肥,硫酸钾属于钾肥,不符合题意;
B、由图可知,四种物质都是由分子构成的,不符合题意;
C、根据氧化物的定义:有两种元素组成的化合物,其中一种元素属于氧元素,B为二氧化碳,D为水,属于氧化物,不符合题意;
D、由图可知,工业上生产尿素的化学方程式为:,符合题意。
故选D。
6.C
【详解】A、加水稀释氢氧化钠溶液,会使碱性减弱pH减小,无限制接近7但不能等于或小于7,而图像小于7;故A错误;
B、水的电解时产生的氧气与氢气的体积比是1:2;而图示中是质量比为1:2.故B错误;
C、由于生成的硫酸钡不溶于酸,所以反应没有先后,一起反应,所以开始就有沉淀生成,故C正确;
D、加入催化剂只改变反应速率而不能增加氧气的质量,应该生成氧气质量相同,故D错误。
故选:C。
7.B
【详解】试题分析:A、冰和干冰,组成元素不同,但是都属于氧化物,物质分类相同,故A正确; B、纯碱和烧碱,组成元素不同,纯碱是由钠离子和碳酸根离子构成的,属于盐;烧碱是由钠离子和氢氧根离子构成的,属于碱,物质分类不相同,故B错误; C、金刚石和石墨,组成元素相同,原子排列不同,因而物理性质不同,故C正确; D、一氧化碳和二氧化碳,组成元素相同,分子结构不同,因而化学性质不同,故D正确.由于本题选择不合理的,故选B
考点:物质的元素组成;常见的氧化物、酸、碱和盐的判别;碳元素组成的单质.
8.A
【详解】A、K2SO4中含有钾元素,属于钾肥,符合题意;
B、NH4HCO3中含有氮元素,属于氮肥,不符合题意;
C、NH4NO3中含有氮元素,属于氮肥,不符合题意;
D、Ca3(PO4)2中含有磷元素,属于磷肥,不符合题意;
故选A。
9.A
【详解】解:A、活性炭具有吸附性,但不能除去水中的可溶性钙镁化合物,不能将硬水软化,故选项课外实验不能成功,符合题意。
B、某些植物的花瓣的汁液可作酸碱指示剂,可用酒精浸泡得到溶液,故选项课外实验能成功,不符合题意。
C、6B 铅笔芯中含有石墨,用6B 铅笔芯、电池、小灯泡和导线,可验证石墨的导电性,故选项课外实验能成功,不符合题意。
D、报纸的透气性好,而保鲜膜的透气性差,用两杯等体积的水可以比较报纸与保鲜膜的透气性,故选项课外实验能成功,不符合题意。故选A。
10.D
【详解】A、硝酸钾是由钾离子和硝酸根离子构成的化合物,属于盐;氢氧化钠是电离时产生的阴离子都是氢氧根离子的化合物,属于碱,盐酸是电离时产生的阳离子都是氢离子的化合物,属于酸,不符合题意;
B、氢氧化钙是电离时产生的阴离子都是氢氧根离子的化合物,属于碱;盐酸是电离时产生的阳离子都是氢离子的化合物,属于酸,氯化钠是由钠离子和氯离子构成的化合物,属于盐,不符合题意;
C、硫酸是电离时产生的阳离子都是氢离子的化合物,属于酸,碳酸钠是由钠离子和碳酸根离子构成的化合物,属于盐,硫酸钡是由钡离子和硫酸根离子构成的化合物,属于盐,不符合题意;
D、硝酸是电离时产生的阳离子都是氢离子的化合物,属于酸,氢氧化钾是电离时产生的阴离子都是氢氧根离子的化合物,属于碱,硫酸铜是由铜离子和硫酸根离子构成的化合物,属于盐,符合题意。
故选D。
11.A
【详解】A、pH>7,显碱性,符合题意;
B、pH<7,显酸性,不符合题意;
C、pH<7,显酸性,不符合题意;
D、pH<7,显酸性,不符合题意。
故选A。
12. 氢氧化钾 氯化钾、氯化钠
【详解】(1)由图像可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钾溶液中。实验前烧杯中盛有氢氧化钾溶液。
(2)c点所示溶液的pH小于7,显酸性,说明稀盐酸过量,所得溶液中的溶质为HCl和KCl,向图中c点所示溶液中加入一定量的碳酸钠溶液,碳酸钠能与稀盐酸反应生成氯化钠、水和二氧化碳,待完全反应后所得溶液中一定含有的溶质是氯化钾、氯化钠,无法确定是否含有盐酸或碳酸钠。
13. Na2CO3++H2SO4 ===Na2SO4 +2H2O 干燥的滤纸不变色,湿润的滤纸变红 CO2+H2O===H2CO3 氢氧化钠溶液 2NaOH+CO2 ===Na2CO3 + H2O
【详解】试题分析:(1)碳酸钠与稀硫酸反应,生成硫酸钠、二氧化碳和水,干燥的滤纸不变色,湿润的滤纸变为红色,证明二氧化碳与水发生反应。
(2)气球明显变瘪,说明装置内压强减小,则胶头滴管中的药品可以使氢氧化钠溶液,氢氧化钠溶液与二氧化碳反应,生成碳酸钠和水;
考点:碱和盐的化学性质,溶液酸碱性。
14. CaO 熟石灰(或消石灰) 澄清溶液变浑浊 补钙 Ca(OH)2+Na2CO3=2NaOH+CaCO3↓
【详解】(1)氧化钙能与水反应,故A是CaO,CaO+H2O==Ca(OH)2 ,B是氢氧化钙,俗称熟石灰。(2)检验二氧化碳用澄清石灰水,二氧化碳能使澄清石灰水变浑浊。(3)CO2 + Ca(OH)2 ==CaCO3 ↓+ H2O,故C是碳酸钙,饼干中常添加碳酸钙,其作用是补钙 。
(4) Ca(OH)2 +Na2CO3=2NaOH+CaCO3↓
点睛:熟悉物质之间的转化关系。
15.(1)2NH4+
(2)Na2CO3
(3)
(4)2N2
【详解】(1)由离子的表示方法,在表示该离子的元素符号或原子团的右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.铵根离子可表示为:NH4+,2个铵根离子在铵根离子前加2,表示为2NH4+;
(2)纯碱是碳酸钠俗名,碳酸钠化学式为Na2CO3;
(3)氧化铝中氧元素的化合价显-2价;由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化铝中氧元素的化合价显-2价可表示为:
(4)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字,则2个氮气分子可表示为:2N2。
16. 5 金属材料 D Mn+2HCl=H2↑+MnCl2
【详解】(1)分别有0、+2、+4、+6、+7五种化合价。
(2)锰钢是金属合金材料。
(3)KMnO4由K+和MnO4-构成,属于碱;所以HMnO4由H+和MnO4-构成,属于酸。
(4)Fe+2HCl=FeCl2↑+H2↑,Mn和Fe的化学性质相似,所以方程式也相似,反应方程式为Mn+2HCl=H2↑+MnCl2;
17. 过滤 BaCO3 CaCl2+Na2CO3=CaCO3↓+2NaCl BaCl2和Na2CO3
【详解】(1)固液分离操作是过滤,故填:过滤。
(2)白色固体能和稀盐酸反应生成气体一定是碳酸盐,一定不是硫酸钡,只有氯化钡和碳酸钠能生成难溶性碳酸盐碳酸钡,白色沉淀A一定是碳酸钡,一定含有氯化钡和碳酸钠,一定不含硫酸钠,故填:BaCO3。
(3)无色滤液中过量碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,白色沉淀是碳酸钙,化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl,无色滤液中加酚酞不变色,说明不含氢氧化钠,故填:CaCl2+Na2CO3=CaCO3↓+2NaCl。
(4)由以上分析可知白色固体含有氯化钡和碳酸钠,一定不含硫酸钠和氢氧化钠,故填:BaCl2和Na2CO3。
18. +3 H2SO4+SO2+2NaClO3=2NaHSO4+2ClO2 碳酸钠 H2O 小于
【详解】(1)NaClO2中钠元素化合价是+1,氧元素化合价是-2,根据化合物中元素化合价代数和为零可知,氯元素的化合价为+3;
(2)“反应”步骤中,NaClO3、H2SO4、SO2反应生成NaHSO4、ClO2,反应的化学方程式:2NaClO3+H2SO4+SO2=2NaHSO4+2ClO2;
(3)“电解”所用食盐水由粗盐水精制而成,精制时为除去Ca2+,要加入的试剂为碳酸钠溶液,是因为碳酸根离子能和钙离子结合生成碳酸钙沉淀;
(4)反应前后钠原子都是2个,氯原子都是2个,反应前氧原子是8个,反应后应该是8个,其中2个包含在未知物质中,反应前氢原子是4个,反应后应该是4个,包含在未知物质中,则X的化学式为H2O;
(5)由图中信息可知,HClO2和ClO2的浓度达到最大值时,pH大于1,小于3,则使用该漂白剂的适宜pH小于3。
19. 稀盐酸 Ca(OH)2+CO2=CaCO3↓+H2O 83.3% 装置C 偏大
【详解】解:(1)碳酸盐和酸反应会生成二氧化碳,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以
实验 实验操作 实验现象
步骤一 取少量样品于试管中,加入足量稀盐酸 产生无色气泡
步骤二 将步骤一产生的气体通入澄清石灰水 产生白色沉淀
②步骤二中发生反应的化学方程式是:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)生成二氧化碳的质量为40.03g+12g+200g﹣247.63g=4.4g
设参加反应的碳酸钙的质量为x
x=10g
所以碳酸钙的质量分数为: ×100%≈83.3%;
(3)氢氧化钠和二氧化碳反应生成碳酸钠和水,所以图2所示装置也可测定珍珠粉中碳酸钙的质量分数,需要测定的数据有样品的质量和装置C的质量,如果没有装置B,二氧化碳携带的水蒸气随二氧化碳进入氢氧化钠溶液中,导致氢氧化钠溶液增加的质量偏大,所以会使测得的碳酸钙的质量分数偏大。
20.(1)9.8g (2)32%
【详解】(1)CuSO4溶液会与NaOH溶液反应生成Cu(OH)2沉淀,由实验数据可得,实验2和实验3产生沉淀的质量相等,可见50gCuSO4溶液完全反应时,所得沉淀的质量为:49.8g-40g=9.8g;
(2)设:50gCuSO4溶液中溶质质量为x。
CuSO4溶液中溶质的质量分数为:。
答:(1)50gCuSO4溶液完全反应时,所得沉淀的质量为9.8g。
(2)CuSO4溶液中溶质的质量分数为32%。
答案第1页,共2页
答案第1页,共2页
