5.1.2硫酸和硫酸根离子的检验(共20张PPT)-人教版2019必修第二册
文档属性
| 名称 | 5.1.2硫酸和硫酸根离子的检验(共20张PPT)-人教版2019必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 67.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-28 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
高中化学
微课堂
CHEMISTRY
第五章 化工生产中的重要非金属元素
5.1.2 硫酸和硫酸根离子的检验
硫酸的用途
炸药
农药化肥
蓄电池
制药
硫酸的制取
S + O2 === SO2
点燃
4FeS2 + 11O2 === 2Fe2O3 + 8SO2
点燃
2SO2 + O2 2SO3
400~500℃
催化剂
SO3 + H2O === H2SO4
(用98.3%的浓硫酸吸收)
不用水吸收SO3:与水反应放热,易产生酸雾,影响吸收。
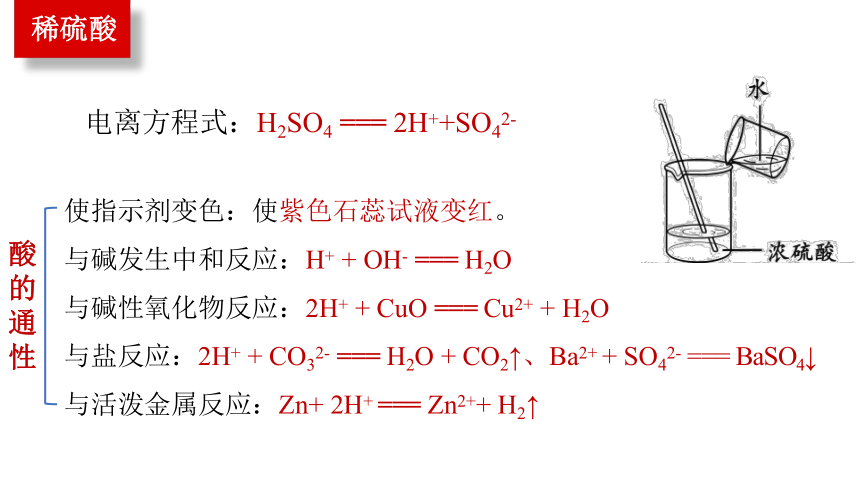
稀硫酸
电离方程式:H2SO4 === 2H++SO42-
使指示剂变色:使紫色石蕊试液变红。
与碱发生中和反应:H+ + OH- === H2O
与碱性氧化物反应:2H+ + CuO === Cu2+ + H2O
与盐反应:2H+ + CO32- === H2O + CO2↑、Ba2+ + SO42- === BaSO4↓
与活泼金属反应:Zn+ 2H+ === Zn2++ H2↑
酸的通性
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
浓硫酸
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
c. 强氧化性
非金属:
C + 2H2SO4(浓) === CO2 ↑ + 2SO2↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
实验5-3
在带导管的橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。在试管中加入2ml浓硫酸,塞好橡胶塞,使铜丝与浓硫酸接触。加热,将产生的气体通入品红溶液,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色。
便于控制反应的发生和停止
实验5-3
实验5-3
a. 加热时左侧试管内有气泡产生;
b. 品红溶液褪色;
c. 紫色石蕊溶液变红;
d. 左侧试管内的物质经稀释后显蓝色。
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
c. 强氧化性
非金属:
C + 2H2SO4(浓) === CO2 ↑ + 2SO2↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
Cu + 2H2SO4(浓) === CuSO4 + SO2↑ + 2H2O
还原剂
氧化剂
酸性
氧化产物
还原产物
金属:
常温下遇到Fe和Al会钝化
资料卡片:硫酸盐
CaSO4·2H2O(生石膏)
2CaSO4·H2O(熟石膏)
BaSO4(钡餐)
CuSO4·5H2O
CuSO4
实验5-4
实验操作
实验现象
原理
生成白色沉淀加盐酸不溶解
生成白色沉淀加盐酸不溶解
生成白色沉淀加盐酸溶解
SO42- + Ba2+ === BaSO4↓
CO32- + Ba2+ === BaCO3↓
BaCO3可溶于酸
BaSO4不溶于酸
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
c. 强氧化性
非金属:
C + 2H2SO4(浓) === CO2 ↑ + 2SO2↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
2、检验:
HCl酸化的BaCl2溶液
排除CO32- 、SO32- 、Ag+干扰
Cu + 2H2SO4(浓) === CuSO4 + SO2↑ + 2H2O
还原剂
氧化剂
酸性
氧化产物
还原产物
金属:
常温下遇到Fe和Al会钝化
思考与讨论
(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂
杂质 加入的试剂 离子方程式
硫酸盐
MgCl2
CaCl2
①过量BaCl2
②过量NaOH
Mg2+ + 2OH- === Mg(OH)2↓
③过量Na2CO3
SO42- + Ba2+ === BaSO4↓
CO32- + Ca2+ === CaCO3↓
(2)加入你选择的试剂除去杂质后,有没有引入其他离子 用什么方法可以除去这些离子?
思考与讨论
(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂
杂质 加入的试剂 离子方程式 除杂试剂
硫酸盐
MgCl2
CaCl2
①过量BaCl2
②过量NaOH
Mg2+ + 2OH- === Mg(OH)2↓
③过量Na2CO3
SO42- + Ba2+ === BaSO4↓
CO32- + Ca2+ === CaCO3↓
(2)加入你选择的试剂除去杂质后,有没有引入其他离子 用什么方法可以除去这些离子?
③过量Na2CO3
④过量HCl
④过量HCl
③在①后,④在最后
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
除杂试剂:过量;
避免引入新的杂质离子。
过量的试剂要除掉;
课堂练习
下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(2)用磷矿物[主要成分是磷酸钙]和硫酸反应制磷酸。
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体。
③高沸点、难挥发性
⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体。
①强酸性
(4)常温下可以用铁或铝的容器贮存浓硫酸。
(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末。
(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体。
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑。
②强氧化性
⑤吸水性
②强氧化性
①强酸性 ④脱水性
感谢聆听!
CHEMISTRY
高中化学
微课堂
CHEMISTRY
第五章 化工生产中的重要非金属元素
5.1.2 硫酸和硫酸根离子的检验
硫酸的用途
炸药
农药化肥
蓄电池
制药
硫酸的制取
S + O2 === SO2
点燃
4FeS2 + 11O2 === 2Fe2O3 + 8SO2
点燃
2SO2 + O2 2SO3
400~500℃
催化剂
SO3 + H2O === H2SO4
(用98.3%的浓硫酸吸收)
不用水吸收SO3:与水反应放热,易产生酸雾,影响吸收。
稀硫酸
电离方程式:H2SO4 === 2H++SO42-
使指示剂变色:使紫色石蕊试液变红。
与碱发生中和反应:H+ + OH- === H2O
与碱性氧化物反应:2H+ + CuO === Cu2+ + H2O
与盐反应:2H+ + CO32- === H2O + CO2↑、Ba2+ + SO42- === BaSO4↓
与活泼金属反应:Zn+ 2H+ === Zn2++ H2↑
酸的通性
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
浓硫酸
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
c. 强氧化性
非金属:
C + 2H2SO4(浓) === CO2 ↑ + 2SO2↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
实验5-3
在带导管的橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。在试管中加入2ml浓硫酸,塞好橡胶塞,使铜丝与浓硫酸接触。加热,将产生的气体通入品红溶液,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一支试管里,观察溶液的颜色。
便于控制反应的发生和停止
实验5-3
实验5-3
a. 加热时左侧试管内有气泡产生;
b. 品红溶液褪色;
c. 紫色石蕊溶液变红;
d. 左侧试管内的物质经稀释后显蓝色。
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
c. 强氧化性
非金属:
C + 2H2SO4(浓) === CO2 ↑ + 2SO2↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
Cu + 2H2SO4(浓) === CuSO4 + SO2↑ + 2H2O
还原剂
氧化剂
酸性
氧化产物
还原产物
金属:
常温下遇到Fe和Al会钝化
资料卡片:硫酸盐
CaSO4·2H2O(生石膏)
2CaSO4·H2O(熟石膏)
BaSO4(钡餐)
CuSO4·5H2O
CuSO4
实验5-4
实验操作
实验现象
原理
生成白色沉淀加盐酸不溶解
生成白色沉淀加盐酸不溶解
生成白色沉淀加盐酸溶解
SO42- + Ba2+ === BaSO4↓
CO32- + Ba2+ === BaCO3↓
BaCO3可溶于酸
BaSO4不溶于酸
5.1.2 硫酸和硫酸根离子的检验
物理性质
1、浓H2SO4
化学性质
色态:无色、粘稠的油状液体
沸点:约338℃——难挥发性酸
密度:1.84g·cm-3——密度大
溶解性:跟水任意比互溶,溶解放出大量热
NH3、H2S×
a. 吸水性
干燥剂
b. 脱水性
把有机物中的H、O按2:1的个数比脱去(H2O)
c. 强氧化性
非金属:
C + 2H2SO4(浓) === CO2 ↑ + 2SO2↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
2、检验:
HCl酸化的BaCl2溶液
排除CO32- 、SO32- 、Ag+干扰
Cu + 2H2SO4(浓) === CuSO4 + SO2↑ + 2H2O
还原剂
氧化剂
酸性
氧化产物
还原产物
金属:
常温下遇到Fe和Al会钝化
思考与讨论
(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂
杂质 加入的试剂 离子方程式
硫酸盐
MgCl2
CaCl2
①过量BaCl2
②过量NaOH
Mg2+ + 2OH- === Mg(OH)2↓
③过量Na2CO3
SO42- + Ba2+ === BaSO4↓
CO32- + Ca2+ === CaCO3↓
(2)加入你选择的试剂除去杂质后,有没有引入其他离子 用什么方法可以除去这些离子?
思考与讨论
(1)经溶解、过滤和蒸发操作得到的粗盐中还含有一些可溶性硫酸盐、CaCl2、MgCl2等杂质,若要除去它们,应加入什么试剂
杂质 加入的试剂 离子方程式 除杂试剂
硫酸盐
MgCl2
CaCl2
①过量BaCl2
②过量NaOH
Mg2+ + 2OH- === Mg(OH)2↓
③过量Na2CO3
SO42- + Ba2+ === BaSO4↓
CO32- + Ca2+ === CaCO3↓
(2)加入你选择的试剂除去杂质后,有没有引入其他离子 用什么方法可以除去这些离子?
③过量Na2CO3
④过量HCl
④过量HCl
③在①后,④在最后
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑哪些问题?
除杂试剂:过量;
避免引入新的杂质离子。
过量的试剂要除掉;
课堂练习
下列各过程主要表现了浓硫酸的哪些性质?
①强酸性 ②强氧化性 ③高沸点、难挥发性 ④脱水性 ⑤吸水性
(2)用磷矿物[主要成分是磷酸钙]和硫酸反应制磷酸。
(3)浓硫酸干燥氢气、氧气、氯气、二氧化硫等气体。
③高沸点、难挥发性
⑤吸水性
(1)用氯化钠固体和浓硫酸在加热条件下制氯化氢气体。
①强酸性
(4)常温下可以用铁或铝的容器贮存浓硫酸。
(5)胆矾放在盛浓硫酸的干燥器中变成白色粉末。
(6)不能用浓硫酸干燥溴化氢、碘化氢和硫化氢等气体。
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑。
②强氧化性
⑤吸水性
②强氧化性
①强酸性 ④脱水性
感谢聆听!
CHEMISTRY
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
