【核心素养】5.1.2硫酸、硫酸根离子的检验(共26张PPT)-人教版2019必修第二册
文档属性
| 名称 | 【核心素养】5.1.2硫酸、硫酸根离子的检验(共26张PPT)-人教版2019必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 44.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-29 00:01:20 | ||
图片预览







文档简介
(共26张PPT)
人教版高一化学必修第二册第五章
《1、硫及其化合物》
---硫酸、硫酸根离子的检验
1.宏观辨识与微观探析:认识硫元素在物质中具有同价态,可通过氧化还原反实现含有不同价态硫元素物质的相互转化
2.变化观念与平衡思想:理解和体验实际问题抽象为数学概念的过程和思想,增强数学的应用意识。
3.证据推理与模型认知”: 能从物质类别和硫元素化合价的角度认识硫酸的性质,
4.“科学探究与创新意识: 通过实验探究浓硫酸的吸水性、脱水性和强氧化性,学会硫酸根离子的检验方法,
5.科学精神与社会责任 :结合真实情境中的应用实例或通过实验探究,了解硫、氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响
核心素养目标
教学目标
教学重点: 1.掌握浓硫酸的三大特性;
2.认识浓硫酸与稀硫酸性质的不同;
3.如何检验硫酸根离子。
4、不同价态含硫物质的转化
教学难点:了解硫酸根离子的检验方法,
情境导入
现代工业之母——硫酸(H2SO4)
硫酸在化学、冶金、医药、染料等有极为广泛的应用。
生产10t青霉素要消耗2.5t硫酸,生产1t有机玻璃要消耗3t硫酸,生产1kg金属锆,要消耗20t硫酸。
有人称硫酸是化学工业生产的“发动机”。世界上常把硫酸的产量作为衡量一个国家工业发达程度的标志。
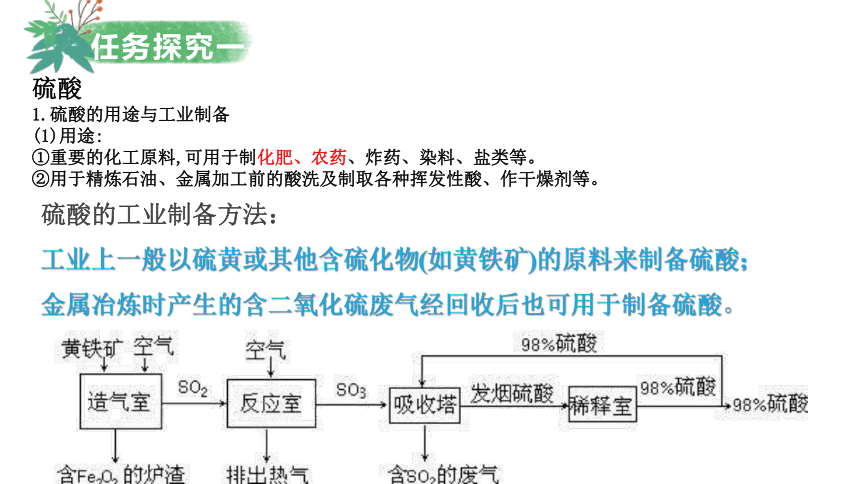
任务探究一
硫酸
1.硫酸的用途与工业制备
(1)用途:
①重要的化工原料,可用于制化肥、农药、炸药、染料、盐类等。
②用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
硫酸的工业制备方法:
工业上一般以硫黄或其他含硫化物(如黄铁矿)的原料来制备硫酸;
金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。
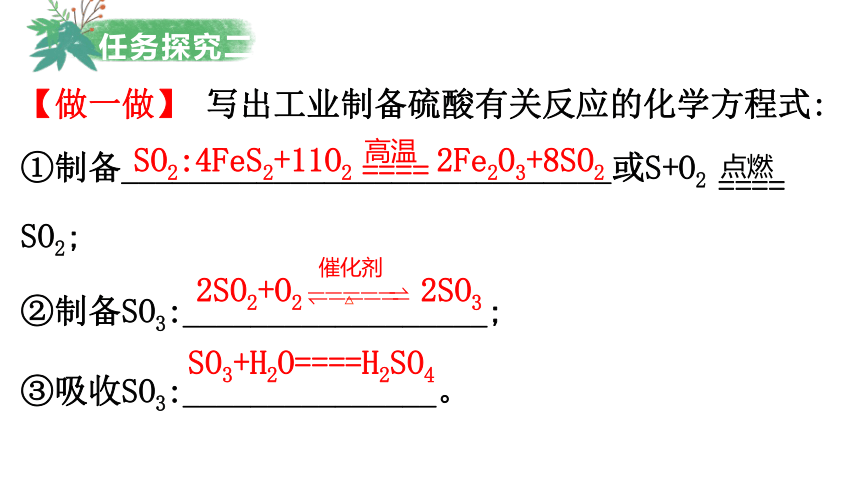
【做一做】 写出工业制备硫酸有关反应的化学方程式:
①制备_____________________________或S+O2
SO2;
②制备SO3:__________________;
③吸收SO3:_______________。
SO2:4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2 2SO3
SO3+H2O====H2SO4
高温
====
点燃
====
△
催化剂
任务探究二
硫酸的工业制备方法
4FeS2+11O2==2Fe2O3+8SO2
高温
2SO2+O2 2SO3
H2O+SO3 ===H2SO4
三原料:
三反应:
三条件:
三阶段:
SO2的制取与净化、SO2催化氧化成SO3 ,SO3的吸收和的生成
三设备:
沸腾炉(制取SO2 )、接触室(催化氧化SO2生成SO3 )、吸收塔(吸收SO3 )
黄铁矿/硫磺 、空气、水
高温(400-500℃)、催化剂(V2O5)、常压
任务探究三
2 硫酸的性质
稀硫酸——酸的通性(是强酸,具有酸的通性0
①电离方程式为H2SO4===2H++SO42-
②硫酸具有酸的通性,可与______________作用,也可与活泼金属、______、碱性
氧化物及_____________反应。
酸碱指示剂
碱
某些盐
任务探究四
【做一做】 写出下列反应的离子方程式:
(1)稀硫酸与活泼金属反应,如Zn:__________________。
(2)稀硫酸与金属氧化物反应,如CuO:_______________
____。
Zn+2H+====Zn2++H2↑
CuO+2H+====Cu2+
任务探究五
(3)稀硫酸与碱反应,如NaOH: _____________。
(4)稀硫酸与部分盐反应,如Na2CO3: _________________
____。
OH-+H+====H2O
+2H+====CO2↑
+H2O
【做一做】
2 硫酸的性质
浓硫酸的特性——强氧化性
活动1:已知Cu和稀硫酸不反应,和浓硫酸反应生成SO2,,预测浓硫酸的性质,并设计实验验证。
任务探究六
2 硫酸的性质
浓硫酸的特性——强氧化性
实验证明,浓硫酸具有强氧化性
活动1:已知Cu和稀硫酸不反应,和浓硫酸反应生成SO2,,预测浓硫酸的性质,并设计实验验证。
实验 现象 a试管中铜丝表面___________;
b试管中的溶液_____________;
c试管中的_________________________;
将a试管里的溶液慢慢倒入水中,_______
_____。
实验 结论 Cu和浓硫酸反应的化学方程式:
_________________________________
有气泡产生
逐渐变为无色
紫色石蕊溶液逐渐变为红色
溶液显
蓝色
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
△
任务探究七
2 硫酸的性质
浓硫酸的特性——强氧化性
活动3:分析稀硫酸和浓硫酸中存在的微粒,思考二者的性质差异。
稀H2SO4 浓H2SO4
溶质行为
微粒形式
粒子性质
H+和SO42-
H2SO4=2H++SO42-
含水量极少,H2SO4极难电离
H2SO4分子
H+具有酸的通性、弱氧化性
SO42-具有能和Ba2+结合成沉淀的性质
H2SO4分子具有强氧化性
任务探究七
2 硫酸的性质
浓硫酸的特性——脱水性
活动1:完成”黑面包“实验,并记录实验现象。
将浓硫酸慢慢加入蔗糖中,并用玻璃棒搅拌
任务探究九
2 硫酸的性质
浓硫酸的特性——脱水性
活动2:基于浓硫酸性质,解释“黑面包”实验的现象
现象 分析 浓硫酸的性质
蔗糖固体颜色逐渐变黑
体积逐渐膨胀,形成气孔
伴有刺激性气味,放出大量的热
C12H22O11→C
浓H2SO4→SO2
浓H2SO4的脱水性
浓H2SO4的强氧化性
任务探究十
2 硫酸的性质
浓硫酸的特性——脱水性
1.把少量浓硫酸滴在纸片或火柴梗上,有什么现象?
变黑
2.把少量浓硫酸滴在pH试纸上,有什么现象?
pH试纸先变红后变黑
活动3:基于浓硫酸性质,思考下列问题
任务探究十一
2 硫酸的性质
浓硫酸的特性——吸水性
活动1:向胆矾晶体上滴入浓硫酸,根据实验现象,推断浓硫酸的性质
滴入浓硫酸
提示:H2SO4分子与水分子可形成一系列稳定的水合物。
体现了浓硫酸的吸水性
任务探究十
2 硫酸的性质
浓硫酸的特性——吸水性
活动2:基于浓硫酸的吸水性,思考下列问题。
浓硫酸能否干燥CO2 / SO2 / H2S / NH3 / Cl2等气体?
能够干燥中性气体(如:H2、O2等)和酸性气体(如:CO2、SO2、Cl2、HCl等)
任务探究十一
练一练
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 ( )
A.上下移动①中铜丝可控制反应生成SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认有CuSO4生成,向①中加水,观察颜色
任务探究十三
【解析】选D。上下移动铜丝可以控制铜与浓硫酸的接触与分离,从而可以控制反应生成SO2的量,A项正确;SO2可使品红溶液褪色,B项正确;SO2有毒,能与NaOH溶液反应,C项正确;铜与浓硫酸反应后①中溶液显蓝色即可证明有CuSO4生成,无需向其中加水,D项错误。
D
结论:浓硫酸与不活泼金属或非金属反应的有关规律
(1)反应要加热,否则不反应。
(2)还原产物一般是SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态的氧化物或含氧酸。
(3)浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。
(4)浓硫酸与不活泼金属反应时,随着反应的进行,硫酸浓度变小,一旦变为稀硫酸,反应就停止。
小结
任务探究十四
3 硫酸根离子的检验
实验 操作
现象与结论
实验 现象 先_________ _____,加入 盐酸后_____ _______ 先________ _____,加入 盐酸后___ _________ 先_________
_____,加入盐
酸后_______
____________
_____
实验 结论 与Ba2+反应生成不溶于 盐酸的_________,离子方程 式: ___________________ 与Ba2+
反应生成白
色沉淀BaCO3,
可溶于盐酸
生成白色
沉淀
沉淀
不溶解
生成白色
沉淀
沉
淀不溶解
生成白色
沉淀
沉淀溶
解,且有气泡
产生
白色沉淀
+Ba2+ BaSO4↓
3 硫酸根离子的检验
任务探究十五
硫酸根检验方法
3 硫酸根离子的检验
被检液 取清液 有无白色沉
淀产生(判断有无 )。
先加稀盐酸的目的是_______________________。
防止 、 、Ag+干扰
任务探究十六
任务探究十八
(1)粗盐中的杂质可以用什么试剂除去?
提示:硫酸盐——BaCl2溶液;CaCl2——Na2CO3溶液;MgCl2——NaOH溶液。
(2)上述除杂试剂会不会引入新的杂质?如何除去杂质离子?
提示:
引入杂质离子 除杂试剂
BaCl2溶液 Ba2+ Na2CO3溶液
Na2CO3溶液 盐酸
NaOH溶液 OH- 盐酸
3 硫酸根离子的检验
任务探究十九
3 硫酸根离子的检验
(3)根据以上分析,写出粗盐提纯的完整流程。
提示:
任务探究十四
下列关于粗盐提纯的说法中正确的是 ( )
A.溶解粗盐时,应尽量让溶液稀一些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中,用大量水洗涤
练一练
【解析】选C。A项中,溶解粗盐时,在保证粗盐溶解的前提下应尽量少加水,避免蒸发时困难;B项中,该操作应在蒸发皿中进行;D项中,用大量水洗涤会造成食盐损失过多。
C
小结
人教版高一化学必修第二册第五章
《1、硫及其化合物》
---硫酸、硫酸根离子的检验
1.宏观辨识与微观探析:认识硫元素在物质中具有同价态,可通过氧化还原反实现含有不同价态硫元素物质的相互转化
2.变化观念与平衡思想:理解和体验实际问题抽象为数学概念的过程和思想,增强数学的应用意识。
3.证据推理与模型认知”: 能从物质类别和硫元素化合价的角度认识硫酸的性质,
4.“科学探究与创新意识: 通过实验探究浓硫酸的吸水性、脱水性和强氧化性,学会硫酸根离子的检验方法,
5.科学精神与社会责任 :结合真实情境中的应用实例或通过实验探究,了解硫、氧化硫的主要性质,认识其在生产中的应用和对生态环境的影响
核心素养目标
教学目标
教学重点: 1.掌握浓硫酸的三大特性;
2.认识浓硫酸与稀硫酸性质的不同;
3.如何检验硫酸根离子。
4、不同价态含硫物质的转化
教学难点:了解硫酸根离子的检验方法,
情境导入
现代工业之母——硫酸(H2SO4)
硫酸在化学、冶金、医药、染料等有极为广泛的应用。
生产10t青霉素要消耗2.5t硫酸,生产1t有机玻璃要消耗3t硫酸,生产1kg金属锆,要消耗20t硫酸。
有人称硫酸是化学工业生产的“发动机”。世界上常把硫酸的产量作为衡量一个国家工业发达程度的标志。
任务探究一
硫酸
1.硫酸的用途与工业制备
(1)用途:
①重要的化工原料,可用于制化肥、农药、炸药、染料、盐类等。
②用于精炼石油、金属加工前的酸洗及制取各种挥发性酸、作干燥剂等。
硫酸的工业制备方法:
工业上一般以硫黄或其他含硫化物(如黄铁矿)的原料来制备硫酸;
金属冶炼时产生的含二氧化硫废气经回收后也可用于制备硫酸。
【做一做】 写出工业制备硫酸有关反应的化学方程式:
①制备_____________________________或S+O2
SO2;
②制备SO3:__________________;
③吸收SO3:_______________。
SO2:4FeS2+11O2 2Fe2O3+8SO2
2SO2+O2 2SO3
SO3+H2O====H2SO4
高温
====
点燃
====
△
催化剂
任务探究二
硫酸的工业制备方法
4FeS2+11O2==2Fe2O3+8SO2
高温
2SO2+O2 2SO3
H2O+SO3 ===H2SO4
三原料:
三反应:
三条件:
三阶段:
SO2的制取与净化、SO2催化氧化成SO3 ,SO3的吸收和的生成
三设备:
沸腾炉(制取SO2 )、接触室(催化氧化SO2生成SO3 )、吸收塔(吸收SO3 )
黄铁矿/硫磺 、空气、水
高温(400-500℃)、催化剂(V2O5)、常压
任务探究三
2 硫酸的性质
稀硫酸——酸的通性(是强酸,具有酸的通性0
①电离方程式为H2SO4===2H++SO42-
②硫酸具有酸的通性,可与______________作用,也可与活泼金属、______、碱性
氧化物及_____________反应。
酸碱指示剂
碱
某些盐
任务探究四
【做一做】 写出下列反应的离子方程式:
(1)稀硫酸与活泼金属反应,如Zn:__________________。
(2)稀硫酸与金属氧化物反应,如CuO:_______________
____。
Zn+2H+====Zn2++H2↑
CuO+2H+====Cu2+
任务探究五
(3)稀硫酸与碱反应,如NaOH: _____________。
(4)稀硫酸与部分盐反应,如Na2CO3: _________________
____。
OH-+H+====H2O
+2H+====CO2↑
+H2O
【做一做】
2 硫酸的性质
浓硫酸的特性——强氧化性
活动1:已知Cu和稀硫酸不反应,和浓硫酸反应生成SO2,,预测浓硫酸的性质,并设计实验验证。
任务探究六
2 硫酸的性质
浓硫酸的特性——强氧化性
实验证明,浓硫酸具有强氧化性
活动1:已知Cu和稀硫酸不反应,和浓硫酸反应生成SO2,,预测浓硫酸的性质,并设计实验验证。
实验 现象 a试管中铜丝表面___________;
b试管中的溶液_____________;
c试管中的_________________________;
将a试管里的溶液慢慢倒入水中,_______
_____。
实验 结论 Cu和浓硫酸反应的化学方程式:
_________________________________
有气泡产生
逐渐变为无色
紫色石蕊溶液逐渐变为红色
溶液显
蓝色
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
△
任务探究七
2 硫酸的性质
浓硫酸的特性——强氧化性
活动3:分析稀硫酸和浓硫酸中存在的微粒,思考二者的性质差异。
稀H2SO4 浓H2SO4
溶质行为
微粒形式
粒子性质
H+和SO42-
H2SO4=2H++SO42-
含水量极少,H2SO4极难电离
H2SO4分子
H+具有酸的通性、弱氧化性
SO42-具有能和Ba2+结合成沉淀的性质
H2SO4分子具有强氧化性
任务探究七
2 硫酸的性质
浓硫酸的特性——脱水性
活动1:完成”黑面包“实验,并记录实验现象。
将浓硫酸慢慢加入蔗糖中,并用玻璃棒搅拌
任务探究九
2 硫酸的性质
浓硫酸的特性——脱水性
活动2:基于浓硫酸性质,解释“黑面包”实验的现象
现象 分析 浓硫酸的性质
蔗糖固体颜色逐渐变黑
体积逐渐膨胀,形成气孔
伴有刺激性气味,放出大量的热
C12H22O11→C
浓H2SO4→SO2
浓H2SO4的脱水性
浓H2SO4的强氧化性
任务探究十
2 硫酸的性质
浓硫酸的特性——脱水性
1.把少量浓硫酸滴在纸片或火柴梗上,有什么现象?
变黑
2.把少量浓硫酸滴在pH试纸上,有什么现象?
pH试纸先变红后变黑
活动3:基于浓硫酸性质,思考下列问题
任务探究十一
2 硫酸的性质
浓硫酸的特性——吸水性
活动1:向胆矾晶体上滴入浓硫酸,根据实验现象,推断浓硫酸的性质
滴入浓硫酸
提示:H2SO4分子与水分子可形成一系列稳定的水合物。
体现了浓硫酸的吸水性
任务探究十
2 硫酸的性质
浓硫酸的特性——吸水性
活动2:基于浓硫酸的吸水性,思考下列问题。
浓硫酸能否干燥CO2 / SO2 / H2S / NH3 / Cl2等气体?
能够干燥中性气体(如:H2、O2等)和酸性气体(如:CO2、SO2、Cl2、HCl等)
任务探究十一
练一练
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是 ( )
A.上下移动①中铜丝可控制反应生成SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认有CuSO4生成,向①中加水,观察颜色
任务探究十三
【解析】选D。上下移动铜丝可以控制铜与浓硫酸的接触与分离,从而可以控制反应生成SO2的量,A项正确;SO2可使品红溶液褪色,B项正确;SO2有毒,能与NaOH溶液反应,C项正确;铜与浓硫酸反应后①中溶液显蓝色即可证明有CuSO4生成,无需向其中加水,D项错误。
D
结论:浓硫酸与不活泼金属或非金属反应的有关规律
(1)反应要加热,否则不反应。
(2)还原产物一般是SO2,一般金属被氧化为高价态的硫酸盐,非金属被氧化为高价态的氧化物或含氧酸。
(3)浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。
(4)浓硫酸与不活泼金属反应时,随着反应的进行,硫酸浓度变小,一旦变为稀硫酸,反应就停止。
小结
任务探究十四
3 硫酸根离子的检验
实验 操作
现象与结论
实验 现象 先_________ _____,加入 盐酸后_____ _______ 先________ _____,加入 盐酸后___ _________ 先_________
_____,加入盐
酸后_______
____________
_____
实验 结论 与Ba2+反应生成不溶于 盐酸的_________,离子方程 式: ___________________ 与Ba2+
反应生成白
色沉淀BaCO3,
可溶于盐酸
生成白色
沉淀
沉淀
不溶解
生成白色
沉淀
沉
淀不溶解
生成白色
沉淀
沉淀溶
解,且有气泡
产生
白色沉淀
+Ba2+ BaSO4↓
3 硫酸根离子的检验
任务探究十五
硫酸根检验方法
3 硫酸根离子的检验
被检液 取清液 有无白色沉
淀产生(判断有无 )。
先加稀盐酸的目的是_______________________。
防止 、 、Ag+干扰
任务探究十六
任务探究十八
(1)粗盐中的杂质可以用什么试剂除去?
提示:硫酸盐——BaCl2溶液;CaCl2——Na2CO3溶液;MgCl2——NaOH溶液。
(2)上述除杂试剂会不会引入新的杂质?如何除去杂质离子?
提示:
引入杂质离子 除杂试剂
BaCl2溶液 Ba2+ Na2CO3溶液
Na2CO3溶液 盐酸
NaOH溶液 OH- 盐酸
3 硫酸根离子的检验
任务探究十九
3 硫酸根离子的检验
(3)根据以上分析,写出粗盐提纯的完整流程。
提示:
任务探究十四
下列关于粗盐提纯的说法中正确的是 ( )
A.溶解粗盐时,应尽量让溶液稀一些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩余少量液体时停止加热,利用余热将液体蒸干
D.将制得的晶体转移到新制过滤器中,用大量水洗涤
练一练
【解析】选C。A项中,溶解粗盐时,在保证粗盐溶解的前提下应尽量少加水,避免蒸发时困难;B项中,该操作应在蒸发皿中进行;D项中,用大量水洗涤会造成食盐损失过多。
C
小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
