化学人教版(2019)选择性必修二2.1.1共价键(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修二2.1.1共价键(共16张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-29 13:35:23 | ||
图片预览


文档简介
(共16张PPT)
第二章 分子结构与性质
第一节 第一课时
共价键
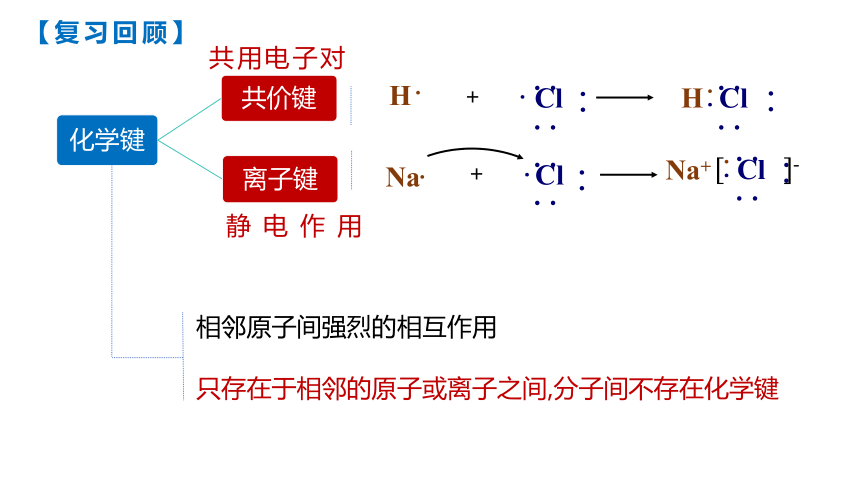
【复习回顾】
相邻原子间强烈的相互作用
只存在于相邻的原子或离子之间,分子间不存在化学键
共用电子对
静电作用
Na
Na+
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
H
H
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
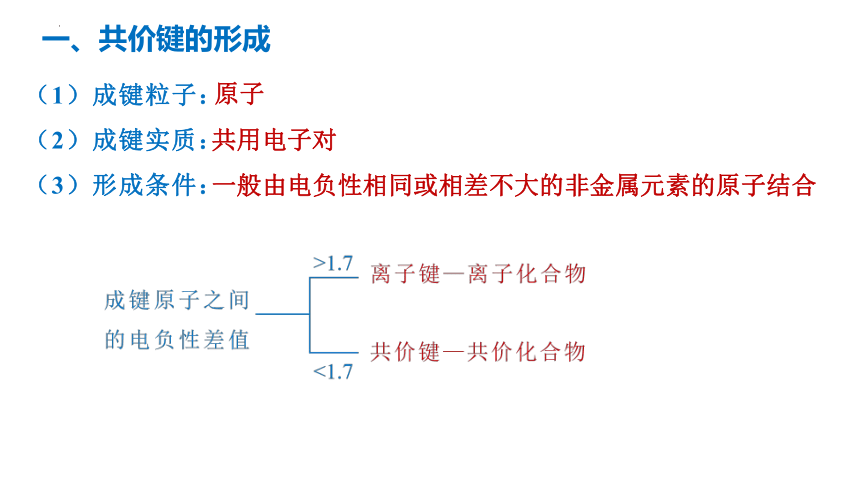
(1)成键粒子:
(2)成键实质:
(3)形成条件:
原子
共用电子对
一般由电负性相同或相差不大的非金属元素的原子结合
一、共价键的形成
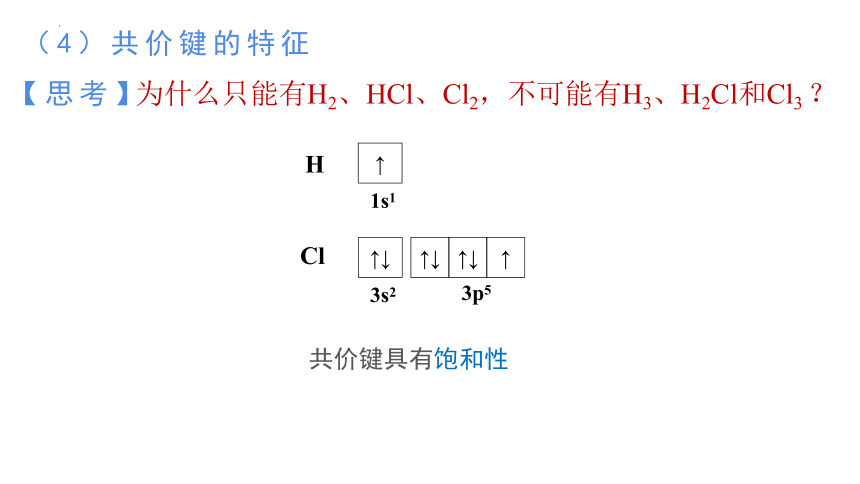
(4)共价键的特征
为什么只能有H2、HCl、Cl2,不可能有H3、H2Cl和Cl3 ?
【思考】
H
↑
1s1
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
共价键具有饱和性
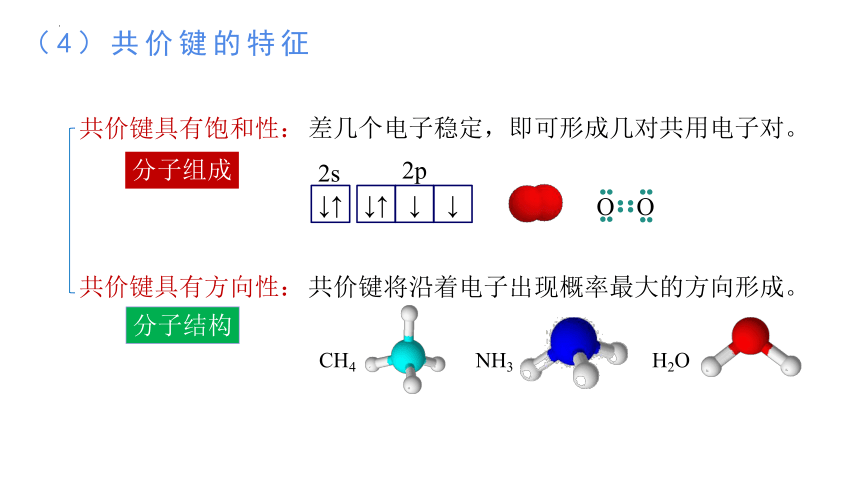
共价键具有饱和性:
差几个电子稳定,即可形成几对共用电子对。
共价键具有方向性:
分子组成
共价键将沿着电子出现概率最大的方向形成。
分子结构
O
O
↓↑
2s
↓↑
↓
↓
2p
CH4
NH3
H2O
(4)共价键的特征
(5)共价键的分类
按成键原子的原子轨道重叠方式分类
σ键
π键
按共用电子对是否发生偏移分类
极性共价键:不同种原子,电子对偏移
非极性共价键:同种原子,电子对不偏移
原子间形成共用电子对
成键原子相互接近时,原子轨道发生重叠,自旋相反的未成对电子形成共用电子对 。
从电子云
角度理解
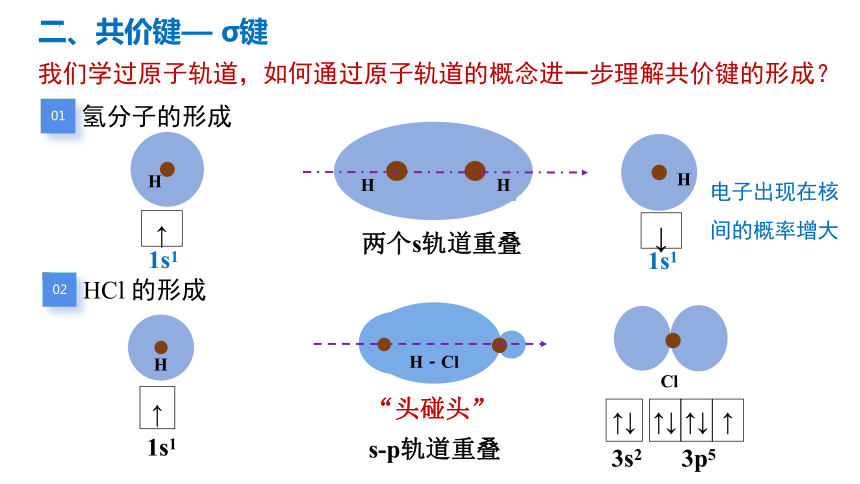
我们学过原子轨道,如何通过原子轨道的概念进一步理解共价键的形成?
二、共价键— σ键共
01
氢分子的形成
H
H
H
H
↑
1s1
↓
1s1
电子出现在核间的概率增大
02
HCl 的形成
H
Cl
H-Cl
↑
1s1
↑↓
↑↓
↑↓
↑
3s2
3p5
“头碰头”
s-p轨道重叠
两个s轨道重叠
03
Cl2 的形成
“头碰头”
p-p轨道重叠:
p-p σ键
二、共价键— σ键共
①概念:两原子的原子轨道以“头碰头”的方式重叠形成的共价键。
②分类:s-s σ键、s-p σ键、p-p σ键。
③特征:头碰头、轴对称、键强度大,不易断裂。
[练习]下列物质的σ键属于哪一种?
H2、NH3、F2、H2O
二、共价键— σ键共
p-p轨道重叠:
p-p π键
电子云由两块组成,
互为镜像
肩并肩、镜面对称、不能旋转,键强度小,易断裂。
特征:
形成共价键的未成对电子的原子轨道,采取“肩并肩”的方式重叠,这种共价键叫π键,主要类型为p-p π键。
三、共价键— π键共
【思考】
1、所有的共价键都有方向性吗?
不是,如s-s σ键就没有方向性。
3、通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
2、σ键和π键,哪个更牢固?
σ键更牢固,π键较易断裂。
σ键和π键强度不同。
p-p σ键
p-p π键
p-p π键
N2 的形成
N2共价三键:
1个 σ键,2个π键
四、σ键 和 π键 的判断
σ键
一般规律:
1个 σ键,1个π键
单键
三键
双键
1个 σ键,2个π键
练习:观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由几个σ键,几个π键构成?
7个 σ键
5个 σ键,1个π键
3个 σ键,2个π键
四、σ键 和 π键 的判断
【归纳总结】
σ键与π键的比较
键类型 σ键 π键
常见类型
原子轨道重叠方式
键的特征
原子轨道重叠程度
成键规律判断 s-s 、s-p、p-p
p-p
“头碰头”重叠
“肩并肩”重叠
轴对称,可旋转
镜面对称,不可旋转
大
小
单键:σ键;
双键:1个σ键、1个π键;
三键:1个σ键、2个π键
正误判断,正确的打“√”,错误的打“x”。
(1)共价键的成键原子只能是非金属原子。( )
(2)所有的σ键的强度都比π键的大。( )
(3)在所有分子中都存在化学键( )
(4)s-s σ键与s-p σ键的电子云形状的对称性相同。( )
(5)键可以绕键轴旋转,π键一定不能绕键轴旋转。( )
【练习】
X
X
X
√
√
学习愉快,学有所获
第二章 分子结构与性质
第一节 第一课时
共价键
【复习回顾】
相邻原子间强烈的相互作用
只存在于相邻的原子或离子之间,分子间不存在化学键
共用电子对
静电作用
Na
Na+
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
[ ]-
H
H
·
·
:
:
:
Cl
·
:
:
:
Cl
·
+
(1)成键粒子:
(2)成键实质:
(3)形成条件:
原子
共用电子对
一般由电负性相同或相差不大的非金属元素的原子结合
一、共价键的形成
(4)共价键的特征
为什么只能有H2、HCl、Cl2,不可能有H3、H2Cl和Cl3 ?
【思考】
H
↑
1s1
Cl
↑↓
↑↓
↑
↑↓
3s2
3p5
共价键具有饱和性
共价键具有饱和性:
差几个电子稳定,即可形成几对共用电子对。
共价键具有方向性:
分子组成
共价键将沿着电子出现概率最大的方向形成。
分子结构
O
O
↓↑
2s
↓↑
↓
↓
2p
CH4
NH3
H2O
(4)共价键的特征
(5)共价键的分类
按成键原子的原子轨道重叠方式分类
σ键
π键
按共用电子对是否发生偏移分类
极性共价键:不同种原子,电子对偏移
非极性共价键:同种原子,电子对不偏移
原子间形成共用电子对
成键原子相互接近时,原子轨道发生重叠,自旋相反的未成对电子形成共用电子对 。
从电子云
角度理解
我们学过原子轨道,如何通过原子轨道的概念进一步理解共价键的形成?
二、共价键— σ键共
01
氢分子的形成
H
H
H
H
↑
1s1
↓
1s1
电子出现在核间的概率增大
02
HCl 的形成
H
Cl
H-Cl
↑
1s1
↑↓
↑↓
↑↓
↑
3s2
3p5
“头碰头”
s-p轨道重叠
两个s轨道重叠
03
Cl2 的形成
“头碰头”
p-p轨道重叠:
p-p σ键
二、共价键— σ键共
①概念:两原子的原子轨道以“头碰头”的方式重叠形成的共价键。
②分类:s-s σ键、s-p σ键、p-p σ键。
③特征:头碰头、轴对称、键强度大,不易断裂。
[练习]下列物质的σ键属于哪一种?
H2、NH3、F2、H2O
二、共价键— σ键共
p-p轨道重叠:
p-p π键
电子云由两块组成,
互为镜像
肩并肩、镜面对称、不能旋转,键强度小,易断裂。
特征:
形成共价键的未成对电子的原子轨道,采取“肩并肩”的方式重叠,这种共价键叫π键,主要类型为p-p π键。
三、共价键— π键共
【思考】
1、所有的共价键都有方向性吗?
不是,如s-s σ键就没有方向性。
3、通过氮气中氮氮三键形成过程的分析,如何判断共价键是σ键或是π键?
2、σ键和π键,哪个更牢固?
σ键更牢固,π键较易断裂。
σ键和π键强度不同。
p-p σ键
p-p π键
p-p π键
N2 的形成
N2共价三键:
1个 σ键,2个π键
四、σ键 和 π键 的判断
σ键
一般规律:
1个 σ键,1个π键
单键
三键
双键
1个 σ键,2个π键
练习:观察乙烷、乙烯、乙炔的分子结构,它们的分子中的共价键分别由几个σ键,几个π键构成?
7个 σ键
5个 σ键,1个π键
3个 σ键,2个π键
四、σ键 和 π键 的判断
【归纳总结】
σ键与π键的比较
键类型 σ键 π键
常见类型
原子轨道重叠方式
键的特征
原子轨道重叠程度
成键规律判断 s-s 、s-p、p-p
p-p
“头碰头”重叠
“肩并肩”重叠
轴对称,可旋转
镜面对称,不可旋转
大
小
单键:σ键;
双键:1个σ键、1个π键;
三键:1个σ键、2个π键
正误判断,正确的打“√”,错误的打“x”。
(1)共价键的成键原子只能是非金属原子。( )
(2)所有的σ键的强度都比π键的大。( )
(3)在所有分子中都存在化学键( )
(4)s-s σ键与s-p σ键的电子云形状的对称性相同。( )
(5)键可以绕键轴旋转,π键一定不能绕键轴旋转。( )
【练习】
X
X
X
√
√
学习愉快,学有所获
