化学人教版(2019)必修第二册5.3.1硅(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.3.1硅(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-29 21:29:21 | ||
图片预览







文档简介
(共27张PPT)
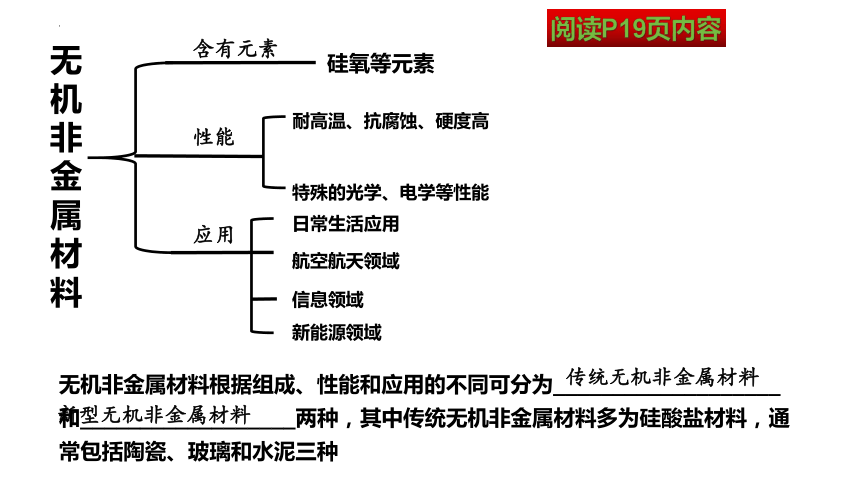
无机非金属材料
无机非金属材料
含有元素
硅氧等元素
性能
耐高温、抗腐蚀、硬度高
特殊的光学、电学等性能
应用
日常生活应用
航空航天领域
信息领域
新能源领域
无机非金属材料根据组成、性能和应用的不同可分为___________________和__________________两种,其中传统无机非金属材料多为硅酸盐材料,通常包括陶瓷、玻璃和水泥三种
传统无机非金属材料
新型无机非金属材料
阅读P19页内容
传统的无机非金属材料--硅酸盐材料
课堂导入
世界著名高科技产业区——硅谷
硅谷(Silicon Valley),位于美国加利福尼亚北部的大都会区旧金山湾区南面。硅谷最早是研究和生产以硅为基础的半导体芯片的地方,因此得名。
探知硅秘
无机非金属材料
——多角度认识硅元素
硅
汉字文化角度:硅=石+土
1、自然界中硅元素存在:岩石、沙子、土壤中
2、硅在地壳中的含量:仅次于氧,排在第二位
从晶体结构及原子结构认识硅,并总结硅的化学性质。
硅与碳一样,最外层4个电子,在化学反应中既不易失去又不易得到电子,主要形成正四价化合物。
——不活泼
硅的存在形式
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
碳—统治有机界:碳是构成有机物的主要元素。
硅—统治无机矿物界:硅是构成岩石与许多矿物的基本元素。
探究课堂
硅的存在
硅是亲氧元素,没有游离态,只有化合态。硅在自然界中主要以:
硅酸盐(如地壳中的大多数矿物)和 氧化物(如水晶、玛瑙)的形式存在。
硅酸盐——石榴石
氧化物——水晶
探究课堂
硅的类型
晶 体 硅
不 定 型 硅
要点探究
探究点一 碳 硅
碳 硅
存在形态
单质的存 在形态 金刚石、石墨、C60等同素异形体 ________和________
单质物 理性质 金刚石:________________ 石墨:__________________ ________色固体、有金属光泽,熔点高、硬度大,有脆性
游离态和化合态
化合物
晶体硅
无定形硅
熔点高、硬度大
硬度小、电的良导体
灰黑
【知识梳理】 一、碳、硅比较
碳 硅
用途 _________用作切割刀具, ________用作电极、铅笔芯 ________材料和合金材料
与非金属 单质反应 与O2反应: ____________________________ 与O2、F2反应:
________________
与氧化 物反应 与CuO、SiO2反应: ______________________________
金刚石
石墨
半导体
碳 硅
与酸反应 与浓H2SO4、浓HNO3反应: 与氢氟酸反应:
【要点深化】
碳、硅的特性
一般规律 碳、硅的特性
非金属单质一般熔点低、硬度小 金刚石、晶体硅熔点高、硬度大
非金属单质一般为绝缘体 硅为半导体,常用于电子部件;石墨为电的良导体
非金属一般不与强碱反应 Si+2NaOH+H2O=Na2SiO3+2H2↑
非金属一般不与非氧化性酸反应 Si+4HF=SiF4↑+2H2↑
硅还原性大于碳
一般情况下,较活泼金属能置换酸或水中的氢,而大多数非金属不能 Si+4HF===SiF4↑+2H2↑
硅的制备
⑴SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
⑵Si+3HCl == SiHCl3+H2
高温
⑶SiHCl3+H2 == Si+3HCl (高纯硅)
高温
若C过量: SiO2+3C == SiC + 2CO ↑
高温
碳化硅(俗名:金刚砂)
工业上用焦炭还原石英砂可知制得含有少量杂质的粗硅
提纯
如何制备高纯度的硅?
硅的制备
SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
知识点补充
探究课堂
晶体硅的物理性质
晶体硅是灰黑色、有金属光泽、硬而脆的固体,其结构类似于金刚石,熔沸点很高、硬度大,导电能力介于导体和绝缘体之间,是良好的半导体材料。
价值5元的沙子
SiO2
Si
价值5000元的芯片
点沙 成金
从沙滩到用户
晶体硅的用途
1.硅酸盐及其结构
(1)硅酸盐的概念
硅酸盐是由硅、氧和金属组成的化合物的总称。它们种类繁多、组成各异、结构复杂,在自然界中广泛存在。
(2)硅酸盐的结构
知识梳理
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合 个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的 相互连接,每个 为两个四面体所共有,与 个Si相结合。
4
O
O
2
为什么硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点?
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点
探知硅秘
重走硅路
——三大硅酸盐材料的使用和制备
—多角度认识硅元素
【活动】根据视频并阅读课本P20-21,找出三大硅酸盐材料的原料、工艺设备、和成分,归纳填写表格
传统硅酸盐材料 主要原料 主要设备 主要成分 性能
陶瓷
玻璃 水泥 公元前4500年
玻璃的诞生
近代
硅酸盐材料的使用和生产
【思考1】结合玻璃生产的原料和成分分析,烧制玻璃发生了怎样的反应?
发生了复杂的物理、化学变化,主要反应:
Na2CO3+SiO2=== Na2SiO3+CO2↑
CaCO3+SiO2=== CaSiO3+CO2↑
高温
高温
无机非金属材料
【思考2】为什么三大硅酸盐材料表现出这样的性能?
黏土
纯碱、石灰石、沙子
黏土、石灰石
玻璃窑
水泥窑
硅酸盐
Na2CO3、SiO2、CaCO3
硅酸盐
硬度高、熔点高、难溶于水、耐腐蚀
结构决定性质——稳定的硅氧四面体结构
要领:各元素写成相应的氧化物,
化合价不变,元素守恒
格式:金属氧化物、二氧化硅、水
(各氧化物前系数为最简整数比)
顺序:金属按活动顺序表
硅酸盐的盐氧化物法书写规律
用氧化物形式表示下列硅酸盐:
1、蛇纹石:H4Mg3Si2O9
2、钙长石:CaAl2SiO6
3、石棉:CaMg3Si4O12
4、长石:KAlSi3O8
5、普通玻璃:CaNa2Si6O14
3MgO·2SiO2·2H2O
CaO·Al2O3·SiO2
CaO·3MgO·4SiO2
K2O·Al2O3·6SiO2
CaO·Na2O·6SiO2
练一练
(1)玻璃:
普通玻璃:以纯碱(Na2CO3)、石灰石和石英(SiO2)为原料,经混合、粉碎,在玻璃窑中熔融制得。
2、硅酸盐工业
① 有关反应的化学方程式:
Na2CO3 + SiO2 ==== Na2SiO3 + CO2↑
CaCO3 + SiO2 ==== CaSiO3 + CO2↑
② 主要成分:
Na2SiO3、CaSiO3、SiO2(Na2O CaO 6SiO2)
高温
高温
以黏土(SiO2、Al2O3)和石灰石(CaCO3)为主要原料
经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,研成细粉就得到水泥。
石膏的作用是调节水泥硬化速度。
(2)水泥:
(3)传统硅酸盐陶瓷:
传统硅酸盐陶瓷是以黏土(SiO2、Al2O3)为原料,经高温烧结而成。日常生活中常见的陶瓷有日用器皿、建筑饰材、卫生洁具等。
谢谢观看
THANKS
无机非金属材料
无机非金属材料
含有元素
硅氧等元素
性能
耐高温、抗腐蚀、硬度高
特殊的光学、电学等性能
应用
日常生活应用
航空航天领域
信息领域
新能源领域
无机非金属材料根据组成、性能和应用的不同可分为___________________和__________________两种,其中传统无机非金属材料多为硅酸盐材料,通常包括陶瓷、玻璃和水泥三种
传统无机非金属材料
新型无机非金属材料
阅读P19页内容
传统的无机非金属材料--硅酸盐材料
课堂导入
世界著名高科技产业区——硅谷
硅谷(Silicon Valley),位于美国加利福尼亚北部的大都会区旧金山湾区南面。硅谷最早是研究和生产以硅为基础的半导体芯片的地方,因此得名。
探知硅秘
无机非金属材料
——多角度认识硅元素
硅
汉字文化角度:硅=石+土
1、自然界中硅元素存在:岩石、沙子、土壤中
2、硅在地壳中的含量:仅次于氧,排在第二位
从晶体结构及原子结构认识硅,并总结硅的化学性质。
硅与碳一样,最外层4个电子,在化学反应中既不易失去又不易得到电子,主要形成正四价化合物。
——不活泼
硅的存在形式
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
硅是一种亲氧元素,在自然界中它总是与氧相互化合的,因此硅都以化合态存在于自然界,主要以氧化物及硅酸盐的形式存在。
碳—统治有机界:碳是构成有机物的主要元素。
硅—统治无机矿物界:硅是构成岩石与许多矿物的基本元素。
探究课堂
硅的存在
硅是亲氧元素,没有游离态,只有化合态。硅在自然界中主要以:
硅酸盐(如地壳中的大多数矿物)和 氧化物(如水晶、玛瑙)的形式存在。
硅酸盐——石榴石
氧化物——水晶
探究课堂
硅的类型
晶 体 硅
不 定 型 硅
要点探究
探究点一 碳 硅
碳 硅
存在形态
单质的存 在形态 金刚石、石墨、C60等同素异形体 ________和________
单质物 理性质 金刚石:________________ 石墨:__________________ ________色固体、有金属光泽,熔点高、硬度大,有脆性
游离态和化合态
化合物
晶体硅
无定形硅
熔点高、硬度大
硬度小、电的良导体
灰黑
【知识梳理】 一、碳、硅比较
碳 硅
用途 _________用作切割刀具, ________用作电极、铅笔芯 ________材料和合金材料
与非金属 单质反应 与O2反应: ____________________________ 与O2、F2反应:
________________
与氧化 物反应 与CuO、SiO2反应: ______________________________
金刚石
石墨
半导体
碳 硅
与酸反应 与浓H2SO4、浓HNO3反应: 与氢氟酸反应:
【要点深化】
碳、硅的特性
一般规律 碳、硅的特性
非金属单质一般熔点低、硬度小 金刚石、晶体硅熔点高、硬度大
非金属单质一般为绝缘体 硅为半导体,常用于电子部件;石墨为电的良导体
非金属一般不与强碱反应 Si+2NaOH+H2O=Na2SiO3+2H2↑
非金属一般不与非氧化性酸反应 Si+4HF=SiF4↑+2H2↑
硅还原性大于碳
一般情况下,较活泼金属能置换酸或水中的氢,而大多数非金属不能 Si+4HF===SiF4↑+2H2↑
硅的制备
⑴SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
⑵Si+3HCl == SiHCl3+H2
高温
⑶SiHCl3+H2 == Si+3HCl (高纯硅)
高温
若C过量: SiO2+3C == SiC + 2CO ↑
高温
碳化硅(俗名:金刚砂)
工业上用焦炭还原石英砂可知制得含有少量杂质的粗硅
提纯
如何制备高纯度的硅?
硅的制备
SiO2+2C == Si+2CO ↑ (粗硅)
高温
内容解读
工业上利用焦炭与SiO2在高温下反应制备粗硅,由此能否说明碳的还原性大于硅?
提示:氧化性、还原性的强弱,必须是在通常的情况下发生的反应,上述反应是在高温条件下发生的,故不能比较还原性的强弱。
知识点补充
探究课堂
晶体硅的物理性质
晶体硅是灰黑色、有金属光泽、硬而脆的固体,其结构类似于金刚石,熔沸点很高、硬度大,导电能力介于导体和绝缘体之间,是良好的半导体材料。
价值5元的沙子
SiO2
Si
价值5000元的芯片
点沙 成金
从沙滩到用户
晶体硅的用途
1.硅酸盐及其结构
(1)硅酸盐的概念
硅酸盐是由硅、氧和金属组成的化合物的总称。它们种类繁多、组成各异、结构复杂,在自然界中广泛存在。
(2)硅酸盐的结构
知识梳理
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合 个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的 相互连接,每个 为两个四面体所共有,与 个Si相结合。
4
O
O
2
为什么硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点?
在硅酸盐中,Si和O构成了硅氧四面体,其结构如图所示。每个Si结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点
探知硅秘
重走硅路
——三大硅酸盐材料的使用和制备
—多角度认识硅元素
【活动】根据视频并阅读课本P20-21,找出三大硅酸盐材料的原料、工艺设备、和成分,归纳填写表格
传统硅酸盐材料 主要原料 主要设备 主要成分 性能
陶瓷
玻璃 水泥 公元前4500年
玻璃的诞生
近代
硅酸盐材料的使用和生产
【思考1】结合玻璃生产的原料和成分分析,烧制玻璃发生了怎样的反应?
发生了复杂的物理、化学变化,主要反应:
Na2CO3+SiO2=== Na2SiO3+CO2↑
CaCO3+SiO2=== CaSiO3+CO2↑
高温
高温
无机非金属材料
【思考2】为什么三大硅酸盐材料表现出这样的性能?
黏土
纯碱、石灰石、沙子
黏土、石灰石
玻璃窑
水泥窑
硅酸盐
Na2CO3、SiO2、CaCO3
硅酸盐
硬度高、熔点高、难溶于水、耐腐蚀
结构决定性质——稳定的硅氧四面体结构
要领:各元素写成相应的氧化物,
化合价不变,元素守恒
格式:金属氧化物、二氧化硅、水
(各氧化物前系数为最简整数比)
顺序:金属按活动顺序表
硅酸盐的盐氧化物法书写规律
用氧化物形式表示下列硅酸盐:
1、蛇纹石:H4Mg3Si2O9
2、钙长石:CaAl2SiO6
3、石棉:CaMg3Si4O12
4、长石:KAlSi3O8
5、普通玻璃:CaNa2Si6O14
3MgO·2SiO2·2H2O
CaO·Al2O3·SiO2
CaO·3MgO·4SiO2
K2O·Al2O3·6SiO2
CaO·Na2O·6SiO2
练一练
(1)玻璃:
普通玻璃:以纯碱(Na2CO3)、石灰石和石英(SiO2)为原料,经混合、粉碎,在玻璃窑中熔融制得。
2、硅酸盐工业
① 有关反应的化学方程式:
Na2CO3 + SiO2 ==== Na2SiO3 + CO2↑
CaCO3 + SiO2 ==== CaSiO3 + CO2↑
② 主要成分:
Na2SiO3、CaSiO3、SiO2(Na2O CaO 6SiO2)
高温
高温
以黏土(SiO2、Al2O3)和石灰石(CaCO3)为主要原料
经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,研成细粉就得到水泥。
石膏的作用是调节水泥硬化速度。
(2)水泥:
(3)传统硅酸盐陶瓷:
传统硅酸盐陶瓷是以黏土(SiO2、Al2O3)为原料,经高温烧结而成。日常生活中常见的陶瓷有日用器皿、建筑饰材、卫生洁具等。
谢谢观看
THANKS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
