化学人教版(2019)必修第二册5.2.2氨气、铵盐(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.2氨气、铵盐(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-29 21:31:43 | ||
图片预览






文档简介
(共29张PPT)
第二节 氮及其化合物
第2课时 氨气和铵盐
【核心素养】
1.宏观辨识与微观探析 辨识化学物质,掌握检验氨气和铵根离子的方法
2.科学探究与创新意识
理解喷泉实验原理、氨气的实验室制法;能设计喷泉创新实验;能解决气体的制备实验中装置的选择和连接问题
3.科学态度与社会责任
通过了解铵盐的通性,掌握氨气的实验室制法【教学重难点
1.教学重点:氨气的化学性质
2.教学难点:氨水的成分、氨气的催化氧化
2023年8月31日,上海宝山区丰翔路1258号翁牌冷藏实业有限公司发生“液氨”泄漏事故,液氨迅速气化,氨气随风飘移,易形成大面积染毒区和燃烧爆炸区,事故发生后造成15人死亡、5人重伤、20人轻伤。消防员组织一定数量的喷雾水枪向地面和空中喷雾,转移氨气的飘流方向和飘散高度。记者赶到事故发生现场,进入厂区后,一股浓烈的气味扑鼻而来,让人感到呼吸困难,寒气逼人,记者的双眼被熏得泪流不止。
【思考】
1.为什么在氨气泄漏时工厂里会寒气逼人?
2.如何吸收弥漫在空气中的大量氨气?
3.被围困在污染区的群众怎样做才能不吸入
氨气?
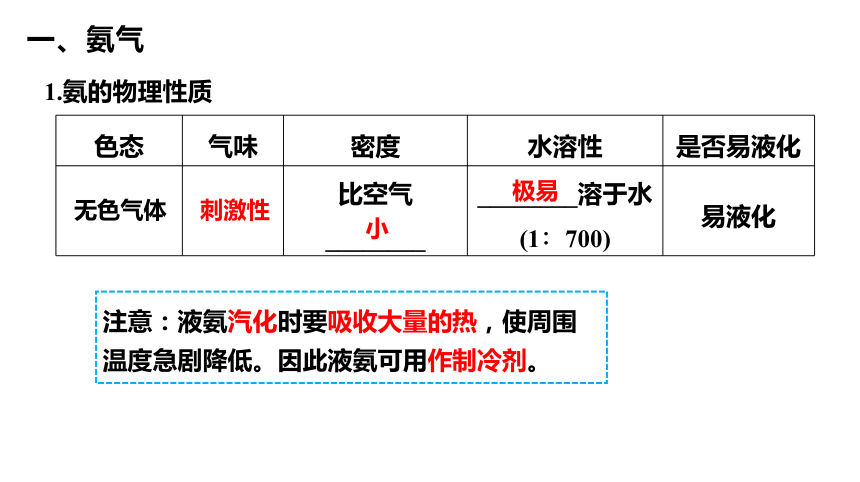
1.氨的物理性质
色态 气味 密度 水溶性 是否易液化
比空气________ ________溶于水 (1∶700) 易液化
无色气体
刺激性
小
极易
注意:液氨汽化时要吸收大量的热,使周围 温度急剧降低。因此液氨可用作制冷剂。
一、氨气
实验操作:
实验结论:
实验现象:
喷泉实验原理:
打开止水夹,挤压胶头滴管
烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉
氨极易溶于水(1:700)且水溶液显碱性
烧瓶内外存在压强差
(1)装置的气密性良好
(2)圆底烧瓶要保持干燥
(3)圆底烧瓶内要充满气体
思考:氨的喷泉实验成功的关键?
打开止水夹,
挤压胶头滴管
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
① 减少“上瓶”的压强
② 增加“下瓶”的压强
锥形瓶内发生化学反应,产生气体,从而使锥形瓶内压强迅速增大,促使锥形瓶内液体迅速向上流动
喷泉实验常见装置及原理 系统集成P23
提示:只要能使烧瓶内外形成足够大的压强差的气体与液体的组合就能产生喷泉。
气体 HCl NH3 CO2、Cl2、H2S、SO2 NO2+O2
溶液 水或碱 水或酸 碱 水或碱
常见的能形成喷泉的组合
A.挤压①的胶头滴管使CCl4全部进入烧瓶,打开止水夹
B.挤压②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
B
【课堂练习】下图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
(1)与水反应
2.NH3的化学性质
①NH3·H2O为可溶性一元弱碱,能使红色石蕊试纸变蓝
②NH3·H2O不稳定,易分解
NH3·H2O====NH3↑+H2O
△
NH3+ H2O
NH3·H2O
NH4++OH-
一水合氨
部分电离
氨气是高中阶段唯一的一种碱性气体
氨水密封保存,置于阴凉处
NH3+ H2O
NH3·H2O
NH4++OH-
【思考】氨水的主要成份有哪些?氨水、液氨、一水合氨有何区别?
液氨 一水合氨(NH3·H2O) 氨水
物质 类别
粒子 种类
NH3·H2O、NH3、H2O
NH4+、H+、OH-
混合物
氨的水溶液
纯净物
电解质
NH3·H2O
纯净物
非电解质
NH3
NH3是碱性气体,氨水是碱性溶液,NH3·H2O才是弱碱
【课堂练习】下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1mol·L-1的氨水指在1L溶液中含NH3、NH3·H2O、NH4+ 物质的量之和为1mol
D
系统集成P21
(2) 与酸的反应
NH3+HCl=NH4Cl(白烟)
思考:氨气遇到浓硝酸、浓硫酸也会产生白烟吗
NH3 + HNO3 = NH4NO3 (白烟)
2NH3 + H2SO4 = (NH4)2SO4
浓氨水与挥发性酸反应,都可生成白烟
与酸反应的本质:NH3 + H+ = NH4+
应用:可检验NH3或HCl
小结:氨气的检验方法
①用蘸取浓盐酸、浓硝酸的玻璃棒靠近,若产生白烟,则证明有NH3
②用湿润的红色石蕊试纸,若试纸变蓝,则证明有NH3
(3)还原性
①氨的催化氧化
4NH3 + 5O2
催化剂
4NO + 6H2O
③与Cl2反应
8NH3 + 3Cl2 === N2 + 6NH4Cl (氨气过量)
2NH3 + 3Cl2 === N2 + 6HCl (氨气少量)
此反应为浓氨水检验氯气管道是否泄漏的原理。
点燃
4NH3+3O2=== 2N2+6H2O
②在纯氧中燃烧
⑤氨水与盐溶液的反应
④与CuO反应:
2NH3 + 3CuO === N2+ 3H2O+3Cu
Fe3++3NH3·H2O = Fe(OH)3 ↓+3NH4+
Al3++3NH3·H2O = Al(OH)3 ↓+3NH4+
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
炸药
吸收硫酸
生产中的
二氧化硫
致冷剂
3.氨的用途和保存:
1.判断正误
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水能导电,所以氨水是电解质( )
(3)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(4)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )
(5)氨属于碱性气体,因而氨可做喷泉实验( )
×
×
×
√
√
【课堂练习】
2.氨是一种重要的工业原料,工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气,下列说法错误的是( )
A.若管道漏气,遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2时有6 mol 电子转移
C
3.下列反应中,说明氨有还原性和碱性的是( )
B
D. NH3+HCl === NH4Cl
B. 8NH3+3Cl2 === 6NH4Cl+N2
C.4NH3+5O2===4NO+6H2O
催化剂
A.2NH3+3CuO === 3Cu+N2+3H2O
4.如图所示,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅰ中产生“红色喷泉”,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是______________________________________。
(2)若要烧瓶Ⅱ中产生“蓝色喷泉”,烧瓶Ⅰ中不产生
“喷泉”现象,其操作方法是__________________________。
(3)若关闭b活塞,打开a、c活塞,再挤压胶头滴管,
在烧瓶中可观察到的现象是_______________________。
(4)若要在该装置中产生“红蓝双色喷泉”现象,其操作方法
是_________________________________________________。
打开a、b活塞,再用热毛巾捂热烧瓶Ⅰ
先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
打开b、c活塞,再挤压胶头滴管
烧瓶Ⅱ中导管口处产生白烟
二、铵盐的性质、NH4+的检验
1.铵盐是由铵根离子(NH4+)和酸根离子组成的化合物
绝大多数铵盐是白色或无色晶体,绝大多数铵盐易溶于水
农业上常用做氮肥
2.化学性质
①不稳定性 ---受热易分解
NH4Cl ===NH3↑+HCl ↑
NH4HCO3 ===NH3 ↑ +CO2 ↑ +H2O
注意:并不是所有的铵盐都受热分解生成NH3
2NH4NO3==========2N2↑+O2↑+4H2O
高温或猛烈撞击
NH4NO3 === N2O ↑ +2H2O
贮存氮肥:密封包装,放于阴凉通风处
②铵盐与碱反应
(NH4)2SO4 + 2NaOH == Na2SO4 + 2H2O + 2NH3 ↑
△
2NH4Cl + Ca(OH)2 == CaCl2+2H2O+2NH3↑
△
反应实质:NH4++ OH- == NH3 ↑ + H2O
(加热或浓溶液生成NH3 和H2O)
△
不加热:NH4++OH-= NH3·H2O
为什么铵态氮肥不能与草木灰(含K2CO3) 混合施用?
铵态氮肥和草木灰混合施用,会生成氨气,降低肥效。
3.NH4+的检验
①原理:NH4++ OH- == NH3 ↑ + H2O
△
②操作及现象
(1)绝大多数铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 NH4+ ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
√
√
×
×
【课堂练习】
1.判断正误
2.下列施用铵态氮肥的方法中,错误的是( )
A.在农作物的生长过程中使用化肥碳酸氢铵后要立即盖上泥土
B.铵态氮肥不能与草木灰混合使用
C.铵态氮肥应贮藏在避光、干燥和阴凉处
D.为了让氮肥迅速地被农作物吸收,宜在高温天进行施肥
D
第二节 氮及其化合物
第2课时 氨气和铵盐
【核心素养】
1.宏观辨识与微观探析 辨识化学物质,掌握检验氨气和铵根离子的方法
2.科学探究与创新意识
理解喷泉实验原理、氨气的实验室制法;能设计喷泉创新实验;能解决气体的制备实验中装置的选择和连接问题
3.科学态度与社会责任
通过了解铵盐的通性,掌握氨气的实验室制法【教学重难点
1.教学重点:氨气的化学性质
2.教学难点:氨水的成分、氨气的催化氧化
2023年8月31日,上海宝山区丰翔路1258号翁牌冷藏实业有限公司发生“液氨”泄漏事故,液氨迅速气化,氨气随风飘移,易形成大面积染毒区和燃烧爆炸区,事故发生后造成15人死亡、5人重伤、20人轻伤。消防员组织一定数量的喷雾水枪向地面和空中喷雾,转移氨气的飘流方向和飘散高度。记者赶到事故发生现场,进入厂区后,一股浓烈的气味扑鼻而来,让人感到呼吸困难,寒气逼人,记者的双眼被熏得泪流不止。
【思考】
1.为什么在氨气泄漏时工厂里会寒气逼人?
2.如何吸收弥漫在空气中的大量氨气?
3.被围困在污染区的群众怎样做才能不吸入
氨气?
1.氨的物理性质
色态 气味 密度 水溶性 是否易液化
比空气________ ________溶于水 (1∶700) 易液化
无色气体
刺激性
小
极易
注意:液氨汽化时要吸收大量的热,使周围 温度急剧降低。因此液氨可用作制冷剂。
一、氨气
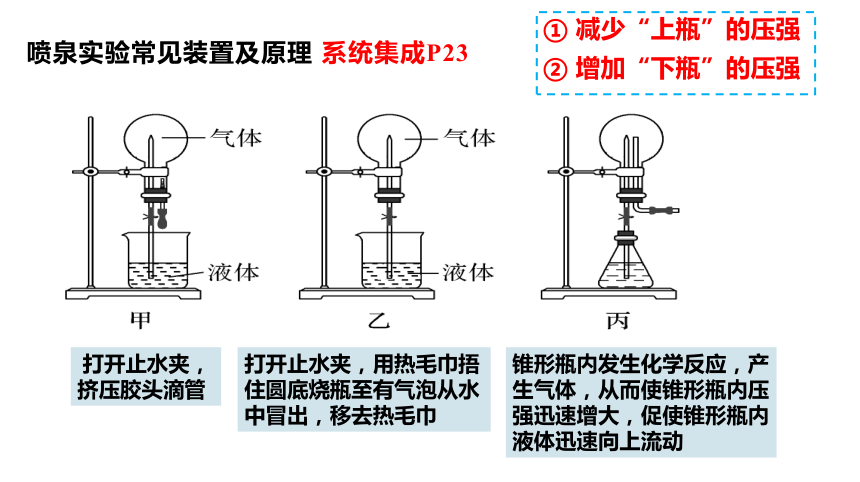
实验操作:
实验结论:
实验现象:
喷泉实验原理:
打开止水夹,挤压胶头滴管
烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉
氨极易溶于水(1:700)且水溶液显碱性
烧瓶内外存在压强差
(1)装置的气密性良好
(2)圆底烧瓶要保持干燥
(3)圆底烧瓶内要充满气体
思考:氨的喷泉实验成功的关键?
打开止水夹,
挤压胶头滴管
打开止水夹,用热毛巾捂住圆底烧瓶至有气泡从水中冒出,移去热毛巾
① 减少“上瓶”的压强
② 增加“下瓶”的压强
锥形瓶内发生化学反应,产生气体,从而使锥形瓶内压强迅速增大,促使锥形瓶内液体迅速向上流动
喷泉实验常见装置及原理 系统集成P23
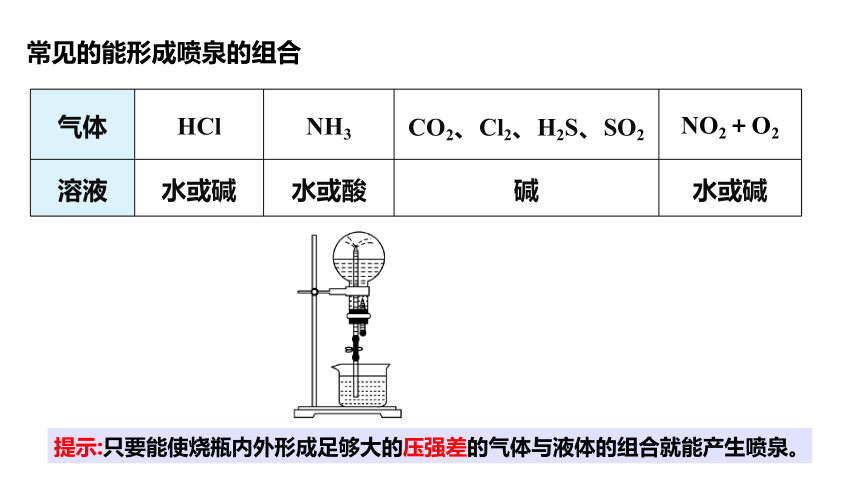
提示:只要能使烧瓶内外形成足够大的压强差的气体与液体的组合就能产生喷泉。
气体 HCl NH3 CO2、Cl2、H2S、SO2 NO2+O2
溶液 水或碱 水或酸 碱 水或碱
常见的能形成喷泉的组合
A.挤压①的胶头滴管使CCl4全部进入烧瓶,打开止水夹
B.挤压②的胶头滴管使饱和NaHCO3溶液全部进入烧瓶,打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.在装置④的水槽中加入适量生石灰并打开止水夹
B
【课堂练习】下图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
(1)与水反应
2.NH3的化学性质
①NH3·H2O为可溶性一元弱碱,能使红色石蕊试纸变蓝
②NH3·H2O不稳定,易分解
NH3·H2O====NH3↑+H2O
△
NH3+ H2O
NH3·H2O
NH4++OH-
一水合氨
部分电离
氨气是高中阶段唯一的一种碱性气体
氨水密封保存,置于阴凉处
NH3+ H2O
NH3·H2O
NH4++OH-
【思考】氨水的主要成份有哪些?氨水、液氨、一水合氨有何区别?
液氨 一水合氨(NH3·H2O) 氨水
物质 类别
粒子 种类
NH3·H2O、NH3、H2O
NH4+、H+、OH-
混合物
氨的水溶液
纯净物
电解质
NH3·H2O
纯净物
非电解质
NH3
NH3是碱性气体,氨水是碱性溶液,NH3·H2O才是弱碱
【课堂练习】下列关于氨水的叙述正确的是( )
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3(除水外)
D.1mol·L-1的氨水指在1L溶液中含NH3、NH3·H2O、NH4+ 物质的量之和为1mol
D
系统集成P21
(2) 与酸的反应
NH3+HCl=NH4Cl(白烟)
思考:氨气遇到浓硝酸、浓硫酸也会产生白烟吗
NH3 + HNO3 = NH4NO3 (白烟)
2NH3 + H2SO4 = (NH4)2SO4
浓氨水与挥发性酸反应,都可生成白烟
与酸反应的本质:NH3 + H+ = NH4+
应用:可检验NH3或HCl
小结:氨气的检验方法
①用蘸取浓盐酸、浓硝酸的玻璃棒靠近,若产生白烟,则证明有NH3
②用湿润的红色石蕊试纸,若试纸变蓝,则证明有NH3
(3)还原性
①氨的催化氧化
4NH3 + 5O2
催化剂
4NO + 6H2O
③与Cl2反应
8NH3 + 3Cl2 === N2 + 6NH4Cl (氨气过量)
2NH3 + 3Cl2 === N2 + 6HCl (氨气少量)
此反应为浓氨水检验氯气管道是否泄漏的原理。
点燃
4NH3+3O2=== 2N2+6H2O
②在纯氧中燃烧
⑤氨水与盐溶液的反应
④与CuO反应:
2NH3 + 3CuO === N2+ 3H2O+3Cu
Fe3++3NH3·H2O = Fe(OH)3 ↓+3NH4+
Al3++3NH3·H2O = Al(OH)3 ↓+3NH4+
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
炸药
吸收硫酸
生产中的
二氧化硫
致冷剂
3.氨的用途和保存:
1.判断正误
(1)液氨可用作制冷剂,是因为其汽化时吸收大量的热( )
(2)氨水能导电,所以氨水是电解质( )
(3)将蘸有浓氨水的玻璃棒靠近浓硫酸有白烟产生( )
(4)氨中氮元素的化合价为-3价,在反应中只能升高而具有还原性( )
(5)氨属于碱性气体,因而氨可做喷泉实验( )
×
×
×
√
√
【课堂练习】
2.氨是一种重要的工业原料,工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气,下列说法错误的是( )
A.若管道漏气,遇氨就会产生白烟
B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应
D.生成1 mol N2时有6 mol 电子转移
C
3.下列反应中,说明氨有还原性和碱性的是( )
B
D. NH3+HCl === NH4Cl
B. 8NH3+3Cl2 === 6NH4Cl+N2
C.4NH3+5O2===4NO+6H2O
催化剂
A.2NH3+3CuO === 3Cu+N2+3H2O
4.如图所示,可以验证NH3和HCl的有关性质。实验前a、b、c活塞均关闭。
(1)若要在烧瓶Ⅰ中产生“红色喷泉”,烧瓶Ⅱ中不产生“喷泉”现象,其操作方法是______________________________________。
(2)若要烧瓶Ⅱ中产生“蓝色喷泉”,烧瓶Ⅰ中不产生
“喷泉”现象,其操作方法是__________________________。
(3)若关闭b活塞,打开a、c活塞,再挤压胶头滴管,
在烧瓶中可观察到的现象是_______________________。
(4)若要在该装置中产生“红蓝双色喷泉”现象,其操作方法
是_________________________________________________。
打开a、b活塞,再用热毛巾捂热烧瓶Ⅰ
先打开a、c活塞,再挤压胶头滴管,片刻后,再打开b活塞
打开b、c活塞,再挤压胶头滴管
烧瓶Ⅱ中导管口处产生白烟
二、铵盐的性质、NH4+的检验
1.铵盐是由铵根离子(NH4+)和酸根离子组成的化合物
绝大多数铵盐是白色或无色晶体,绝大多数铵盐易溶于水
农业上常用做氮肥
2.化学性质
①不稳定性 ---受热易分解
NH4Cl ===NH3↑+HCl ↑
NH4HCO3 ===NH3 ↑ +CO2 ↑ +H2O
注意:并不是所有的铵盐都受热分解生成NH3
2NH4NO3==========2N2↑+O2↑+4H2O
高温或猛烈撞击
NH4NO3 === N2O ↑ +2H2O
贮存氮肥:密封包装,放于阴凉通风处
②铵盐与碱反应
(NH4)2SO4 + 2NaOH == Na2SO4 + 2H2O + 2NH3 ↑
△
2NH4Cl + Ca(OH)2 == CaCl2+2H2O+2NH3↑
△
反应实质:NH4++ OH- == NH3 ↑ + H2O
(加热或浓溶液生成NH3 和H2O)
△
不加热:NH4++OH-= NH3·H2O
为什么铵态氮肥不能与草木灰(含K2CO3) 混合施用?
铵态氮肥和草木灰混合施用,会生成氨气,降低肥效。
3.NH4+的检验
①原理:NH4++ OH- == NH3 ↑ + H2O
△
②操作及现象
(1)绝大多数铵盐都易溶于水,且都易分解( )
(2)铵盐都不稳定,受热分解都生成NH3( )
(3)向某溶液中加入稀NaOH溶液,湿润的红色石蕊试纸不变蓝,则原溶液中一定无 NH4+ ( )
(4)NH4Cl受热分解,所以可用加热的方法分离NH4Cl和NaCl( )
√
√
×
×
【课堂练习】
1.判断正误
2.下列施用铵态氮肥的方法中,错误的是( )
A.在农作物的生长过程中使用化肥碳酸氢铵后要立即盖上泥土
B.铵态氮肥不能与草木灰混合使用
C.铵态氮肥应贮藏在避光、干燥和阴凉处
D.为了让氮肥迅速地被农作物吸收,宜在高温天进行施肥
D
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
