2023年广东省普通高中化学学业水平合格性考试真题卷(含解析)
文档属性
| 名称 | 2023年广东省普通高中化学学业水平合格性考试真题卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 414.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-02-29 23:05:23 | ||
图片预览




文档简介
2023年广东省普通高中学业水平合格性考试真题卷
(时间:60分钟 满分:100分)
班级:__________ 姓名:__________ 考号:__________
一、单选题:本大题共35小题,每小题2分,共70分。在每小题列出的四个选项中,只有一个选项符合题目要求。
1.我国古代劳动人民制造了美观的灯具,下列文物的主要材质属于无机非金属材料的是( )
文物
选项 A.错银铜牛灯 B.鎏金羊形铜灯 C.花卉纹陶瓷书灯 D.彩绘雁鱼铜灯
2.2023年5月10日,长征七号遥七运载火箭将“天舟六号”货运飞船送入预定轨道。该火箭采用液氧煤油发动机。液氧为( )
A.化合物 B.溶液
C.混合物 D.单质
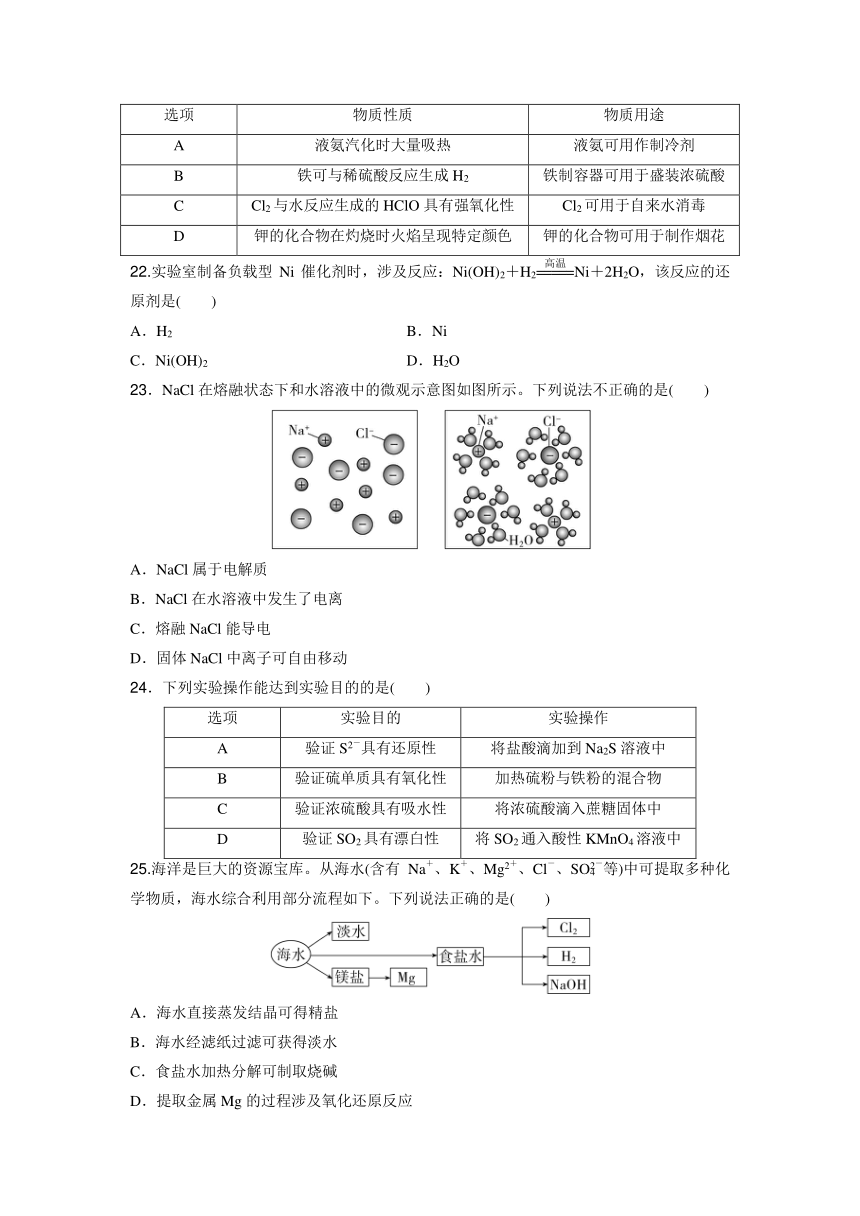
3.2022年,我国科学家利用重离子加速器合成了一种新核素Th,该核素( )
A.质子数为207 B.中子数为90
C.核外电子数为90 D.与Pb互为同位素
4.“奋斗者号”载入深海潜水器在海底拍到如图所示的壮丽景象。其中的光柱主要源于( )
A.分子运动
B.丁达尔效应
C.光的反射
D.海水的流动
5.某工厂强酸性废水中,可能大量存在的一组离子是( )
A.Mg2+、Cl- B.K+、OH-
C.Na+、CO D.Ba2+、SO
6.在劳动中合理利用化学知识可达到事半功倍的效果。下列做法不涉及化学变化的是( )
A.用食醋清除水壶中的少量水垢
B.用酒精擦拭桌面上的油性笔迹
C.用不锈钢高压锅快速蒸煮肉类食物
D.用含NaOH和Al粉的管道疏通剂疏通厨卫管道
7.配制250 mL 0.100 mol·L-1的NaCl溶液时,不需要用到的仪器是( )
8.咖啡的提取物广泛应用于食品、饮料等,其主要功效成分为咖啡因(C8H10N4O2)。1 mol C8H10N4O2中,N的物质的量为( )
A.1 mol B.4 mol
C.8 mol D.10 mol
9.下列体检项目的检查结果以物质的量浓度呈现的是( )
选项 项目名称 检查结果 单位
A 总蛋白 70.6 g·L-1
B 总胆固醇 4.27 mmol·L-1
C 收缩压 105 mmHg
D 谷丙转氨酶 7 U·L-1
10.某饮用水中K+的含量为0.39 mg·L-1,佳佳同学参加学农活动时喝了1 L该饮用水,则她摄入的K+数目约为( )
A.6.02×1018 B.6.02×1021
C.3.01×1021 D.3.01×1018
11.某同学在实验室进行Cl2制备实验。下列做法不符合实验室安全规范的是( )
A.实验开始前,佩戴好护目镜
B.实验过程中,保持排风设备开启
C.检查并确认装置气密性后,按实验方案进行实验
D.实验结束后,将反应残余物倒入下水道
12.党的二十大报告提出:“推动绿色发展,促进人与自然和谐共生。”下列做法不符合绿色化学理念的是( )
A.生产过程中“先污染后治理”
B.提高化工生产中的能源利用率
C.研究开发可降解的高分子材料
D.用原子利用率100%的反应生产环氧乙烷
13.用如图所示装置除去Cl2中混有的少量HCl,溶液a应为( )
A.饱和食盐水
B.NaOH溶液
C.AgNO3溶液
D.饱和NaHCO3溶液
14.我国的年发电量高居世界第一。下列过程中,涉及电能转化为化学能的是( )
A.用风能发电 B.用电风扇降温
C.给蓄电池充电 D.自来水厂将水抽到高处
15.用聚合物包覆Mg微球可制得镁基微马达(如图)。在盐酸中,微马达包覆层开口处反应排出气体使其定向运动。在该微马达中能替代Mg的金属是( )
A.Zn B.Cu
C.Ag D.Au
16.药物的开发利用提高了人类健康水平,但药物使用必须规范合理。下列用药方法合理的是( )
A.为快速缓解病情,超量服用药物
B.早上忘记服药,中午加倍用药以弥补疗效
C.医生根据病人体重、年龄等因素调整药物用量
D.家庭成员出现相同症状,成人直接将自己的药物给儿童服用
17.同分异构现象的广泛存在,是有机物种类繁多的重要原因之一。下列烷烃中,存在同分异构现象的是( )
A.CH4 B.C2H6
C.C3H8 D.C4H10
18.运用思维图学习,有助于提高归纳整理能力。如图为物质X的思维图。X可能为( )
A.N2 B.NO2
C.NO D.SO3
19.实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类在利用自然资源方面追求的目标。下列做法不利于实现该目标的是( )
A.以天然气为原料生产甲醇
B.将煤气化使其转化为水煤气
C.大力推广以煤为燃料的火力发电
D.石油裂解获得乙烯等重要化工原料
20.近年来,蚕丝成为材料领域中的新星。下列关于蚕丝的说法不正确的是( )
A.主要成分为纤维素 B.难溶于水
C.主要成分为蛋白质 D.是天然高分子材料
21.物质的性质决定其用途,下列物质性质与其用途不匹配的是( )
选项 物质性质 物质用途
A 液氨汽化时大量吸热 液氨可用作制冷剂
B 铁可与稀硫酸反应生成H2 铁制容器可用于盛装浓硫酸
C Cl2与水反应生成的HClO具有强氧化性 Cl2可用于自来水消毒
D 钾的化合物在灼烧时火焰呈现特定颜色 钾的化合物可用于制作烟花
22.实验室制备负载型Ni催化剂时,涉及反应:Ni(OH)2+H2Ni+2H2O,该反应的还原剂是( )
A.H2 B.Ni
C.Ni(OH)2 D.H2O
23.NaCl在熔融状态下和水溶液中的微观示意图如图所示。下列说法不正确的是( )
A.NaCl属于电解质
B.NaCl在水溶液中发生了电离
C.熔融NaCl能导电
D.固体NaCl中离子可自由移动
24.下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
A 验证S2-具有还原性 将盐酸滴加到Na2S溶液中
B 验证硫单质具有氧化性 加热硫粉与铁粉的混合物
C 验证浓硫酸具有吸水性 将浓硫酸滴入蔗糖固体中
D 验证SO2具有漂白性 将SO2通入酸性KMnO4溶液中
25.海洋是巨大的资源宝库。从海水(含有Na+、K+、Mg2+、Cl-、SO等)中可提取多种化学物质,海水综合利用部分流程如下。下列说法正确的是( )
A.海水直接蒸发结晶可得精盐
B.海水经滤纸过滤可获得淡水
C.食盐水加热分解可制取烧碱
D.提取金属Mg的过程涉及氧化还原反应
26.如图是常用的气体发生装置示意图。该装置适合于( )
A.用铜屑和浓硫酸制备SO2
B.用铜片和浓硝酸制备NO2
C.用浓盐酸和MnO2制备Cl2
D.用固体NH4Cl和Ca(OH)2制备NH3
27.高纯硅是制造半导体芯片的基础材料。在硅的制备和提纯过程中,硅元素化合价升高的是( )
A.石英砂和焦炭反应得到粗硅
B.粗硅与HCl反应制得SiHCl3粗品
C.用蒸馏法对SiHCl3粗品进行提纯
D.H2和SiHCl3反应得到高纯硅
28.铝及其化合物的用途广泛。部分含铝物质的类别与所含铝元素化合价的关系如图所示。下列推断不正确的是( )
A.a可与O2反应转化为b
B.a可与盐酸反应转化为c
C.b可与KOH溶液反应转化为c
D.c的溶液可与O2反应转化为a
29.丙烷脱氢生成丙烯的反应为C3H8(g) == C3H6(g)+H2(g)。该反应在恒容密闭容器中进行,下列情况不能说明该反应一定达到化学平衡的是( )
A.C3H8的质量保持不变
B.C3H6的含量保持不变
C.H2的物质的量保持不变
D.C3H8的消耗速率与C3H6的生成速率相等
30.密闭容器中丁二烯(C4H6)进行“二聚反应”,不同时间C4H6的浓度如表所示:
t/s 0 1 000 2 000 3 000
c(C4H6)/(mmol·L-1) 10.0 6.3 4.6 3.6
前2 000 s内C4H6的平均反应速率为( )
A.2.3×10-3 mmol·L-1·s-1
B.2.7×10-3 mmol·L-1·s-1
C.3.2×10-3 mmol·L-1·s-1
D.4.6×10-3 mmol·L-1·s-1
31.科学家采用一种“机械化学”的新方法,在45 ℃和常压条件下,使N2和H2反应生成NH3。下列说法不正确的是( )
A.该方法属于人工固氮
B.该反应是一个可逆反应
C.该反应的气体分子总数增加
D.原料N2可由分离液化空气获得
32.由碳元素组成的石墨烯和碳纳米管在柔性电子器件领域具有广阔的应用前景。碳纳米管和石墨烯互为( )
A.同位素 B.同分异构体
C.同系物 D.同素异形体
33.钒(V)电池是一种绿色环保蓄电池。某钒电池结构如图所示,电池放电时,正极反应中V由+5价变为+4价,则负极的电极反应式为( )
A.V2+-e-===V3+
B.VO2+-e-===VO
C.V3++e-===V2+
D.VO+e-===VO2+
34.钠及其化合物用途广泛。下列反应对应的离子方程式书写正确的是( )
A.用NaOH溶液吸收Cl2:Cl2+OH-===HClO+Cl-
B.用小苏打治疗胃酸过多:CO+2H+===CO2↑+H2O
C.用Na2O2与水反应制O2:Na2O2+2H2O===2Na++2OH-+O2↑
D.用NaOH溶液溶解Al(OH)3:Al(OH)3+OH-===AlO+2H2O
35.科学家在春秋战国时期的古芮国遗址中发现一种化妆品。经检测,该化妆品中的油脂经过漫长时间发生了水解。油脂的水解产物有( )
A.脂肪酸 B.氨基酸
C.葡萄糖 D.麦芽糖
二、不定项选择题:本大题共15小题,每小题2分,共30分。在每小题列出的四个选项中,至少有一个选项符合题目要求,少选且正确给1分,未选、多选、错选均不给分。
用FeCl3溶液腐蚀覆铜板上不需要的铜,是制作印刷电路板的关键技术,该过程中产生的腐蚀废液可回收利用。实验流程如下:
综合上述材料,回答36~40小题。
36.“氧化”步骤中,可用的试剂为( )
A.碘水 B.氨水
C.氯气 D.稀盐酸
37.“调pH”后,检验Fe3+是否沉淀完全的操作为:取少量浊液于试管中,( )
A.滴加几滴酸性KMnO4溶液
B.加入盐酸酸化,再滴加几滴KSCN溶液
C.静置,取上层清液于另一试管中,滴加酚酞溶液
D.静置,取上层清液于另一试管中,滴加KSCN溶液
38.进行“灼烧”操作时需用到的仪器有( )
A.坩埚 B.烧杯
C.漏斗 D.酒精灯
39.CuCl2溶解度随温度的变化如下图所示,用盐酸“酸化”后,在HCl氛围下进行的“步骤X”包含的操作有( )
A.蒸发浓缩 B.冷却结晶
C.蒸发结晶 D.加热蒸干
40.某同学在“氧化”步骤中使用H2O2做氧化剂,观察到溶液颜色加深且有气体产生。该同学根据已学知识进行的推测合理的是( )
A.该步骤中Fe2+被氧化为Fe3+
B.该气体能使带火星的木条复燃
C.H2O2在分解产生气体的反应中只做氧化剂
D.H2O2的分解产物对环境友好,不造成污染
化学家舍勒是化学史上最灿烂的明星之一,他把一生都献给了化学。舍勒发现了氧、氯、锰、氟等元素,以及盐酸、氨、氢氟酸、磷酸、亚硝酸、亚砷酸铜、钨酸钙、硫酸亚铁和苹果酸等很多物质。这些物质的部分组成元素在元素周期表中的位置如下所示:
结合上述材料,回答41~45小题。
41.下列说法正确的有( )
A.非金属性:Cl>S>P
B.原子半径:O>N>C
C.碱性:Ca(OH)2>Mg(OH)2
D.原子最外层电子数:H>Na>F
42.亚砷酸铜俗称舍勒绿,其中的砷(As)位于( )
A.第4周期第ⅤA族 B.第3周期第ⅤA族
C.第4周期第15列 D.第3周期第15列
43.化学区别于其他科学最本质的特征是发现和创造新物质。到目前为止,由元素周期表中的一百多种元素组成的物质已超过1亿种。下列化合物中含有离子键的有( )
A.NF B.CaSO4
C.NH3 D.NaNO2
44.在有机化学还处于萌芽阶段时,舍勒就发现了十几种有机酸。已知苹果酸的分子式为C4H6O5,其在足量O2中完全燃烧,生成CO2与H2O的物质的量之比为( )
A.4∶3 B.3∶2
C.2∶1 D.2∶3
45.舍勒发现的下列物质中,含有非极性共价键的物质是( )
A.Cl2 B.HCl
C.H3PO4 D.FeSO4
近年来,我国科学家在利用碳的氧化物制备基础有机原料领域取得了一系列令世界瞩目的成果,如:
①利用月壤作为光催化剂,实现CO2与H2反应合成CH4与CH3OH(甲醇);
②研制了一种新催化剂,实现CO2与H2在常压下转化为烯烃(如1戊烯);
③开发了一种新型电催化剂,实现CO与H2高效率生成CH3COOH。
结合上述材料,回答46~50小题。
46.关于成果①中反应产物的说法正确的是( )
A.CH3OH中含有羧基
B.CH3OH的相对分子质量为32
C.CH4的分子空间结构为正四面体
D.CH4与Cl2在光照下可发生取代反应
47.与乙烯类似,1戊烯(CH2===CHCH2CH2CH3)可与Br2发生加成反应,产物为( )
A.CH2Br—CHBr—CH2—CH2—CH3
B.CH3—CHBr—CHBr—CH2—CH3
C.CH2Br—CH2—CH2—CH2—CH2Br
D.CHBr2—CH2—CH2—CH2—CH3
48.成果③中,CO与H2转化为CH3COOH时,会产生少量的副产物乙醇。下列物质中,既能与乙酸反应,又能与乙醇反应的是( )
A.Na B.O2
C.Na2CO3 D.NaCl
49.化学工业中,乙酸可由甲醇羰基化法生产,反应为CH3OH+X―→CH3COOH。已知该反应的原子利用率为100%,则X为( )
A.CH4 B.O2
C.CO2 D.CO
50.上述材料所提及的产物中,含有的化学键包括( )
A.碳氢键 B.碳碳单键
C.碳碳双键 D.碳碳三键
参考答案
1.C A项主要材质是金属银和铜;B项主要材质是金属铜;C项主要材料是陶瓷,属于无机非金属材料;D项主要材质是金属铜。
2.D 液氧只含一种元素氧,是单质,答案选D。
3.C A项,质子数为90;B项,中子数=207-90=117;C项,核外电子数与质子数相等,均为90;D项,同位素必须是同种元素。
4.B 海水属于胶体,海水中的胶粒对光有散射作用。
5.A A项,没有产生沉淀气体难电离的物质,也没有发生氧化还原反应,所以能共存;B项,OH-与H+生成水,不能共存;C项,CO与H+生成二氧化碳和水,不能共存;D项,SO和Ba2+生成不溶于酸的沉淀,不能共存。
6.B A项,醋酸和水垢反应,溶解难溶物质;B项,酒精和油性物质相似相溶,不涉及化学变化;C项,在加热的情况下食物发生许多物理和化学变化;D项,氢氧化钠和铝反应产生的氢气会加大气压使管道疏通。
7.D 配制一定物质的量浓度的溶液的实验步骤:计算、称量(或量取)、溶解、移液、洗涤、定容、摇匀等,由实验步骤确定所用仪器,则配制250 mL 0.10 mol·L-1的NaCl溶液时,称量用到托盘天平、药匙,溶解用到烧杯、玻璃棒,移液要向250 mL容量瓶中转移并用玻璃棒引流,定容用到胶头滴管,不需要用到的仪器为试管,答案选D。
8.B 1 mol C8H10N4O2中含有4 mol N,8 mol C,10 mol H,所以答案选B。
9.B A项中单位是克每升,是质量浓度;B项中单位是毫摩尔每升,符合题目要求;C项是压强的单位;D项中U·L-1是浓度单位,U是国际单位的简写。
10.A n==0.01 mmol;N=NA×n=6.02×1023×0.000 01=6.02×1018。
11.D 盐酸和二氧化锰混合产生氯气:MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑,产生有毒有害的氯气,所以用到护目镜,A项正确;B项是使用排风设备,有利于排出有毒气体;C项是保证装置气密性,防止氯气泄漏;D项涉及对酸溶液和锰离子的处理,需要用碱性物质处理才能排放。
12.A A项,不能污染环境;B项,提高能源利用率,可防止残渣排放;C项,开发可以降解的高分子材料,可防止白色污染;D项,原子利用率高,可防止产生其他物质。B、C、D三项均符合绿色化学理念。
13.A A项,饱和食盐水中有大量氯离子,可抑制氯气与水反应生成氯离子,从而抑制氯气溶于水;B项,碱液会与氯气反应;C项,氯气会与银离子反应;D项,碱性溶液会与氯气反应。
14.C A项是机械能转化为电能;B项是电能转化为机械能;C项是消耗电能转为化学能;D项是消耗电能转化为势能。
15.A A项:Zn+2H+===Zn2++H2↑,释放氢气产生动力。B、C、D三项中的金属活动性排在氢之后,不发生反应,也就不能制微马达。
16.C 使用药物需要在医生的诊断下根据病人的实际情况调整用量,所以C项是对的。A项超量,错误;B项加倍,错误;D项没有医生的指导,错误。
17.D A、B、C三项中碳原子数太少,不能形成碳链异构结构,没有同分异构体。D项有正丁烷和异丁烷两种同分异构体,所以答案选D。
18.C A项,N2不是氧化物,是单质,不符合题意;B项,NO2能与水反应,溶于水,不符合题意;D项,SO3不能与氧气反应,没有还原性,不符合题意。
19.C A、B、D三项都不会造成环境污染,有利于实现目标。C项,大量使用燃煤,将产生大量的有害气体和烟尘,不利于实现该目标。故答案选C。
20.A 蚕丝主要成分是蛋白质,是难溶于水的天然高分子材料。
21.B A、C、D三项中性质和用途相匹配。B项铁在浓硫酸中会被氧化产生致密的氧化膜,产生钝化现象,不会进一步与浓硫酸反应,所以可以用铁制容器盛装浓硫酸。
22.A A项,氢气失去电子,是还原剂;B项,镍是还原产物;C项,氢氧化镍得电子,是氧化剂;D项,水是氧化产物。故答案选A。
23.D NaCl溶于水的过程中生成Na+和Cl-,离子键被破坏,是电解质,氯化钠固体在融化状态下阴、阳离子能自由移动,通电即可导电,故A项正确;将NaCl固体加入水中时,在水分子的作用下,Na+和Cl-之间的相互作用被破坏,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子,发生了电离,故B正确;氯化钠固体在融化状态下阴、阳离子能自由移动,通电即可导电,故C项正确;NaCl固体中含有带正电荷的钠离子和带负电荷的氯离子,由于带相反电荷的离子间的相互作用,Na+和Cl-按一定规则紧密地排列着,NaCl固体中的阴、阳离子不可以自由移动,故D项错误。
24.B A项中盐酸滴加到硫化钠溶液中产生硫化氢气体,体现酸性;B项中生成硫化亚铁,硫得到电子,体现氧化性;C项中浓硫酸体现脱水性;D项中二氧化硫体现还原性。
25.D A项,海水蒸发得到粗盐,粗盐提纯后得到精盐;B项,海水过滤得到去掉泥沙的海水;C项,食盐水加热结晶成为食盐,不能得到烧碱,烧碱要电解饱和食盐水才能制得;D项,提取金属镁需要使海水中的镁离子得到电子,涉及氧化还原反应。答案选D。
26.B A项,需要加热;B项,不需要加热就可以制取二氧化氮;C项,需要加热;D项,需要加热,而且一般在大试管中进行反应。
27.B A项,硅化合价降低;B项,由单质转变为化合物,化合价升高;C项,没有发生化学反应;D项,氢气还原化合物SiHCl3得到硅单质,硅元素的化合价降低。
28.D 题图中所示铝元素不同化合价的物质:a为Al,b为Al2O3,c为KAl(OH)4或AlCl3。Al与O2发生反应生成Al2O3,故A项不符合题意;Al2O3与盐酸反应生成AlCl3,故B项不符合题意;Al2O3与碱液反应生成KAl(OH)4,故C项不符合题意;盐溶液中铝是正三价,不能被氧气所氧化,所以D项符合题意。
29.D A、B、C三项均符合平衡状态标志之一:各成分的量保持不变;D项没有体现平衡状态标志之一:某物质正、逆反应速率相等,C3H8的消耗速率与C3H6的生成速率相等只体现两物质正反应速率相等。
30.B v(C4H6)==2.7×10-3 mmol·L-1·s-1。
31.C A项,把氮气转变为氨,由单质变为化合物,属于人工固氮;B项,反应物和产物都是气体的非爆炸性反应一般是可逆反应;C项,由化学方程式N2+3H2??2NH3可知:由反应物生成产物是物质的量减少的反应;D项,把空气液化,然后利用沸点不同分离氮气和氧气等。
32.D
33.A 正极得到电子,正极反应中V由+5价变为+4价,只有VO转变VO2+符合,负极则失去电子,所以A项符合题意。
34.D A项,NaOH与Cl2反应得到次氯酸盐,没有次氯酸,错误;B项,小苏打是碳酸氢盐,离子方程式中的反应物要写碳酸氢根的形式,错误;C项,原子个数不守恒,错误;D项符合要求,正确。
35.A A项,油脂水解得到脂肪酸和甘油,正确;B项,蛋白质水解得到氨基酸;C项,多糖水解的产物有葡萄糖;D项,麦芽糖由糖类水解得到。
36.C A项,碘水的氧化能力弱,不能氧化亚铁离子;B项,氨水不具有氧化性,不符合要求;C项,氯气是强氧化剂,符合要求;D项,盐酸不能氧化亚铁离子。
37.D A项,高锰酸钾对铁离子不起氧化作用,不能用来检验铁离子;B项,加盐酸酸化,氢氧化铁与酸反应产生铁离子,干扰检验,不符合要求;C项,铁离子或者亚铁离子具有同样的效果,不符合要求;D项,铁离子会有显色反应,符合要求。故答案选D。
38.AD 高温灼烧要使用坩埚和酒精灯,不需要烧杯和漏斗。
39.AB 针对溶解度随温度升高而增大的物质采取的方法是蒸发浓缩,冷却结晶。针对溶解度随温度而降低的物质采取的方法则是蒸发结晶,趁热过滤,或者直接蒸干。
40.ABD A项,亚铁离子被双氧水氧化,符合正确推理;B项,双氧水在催化剂的条件下促进分解,产生氧气和水,符合题意;C项,双氧水分解中,双氧水既是氧化剂又是还原剂,故C项不正确;D项,双氧水分解产物是水和氧气,不造成污染,符合题意。
41.AC A项,同周期元素从左至右,元素的非金属性逐渐增大,正确;B项,同周期原子从左至右半径逐渐变小,不正确;C项,同主族元素从上至下金属增强,最高价氧化物的水化物的碱性增强,正确;D项,第ⅠA族元素的最外层电子数相等(均为1),F为第ⅦA族元素,最外层电子数为7,不正确。
42.AC 砷属于第4周期第ⅤA族元素,位于周期表第15列,答案选AC。
43.BD 活泼金属阳离子与强酸阴离子构成离子化合物,具有离子键,符合题目要求,所以答案选BD。A、C项全是非金属元素构成的分子,只含有共价键。
44.A 根据原子个数守恒,苹果酸分子含有4个碳原子,6个氢原子,形成的二氧化碳和水的个数之比是4∶3,故答案选A。
45.A 同种原子之间形成非极性共价键,所以氯气符合要求;B、C、D三项均是不同原子之间形成极性共价键。故答案选A。
46.BCD 甲醇只含有羟基,A项不正确;甲醇的相对分子质量为32,B项正确;甲烷是正四面体结构,C项正确;甲烷和氯气在光照下可以发生一系列取代反应,D项正确。
47.A 1戊烯与溴加成在1,2号位置,所以答案选A。
48.A 钠可以与酸反应,也可以和醇反应置换出氢气,A项符合题意;B项中氧气只能与醇反应,不与酸反应;C项中乙酸可以与碳酸钠反应生成碳酸并分解产生二氧化碳和水;D项中氯化钠不与乙酸反应,也不与乙醇反应。
49.D 根据方程式原子个数守恒,可知X是CO。
50.ABC 产物甲烷含有碳氢键;甲醇含有碳氢键和氢氧键和碳氧单键;1戊烯含有碳氢键、碳碳双键和碳碳单键;乙酸含有碳碳单键、碳氢键、氢氧键、碳氧单键和碳氧双键。综上所述,没有碳碳三键。故答案选ABC。
(时间:60分钟 满分:100分)
班级:__________ 姓名:__________ 考号:__________
一、单选题:本大题共35小题,每小题2分,共70分。在每小题列出的四个选项中,只有一个选项符合题目要求。
1.我国古代劳动人民制造了美观的灯具,下列文物的主要材质属于无机非金属材料的是( )
文物
选项 A.错银铜牛灯 B.鎏金羊形铜灯 C.花卉纹陶瓷书灯 D.彩绘雁鱼铜灯
2.2023年5月10日,长征七号遥七运载火箭将“天舟六号”货运飞船送入预定轨道。该火箭采用液氧煤油发动机。液氧为( )
A.化合物 B.溶液
C.混合物 D.单质
3.2022年,我国科学家利用重离子加速器合成了一种新核素Th,该核素( )
A.质子数为207 B.中子数为90
C.核外电子数为90 D.与Pb互为同位素
4.“奋斗者号”载入深海潜水器在海底拍到如图所示的壮丽景象。其中的光柱主要源于( )
A.分子运动
B.丁达尔效应
C.光的反射
D.海水的流动
5.某工厂强酸性废水中,可能大量存在的一组离子是( )
A.Mg2+、Cl- B.K+、OH-
C.Na+、CO D.Ba2+、SO
6.在劳动中合理利用化学知识可达到事半功倍的效果。下列做法不涉及化学变化的是( )
A.用食醋清除水壶中的少量水垢
B.用酒精擦拭桌面上的油性笔迹
C.用不锈钢高压锅快速蒸煮肉类食物
D.用含NaOH和Al粉的管道疏通剂疏通厨卫管道
7.配制250 mL 0.100 mol·L-1的NaCl溶液时,不需要用到的仪器是( )
8.咖啡的提取物广泛应用于食品、饮料等,其主要功效成分为咖啡因(C8H10N4O2)。1 mol C8H10N4O2中,N的物质的量为( )
A.1 mol B.4 mol
C.8 mol D.10 mol
9.下列体检项目的检查结果以物质的量浓度呈现的是( )
选项 项目名称 检查结果 单位
A 总蛋白 70.6 g·L-1
B 总胆固醇 4.27 mmol·L-1
C 收缩压 105 mmHg
D 谷丙转氨酶 7 U·L-1
10.某饮用水中K+的含量为0.39 mg·L-1,佳佳同学参加学农活动时喝了1 L该饮用水,则她摄入的K+数目约为( )
A.6.02×1018 B.6.02×1021
C.3.01×1021 D.3.01×1018
11.某同学在实验室进行Cl2制备实验。下列做法不符合实验室安全规范的是( )
A.实验开始前,佩戴好护目镜
B.实验过程中,保持排风设备开启
C.检查并确认装置气密性后,按实验方案进行实验
D.实验结束后,将反应残余物倒入下水道
12.党的二十大报告提出:“推动绿色发展,促进人与自然和谐共生。”下列做法不符合绿色化学理念的是( )
A.生产过程中“先污染后治理”
B.提高化工生产中的能源利用率
C.研究开发可降解的高分子材料
D.用原子利用率100%的反应生产环氧乙烷
13.用如图所示装置除去Cl2中混有的少量HCl,溶液a应为( )
A.饱和食盐水
B.NaOH溶液
C.AgNO3溶液
D.饱和NaHCO3溶液
14.我国的年发电量高居世界第一。下列过程中,涉及电能转化为化学能的是( )
A.用风能发电 B.用电风扇降温
C.给蓄电池充电 D.自来水厂将水抽到高处
15.用聚合物包覆Mg微球可制得镁基微马达(如图)。在盐酸中,微马达包覆层开口处反应排出气体使其定向运动。在该微马达中能替代Mg的金属是( )
A.Zn B.Cu
C.Ag D.Au
16.药物的开发利用提高了人类健康水平,但药物使用必须规范合理。下列用药方法合理的是( )
A.为快速缓解病情,超量服用药物
B.早上忘记服药,中午加倍用药以弥补疗效
C.医生根据病人体重、年龄等因素调整药物用量
D.家庭成员出现相同症状,成人直接将自己的药物给儿童服用
17.同分异构现象的广泛存在,是有机物种类繁多的重要原因之一。下列烷烃中,存在同分异构现象的是( )
A.CH4 B.C2H6
C.C3H8 D.C4H10
18.运用思维图学习,有助于提高归纳整理能力。如图为物质X的思维图。X可能为( )
A.N2 B.NO2
C.NO D.SO3
19.实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类在利用自然资源方面追求的目标。下列做法不利于实现该目标的是( )
A.以天然气为原料生产甲醇
B.将煤气化使其转化为水煤气
C.大力推广以煤为燃料的火力发电
D.石油裂解获得乙烯等重要化工原料
20.近年来,蚕丝成为材料领域中的新星。下列关于蚕丝的说法不正确的是( )
A.主要成分为纤维素 B.难溶于水
C.主要成分为蛋白质 D.是天然高分子材料
21.物质的性质决定其用途,下列物质性质与其用途不匹配的是( )
选项 物质性质 物质用途
A 液氨汽化时大量吸热 液氨可用作制冷剂
B 铁可与稀硫酸反应生成H2 铁制容器可用于盛装浓硫酸
C Cl2与水反应生成的HClO具有强氧化性 Cl2可用于自来水消毒
D 钾的化合物在灼烧时火焰呈现特定颜色 钾的化合物可用于制作烟花
22.实验室制备负载型Ni催化剂时,涉及反应:Ni(OH)2+H2Ni+2H2O,该反应的还原剂是( )
A.H2 B.Ni
C.Ni(OH)2 D.H2O
23.NaCl在熔融状态下和水溶液中的微观示意图如图所示。下列说法不正确的是( )
A.NaCl属于电解质
B.NaCl在水溶液中发生了电离
C.熔融NaCl能导电
D.固体NaCl中离子可自由移动
24.下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
A 验证S2-具有还原性 将盐酸滴加到Na2S溶液中
B 验证硫单质具有氧化性 加热硫粉与铁粉的混合物
C 验证浓硫酸具有吸水性 将浓硫酸滴入蔗糖固体中
D 验证SO2具有漂白性 将SO2通入酸性KMnO4溶液中
25.海洋是巨大的资源宝库。从海水(含有Na+、K+、Mg2+、Cl-、SO等)中可提取多种化学物质,海水综合利用部分流程如下。下列说法正确的是( )
A.海水直接蒸发结晶可得精盐
B.海水经滤纸过滤可获得淡水
C.食盐水加热分解可制取烧碱
D.提取金属Mg的过程涉及氧化还原反应
26.如图是常用的气体发生装置示意图。该装置适合于( )
A.用铜屑和浓硫酸制备SO2
B.用铜片和浓硝酸制备NO2
C.用浓盐酸和MnO2制备Cl2
D.用固体NH4Cl和Ca(OH)2制备NH3
27.高纯硅是制造半导体芯片的基础材料。在硅的制备和提纯过程中,硅元素化合价升高的是( )
A.石英砂和焦炭反应得到粗硅
B.粗硅与HCl反应制得SiHCl3粗品
C.用蒸馏法对SiHCl3粗品进行提纯
D.H2和SiHCl3反应得到高纯硅
28.铝及其化合物的用途广泛。部分含铝物质的类别与所含铝元素化合价的关系如图所示。下列推断不正确的是( )
A.a可与O2反应转化为b
B.a可与盐酸反应转化为c
C.b可与KOH溶液反应转化为c
D.c的溶液可与O2反应转化为a
29.丙烷脱氢生成丙烯的反应为C3H8(g) == C3H6(g)+H2(g)。该反应在恒容密闭容器中进行,下列情况不能说明该反应一定达到化学平衡的是( )
A.C3H8的质量保持不变
B.C3H6的含量保持不变
C.H2的物质的量保持不变
D.C3H8的消耗速率与C3H6的生成速率相等
30.密闭容器中丁二烯(C4H6)进行“二聚反应”,不同时间C4H6的浓度如表所示:
t/s 0 1 000 2 000 3 000
c(C4H6)/(mmol·L-1) 10.0 6.3 4.6 3.6
前2 000 s内C4H6的平均反应速率为( )
A.2.3×10-3 mmol·L-1·s-1
B.2.7×10-3 mmol·L-1·s-1
C.3.2×10-3 mmol·L-1·s-1
D.4.6×10-3 mmol·L-1·s-1
31.科学家采用一种“机械化学”的新方法,在45 ℃和常压条件下,使N2和H2反应生成NH3。下列说法不正确的是( )
A.该方法属于人工固氮
B.该反应是一个可逆反应
C.该反应的气体分子总数增加
D.原料N2可由分离液化空气获得
32.由碳元素组成的石墨烯和碳纳米管在柔性电子器件领域具有广阔的应用前景。碳纳米管和石墨烯互为( )
A.同位素 B.同分异构体
C.同系物 D.同素异形体
33.钒(V)电池是一种绿色环保蓄电池。某钒电池结构如图所示,电池放电时,正极反应中V由+5价变为+4价,则负极的电极反应式为( )
A.V2+-e-===V3+
B.VO2+-e-===VO
C.V3++e-===V2+
D.VO+e-===VO2+
34.钠及其化合物用途广泛。下列反应对应的离子方程式书写正确的是( )
A.用NaOH溶液吸收Cl2:Cl2+OH-===HClO+Cl-
B.用小苏打治疗胃酸过多:CO+2H+===CO2↑+H2O
C.用Na2O2与水反应制O2:Na2O2+2H2O===2Na++2OH-+O2↑
D.用NaOH溶液溶解Al(OH)3:Al(OH)3+OH-===AlO+2H2O
35.科学家在春秋战国时期的古芮国遗址中发现一种化妆品。经检测,该化妆品中的油脂经过漫长时间发生了水解。油脂的水解产物有( )
A.脂肪酸 B.氨基酸
C.葡萄糖 D.麦芽糖
二、不定项选择题:本大题共15小题,每小题2分,共30分。在每小题列出的四个选项中,至少有一个选项符合题目要求,少选且正确给1分,未选、多选、错选均不给分。
用FeCl3溶液腐蚀覆铜板上不需要的铜,是制作印刷电路板的关键技术,该过程中产生的腐蚀废液可回收利用。实验流程如下:
综合上述材料,回答36~40小题。
36.“氧化”步骤中,可用的试剂为( )
A.碘水 B.氨水
C.氯气 D.稀盐酸
37.“调pH”后,检验Fe3+是否沉淀完全的操作为:取少量浊液于试管中,( )
A.滴加几滴酸性KMnO4溶液
B.加入盐酸酸化,再滴加几滴KSCN溶液
C.静置,取上层清液于另一试管中,滴加酚酞溶液
D.静置,取上层清液于另一试管中,滴加KSCN溶液
38.进行“灼烧”操作时需用到的仪器有( )
A.坩埚 B.烧杯
C.漏斗 D.酒精灯
39.CuCl2溶解度随温度的变化如下图所示,用盐酸“酸化”后,在HCl氛围下进行的“步骤X”包含的操作有( )
A.蒸发浓缩 B.冷却结晶
C.蒸发结晶 D.加热蒸干
40.某同学在“氧化”步骤中使用H2O2做氧化剂,观察到溶液颜色加深且有气体产生。该同学根据已学知识进行的推测合理的是( )
A.该步骤中Fe2+被氧化为Fe3+
B.该气体能使带火星的木条复燃
C.H2O2在分解产生气体的反应中只做氧化剂
D.H2O2的分解产物对环境友好,不造成污染
化学家舍勒是化学史上最灿烂的明星之一,他把一生都献给了化学。舍勒发现了氧、氯、锰、氟等元素,以及盐酸、氨、氢氟酸、磷酸、亚硝酸、亚砷酸铜、钨酸钙、硫酸亚铁和苹果酸等很多物质。这些物质的部分组成元素在元素周期表中的位置如下所示:
结合上述材料,回答41~45小题。
41.下列说法正确的有( )
A.非金属性:Cl>S>P
B.原子半径:O>N>C
C.碱性:Ca(OH)2>Mg(OH)2
D.原子最外层电子数:H>Na>F
42.亚砷酸铜俗称舍勒绿,其中的砷(As)位于( )
A.第4周期第ⅤA族 B.第3周期第ⅤA族
C.第4周期第15列 D.第3周期第15列
43.化学区别于其他科学最本质的特征是发现和创造新物质。到目前为止,由元素周期表中的一百多种元素组成的物质已超过1亿种。下列化合物中含有离子键的有( )
A.NF B.CaSO4
C.NH3 D.NaNO2
44.在有机化学还处于萌芽阶段时,舍勒就发现了十几种有机酸。已知苹果酸的分子式为C4H6O5,其在足量O2中完全燃烧,生成CO2与H2O的物质的量之比为( )
A.4∶3 B.3∶2
C.2∶1 D.2∶3
45.舍勒发现的下列物质中,含有非极性共价键的物质是( )
A.Cl2 B.HCl
C.H3PO4 D.FeSO4
近年来,我国科学家在利用碳的氧化物制备基础有机原料领域取得了一系列令世界瞩目的成果,如:
①利用月壤作为光催化剂,实现CO2与H2反应合成CH4与CH3OH(甲醇);
②研制了一种新催化剂,实现CO2与H2在常压下转化为烯烃(如1戊烯);
③开发了一种新型电催化剂,实现CO与H2高效率生成CH3COOH。
结合上述材料,回答46~50小题。
46.关于成果①中反应产物的说法正确的是( )
A.CH3OH中含有羧基
B.CH3OH的相对分子质量为32
C.CH4的分子空间结构为正四面体
D.CH4与Cl2在光照下可发生取代反应
47.与乙烯类似,1戊烯(CH2===CHCH2CH2CH3)可与Br2发生加成反应,产物为( )
A.CH2Br—CHBr—CH2—CH2—CH3
B.CH3—CHBr—CHBr—CH2—CH3
C.CH2Br—CH2—CH2—CH2—CH2Br
D.CHBr2—CH2—CH2—CH2—CH3
48.成果③中,CO与H2转化为CH3COOH时,会产生少量的副产物乙醇。下列物质中,既能与乙酸反应,又能与乙醇反应的是( )
A.Na B.O2
C.Na2CO3 D.NaCl
49.化学工业中,乙酸可由甲醇羰基化法生产,反应为CH3OH+X―→CH3COOH。已知该反应的原子利用率为100%,则X为( )
A.CH4 B.O2
C.CO2 D.CO
50.上述材料所提及的产物中,含有的化学键包括( )
A.碳氢键 B.碳碳单键
C.碳碳双键 D.碳碳三键
参考答案
1.C A项主要材质是金属银和铜;B项主要材质是金属铜;C项主要材料是陶瓷,属于无机非金属材料;D项主要材质是金属铜。
2.D 液氧只含一种元素氧,是单质,答案选D。
3.C A项,质子数为90;B项,中子数=207-90=117;C项,核外电子数与质子数相等,均为90;D项,同位素必须是同种元素。
4.B 海水属于胶体,海水中的胶粒对光有散射作用。
5.A A项,没有产生沉淀气体难电离的物质,也没有发生氧化还原反应,所以能共存;B项,OH-与H+生成水,不能共存;C项,CO与H+生成二氧化碳和水,不能共存;D项,SO和Ba2+生成不溶于酸的沉淀,不能共存。
6.B A项,醋酸和水垢反应,溶解难溶物质;B项,酒精和油性物质相似相溶,不涉及化学变化;C项,在加热的情况下食物发生许多物理和化学变化;D项,氢氧化钠和铝反应产生的氢气会加大气压使管道疏通。
7.D 配制一定物质的量浓度的溶液的实验步骤:计算、称量(或量取)、溶解、移液、洗涤、定容、摇匀等,由实验步骤确定所用仪器,则配制250 mL 0.10 mol·L-1的NaCl溶液时,称量用到托盘天平、药匙,溶解用到烧杯、玻璃棒,移液要向250 mL容量瓶中转移并用玻璃棒引流,定容用到胶头滴管,不需要用到的仪器为试管,答案选D。
8.B 1 mol C8H10N4O2中含有4 mol N,8 mol C,10 mol H,所以答案选B。
9.B A项中单位是克每升,是质量浓度;B项中单位是毫摩尔每升,符合题目要求;C项是压强的单位;D项中U·L-1是浓度单位,U是国际单位的简写。
10.A n==0.01 mmol;N=NA×n=6.02×1023×0.000 01=6.02×1018。
11.D 盐酸和二氧化锰混合产生氯气:MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑,产生有毒有害的氯气,所以用到护目镜,A项正确;B项是使用排风设备,有利于排出有毒气体;C项是保证装置气密性,防止氯气泄漏;D项涉及对酸溶液和锰离子的处理,需要用碱性物质处理才能排放。
12.A A项,不能污染环境;B项,提高能源利用率,可防止残渣排放;C项,开发可以降解的高分子材料,可防止白色污染;D项,原子利用率高,可防止产生其他物质。B、C、D三项均符合绿色化学理念。
13.A A项,饱和食盐水中有大量氯离子,可抑制氯气与水反应生成氯离子,从而抑制氯气溶于水;B项,碱液会与氯气反应;C项,氯气会与银离子反应;D项,碱性溶液会与氯气反应。
14.C A项是机械能转化为电能;B项是电能转化为机械能;C项是消耗电能转为化学能;D项是消耗电能转化为势能。
15.A A项:Zn+2H+===Zn2++H2↑,释放氢气产生动力。B、C、D三项中的金属活动性排在氢之后,不发生反应,也就不能制微马达。
16.C 使用药物需要在医生的诊断下根据病人的实际情况调整用量,所以C项是对的。A项超量,错误;B项加倍,错误;D项没有医生的指导,错误。
17.D A、B、C三项中碳原子数太少,不能形成碳链异构结构,没有同分异构体。D项有正丁烷和异丁烷两种同分异构体,所以答案选D。
18.C A项,N2不是氧化物,是单质,不符合题意;B项,NO2能与水反应,溶于水,不符合题意;D项,SO3不能与氧气反应,没有还原性,不符合题意。
19.C A、B、D三项都不会造成环境污染,有利于实现目标。C项,大量使用燃煤,将产生大量的有害气体和烟尘,不利于实现该目标。故答案选C。
20.A 蚕丝主要成分是蛋白质,是难溶于水的天然高分子材料。
21.B A、C、D三项中性质和用途相匹配。B项铁在浓硫酸中会被氧化产生致密的氧化膜,产生钝化现象,不会进一步与浓硫酸反应,所以可以用铁制容器盛装浓硫酸。
22.A A项,氢气失去电子,是还原剂;B项,镍是还原产物;C项,氢氧化镍得电子,是氧化剂;D项,水是氧化产物。故答案选A。
23.D NaCl溶于水的过程中生成Na+和Cl-,离子键被破坏,是电解质,氯化钠固体在融化状态下阴、阳离子能自由移动,通电即可导电,故A项正确;将NaCl固体加入水中时,在水分子的作用下,Na+和Cl-之间的相互作用被破坏,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子,发生了电离,故B正确;氯化钠固体在融化状态下阴、阳离子能自由移动,通电即可导电,故C项正确;NaCl固体中含有带正电荷的钠离子和带负电荷的氯离子,由于带相反电荷的离子间的相互作用,Na+和Cl-按一定规则紧密地排列着,NaCl固体中的阴、阳离子不可以自由移动,故D项错误。
24.B A项中盐酸滴加到硫化钠溶液中产生硫化氢气体,体现酸性;B项中生成硫化亚铁,硫得到电子,体现氧化性;C项中浓硫酸体现脱水性;D项中二氧化硫体现还原性。
25.D A项,海水蒸发得到粗盐,粗盐提纯后得到精盐;B项,海水过滤得到去掉泥沙的海水;C项,食盐水加热结晶成为食盐,不能得到烧碱,烧碱要电解饱和食盐水才能制得;D项,提取金属镁需要使海水中的镁离子得到电子,涉及氧化还原反应。答案选D。
26.B A项,需要加热;B项,不需要加热就可以制取二氧化氮;C项,需要加热;D项,需要加热,而且一般在大试管中进行反应。
27.B A项,硅化合价降低;B项,由单质转变为化合物,化合价升高;C项,没有发生化学反应;D项,氢气还原化合物SiHCl3得到硅单质,硅元素的化合价降低。
28.D 题图中所示铝元素不同化合价的物质:a为Al,b为Al2O3,c为KAl(OH)4或AlCl3。Al与O2发生反应生成Al2O3,故A项不符合题意;Al2O3与盐酸反应生成AlCl3,故B项不符合题意;Al2O3与碱液反应生成KAl(OH)4,故C项不符合题意;盐溶液中铝是正三价,不能被氧气所氧化,所以D项符合题意。
29.D A、B、C三项均符合平衡状态标志之一:各成分的量保持不变;D项没有体现平衡状态标志之一:某物质正、逆反应速率相等,C3H8的消耗速率与C3H6的生成速率相等只体现两物质正反应速率相等。
30.B v(C4H6)==2.7×10-3 mmol·L-1·s-1。
31.C A项,把氮气转变为氨,由单质变为化合物,属于人工固氮;B项,反应物和产物都是气体的非爆炸性反应一般是可逆反应;C项,由化学方程式N2+3H2??2NH3可知:由反应物生成产物是物质的量减少的反应;D项,把空气液化,然后利用沸点不同分离氮气和氧气等。
32.D
33.A 正极得到电子,正极反应中V由+5价变为+4价,只有VO转变VO2+符合,负极则失去电子,所以A项符合题意。
34.D A项,NaOH与Cl2反应得到次氯酸盐,没有次氯酸,错误;B项,小苏打是碳酸氢盐,离子方程式中的反应物要写碳酸氢根的形式,错误;C项,原子个数不守恒,错误;D项符合要求,正确。
35.A A项,油脂水解得到脂肪酸和甘油,正确;B项,蛋白质水解得到氨基酸;C项,多糖水解的产物有葡萄糖;D项,麦芽糖由糖类水解得到。
36.C A项,碘水的氧化能力弱,不能氧化亚铁离子;B项,氨水不具有氧化性,不符合要求;C项,氯气是强氧化剂,符合要求;D项,盐酸不能氧化亚铁离子。
37.D A项,高锰酸钾对铁离子不起氧化作用,不能用来检验铁离子;B项,加盐酸酸化,氢氧化铁与酸反应产生铁离子,干扰检验,不符合要求;C项,铁离子或者亚铁离子具有同样的效果,不符合要求;D项,铁离子会有显色反应,符合要求。故答案选D。
38.AD 高温灼烧要使用坩埚和酒精灯,不需要烧杯和漏斗。
39.AB 针对溶解度随温度升高而增大的物质采取的方法是蒸发浓缩,冷却结晶。针对溶解度随温度而降低的物质采取的方法则是蒸发结晶,趁热过滤,或者直接蒸干。
40.ABD A项,亚铁离子被双氧水氧化,符合正确推理;B项,双氧水在催化剂的条件下促进分解,产生氧气和水,符合题意;C项,双氧水分解中,双氧水既是氧化剂又是还原剂,故C项不正确;D项,双氧水分解产物是水和氧气,不造成污染,符合题意。
41.AC A项,同周期元素从左至右,元素的非金属性逐渐增大,正确;B项,同周期原子从左至右半径逐渐变小,不正确;C项,同主族元素从上至下金属增强,最高价氧化物的水化物的碱性增强,正确;D项,第ⅠA族元素的最外层电子数相等(均为1),F为第ⅦA族元素,最外层电子数为7,不正确。
42.AC 砷属于第4周期第ⅤA族元素,位于周期表第15列,答案选AC。
43.BD 活泼金属阳离子与强酸阴离子构成离子化合物,具有离子键,符合题目要求,所以答案选BD。A、C项全是非金属元素构成的分子,只含有共价键。
44.A 根据原子个数守恒,苹果酸分子含有4个碳原子,6个氢原子,形成的二氧化碳和水的个数之比是4∶3,故答案选A。
45.A 同种原子之间形成非极性共价键,所以氯气符合要求;B、C、D三项均是不同原子之间形成极性共价键。故答案选A。
46.BCD 甲醇只含有羟基,A项不正确;甲醇的相对分子质量为32,B项正确;甲烷是正四面体结构,C项正确;甲烷和氯气在光照下可以发生一系列取代反应,D项正确。
47.A 1戊烯与溴加成在1,2号位置,所以答案选A。
48.A 钠可以与酸反应,也可以和醇反应置换出氢气,A项符合题意;B项中氧气只能与醇反应,不与酸反应;C项中乙酸可以与碳酸钠反应生成碳酸并分解产生二氧化碳和水;D项中氯化钠不与乙酸反应,也不与乙醇反应。
49.D 根据方程式原子个数守恒,可知X是CO。
50.ABC 产物甲烷含有碳氢键;甲醇含有碳氢键和氢氧键和碳氧单键;1戊烯含有碳氢键、碳碳双键和碳碳单键;乙酸含有碳碳单键、碳氢键、氢氧键、碳氧单键和碳氧双键。综上所述,没有碳碳三键。故答案选ABC。
同课章节目录
