7.3溶液浓稀的表示同步练习科粤版(2012)化学九年级下册(含解析)
文档属性
| 名称 | 7.3溶液浓稀的表示同步练习科粤版(2012)化学九年级下册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 805.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 12:19:29 | ||
图片预览


文档简介
7.3溶液浓稀的表示同步练习科粤版(2012)化学九年级下册
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.炎热的夏天,小林打开冰箱,从4℃的储藏室里拿出一杯底部有少量蔗糖晶体的溶液a,在室温下放置一段时间后,发现晶体消失了,得到溶液b。判断下列说法正确的是
A.4℃时,a溶液一定是饱和溶液
B.室温下,b溶液一定是饱和溶液
C.蔗糖晶体的溶解度随温度的升高而降低
D.从储藏室取出放置一段时间后,所得蔗糖溶液中蔗糖的质量分数增大
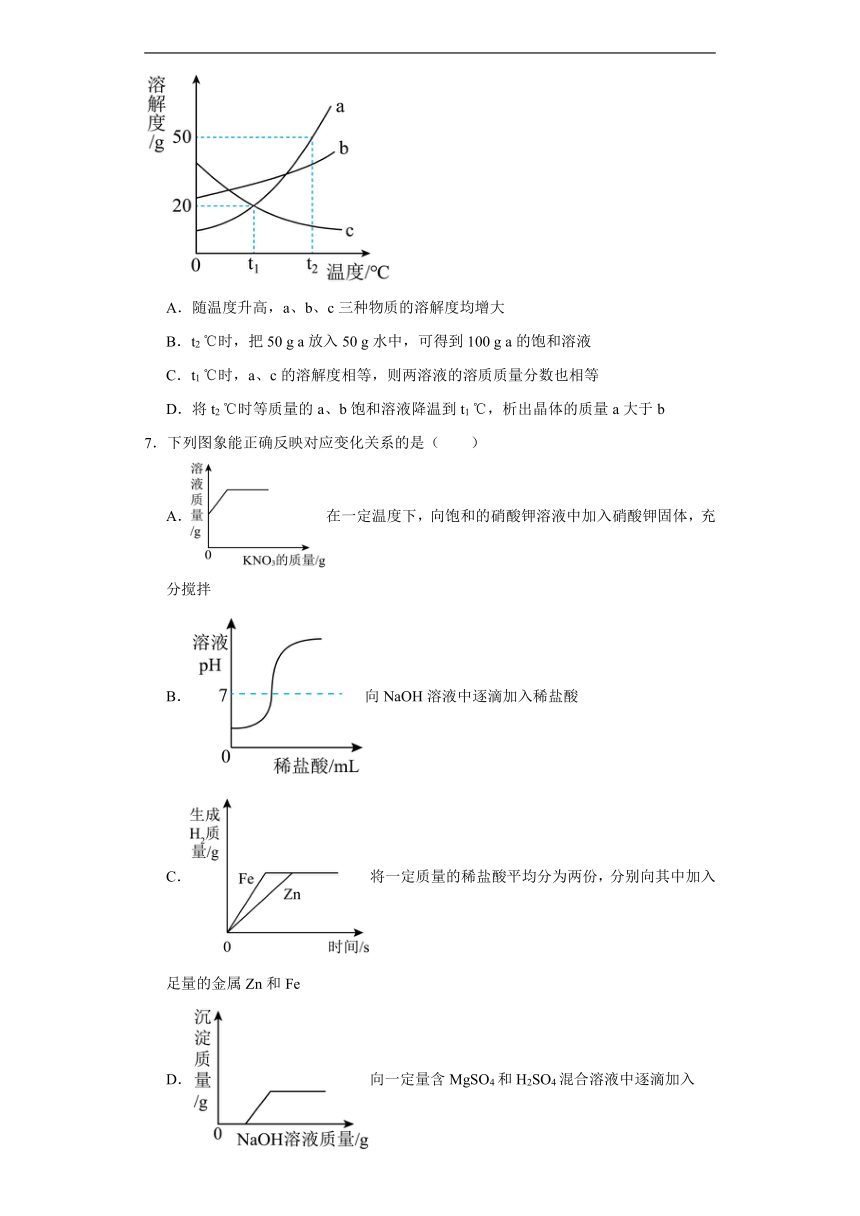
2.如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是
A.t2℃时,三种物质的溶解度是a>b>c
B.t2℃时,将a物质50g(不含结晶水)放入100g水中充分溶解得到a的饱和溶液
C.将t2℃时,三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c
D.升温可将c的饱和溶液变为不饱和溶液
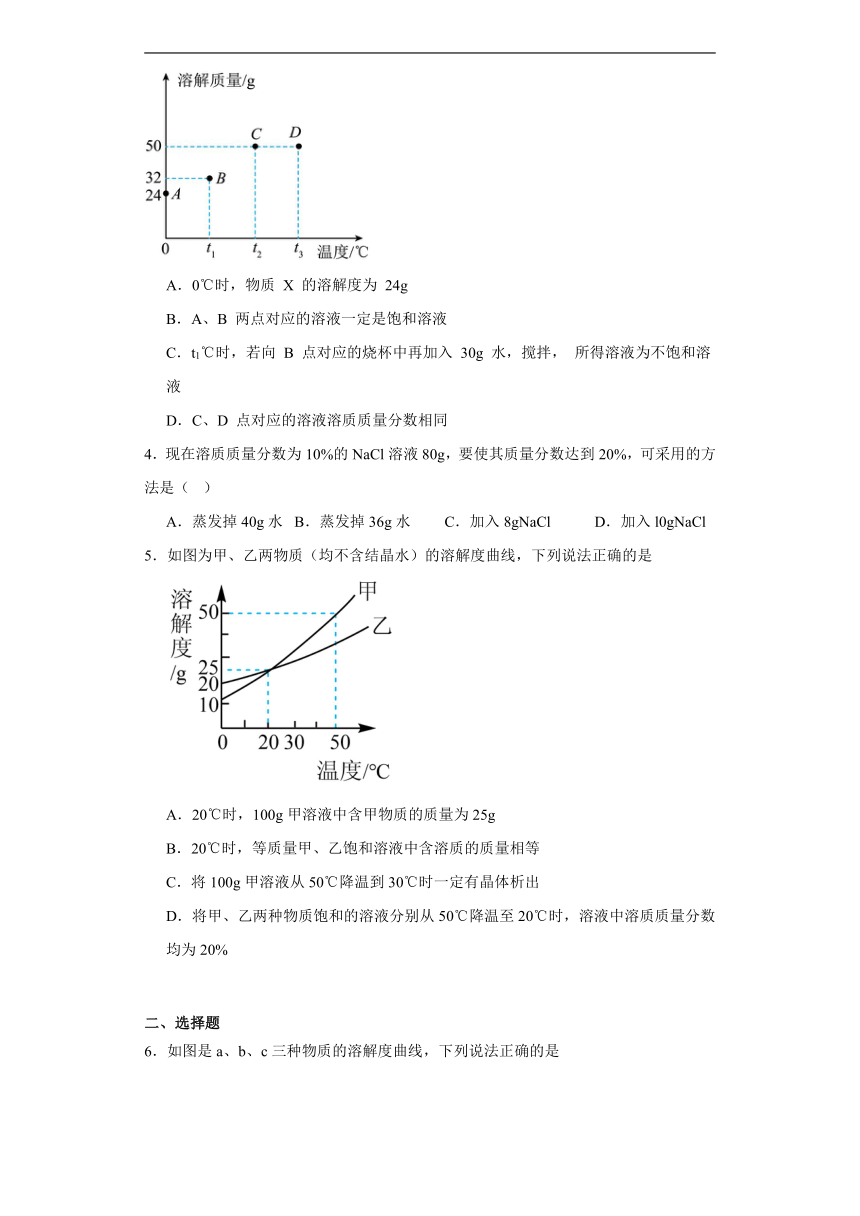
3.将 30g 固体物质 X(不含结晶水)投入盛有 20g 水的烧杯中,搅拌,测得 0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中 A、B、C、D 点所示。根据图示判断下列说法正确的是
A.0℃时,物质 X 的溶解度为 24g
B.A、B 两点对应的溶液一定是饱和溶液
C.t1℃时,若向 B 点对应的烧杯中再加入 30g 水,搅拌, 所得溶液为不饱和溶液
D.C、D 点对应的溶液溶质质量分数相同
4.现在溶质质量分数为10%的NaCl溶液80g,要使其质量分数达到20%,可采用的方法是( )
A.蒸发掉40g水 B.蒸发掉36g水 C.加入8gNaCl D.加入l0gNaCl
5.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.20℃时,100g甲溶液中含甲物质的质量为25g
B.20℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.将100g甲溶液从50℃降温到30℃时一定有晶体析出
D.将甲、乙两种物质饱和的溶液分别从50℃降温至20℃时,溶液中溶质质量分数均为20%
二、选择题
6.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.随温度升高,a、b、c三种物质的溶解度均增大
B.t2 ℃时,把50 g a放入50 g水中,可得到100 g a的饱和溶液
C.t1 ℃时,a、c的溶解度相等,则两溶液的溶质质量分数也相等
D.将t2 ℃时等质量的a、b饱和溶液降温到t1 ℃,析出晶体的质量a大于b
7.下列图象能正确反映对应变化关系的是( )
A.在一定温度下,向饱和的硝酸钾溶液中加入硝酸钾固体,充分搅拌
B.向NaOH溶液中逐滴加入稀盐酸
C.将一定质量的稀盐酸平均分为两份,分别向其中加入足量的金属Zn和Fe
D.向一定量含MgSO4和H2SO4混合溶液中逐滴加入NaOH溶液
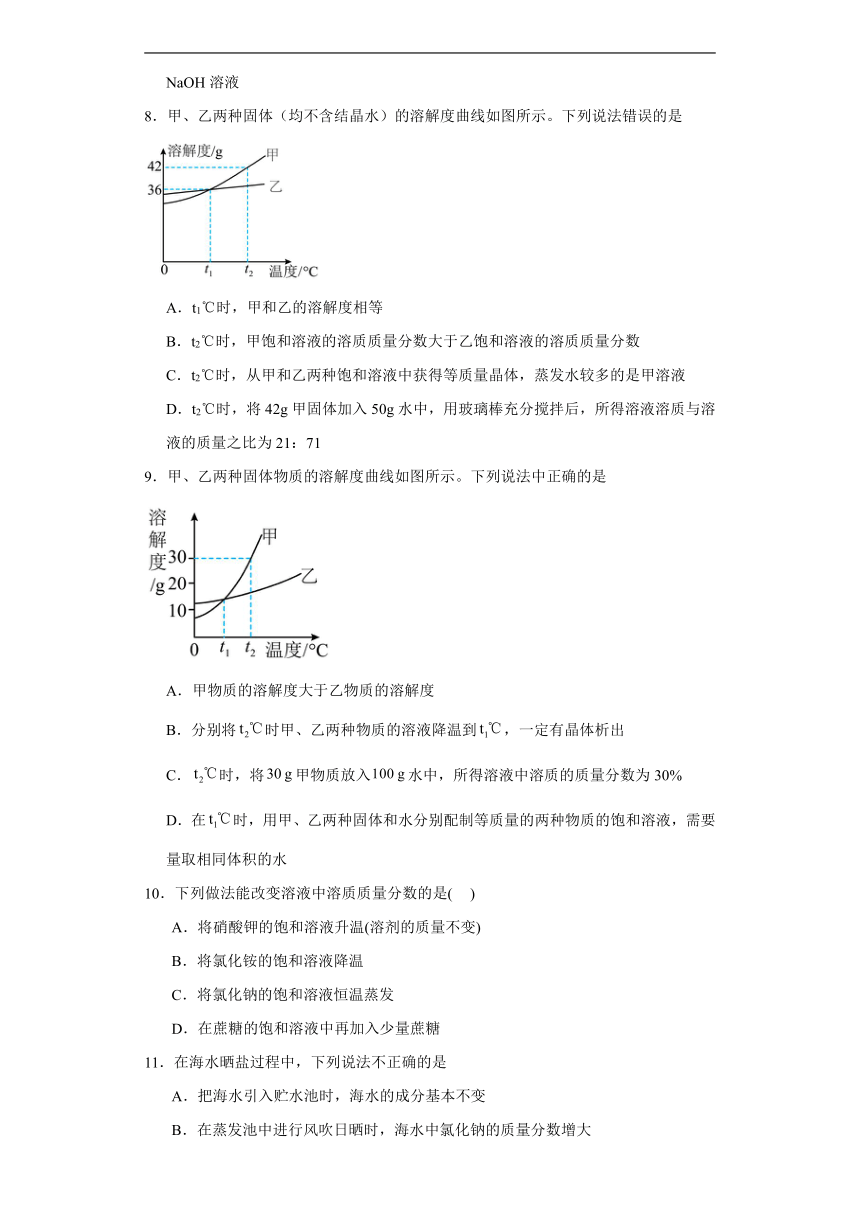
8.甲、乙两种固体(均不含结晶水)的溶解度曲线如图所示。下列说法错误的是
A.t1℃时,甲和乙的溶解度相等
B.t2℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数
C.t2℃时,从甲和乙两种饱和溶液中获得等质量晶体,蒸发水较多的是甲溶液
D.t2℃时,将42g甲固体加入50g水中,用玻璃棒充分搅拌后,所得溶液溶质与溶液的质量之比为21:71
9.甲、乙两种固体物质的溶解度曲线如图所示。下列说法中正确的是
A.甲物质的溶解度大于乙物质的溶解度
B.分别将时甲、乙两种物质的溶液降温到,一定有晶体析出
C.时,将甲物质放入水中,所得溶液中溶质的质量分数为30%
D.在时,用甲、乙两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水
10.下列做法能改变溶液中溶质质量分数的是( )
A.将硝酸钾的饱和溶液升温(溶剂的质量不变)
B.将氯化铵的饱和溶液降温
C.将氯化钠的饱和溶液恒温蒸发
D.在蔗糖的饱和溶液中再加入少量蔗糖
11.在海水晒盐过程中,下列说法不正确的是
A.把海水引入贮水池时,海水的成分基本不变
B.在蒸发池中进行风吹日晒时,海水中氯化钠的质量分数增大
C.在结晶池中继续风吹日晒时,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
12.1926 年我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。侯氏制碱法以 食盐为主要原料制取纯碱,制得的纯碱中常含有少 量氯化钠。Na2CO3 和 NaCl 的溶解度曲线如图所示下列关于两种物质的说法中不正确的是
A.Na2CO3 的溶解度受温度的影响比 NaCl 大
B.t1℃时,100 g Na2CO3 饱和溶液中含有 20 gNa2CO3
C.t2℃时,NaCl 饱和溶液与 Na2CO3 饱和溶液中溶质的质量分数相同
D.温度高于 t2℃时,Na2CO3 的溶解度大于 NaCl 的溶解度
13.甲、乙两种固体(不含结晶水)的溶解度曲线如图所示,下列说法中错误的是
A.40℃时,等质量甲、乙两物质的溶液,所含溶质质量甲大于乙
B.20℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等
C.40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至20℃,甲析出的晶体比乙多
D.20℃时,甲、乙的溶解度都是30g
14.下列图像能正确反映其对应关系的是( )
A.等量的镁和氧气充分反应
B.少量的碳在密闭的集气瓶中与氧气完全燃烧
C.常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中
D.加热KNO3、Ca(OH)2的饱和溶液(不考虑溶剂的蒸发)
15.溶液的组成变化与浓溶液和稀溶液有着密切的关系。下列有关溶液浓、稀的说法正确的是
①溶质质量增大,溶剂质量不变,则溶液质量增大,溶液会变浓。
②溶质质量减小,溶剂质量不变,则溶液质量减小,溶液会变稀。
③溶质质量不变,溶剂质量增大,则溶液质量增大,溶液会变稀。
④溶质质量不变,溶剂质量减小,则溶液质量减小,溶液会变浓。
A.①②③④ B.①②③ C.②③④ D.①③④
三、综合应用题
16.在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如下图所示,甲、丙还有剩余固体,乙固体全部溶解。升温到80 ℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化。
(1)室温时, (选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。
(2)上图中能表示乙物质的溶解度曲线的是 (填“a”、“b”或“c”,下同),
(3)t2 ℃时,甲、乙、丙三种物质的等质量的饱和溶液降到t1 ℃时,所得溶液中水的质量由大到小的顺序是
(4)小强同学要在实验室配制15%的氯化钠溶液50 g。需要量筒规格为 ml(填“20或50或100”),该同学按下图所示步骤依次操作:
按B量取所需的水配得的溶液溶质质量分数 (填“偏大或偏小或无影响”);E中玻璃棒的作用是 。若上图A中砝码的质量为5 g,游码为2.5 g,则称得氯化钠的质量 克
17.过氧乙酸溶液是杀死病毒的一种有效药剂,某商店出售一种过氧乙酸消毒液,其标签上的部分文字说明如图所示。试分析并计算:
过氧乙酸消毒液(C2H4O3)
质量 500g
溶质质量分数 40%
使用方法 浸泡、喷雾、熏蒸等方法,用水稀释后使用
密封、避光、避热、不可与可燃物混合存放、防猛烈撞击
(1)由储存方法中要避热储存,推断过氧乙酸可能具有的性质是 (写一条即可)。
(2)一瓶这种溶液中含溶质过氧乙酸的质量是 g。(结果精确到0.1%)
(3)对环境进行消毒时,常用到15%的过氧乙酸溶液,欲配制1000g15%过氧乙酸溶液,需40%的原溶液多少g?需加水质量为多少mL?(写出计算过程)
18.下图所示为实验室常用的实验装置:
回答下列问题:
(1)写出带标号②仪器的名称: 。若实验室制取氧气的发生装置可以选用A,则选择的依据是什么 ?写出用氯酸钾为原料制取氧气的化学方程式 。
(2)实验室制取并收集一瓶二氧化碳气体应选择的装置是 。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为: 。
(4)下图为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,请另写一个优点: 。
若用如下图装置按箭头所示的流向收集一瓶二氧化碳气体,请将集气瓶内的导管补画完整 。
(5)取溶质质量分数为8.5%的过氧化氢溶液20g倒入烧杯中,在催化剂的作用下使其完全分解,计算理论上共能产生氧气多少克 ?
参考答案:
1.AD
【详解】冰箱冷藏室中拿出一杯底部有少量蔗糖的溶液a,因为蔗糖未全部溶解,所以溶液a一定是饱和溶液,放置室温一段时间后晶体消失,说明未溶解的蔗糖再次溶于水,所以溶液a的质量分数小于溶液b的质量分数,蔗糖晶体的溶解度随着温度的升高而升高,室温下溶液b不一定是饱和溶液,可能饱和也可能不饱和.蔗糖晶体的溶解度随温度的升高而升高。故选AD。
2.CD
【详解】A、t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c,该选项分析正确;
B、t2℃时,a的溶解度是50g,即100g水中最多溶解50g的a,所以将50g a物质放入100g水中充分溶解得到a的饱和溶液,该选项分析正确;
C、ab的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以将t2℃时a,b,c三种物质的饱和溶液降温至t1℃时,ab析出晶体,溶质的质量分数减小,c溶解度增大,溶质的质量分数不变,与降温前相等,由于饱和溶液中溶质的质量分数为,即溶解度越大质量分数也就越大,而t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以此时溶液的质量分数关系是b>a>c,该选项分析错误;
D、c的溶解度随温度的降低而增大,所以将c的饱和溶液变为不饱和溶液,可采用降温的方法,该选项分析错误,
故选CD。
3.BD
【详解】A、根据图示,0℃时,20g水中最多溶解4g,溶解度是100g水中的溶解的最大量,所以溶解度不是24g,故A不符合题意;
B、30gX加入20g水中,溶液质量为24g,说明只溶解了4g,有26g没溶解,说明该溶液是饱和溶液,同理B点所示溶液只溶解了12g溶质,有18g没溶解,也是饱和溶液,故B符合题意;
C、t1℃时,B点溶液20g水中溶解了12g溶质,根据溶液的均一的,求得30g水中可以溶解18g,刚好50g溶液里可以全部溶解30g,但后续并不知道该溶液能否继续溶解该溶质,所以无法确定溶液的饱和性,故C不符合题意;
D、C、D点对应的溶质质量为30g,溶液为50g,所以质量分数相同,故D符合题意;
故选BD。
【点睛】本题难度不大,结合图中所给信息进行仔细分析。
4.AD
【详解】现在溶质质量分数为10%的NaCl溶液80g,要使其质量分数达到20%,可采用的方法是蒸发溶剂,或者增加溶质,设蒸发溶剂质量为x,则80g×10%=(80g-x)×20%,x=40g,设增加溶质质量为y,则,y=10g,故选:AD。
5.BD
【详解】A、通过分析溶解度曲线可知,20℃时,甲物质的溶解度是25g,所以125g甲溶液中含甲物质的质量为25g,故A错误;
B、20℃时,甲、乙物质的溶解度相等,所以等质量甲、乙饱和溶液中含溶质的质量相等,故B正确;
C、甲物质的溶解度随温度的升高而增大,所以将甲饱和溶液从50℃降温到30℃时一定有晶体析出,故C错误;
D、由溶解度曲线的意义可知,甲、乙的溶解度都随温度的降低而减小,将甲、乙两物质的饱和溶液从50℃降温到20℃均会有晶体析出,都是20℃时的饱和溶液,甲、乙的溶解度都是25g,溶液中溶质质量分数均为:×100%=20%,故D正确。
故选BD。
【点睛】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
6.D
【详解】A、根据溶解度曲线图可知a、b的溶解度随温度的升高而增大,c的溶解度随温度的升高而减小,A错误;
B、t2℃时,a的溶解度是50g,所以100g水中最多溶解50g,50g水中最多溶解25g,即形成75g饱和溶液,B错误;
C、t1℃时,a、c的溶解度相等,如果都是饱和溶液,则溶液的溶质质量分数相等,如果不都是饱和溶液,则无法判断质量分数的大小,C错误;
D、在t2℃至t1℃,a的溶解度变化最大,b的溶解度变化较小,c的溶解度随温度降低而增大,所以将等质量的a、b两种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是a;D正确。
综上所述:选择D。
7.D
【详解】A、在一定温度下,向饱和的硝酸钾溶液中加入硝酸钾固体,充分搅拌硝酸钾不能继续溶解,因此溶液的质量不应该发生变化,错误;
B、向NaOH溶液中逐滴加入稀盐酸,pH不断下降,错误;
C、锌的活动性大于铁,因此锌反应较快,错误;
D、向一定量含MgSO4和H2SO4混合溶液中逐滴加入NaOH溶液,氢氧化钠先与硫酸反应,然后与硫酸镁反应生成沉淀,曲线正确;
故选D。
8.C
【详解】A、由图示可知,甲和乙的溶解度曲线在t1℃时相交,则表示在t1℃时,甲和乙的溶解度相等,故A正确;
B、根据图像,t2℃时,甲的溶解度为42g,乙的溶解度为36g,则该温度下的甲的饱和溶液溶质质量分数为,乙的饱和溶液溶质质量分数为,则t2℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数,故B正确;
C、t2℃时,甲的溶解度大于乙的溶解度,即相同质量的水中溶解的甲的质量大于乙的质量,故从甲和乙两种饱和溶液中获得等质量晶体,蒸发水较多的是乙溶液,故C错误;
D、t2℃时,甲的溶解度为42g,即该温度下100g水中溶解42g甲即能达到饱和状态。将42g甲固体加入50g水中,用玻璃棒充分搅拌后,可溶解21g,所得溶液质量为50g+21g=71g,溶质与溶液的质量之比为21:71,故D正确;
故选C。
9.D
【详解】A、未给定温度,无法比较,故A错误;
B、甲、乙原饱和溶液降温后一定有晶体析出,不知降温前甲、乙溶液是否饱和,若不饱和,则降温不一定有晶体析出,故B错误;
C、所得溶液的溶质质量分数为×100%≈23.1%,故C错误;
D、t1℃时,甲、乙的溶解度相同,配制等质量的两种物质的饱和溶液,需要水的质量相同,量取水的体积相同,故D正确。故选D。
10.B
【分析】
【详解】A、硝酸钾的溶解度随温度的升高而增大,将硝酸钾的饱和溶液升温(溶剂的质量不变),溶质和溶剂的质量均不变,则溶质质量分数不变,故A不正确;
B、氯化铵的溶解度随温度的升高而增大,将氯化铵的饱和溶液降温,有氯化铵固体析出,有溶质析出,溶质质量分数减小,故B正确;
C、将氯化钠的饱和溶液恒温蒸发,溶液还是同一温度下饱和溶液,溶质质量分数不变,故C不正确;
D、在蔗糖的饱和溶液中再加入少量蔗糖,蔗糖不再溶解,溶质质量分数不变,故D不正确。故选B。
11.D
【详解】A、海水进入贮水池,海水的成分基本不变,故A正确;
B、在蒸发池中,水的质量不断减少,海水中氯化钠的质量分数,在饱和以前逐渐增大,故B正确;
C、在蒸发池中,海水中水的质量逐渐减小;故C正确;
D、析出晶体后的母液,不能继续溶解氯化钠,是氯化钠的饱和溶液,故D错误。故选D。
【点睛】析出晶体后的母液,是该温度下,该溶质的饱和溶液。
12.B
【详解】A、由溶解度曲线可知:Na2CO3的溶解度受温度的影响比NaCl大正确,正确但不符合题意,故选项错误;
B、t1℃时,120gNa2CO3饱和溶液中含有20gNa2CO3,100g错误,错误符合题意,故选项正确;
C、t2℃时,NaCl饱和溶液与Na2CO3饱和溶液中溶质的质量分数相同正确,因为在该温度下,它们溶解度相等,正确但不符合题意,故选项错误;
D、温度高于t2℃时,Na2CO3的溶解度大于NaCl的溶解度正确,正确但不符合题意,故选项错误;
故选B。
13.A
【详解】A、40℃时,溶解度甲大于乙,则等质量甲、乙两物质的饱和溶液,所含溶质质量甲大于乙,选项中没有指明溶液是否饱和,无法比较,故A说法错误;
B、20℃时,溶解度甲等于乙,则甲、乙两物质的饱和溶液中溶质的质量分数相等,故B说法正确;
C、甲的溶解度受温度影响较大,则40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至20℃,甲析出的晶体比乙多,故C说法正确;
D、20℃时,甲、乙的溶解度都是30g,故D说法正确;
故选:A。
14.C
【详解】A、根据镁和氧气反应化学方程式可知,每48份镁与32份质量的氧气反应 ,等量的镁和氧气充分反应时,消耗镁的质量比氧气更多,氧气有剩余而镁消耗完全,图像不能正确反映其对应关系,不符合题意;
B、碳和氧气在点燃条件下生成二氧化碳,其化学方程式为:,反应每消耗1分子的氧气,产生1分子的二氧化碳,因此气体分子数目保持不变,图像不能正确反映其对应关系,不符合题意;
C、镁的活动性比铁强,因此镁反应产生氢气的斜率大于铁反应产生氢气的斜率,等量的稀盐酸完全反应提供氢元素相等,产生的氢气质量相等,图像能正确反映其对应关系,符合题意;
D、硝酸钾的溶解度随温度的升高而增大,硝酸钾饱和溶液变成不饱和溶液,溶质质量分数保持不变,氢氧化钙的溶解度随温度的升高而增大,饱和氢氧化钙溶液升温有晶体析出,溶质质量分数变小,图像不能正确反映其对应关系,不符合题意;
故选:C。
15.A
【分析】根据溶液的质量=溶质的质量+溶剂的质量,溶质的质量分数=×100%= ×100%进行分析。
【详解】①因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量增大,溶剂质量不变,溶液质量增大,溶液会变浓,正确;②因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量减小,溶剂质量不变,则溶液质量减小,溶液会变稀,正确;③因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量不变,溶剂质量增大,则溶液质量增大,溶液会变稀,正确;④因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量不变,溶剂质量减小,则溶液质量减小,溶液会变浓,正确。故选A。
16. 乙 C c>b>a 50、 偏小、 搅拌,加快氯化钠溶解速率 , 2.5
【详解】(1)甲、丙溶液中有未溶解的固体而乙溶液中没有未溶解的固体,所以室温时,乙溶液可能是不饱和溶液;(2)根据升温到80℃时,发现乙固体析出,所以乙物质的溶解度随温度的升高而减小,图2中能表示乙物质的溶解度曲线的是c; (3)t2℃时,甲、乙、丙三种物质的溶解度大小顺序是a>b>c,所以t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中水的质量由大到小的顺序是c>b>a;(4)小强同学要在实验室配制15%的氯化钠溶液50g,需要氯化钠的质量=15%×50g=7.5g,需要水的体积为42.5mL,所以用规格为50mL的量筒取所需要的水;仰视读数,读数偏小,实际体积偏大,故按B量取所需的水配得的溶液溶质质量分数偏小;E中玻璃棒的作用是搅拌,加快氯化钠溶解速率;若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际=5g 2.5g=2.5g。
17.(1)受热不稳定
(2)200
(3)375g ;625mL
解:欲配制1000g15%过氧乙酸溶液,需40%的原溶液的质量为x,
则1000g×15%=40%×x,x=375g,
需要加水的质量为:1000g-375g=625g,合625mL。
答:需40%的原溶液375g,需加水625mL。
【详解】(1)由储存方法中要避热储存,推断过氧乙酸可能具有的性质是受热不稳定,故填:受热不稳定。
(2)一瓶这种溶液中含溶质过氧乙酸的质量是:500g×40%=200g,故填:200。
(3)见答案。
18. 长颈漏斗 反应物是固体,反应条件是加热 BD 节约药品、可随时控制反应发生或停止 0.8g
【详解】(1)标号②仪器的名称为长颈漏斗。若实验室制取氧气的发生装置可以选用A,A为固-固加热型发生装置,则选择的依据是反应物是固体,反应条件是加热;用氯酸钾为原料制取氧气,氯酸钾在二氧化锰作催化剂的条件下分解生成氯化钾和氧气,反应的化学方程式为。
(2)实验室制二氧化碳的原理是大理石或石灰石与稀盐酸反应生成二氧化碳、氯化钙和水,选择固液不加热型发生装置,二氧化碳密度比空气密度大,溶于水且与水反应,选择向上排空气法收集装置,综上所述,实验室制取并收集一瓶二氧化碳气体应选择的装置是BD。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为。
(4)如图所示为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,通过向上提起底部有破洞的试管,固体药品与液体药品就会分离,反应就会停止,因此还有节约药品、可随时控制反应发生或停止的优点。二氧化碳的密度比空气密度大,若用倒置的万用瓶通过排空气法收集二氧化碳,二氧化碳应该从短管进,则集气瓶内的导管应该为。
(5)由题意20g8.5%的过氧化氢溶液含有过氧化氢的质量为,设理论上共能产生氧气的质量为x,则有:
由解得x=0.8g
答:质量分数为8.5%的过氧化氢溶液20g完全分解理论上共能产生氧气0.8g。
学校:___________姓名:___________班级:___________考号:___________
一、多选题
1.炎热的夏天,小林打开冰箱,从4℃的储藏室里拿出一杯底部有少量蔗糖晶体的溶液a,在室温下放置一段时间后,发现晶体消失了,得到溶液b。判断下列说法正确的是
A.4℃时,a溶液一定是饱和溶液
B.室温下,b溶液一定是饱和溶液
C.蔗糖晶体的溶解度随温度的升高而降低
D.从储藏室取出放置一段时间后,所得蔗糖溶液中蔗糖的质量分数增大
2.如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是
A.t2℃时,三种物质的溶解度是a>b>c
B.t2℃时,将a物质50g(不含结晶水)放入100g水中充分溶解得到a的饱和溶液
C.将t2℃时,三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c
D.升温可将c的饱和溶液变为不饱和溶液
3.将 30g 固体物质 X(不含结晶水)投入盛有 20g 水的烧杯中,搅拌,测得 0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中 A、B、C、D 点所示。根据图示判断下列说法正确的是
A.0℃时,物质 X 的溶解度为 24g
B.A、B 两点对应的溶液一定是饱和溶液
C.t1℃时,若向 B 点对应的烧杯中再加入 30g 水,搅拌, 所得溶液为不饱和溶液
D.C、D 点对应的溶液溶质质量分数相同
4.现在溶质质量分数为10%的NaCl溶液80g,要使其质量分数达到20%,可采用的方法是( )
A.蒸发掉40g水 B.蒸发掉36g水 C.加入8gNaCl D.加入l0gNaCl
5.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.20℃时,100g甲溶液中含甲物质的质量为25g
B.20℃时,等质量甲、乙饱和溶液中含溶质的质量相等
C.将100g甲溶液从50℃降温到30℃时一定有晶体析出
D.将甲、乙两种物质饱和的溶液分别从50℃降温至20℃时,溶液中溶质质量分数均为20%
二、选择题
6.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.随温度升高,a、b、c三种物质的溶解度均增大
B.t2 ℃时,把50 g a放入50 g水中,可得到100 g a的饱和溶液
C.t1 ℃时,a、c的溶解度相等,则两溶液的溶质质量分数也相等
D.将t2 ℃时等质量的a、b饱和溶液降温到t1 ℃,析出晶体的质量a大于b
7.下列图象能正确反映对应变化关系的是( )
A.在一定温度下,向饱和的硝酸钾溶液中加入硝酸钾固体,充分搅拌
B.向NaOH溶液中逐滴加入稀盐酸
C.将一定质量的稀盐酸平均分为两份,分别向其中加入足量的金属Zn和Fe
D.向一定量含MgSO4和H2SO4混合溶液中逐滴加入NaOH溶液
8.甲、乙两种固体(均不含结晶水)的溶解度曲线如图所示。下列说法错误的是
A.t1℃时,甲和乙的溶解度相等
B.t2℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数
C.t2℃时,从甲和乙两种饱和溶液中获得等质量晶体,蒸发水较多的是甲溶液
D.t2℃时,将42g甲固体加入50g水中,用玻璃棒充分搅拌后,所得溶液溶质与溶液的质量之比为21:71
9.甲、乙两种固体物质的溶解度曲线如图所示。下列说法中正确的是
A.甲物质的溶解度大于乙物质的溶解度
B.分别将时甲、乙两种物质的溶液降温到,一定有晶体析出
C.时,将甲物质放入水中,所得溶液中溶质的质量分数为30%
D.在时,用甲、乙两种固体和水分别配制等质量的两种物质的饱和溶液,需要量取相同体积的水
10.下列做法能改变溶液中溶质质量分数的是( )
A.将硝酸钾的饱和溶液升温(溶剂的质量不变)
B.将氯化铵的饱和溶液降温
C.将氯化钠的饱和溶液恒温蒸发
D.在蔗糖的饱和溶液中再加入少量蔗糖
11.在海水晒盐过程中,下列说法不正确的是
A.把海水引入贮水池时,海水的成分基本不变
B.在蒸发池中进行风吹日晒时,海水中氯化钠的质量分数增大
C.在结晶池中继续风吹日晒时,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的不饱和溶液
12.1926 年我国著名化学家侯德榜先生创立了侯氏制碱法,促进了世界制碱技术的发展。侯氏制碱法以 食盐为主要原料制取纯碱,制得的纯碱中常含有少 量氯化钠。Na2CO3 和 NaCl 的溶解度曲线如图所示下列关于两种物质的说法中不正确的是
A.Na2CO3 的溶解度受温度的影响比 NaCl 大
B.t1℃时,100 g Na2CO3 饱和溶液中含有 20 gNa2CO3
C.t2℃时,NaCl 饱和溶液与 Na2CO3 饱和溶液中溶质的质量分数相同
D.温度高于 t2℃时,Na2CO3 的溶解度大于 NaCl 的溶解度
13.甲、乙两种固体(不含结晶水)的溶解度曲线如图所示,下列说法中错误的是
A.40℃时,等质量甲、乙两物质的溶液,所含溶质质量甲大于乙
B.20℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等
C.40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至20℃,甲析出的晶体比乙多
D.20℃时,甲、乙的溶解度都是30g
14.下列图像能正确反映其对应关系的是( )
A.等量的镁和氧气充分反应
B.少量的碳在密闭的集气瓶中与氧气完全燃烧
C.常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中
D.加热KNO3、Ca(OH)2的饱和溶液(不考虑溶剂的蒸发)
15.溶液的组成变化与浓溶液和稀溶液有着密切的关系。下列有关溶液浓、稀的说法正确的是
①溶质质量增大,溶剂质量不变,则溶液质量增大,溶液会变浓。
②溶质质量减小,溶剂质量不变,则溶液质量减小,溶液会变稀。
③溶质质量不变,溶剂质量增大,则溶液质量增大,溶液会变稀。
④溶质质量不变,溶剂质量减小,则溶液质量减小,溶液会变浓。
A.①②③④ B.①②③ C.②③④ D.①③④
三、综合应用题
16.在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如下图所示,甲、丙还有剩余固体,乙固体全部溶解。升温到80 ℃时,发现甲固体全部溶解,乙固体析出,丙固体没有明显变化。
(1)室温时, (选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。
(2)上图中能表示乙物质的溶解度曲线的是 (填“a”、“b”或“c”,下同),
(3)t2 ℃时,甲、乙、丙三种物质的等质量的饱和溶液降到t1 ℃时,所得溶液中水的质量由大到小的顺序是
(4)小强同学要在实验室配制15%的氯化钠溶液50 g。需要量筒规格为 ml(填“20或50或100”),该同学按下图所示步骤依次操作:
按B量取所需的水配得的溶液溶质质量分数 (填“偏大或偏小或无影响”);E中玻璃棒的作用是 。若上图A中砝码的质量为5 g,游码为2.5 g,则称得氯化钠的质量 克
17.过氧乙酸溶液是杀死病毒的一种有效药剂,某商店出售一种过氧乙酸消毒液,其标签上的部分文字说明如图所示。试分析并计算:
过氧乙酸消毒液(C2H4O3)
质量 500g
溶质质量分数 40%
使用方法 浸泡、喷雾、熏蒸等方法,用水稀释后使用
密封、避光、避热、不可与可燃物混合存放、防猛烈撞击
(1)由储存方法中要避热储存,推断过氧乙酸可能具有的性质是 (写一条即可)。
(2)一瓶这种溶液中含溶质过氧乙酸的质量是 g。(结果精确到0.1%)
(3)对环境进行消毒时,常用到15%的过氧乙酸溶液,欲配制1000g15%过氧乙酸溶液,需40%的原溶液多少g?需加水质量为多少mL?(写出计算过程)
18.下图所示为实验室常用的实验装置:
回答下列问题:
(1)写出带标号②仪器的名称: 。若实验室制取氧气的发生装置可以选用A,则选择的依据是什么 ?写出用氯酸钾为原料制取氧气的化学方程式 。
(2)实验室制取并收集一瓶二氧化碳气体应选择的装置是 。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为: 。
(4)下图为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,请另写一个优点: 。
若用如下图装置按箭头所示的流向收集一瓶二氧化碳气体,请将集气瓶内的导管补画完整 。
(5)取溶质质量分数为8.5%的过氧化氢溶液20g倒入烧杯中,在催化剂的作用下使其完全分解,计算理论上共能产生氧气多少克 ?
参考答案:
1.AD
【详解】冰箱冷藏室中拿出一杯底部有少量蔗糖的溶液a,因为蔗糖未全部溶解,所以溶液a一定是饱和溶液,放置室温一段时间后晶体消失,说明未溶解的蔗糖再次溶于水,所以溶液a的质量分数小于溶液b的质量分数,蔗糖晶体的溶解度随着温度的升高而升高,室温下溶液b不一定是饱和溶液,可能饱和也可能不饱和.蔗糖晶体的溶解度随温度的升高而升高。故选AD。
2.CD
【详解】A、t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c,该选项分析正确;
B、t2℃时,a的溶解度是50g,即100g水中最多溶解50g的a,所以将50g a物质放入100g水中充分溶解得到a的饱和溶液,该选项分析正确;
C、ab的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以将t2℃时a,b,c三种物质的饱和溶液降温至t1℃时,ab析出晶体,溶质的质量分数减小,c溶解度增大,溶质的质量分数不变,与降温前相等,由于饱和溶液中溶质的质量分数为,即溶解度越大质量分数也就越大,而t1℃时b的溶解度大于a的溶解度大于t2℃时c的溶解度,所以此时溶液的质量分数关系是b>a>c,该选项分析错误;
D、c的溶解度随温度的降低而增大,所以将c的饱和溶液变为不饱和溶液,可采用降温的方法,该选项分析错误,
故选CD。
3.BD
【详解】A、根据图示,0℃时,20g水中最多溶解4g,溶解度是100g水中的溶解的最大量,所以溶解度不是24g,故A不符合题意;
B、30gX加入20g水中,溶液质量为24g,说明只溶解了4g,有26g没溶解,说明该溶液是饱和溶液,同理B点所示溶液只溶解了12g溶质,有18g没溶解,也是饱和溶液,故B符合题意;
C、t1℃时,B点溶液20g水中溶解了12g溶质,根据溶液的均一的,求得30g水中可以溶解18g,刚好50g溶液里可以全部溶解30g,但后续并不知道该溶液能否继续溶解该溶质,所以无法确定溶液的饱和性,故C不符合题意;
D、C、D点对应的溶质质量为30g,溶液为50g,所以质量分数相同,故D符合题意;
故选BD。
【点睛】本题难度不大,结合图中所给信息进行仔细分析。
4.AD
【详解】现在溶质质量分数为10%的NaCl溶液80g,要使其质量分数达到20%,可采用的方法是蒸发溶剂,或者增加溶质,设蒸发溶剂质量为x,则80g×10%=(80g-x)×20%,x=40g,设增加溶质质量为y,则,y=10g,故选:AD。
5.BD
【详解】A、通过分析溶解度曲线可知,20℃时,甲物质的溶解度是25g,所以125g甲溶液中含甲物质的质量为25g,故A错误;
B、20℃时,甲、乙物质的溶解度相等,所以等质量甲、乙饱和溶液中含溶质的质量相等,故B正确;
C、甲物质的溶解度随温度的升高而增大,所以将甲饱和溶液从50℃降温到30℃时一定有晶体析出,故C错误;
D、由溶解度曲线的意义可知,甲、乙的溶解度都随温度的降低而减小,将甲、乙两物质的饱和溶液从50℃降温到20℃均会有晶体析出,都是20℃时的饱和溶液,甲、乙的溶解度都是25g,溶液中溶质质量分数均为:×100%=20%,故D正确。
故选BD。
【点睛】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
6.D
【详解】A、根据溶解度曲线图可知a、b的溶解度随温度的升高而增大,c的溶解度随温度的升高而减小,A错误;
B、t2℃时,a的溶解度是50g,所以100g水中最多溶解50g,50g水中最多溶解25g,即形成75g饱和溶液,B错误;
C、t1℃时,a、c的溶解度相等,如果都是饱和溶液,则溶液的溶质质量分数相等,如果不都是饱和溶液,则无法判断质量分数的大小,C错误;
D、在t2℃至t1℃,a的溶解度变化最大,b的溶解度变化较小,c的溶解度随温度降低而增大,所以将等质量的a、b两种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是a;D正确。
综上所述:选择D。
7.D
【详解】A、在一定温度下,向饱和的硝酸钾溶液中加入硝酸钾固体,充分搅拌硝酸钾不能继续溶解,因此溶液的质量不应该发生变化,错误;
B、向NaOH溶液中逐滴加入稀盐酸,pH不断下降,错误;
C、锌的活动性大于铁,因此锌反应较快,错误;
D、向一定量含MgSO4和H2SO4混合溶液中逐滴加入NaOH溶液,氢氧化钠先与硫酸反应,然后与硫酸镁反应生成沉淀,曲线正确;
故选D。
8.C
【详解】A、由图示可知,甲和乙的溶解度曲线在t1℃时相交,则表示在t1℃时,甲和乙的溶解度相等,故A正确;
B、根据图像,t2℃时,甲的溶解度为42g,乙的溶解度为36g,则该温度下的甲的饱和溶液溶质质量分数为,乙的饱和溶液溶质质量分数为,则t2℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数,故B正确;
C、t2℃时,甲的溶解度大于乙的溶解度,即相同质量的水中溶解的甲的质量大于乙的质量,故从甲和乙两种饱和溶液中获得等质量晶体,蒸发水较多的是乙溶液,故C错误;
D、t2℃时,甲的溶解度为42g,即该温度下100g水中溶解42g甲即能达到饱和状态。将42g甲固体加入50g水中,用玻璃棒充分搅拌后,可溶解21g,所得溶液质量为50g+21g=71g,溶质与溶液的质量之比为21:71,故D正确;
故选C。
9.D
【详解】A、未给定温度,无法比较,故A错误;
B、甲、乙原饱和溶液降温后一定有晶体析出,不知降温前甲、乙溶液是否饱和,若不饱和,则降温不一定有晶体析出,故B错误;
C、所得溶液的溶质质量分数为×100%≈23.1%,故C错误;
D、t1℃时,甲、乙的溶解度相同,配制等质量的两种物质的饱和溶液,需要水的质量相同,量取水的体积相同,故D正确。故选D。
10.B
【分析】
【详解】A、硝酸钾的溶解度随温度的升高而增大,将硝酸钾的饱和溶液升温(溶剂的质量不变),溶质和溶剂的质量均不变,则溶质质量分数不变,故A不正确;
B、氯化铵的溶解度随温度的升高而增大,将氯化铵的饱和溶液降温,有氯化铵固体析出,有溶质析出,溶质质量分数减小,故B正确;
C、将氯化钠的饱和溶液恒温蒸发,溶液还是同一温度下饱和溶液,溶质质量分数不变,故C不正确;
D、在蔗糖的饱和溶液中再加入少量蔗糖,蔗糖不再溶解,溶质质量分数不变,故D不正确。故选B。
11.D
【详解】A、海水进入贮水池,海水的成分基本不变,故A正确;
B、在蒸发池中,水的质量不断减少,海水中氯化钠的质量分数,在饱和以前逐渐增大,故B正确;
C、在蒸发池中,海水中水的质量逐渐减小;故C正确;
D、析出晶体后的母液,不能继续溶解氯化钠,是氯化钠的饱和溶液,故D错误。故选D。
【点睛】析出晶体后的母液,是该温度下,该溶质的饱和溶液。
12.B
【详解】A、由溶解度曲线可知:Na2CO3的溶解度受温度的影响比NaCl大正确,正确但不符合题意,故选项错误;
B、t1℃时,120gNa2CO3饱和溶液中含有20gNa2CO3,100g错误,错误符合题意,故选项正确;
C、t2℃时,NaCl饱和溶液与Na2CO3饱和溶液中溶质的质量分数相同正确,因为在该温度下,它们溶解度相等,正确但不符合题意,故选项错误;
D、温度高于t2℃时,Na2CO3的溶解度大于NaCl的溶解度正确,正确但不符合题意,故选项错误;
故选B。
13.A
【详解】A、40℃时,溶解度甲大于乙,则等质量甲、乙两物质的饱和溶液,所含溶质质量甲大于乙,选项中没有指明溶液是否饱和,无法比较,故A说法错误;
B、20℃时,溶解度甲等于乙,则甲、乙两物质的饱和溶液中溶质的质量分数相等,故B说法正确;
C、甲的溶解度受温度影响较大,则40℃时,将等质量的甲、乙两物质的饱和溶液,分别降温至20℃,甲析出的晶体比乙多,故C说法正确;
D、20℃时,甲、乙的溶解度都是30g,故D说法正确;
故选:A。
14.C
【详解】A、根据镁和氧气反应化学方程式可知,每48份镁与32份质量的氧气反应 ,等量的镁和氧气充分反应时,消耗镁的质量比氧气更多,氧气有剩余而镁消耗完全,图像不能正确反映其对应关系,不符合题意;
B、碳和氧气在点燃条件下生成二氧化碳,其化学方程式为:,反应每消耗1分子的氧气,产生1分子的二氧化碳,因此气体分子数目保持不变,图像不能正确反映其对应关系,不符合题意;
C、镁的活动性比铁强,因此镁反应产生氢气的斜率大于铁反应产生氢气的斜率,等量的稀盐酸完全反应提供氢元素相等,产生的氢气质量相等,图像能正确反映其对应关系,符合题意;
D、硝酸钾的溶解度随温度的升高而增大,硝酸钾饱和溶液变成不饱和溶液,溶质质量分数保持不变,氢氧化钙的溶解度随温度的升高而增大,饱和氢氧化钙溶液升温有晶体析出,溶质质量分数变小,图像不能正确反映其对应关系,不符合题意;
故选:C。
15.A
【分析】根据溶液的质量=溶质的质量+溶剂的质量,溶质的质量分数=×100%= ×100%进行分析。
【详解】①因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量增大,溶剂质量不变,溶液质量增大,溶液会变浓,正确;②因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量减小,溶剂质量不变,则溶液质量减小,溶液会变稀,正确;③因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量不变,溶剂质量增大,则溶液质量增大,溶液会变稀,正确;④因为溶液的质量=溶质的质量+溶剂的质量,若溶质质量不变,溶剂质量减小,则溶液质量减小,溶液会变浓,正确。故选A。
16. 乙 C c>b>a 50、 偏小、 搅拌,加快氯化钠溶解速率 , 2.5
【详解】(1)甲、丙溶液中有未溶解的固体而乙溶液中没有未溶解的固体,所以室温时,乙溶液可能是不饱和溶液;(2)根据升温到80℃时,发现乙固体析出,所以乙物质的溶解度随温度的升高而减小,图2中能表示乙物质的溶解度曲线的是c; (3)t2℃时,甲、乙、丙三种物质的溶解度大小顺序是a>b>c,所以t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中水的质量由大到小的顺序是c>b>a;(4)小强同学要在实验室配制15%的氯化钠溶液50g,需要氯化钠的质量=15%×50g=7.5g,需要水的体积为42.5mL,所以用规格为50mL的量筒取所需要的水;仰视读数,读数偏小,实际体积偏大,故按B量取所需的水配得的溶液溶质质量分数偏小;E中玻璃棒的作用是搅拌,加快氯化钠溶解速率;若上图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际=5g 2.5g=2.5g。
17.(1)受热不稳定
(2)200
(3)375g ;625mL
解:欲配制1000g15%过氧乙酸溶液,需40%的原溶液的质量为x,
则1000g×15%=40%×x,x=375g,
需要加水的质量为:1000g-375g=625g,合625mL。
答:需40%的原溶液375g,需加水625mL。
【详解】(1)由储存方法中要避热储存,推断过氧乙酸可能具有的性质是受热不稳定,故填:受热不稳定。
(2)一瓶这种溶液中含溶质过氧乙酸的质量是:500g×40%=200g,故填:200。
(3)见答案。
18. 长颈漏斗 反应物是固体,反应条件是加热 BD 节约药品、可随时控制反应发生或停止 0.8g
【详解】(1)标号②仪器的名称为长颈漏斗。若实验室制取氧气的发生装置可以选用A,A为固-固加热型发生装置,则选择的依据是反应物是固体,反应条件是加热;用氯酸钾为原料制取氧气,氯酸钾在二氧化锰作催化剂的条件下分解生成氯化钾和氧气,反应的化学方程式为。
(2)实验室制二氧化碳的原理是大理石或石灰石与稀盐酸反应生成二氧化碳、氯化钙和水,选择固液不加热型发生装置,二氧化碳密度比空气密度大,溶于水且与水反应,选择向上排空气法收集装置,综上所述,实验室制取并收集一瓶二氧化碳气体应选择的装置是BD。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为。
(4)如图所示为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,通过向上提起底部有破洞的试管,固体药品与液体药品就会分离,反应就会停止,因此还有节约药品、可随时控制反应发生或停止的优点。二氧化碳的密度比空气密度大,若用倒置的万用瓶通过排空气法收集二氧化碳,二氧化碳应该从短管进,则集气瓶内的导管应该为。
(5)由题意20g8.5%的过氧化氢溶液含有过氧化氢的质量为,设理论上共能产生氧气的质量为x,则有:
由解得x=0.8g
答:质量分数为8.5%的过氧化氢溶液20g完全分解理论上共能产生氧气0.8g。
