3.1.1亚铁盐和铁盐课件(共34张PPT) 化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.1.1亚铁盐和铁盐课件(共34张PPT) 化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 26.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 08:34:44 | ||
图片预览









文档简介
(共34张PPT)
亚铁盐和铁盐
第一节 铁的多样性
目 录
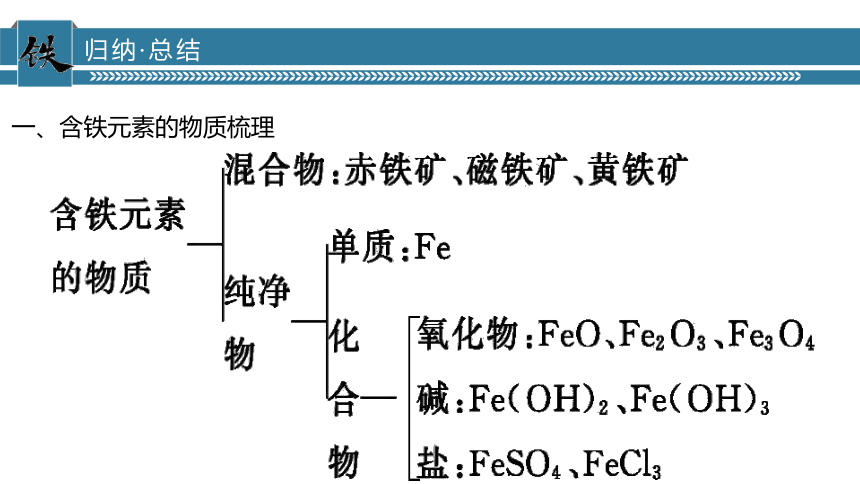
含铁元素的物质梳理
亚铁盐和铁盐
学习目标
1.了解亚铁盐和铁盐的组成,能利用实验探究的方式实现Fe2+和Fe3+之间的转化。(科学探究与创新意识)
2.通过分析、推理探究Fe2+、Fe3+的检验方法。(证据推理与模型认知)
导入
铁是重要的金属元素,在地壳中的含量仅次于氧、硅、铝元素。
O、Si、Al
联想·质疑
实验室中含有铁元素的物质
一、含铁元素的物质梳理
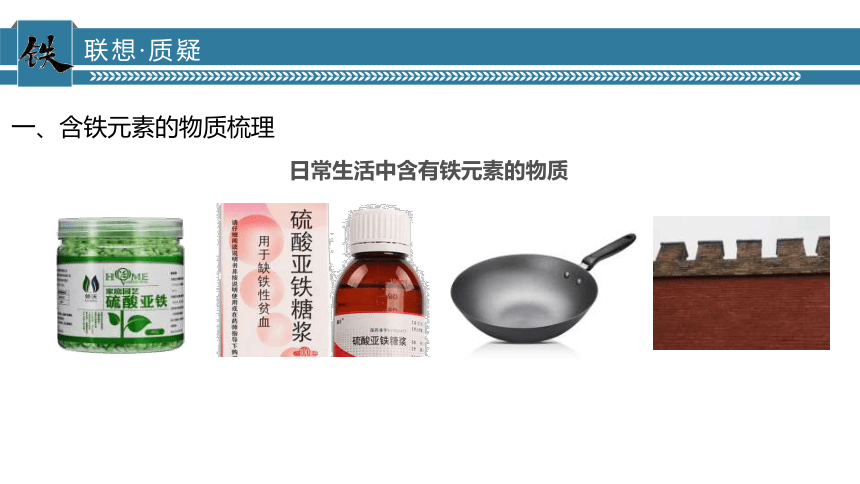
日常生活中含有铁元素的物质
联想·质疑
一、含铁元素的物质梳理
联想·质疑
新疆托克逊铁陨石
愚人金 黄铁矿
(主要成分为FeS2)
(主要成分为Fe2O3)
赤铁矿
磁铁矿
(主要成分为Fe3O4)
日常生活中含有铁元素的物质
一、含铁元素的物质梳理
归纳·总结
一、含铁元素的物质梳理
归纳·总结
铁元素的化合价
一、含铁元素的物质梳理
活动·探究
类别 组成 举例
亚铁盐 含 的盐 FeSO4、FeCl2、Fe(NO3)2等
铁盐 含 的盐 Fe2(SO4)3、FeCl3、Fe(NO3)3等
Fe2+
Fe3+
1.组成和举例
二、铁盐和亚铁盐
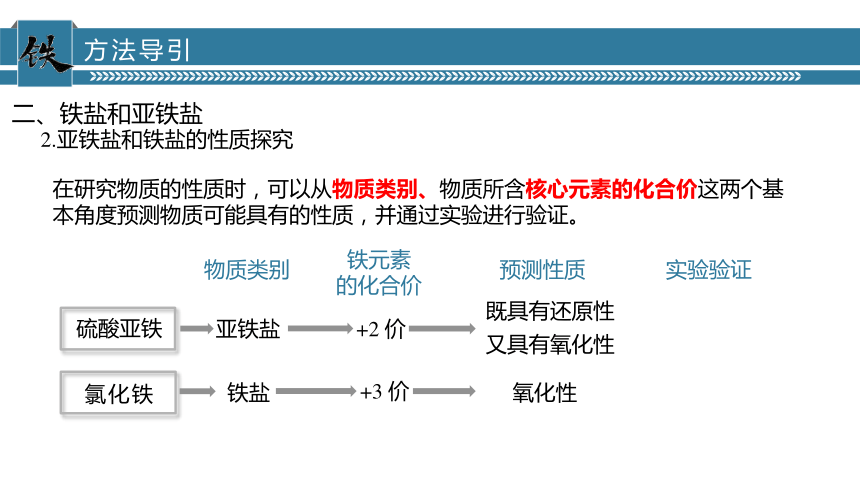
方法导引
在研究物质的性质时,可以从物质类别、物质所含核心元素的化合价这两个基本角度预测物质可能具有的性质,并通过实验进行验证。
铁元素
的化合价
物质类别
预测性质
实验验证
亚铁盐
铁盐
+2 价
+3 价
既具有还原性
又具有氧化性
氧化性
硫酸亚铁
氯化铁
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
实验目的
实验用品
性质预测
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐和铁盐的性质。
FeSO4 溶液,FeCl3 溶液,NaOH 溶液,KSCN(硫氰酸钾)溶液,酸性KMnO4 溶液,氯水,KI 溶液,淀粉溶液,稀硫酸,铁粉,锌片,铜片;
试管,胶头滴管,镊子,钥匙。
预测硫酸亚铁、氯化铁分别具有怎样的性质,并说明预测的依据。
活动·探究
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
活动·探究
实验内容 实验现象 结论
NaOH溶液滴入FeSO4溶液 先生成 沉淀,迅速变成 ,最后变成 沉淀 反应方程式
NaOH溶液滴入FeCl3溶液 生成 沉淀 离子方程式
(1)Fe2+、Fe3+与碱的反应
白色
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
灰绿色
红褐色
Fe2+ + 2OH- === Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
红褐色
Fe3+ + 3OH- === Fe(OH)3↓
方法导引
观察物质的外观性质
预测物质的性质
解释及结论
发现特殊现象
提出新的问题
实验和观察
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
已知:
铁的检验:依据 Fe3+ 与 SCN- 反应使溶液显红色的性质,可以用 KSCN 溶液检验 Fe3+ 的存在。
滴加 KSCN 溶液
FeC13溶液
反应后溶液显红色
Fe3++3SCN-=== Fe(SCN)3
硫氰根
硫氰化钾
硫氰化铁
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
实验①
[实验现象]加入KSCN溶液后,溶液呈 色。
加入足量铁粉后,溶液褪色。
[实验结论] Fe3+具有氧化性,Fe具有还原性
得e-
红
离子方程式:2Fe3++Fe === 3Fe2+
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
实验②
[实验现象]加入KSCN溶液后,溶液呈 色。
加入足量铜片后,溶液红色消失,变为
[实验结论]Fe3+具有氧化性,Cu具有还原性
得e-
红
离子方程式:2Fe3++Cu === 2Fe2++Cu2+
蓝色
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
实验③
[实验现象]加入KSCN溶液后,溶液呈红色,滴加KI溶液后,溶液由红色变为蓝色
[实验结论]Fe3+具有氧化性,被I-还原为Fe2+
得e-
离子方程式:2Fe3+ + 2I- === 2Fe2+ + I2
向FeCl3溶液中先滴加KSCN溶液和淀粉溶液,再滴加KI溶液
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验① Fe2+和氯水反应
[实验现象]加入KSCN溶液,无明显现象
再滴加氯水溶液呈 色。
[实验结论]Fe2+具有还原性
离子方程式:2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
Fe3++3SCN- === Fe(SCN)3
红
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验②
把FeSO4滴入酸性KMnO4溶液
[实验现象]加入FeSO4溶液,酸性KMnO4溶液紫红色褪去,溶液略呈黄色。
[实验结论]Fe2+具有还原性,被酸性KMnO4氧化为Fe3+。
离子方程式:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验③
过氧化氢H2O2滴入FeSO4溶液
[实验现象]加入H2O2溶液,溶液浅绿色褪去,溶液略呈黄色。
[实验结论]Fe2+具有还原性,被H2O2氧化为Fe3+。
离子方程式: 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验④
FeCl2溶液加入过量锌粉
[实验现象]溶液由 色变为无色。
[实验结论]Fe2+具有氧化性,离子方程式: Fe2+ + Zn === Fe + Zn2+
浅绿
深·度·思·考
(1)实验室配制FeSO4溶液时加铁粉的作用是什么?
(2)如何保存硫酸亚铁溶液?
Fe2+易被氧化为Fe3+,加入铁粉或铁钉,发生反应:2Fe3++Fe === 3Fe2+,可防止硫酸亚铁溶液被氧化。
密封保存
(3)如何除去氯化铁中的Fe2+?写出反应的离子方程式。
(4)如何检验溶液中的Fe2+?
加入新制的氯水,2Fe2++Cl2 === 2Fe3++2Cl-
待测液
无现象
血红色
KSCN溶液
Cl2(H2O2)
深·度·思·考
深·度·思·考
注:
1、除FeCl3中的Fe2+:
除FeCl2中的Fe3+:
2、检验Fe3+:
3、检验Fe2+:①向溶液中先滴加KSCN溶液,若无现象,再向其中加入H2O2或新制氯水,若溶液变为红色,说明溶液中有Fe2+②向溶液中滴加K3Fe(CN)6,若产生蓝色沉淀,说明溶液中有Fe2+
向溶液中滴加新制氯水,2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
向溶液中加入铁粉,2Fe3++Fe === 3Fe2+
向溶液中滴加KSCN溶液,若溶液变为红色,说明溶液中有Fe3+
Fe3++3SCN- === Fe(SCN)3
亚铁盐和铁盐
总结:
(1)与碱的反应
Fe2+ + 2OH- === Fe(OH)2↓
4Fe(OH)2+O2+2H2O==4Fe(OH)3
(2)氧化性
Fe2+ + Zn === Fe + Zn2+
(3)还原性
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
1.亚铁盐的性质
(1)与碱的反应
Fe3++3OH- === Fe(OH)3↓
(2)氧化性
2Fe3++Zn === 2Fe2++Zn2+
2Fe3++2I- === 2Fe2++I2
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++Fe === 3Fe2+
保存FeSO4溶液需加入铁粉防止Fe2+被氧化
常用于工业腐蚀线路板
(3)特性
Fe3++3SCN- === Fe(SCN)3
红色易溶于水的物质
可使淀粉-KI溶液变蓝
亚铁盐和铁盐
总结:
2.铁盐的性质
亚铁盐和铁盐
典例:
已知A是一种常见金属,F是一种红褐色沉
淀。根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式:
A.________,C.________,F.________,G.________。
(2)检验D中阳离子的方法____________________。
(3)写出下列转化的离子方程式或化学方程式。
①A→C:__________________________________;
②C→D:__________________________________。
(4)两种转化关系
含有相同价态铁元素之间的转化,可借助 。
含有不同价态铁元素的物质之间的转化,可借助 。
测
当堂测试
测试1
1.能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN-,②Fe,③Fe2+,④Cu,⑤H2S,⑥OH-
B
A. ①②③ B. ②④⑤ C. ①③⑥ D. ①②⑤
测
当堂测试
测试2
2.将过量的过氧化钠投入氯化亚铁溶液中,可观察到的实验现象是( )
A.有白色沉淀生成
B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色
D.不可能有无色气体产生
B
测
当堂测试
测试3
3.一定量的铁粉在氯气中充分燃烧,将所得固体完全溶解于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是_________________________________。
(2)推测A中可能含有的金属阳离子:
①只有Fe3+;
②只有Fe2+;
③______________________。
含有 Fe2+和 Fe3+
2Fe+3Cl2 ==== 2FeCl3
点燃
测
当堂测试
测试3
(3)甲同学探究溶液A的组成。
查阅资料:16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4溶液紫色退去,实验结论:__________(填字母)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
根据你选择的实验结论,简述理由:________________________________________
______________________________________________________________________。
因还原性:Fe2+>Cl-。Fe2+将 还原为Mn2+,溶液紫色褪去;若溶液中无Fe2+,Cl-也能将还原为Mn2+,溶液紫色褪去
ab
亚 铁 盐
与碱的反应
铁 盐
与碱的反应
还原性
氧化性
还原性
Fe2+
Fe3+
课堂小结
本节内容结束
亚铁盐和铁盐
第一节 铁的多样性
目 录
含铁元素的物质梳理
亚铁盐和铁盐
学习目标
1.了解亚铁盐和铁盐的组成,能利用实验探究的方式实现Fe2+和Fe3+之间的转化。(科学探究与创新意识)
2.通过分析、推理探究Fe2+、Fe3+的检验方法。(证据推理与模型认知)
导入
铁是重要的金属元素,在地壳中的含量仅次于氧、硅、铝元素。
O、Si、Al
联想·质疑
实验室中含有铁元素的物质
一、含铁元素的物质梳理
日常生活中含有铁元素的物质
联想·质疑
一、含铁元素的物质梳理
联想·质疑
新疆托克逊铁陨石
愚人金 黄铁矿
(主要成分为FeS2)
(主要成分为Fe2O3)
赤铁矿
磁铁矿
(主要成分为Fe3O4)
日常生活中含有铁元素的物质
一、含铁元素的物质梳理
归纳·总结
一、含铁元素的物质梳理
归纳·总结
铁元素的化合价
一、含铁元素的物质梳理
活动·探究
类别 组成 举例
亚铁盐 含 的盐 FeSO4、FeCl2、Fe(NO3)2等
铁盐 含 的盐 Fe2(SO4)3、FeCl3、Fe(NO3)3等
Fe2+
Fe3+
1.组成和举例
二、铁盐和亚铁盐
方法导引
在研究物质的性质时,可以从物质类别、物质所含核心元素的化合价这两个基本角度预测物质可能具有的性质,并通过实验进行验证。
铁元素
的化合价
物质类别
预测性质
实验验证
亚铁盐
铁盐
+2 价
+3 价
既具有还原性
又具有氧化性
氧化性
硫酸亚铁
氯化铁
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
实验目的
实验用品
性质预测
以硫酸亚铁、氯化铁为例,通过实验探究亚铁盐和铁盐的性质。
FeSO4 溶液,FeCl3 溶液,NaOH 溶液,KSCN(硫氰酸钾)溶液,酸性KMnO4 溶液,氯水,KI 溶液,淀粉溶液,稀硫酸,铁粉,锌片,铜片;
试管,胶头滴管,镊子,钥匙。
预测硫酸亚铁、氯化铁分别具有怎样的性质,并说明预测的依据。
活动·探究
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
活动·探究
实验内容 实验现象 结论
NaOH溶液滴入FeSO4溶液 先生成 沉淀,迅速变成 ,最后变成 沉淀 反应方程式
NaOH溶液滴入FeCl3溶液 生成 沉淀 离子方程式
(1)Fe2+、Fe3+与碱的反应
白色
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
灰绿色
红褐色
Fe2+ + 2OH- === Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
红褐色
Fe3+ + 3OH- === Fe(OH)3↓
方法导引
观察物质的外观性质
预测物质的性质
解释及结论
发现特殊现象
提出新的问题
实验和观察
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
已知:
铁的检验:依据 Fe3+ 与 SCN- 反应使溶液显红色的性质,可以用 KSCN 溶液检验 Fe3+ 的存在。
滴加 KSCN 溶液
FeC13溶液
反应后溶液显红色
Fe3++3SCN-=== Fe(SCN)3
硫氰根
硫氰化钾
硫氰化铁
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
实验①
[实验现象]加入KSCN溶液后,溶液呈 色。
加入足量铁粉后,溶液褪色。
[实验结论] Fe3+具有氧化性,Fe具有还原性
得e-
红
离子方程式:2Fe3++Fe === 3Fe2+
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
实验②
[实验现象]加入KSCN溶液后,溶液呈 色。
加入足量铜片后,溶液红色消失,变为
[实验结论]Fe3+具有氧化性,Cu具有还原性
得e-
红
离子方程式:2Fe3++Cu === 2Fe2++Cu2+
蓝色
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(2)Fe3+的氧化性实验探究
实验③
[实验现象]加入KSCN溶液后,溶液呈红色,滴加KI溶液后,溶液由红色变为蓝色
[实验结论]Fe3+具有氧化性,被I-还原为Fe2+
得e-
离子方程式:2Fe3+ + 2I- === 2Fe2+ + I2
向FeCl3溶液中先滴加KSCN溶液和淀粉溶液,再滴加KI溶液
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验① Fe2+和氯水反应
[实验现象]加入KSCN溶液,无明显现象
再滴加氯水溶液呈 色。
[实验结论]Fe2+具有还原性
离子方程式:2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
Fe3++3SCN- === Fe(SCN)3
红
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验②
把FeSO4滴入酸性KMnO4溶液
[实验现象]加入FeSO4溶液,酸性KMnO4溶液紫红色褪去,溶液略呈黄色。
[实验结论]Fe2+具有还原性,被酸性KMnO4氧化为Fe3+。
离子方程式:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验③
过氧化氢H2O2滴入FeSO4溶液
[实验现象]加入H2O2溶液,溶液浅绿色褪去,溶液略呈黄色。
[实验结论]Fe2+具有还原性,被H2O2氧化为Fe3+。
离子方程式: 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
方法导引
2.亚铁盐和铁盐的性质探究
二、铁盐和亚铁盐
(3)Fe2+的氧化性和还原性实验探究
实验④
FeCl2溶液加入过量锌粉
[实验现象]溶液由 色变为无色。
[实验结论]Fe2+具有氧化性,离子方程式: Fe2+ + Zn === Fe + Zn2+
浅绿
深·度·思·考
(1)实验室配制FeSO4溶液时加铁粉的作用是什么?
(2)如何保存硫酸亚铁溶液?
Fe2+易被氧化为Fe3+,加入铁粉或铁钉,发生反应:2Fe3++Fe === 3Fe2+,可防止硫酸亚铁溶液被氧化。
密封保存
(3)如何除去氯化铁中的Fe2+?写出反应的离子方程式。
(4)如何检验溶液中的Fe2+?
加入新制的氯水,2Fe2++Cl2 === 2Fe3++2Cl-
待测液
无现象
血红色
KSCN溶液
Cl2(H2O2)
深·度·思·考
深·度·思·考
注:
1、除FeCl3中的Fe2+:
除FeCl2中的Fe3+:
2、检验Fe3+:
3、检验Fe2+:①向溶液中先滴加KSCN溶液,若无现象,再向其中加入H2O2或新制氯水,若溶液变为红色,说明溶液中有Fe2+②向溶液中滴加K3Fe(CN)6,若产生蓝色沉淀,说明溶液中有Fe2+
向溶液中滴加新制氯水,2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
向溶液中加入铁粉,2Fe3++Fe === 3Fe2+
向溶液中滴加KSCN溶液,若溶液变为红色,说明溶液中有Fe3+
Fe3++3SCN- === Fe(SCN)3
亚铁盐和铁盐
总结:
(1)与碱的反应
Fe2+ + 2OH- === Fe(OH)2↓
4Fe(OH)2+O2+2H2O==4Fe(OH)3
(2)氧化性
Fe2+ + Zn === Fe + Zn2+
(3)还原性
2Fe2+ + Cl2 === 2Fe3+ + 2Cl-
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
1.亚铁盐的性质
(1)与碱的反应
Fe3++3OH- === Fe(OH)3↓
(2)氧化性
2Fe3++Zn === 2Fe2++Zn2+
2Fe3++2I- === 2Fe2++I2
2Fe3++Cu === 2Fe2++Cu2+
2Fe3++Fe === 3Fe2+
保存FeSO4溶液需加入铁粉防止Fe2+被氧化
常用于工业腐蚀线路板
(3)特性
Fe3++3SCN- === Fe(SCN)3
红色易溶于水的物质
可使淀粉-KI溶液变蓝
亚铁盐和铁盐
总结:
2.铁盐的性质
亚铁盐和铁盐
典例:
已知A是一种常见金属,F是一种红褐色沉
淀。根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式:
A.________,C.________,F.________,G.________。
(2)检验D中阳离子的方法____________________。
(3)写出下列转化的离子方程式或化学方程式。
①A→C:__________________________________;
②C→D:__________________________________。
(4)两种转化关系
含有相同价态铁元素之间的转化,可借助 。
含有不同价态铁元素的物质之间的转化,可借助 。
测
当堂测试
测试1
1.能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN-,②Fe,③Fe2+,④Cu,⑤H2S,⑥OH-
B
A. ①②③ B. ②④⑤ C. ①③⑥ D. ①②⑤
测
当堂测试
测试2
2.将过量的过氧化钠投入氯化亚铁溶液中,可观察到的实验现象是( )
A.有白色沉淀生成
B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色
D.不可能有无色气体产生
B
测
当堂测试
测试3
3.一定量的铁粉在氯气中充分燃烧,将所得固体完全溶解于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是_________________________________。
(2)推测A中可能含有的金属阳离子:
①只有Fe3+;
②只有Fe2+;
③______________________。
含有 Fe2+和 Fe3+
2Fe+3Cl2 ==== 2FeCl3
点燃
测
当堂测试
测试3
(3)甲同学探究溶液A的组成。
查阅资料:16HCl+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4溶液紫色退去,实验结论:__________(填字母)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
根据你选择的实验结论,简述理由:________________________________________
______________________________________________________________________。
因还原性:Fe2+>Cl-。Fe2+将 还原为Mn2+,溶液紫色褪去;若溶液中无Fe2+,Cl-也能将还原为Mn2+,溶液紫色褪去
ab
亚 铁 盐
与碱的反应
铁 盐
与碱的反应
还原性
氧化性
还原性
Fe2+
Fe3+
课堂小结
本节内容结束
