山东省潍坊市昌邑市2023-2024学年九年级下学期开学化学试题(含解析)
文档属性
| 名称 | 山东省潍坊市昌邑市2023-2024学年九年级下学期开学化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 493.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 10:38:31 | ||
图片预览



文档简介
九年级化学
(时间50分钟,满分100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Zn 65 K 39 Fe 56 Mg 24 Cu 64 Ag 108
一、选择题:本题共4小题,每小题4分,共16分,每小题只有一个选项符合题意。
1.下列关于物质的性质与用途对应关系不正确的是
A.氮气化学性质不活泼,可用作食品防腐
B.干冰升华吸热,可用作制冷剂
C.金刚石硬度大,可用于做钻石
D.稀有气体通电能发光,可用作霓虹灯
2.化学链燃烧是利用“载氧体”将空气中的氧传输至燃料的新技术。以下是甲烷化学链燃烧的示意图。下列有关说法正确的是
A.Cu2O中铜元素显+2价
B.“空气反应器”中N2是生成物
C.“燃料反应器”中发生的是分解反应
D.化学链燃烧有利于CO2的分离处理
3.以下归纳和总结完全正确的一组是
A.化学与环境 B.化学与安全
①使用脱硫煤可完全解决酸雨问题 ②工业废水未经处理就排放会造成水污染 ①点燃可燃性气体前一定要验纯 ②煤气泄漏应立即打开排气扇通风
C.化学与社会发展 D.化学与生活
①使用乙醇汽油可以节约石油资源 ②青铜和钢都属于金属材料 ①用碳素墨水书写档案 ②铝锅上的污垢用钢丝刷擦洗
A.A B.B C.C D.D
4.推理是化学学习中常用的思维方法,需具备科学严谨性,以下推理错误的是
A.物质与氧气发生的反应属于氧化反应,所以硫的燃烧是氧化反应
B.用洗涤剂去油污是乳化现象,所以汽油去油污也是乳化现象
C.溶液是均一、稳定的混合物,所以高锰酸钾溶液中各部分的组成和性质相同
D.合金的硬度一般比组成他们的纯金属高,因此铝合金的硬度大于铝
二、选择题:本题共3小题,每小题5分,共15分。每小题有一个或两个选项符合题意,全部选对得5分,选对但不全的得3分,有选错的得0分。
5.下列所选实验方案正确的一组是
项目 物质 实验方案
A 鉴别黄铜和真金 灼烧后观察颜色
B 除去中的 高温
C 鉴别、 加水根据温度判断
D 除去中混有的CO 将混合气体点燃
A.A B.B C.C D.D
6.如图所示四个图像对应的变化过程正确的是
A.气体物质的溶解度与温度和压强的关系
B.向饱和碳酸钠溶液中继续加氯化钠固体
C.加热碳和氧化铜的混合物
D.向等质量的Zn、Fe中滴加等浓度等质量的稀盐酸
7.在硝酸铜、硝酸银、硝酸镁的混合溶液中加入一定量的锌粉,充分反应后过滤。下列说法正确的是
A.若滤液为蓝色,溶液的质量可能减小
B.若滤液为无色,则滤渣中一定有银、铜和锌
C.若滤液为蓝色,则滤液中的溶质一定有硝酸铜、硝酸锌,可能有硝酸银
D.若往滤渣中加入稀盐酸有气泡产生,则滤液中的溶质只有硝酸镁、硝酸锌
三、非选择题:本题共4小题,共69分。
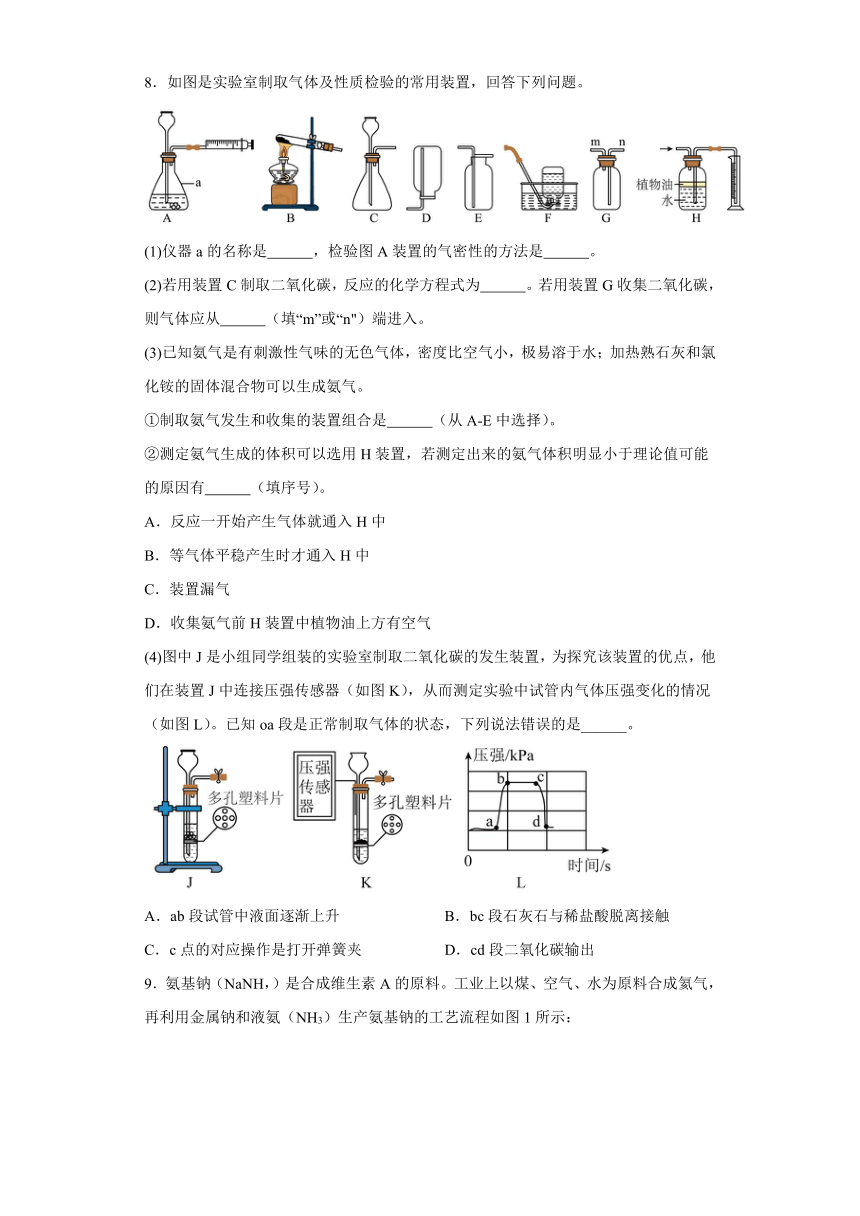
8.如图是实验室制取气体及性质检验的常用装置,回答下列问题。
(1)仪器a的名称是 ,检验图A装置的气密性的方法是 。
(2)若用装置C制取二氧化碳,反应的化学方程式为 。若用装置G收集二氧化碳,则气体应从 (填“m”或“n")端进入。
(3)已知氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水;加热熟石灰和氯化铵的固体混合物可以生成氨气。
①制取氨气发生和收集的装置组合是 (从A-E中选择)。
②测定氨气生成的体积可以选用H装置,若测定出来的氨气体积明显小于理论值可能的原因有 (填序号)。
A.反应一开始产生气体就通入H中
B.等气体平稳产生时才通入H中
C.装置漏气
D.收集氨气前H装置中植物油上方有空气
(4)图中J是小组同学组装的实验室制取二氧化碳的发生装置,为探究该装置的优点,他们在装置J中连接压强传感器(如图K),从而测定实验中试管内气体压强变化的情况(如图L)。已知oa段是正常制取气体的状态,下列说法错误的是______。
A.ab段试管中液面逐渐上升 B.bc段石灰石与稀盐酸脱离接触
C.c点的对应操作是打开弹簧夹 D.cd段二氧化碳输出
9.氨基钠(NaNH,)是合成维生素A的原料。工业上以煤、空气、水为原料合成氦气,再利用金属钠和液氨(NH3)生产氨基钠的工艺流程如图1所示:
(1)煤加入“煤气发生炉”前需进行粉碎处理,其目的是 。
(2)已知“煤气发生炉”中的主要反应为:①C+O2CO2,②C+H2OCO2+H2,以上两个反应必须要进行调控才能保持炉内所需达到的温度,则反应② (填“放出”或“吸收”)热量。
(3)“合成塔”中的物质在高温、高压和一定催化剂的条件下进行反应,请写出反应的化学方程式 。
(4)加热条件下“反应釜”中发生反应获得氨基钠,化学方程式为 。
(5)整个生产过程中,可以循环利用的物质有 。
(6)为研究温度、金属钠的投加量对产物中氮基钠含量的影响,每次取120mL 液氨做系列实验,结果如图 2 所示。分析可知,用120mL 液氨制备氨基钠的最佳条件是 。
10.纳米零价铁在环保领域应用广泛,以菱铁矿(主要成分为FeCO3,其它成高温分不参与反应)为原料,制备纳米零价铁的反应为:H2 +FeCO3Fe +H2O+CO2,反应一段时间后,某学习小组对剩余固体的成分进行探究。
查阅资料:①浓硫酸吸水,可以对气体进行干燥
②H2O能使无水硫酸铜变蓝
③FeCO3+H2SO4=FeSO4+H2O+CO2 ↑
【提出问题】剩余固体的成分是什么?
【作出猜想】
(1)剩余固体的成分:猜想一:Fe;猜想二:FeCO3;猜想三: 。
【实验探究】该学习小组利用下图装置,对剩余固体成分进行探究,请根据以下实验操作及现象回答问题。
(2)将剩余固体放入装置A中,加入稀硫酸,A中产生气泡且溶液变为浅绿色,小芳同学判断猜想一正确,小刚同学认为小芳的判断不合理,理由是: 。
(3)观察到装置B中溶液变浑浊,写出装置B中的化学反应方程式 。
观察到装置D中黑色粉末变红色。
【实验结论】
(4)猜想 正确
【反思交流】
(5)如果将装置 E 去掉, (填“能”或“不能”)验证剩余固体中含有Fe,理由是 。
(6)制备纳米铁时,需要在充满氩气的环境中进行,是因为 。实验结束后,处理实验后的残余药品时,铁粉和铜粉不小心混在了一起,请你设计实验用化学方法提纯铜粉 。
11.某同学取和KCl固体混合物10.8g,加水使其完全溶解。将100g一定浓度的KOH溶液平均分成5等份,依次加入到上述溶液中,发生反应的化学方程式:(其它物质之间均不发生反应)。生成沉淀的质量与KOH溶液的质量关系如下表:
实验次数 第一次 第二次 第三次 第四次 第五次
KOH溶液的质量/g 20 20 20 20 20
产生沉淀的质量/g 1.45 m 4.35 5.8 5.8
请分析计算:
(1)表中m的值是 。
(2)加入KOH溶液第 次时恰好完全反应。
(3)计算恰好完全反应时,所得溶液中溶质的质量(要写出计算过程)。
试卷第4页,共5页
1.C
【详解】A、氮气化学性质不活泼,很难与其它物质反应化学反应,可用于食品防腐,故A正确;
B、干冰升华吸热,具有制冷效果,可用作制冷剂,故B正确;
C、金刚石硬度大,可用于切割玻璃,作钻头,金刚石可以用于制造钻石,是因为其是无色透明、正八面体形状的固体,故C错误;
D、稀有气体通电时发不同颜色的光,可做霓虹灯,故D正确。
故选C。
2.D
【详解】A、Cu2O中,氧元素化合价为-2价,设铜元素化合价为x,根据“化合物中各元素化合价代数和为零”,则2x+(-2)=0,解得x=+1,该选项说法不正确;
B、由流程可知,“空气反应器”中是将空气中的氮气和氧气分离,没有发生化学变化,该选项说法不正确;
C、“燃料反应器”中,甲烷和氧气反应生成二氧化碳和水,不符合“一变多”的特点,则不属于分解反应,该选项说法不正确;
D、化学链燃烧技术避免了燃料与空气的直接接触,便于捕集处理燃烧时产生的二氧化碳,有利于CO2的分离处理,该选项说法正确。
故选D。
3.C
【详解】A、①造成酸雨的物质有二氧化硫、以及氮的氧化物等,使用脱硫煤可有效解决酸雨问题,并不能完全解决酸雨问题,故错误;②工业废水中含有大量污染物,未经处理就排放会造成水污染,故正确;故A不完全正确,不符合题意;
B、①可燃性气体不纯,遇明火或电火花会发生爆炸,所以点燃可燃性气体前一定要验纯,防止发生爆炸,故正确;②煤气是可燃性气体,一旦泄漏,应先关闭燃气阀门,然后打开门窗通风,切不可打开排气扇,以防电火花引爆煤气,发生危险,故错误;故B不完全正确,不符合题意;
C、①乙醇具有可燃性,使用乙醇汽油可以节约石油资源,故正确;②青铜和钢都属于合金,都属于金属材料,故正确;故C完全正确,符合题意;
D、①碳素墨水的主要成分是碳,常温下,碳的化学性质稳定,则用碳素墨水书写档案,可长时间保存,故正确;②铝在常温下与氧气反应生成一层致密的氧化铝保护膜,可阻止内部铝的进一步氧化,所以铝锅上的污垢不能用钢丝刷擦洗,防止损坏氧化膜保护层,故错误;故D不完全正确,不符合题意;
故选:C。
4.B
【详解】A、物质与氧气发生的反应属于氧化反应,硫燃烧为与氧气的反应,则属于氧化反应,该选项推理正确;
B、洗涤剂具有乳化作用,能除油污,但汽油能除油污,是因为汽油能溶解油污,该选项推理错误;
C、溶液为均一、稳定的混合物,则高锰酸钾溶液的各部分的组成和性质相同,该选项推理正确;
D、合金的硬度一般比组成的纯金属的硬度大,则铝合金的硬度大于铝,该选项推理正确。
故选B。
5.AC
【详解】A. 黄铜是铜和锌的合金,灼烧时,铜与氧气反应生成黑色的氧化铜,而金不与氧气反应,无现象,所以通过灼烧后观察颜色的方法可鉴别黄铜和真金,此选项正确;
B. 氧化钙在高温条件下不能发生反应,所以用高温的方法不能除去氧化钙,此选项错误;
C. 氢氧化钠固体溶于水放出大量的热,温度升高,硝酸铵溶于水吸收大量的热,温度降低,所以将两种固体分别溶于水,温度升高的是氢氧化钠固体,温度降低的是硝酸铵固体,用加水根据温度判断的方法可鉴别氢氧化钠固体和硝酸铵固体,此选项正确;
D.二氧化碳不支持燃烧,一氧化碳在二氧化碳中不能燃烧,用将混合气体点燃的方法不能除去二氧化碳中的一氧化碳,此选项错误。
故选AC。
6.D
【详解】A、气体的溶解度随温度升高而减小,随压强的增大而增大,该图像不正确;
B、饱和溶液是指不能继续溶解该溶质,但能溶解其它溶质,则向饱和碳酸钠溶液中继续加氯化钠固体,氯化钠固体溶解,则溶液质量增大,该图像不正确;
C、碳和氧化铜反应生成铜和二氧化碳,反应过程中固体质量减小,但固体质量不会减为零,该图像不正确;
D、刚开始滴加盐酸时,盐酸完全反应,消耗等量的盐酸时,根据质量守恒定律,可知生成氢气的质量相同,但当盐酸过量时,由于、,消耗等量的铁和锌时,铁生成的氢气质量较多,该选项图像正确。
故选D。
7.AD
【分析】在硝酸铜、硝酸银、硝酸镁的混合溶液中加入一定量的锌粉,锌粉先与硝酸银反应:,再与硝酸铜反应:,锌不能与硝酸镁反应。
【详解】A、当滤液为蓝色时,说明滤液中还有硝酸铜,锌在与硝酸银反应后,可能没有与硝酸铜反应,也可能与部分硝酸铜反应了。
在锌与硝酸银的反应中,每65份质量的锌可置换出216份质量的银,反应后溶液质量变轻。当锌与硝酸银反应后,没有与硝酸铜反应,溶液质量一定减轻;
当锌与硝酸银反应后,也与硝酸铜反应了。在锌与硝酸铜的反应中每65份质量的锌可置换出64份质量的铜,反应后溶液质量变重了,当溶液减轻的质量多于溶液增重的质量,溶液的质量减轻;当溶液减轻的质量少于溶液增重的质量,溶液的质量增重;当溶液减轻的质量等于溶液增重的质量,溶液的质量不变,故选项正确;
B、若滤液为无色,说明锌可能恰好将硝酸银、硝酸铜完全反应,此时滤渣为银、铜;或锌在将硝酸银、硝酸铜完全反应后,锌还过量,此时滤渣为银、铜、锌,故选项不正确;
C、若滤液为蓝色,则滤液中的溶质一定有硝酸铜、硝酸锌、硝酸镁,可能有硝酸银,故选项不正确;
D、若往滤渣中加入稀盐酸有气泡产生,说明滤渣中一定有银、铜、锌,则滤液中的溶质只有硝酸镁、硝酸锌,故选项正确。
故选:AD。
8.(1) 锥形瓶 液封后继续注水,形成的水柱一段时间后高度不发生变化(或液封后推动注射器形成的水柱一段时间后高度不发生变化;或拉动注射器,长颈漏斗下段有气泡出现)
(2) CaCO3+2HCl=CaCl2+H2O+CO2↑ n
(3) BD BC
(4)A
【详解】(1)由图可知,仪器a为锥形瓶;
检查A装置气密性时,可先向装置中装入水,使长颈漏斗下端液封,然后继续注水,由于装置中的气体压缩,装置中的压强增大,则会形成一段稳定的水柱,或拉动注射器,由于装置中的压强减小,则空气会从长颈漏斗中进入,则长颈漏斗下段会有气泡出现。
(2)实验室用大理石和稀盐酸制取二氧化碳,大理石的主要成分为碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:;
二氧化碳密度比空气大,用G装置收集时,气体应从n端进入。
(3)①制取氨气的反应为加热固体的反应,发生装置选B,氨气密度比空气小,极易溶于水,则收集装置选D。
②A、刚产生的气体中混有空气,则会使结果偏大,该选项不符合题意;
B、等气体平稳产生时才通入H中,操作正确,但有部分氨气没有收集,会使结果偏小,该选项符合题意;
C、装置漏气,会有部分气体没有收集,会使结果偏小,该选项符合题意;
D、H中进入氨气后,装置中的压强增大,液体被压入量筒中,则植物油上方有空气,不会影响收集气体的体积,该选项不符合题意。
故选BC。
(4)关闭弹簧夹,产生的气体无法排出,装置中的压强增大,液体被压入长颈漏斗中,固液分离,反应停止,则:
A、ab段压强慢慢增大,说明此时液体被压入长颈漏斗中,试管中的液面逐渐下降,该选项说法错误;
B、bc段压强不变,说明此时固体和液体分离,该选项说法正确;
C、c点后压强减小,至d点时恢复到开始时的压强,说明此时操作为打开弹簧夹,装置中的气体排出,压强减小,该选项说法正确;
D、结合前面分析可知,cd段二氧化碳排出,该选项说法正确。
故选A。
9.(1)增大反应物的接触面积,使反应更快更充分
(2)吸收
(3)N2+3H22NH3
(4)2NH3+2Na2NaNH2+H2↑
(5)H2、N2
(6)温度为50℃,金属钠的投加量为2.5g
【详解】(1)煤加入“煤气发生炉”前需进行粉碎处理,其目的是增大反应物的接触面积,使反应更快更充分;
(2)“煤气发生炉”中的两个反应必须要进行调控才能保持炉内所需达到的温度,碳燃烧放出热量,反应②碳和水蒸气在高温下反应生成二氧化碳和氢气,则该反应吸收热量;
(3)氮气和氢气在高温、高压和一定催化剂的条件下进行反应生成氨气,化学方程式为:;
(4)加热条件下“反应釜”中氨气和钠发生反应生成氨基钠和氢气,化学方程式为:;
(5)根据流程图,整个生产过程中,氢气既是反应物又是生成物,合成塔中没有完全反应的氮气可送回炭化塔作为反应物参加反应,可以循环利用的物质有H2、N2;
(6)由图2可知,当反应条件为50℃,金属钠的投加量为2.5g时,氨基钠的含量最高,则用120mL液氨制备氨基钠的最佳条件是温度为50℃,金属钠的投加量为2.5g。
10.(1)Fe、FeCO3
(2)碳酸亚铁与硫酸反应生成硫酸亚铁、水和二氧化碳,产生气泡,同时生成的硫酸亚铁溶液显浅绿色
(3)CO2 + Ca(OH)2=CaCO3↓+ H2O
(4)三
(5) 能 硫酸与碳酸亚铁生成的二氧化碳不能还原氧化铜,只能是铁与硫酸反应生成氢气,氢气再与氧化铜反应生成铜和水,观察到黑色粉末变红,证明有氢气存在,从而推出固体含有铁
(6) 防止铁粉在高温下被空气中的氧气氧化 取反应后的药品放入装置中,加入足量的稀盐酸(硫酸),过滤,洗涤,干燥
【详解】(1)根据其它猜想可知,剩余固体还可能为铁和碳酸亚铁的混合物。
(2)铁和硫酸反应生成硫酸亚铁和氢气,碳酸亚铁和硫酸反应生成硫酸亚铁、二氧化碳和水,现象均为A中产生气泡且溶液变为浅绿色,则小芳的判断不正确。
(3)二氧化碳和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:。
(4)由于氢气能和氧化铜反应生成铜和水,结合前面分析可知,气体产物中含有氢气和二氧化碳,则说明剩余固体的成分为铁和碳酸亚铁,则猜想三正确。
(5)由于硫酸与碳酸亚铁生成的二氧化碳不能还原氧化铜,只能是铁与硫酸反应生成氢气,氢气再与氧化铜反应生成铜和水,观察到黑色粉末变红,证明有氢气存在,从而推出固体含有铁,则将装置 E 去掉,也能验证剩余固体中有铁。
(6)铁粉在高温条件下会与空气中的氧气反应,则需要在充满氩气的环境中制备纳米铁;
铁能和盐酸或硫酸反应,但铜不能,则可取反应后的药品放入装置中,加入足量的稀盐酸(硫酸),过滤,洗涤,干燥,即可得到纯铜粉。
11.(1)2.9
(2)四
(3)16.2g
解:设参加反应的MgC12的质量为x,生成KC1的质量为y。
,x=5.8g
,y=14.9g
所得溶液中溶质的质量为:10.8g-9.5g+14.9g=16.2g
答:恰好完全反应时,所得溶液中溶质质量是16.2g。
【详解】(1)根据表中数据可知,依次加入KOH溶液时,沉淀质量逐渐增多,第一次加入20gKOH溶液时生成1.45g沉淀,所以表中m的值是1.45+1.45=2.9。
(2)如果MgCl2充足,第四次加入KOH溶液,产生沉淀的质量为:1.45g×4=5.8g,第五次加入KOH溶液时,沉淀质量不再增多,所以加入KOH溶液第四次时恰好完全反应。
(3)见答案
答案第6页,共7页
答案第7页,共7页
(时间50分钟,满分100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Zn 65 K 39 Fe 56 Mg 24 Cu 64 Ag 108
一、选择题:本题共4小题,每小题4分,共16分,每小题只有一个选项符合题意。
1.下列关于物质的性质与用途对应关系不正确的是
A.氮气化学性质不活泼,可用作食品防腐
B.干冰升华吸热,可用作制冷剂
C.金刚石硬度大,可用于做钻石
D.稀有气体通电能发光,可用作霓虹灯
2.化学链燃烧是利用“载氧体”将空气中的氧传输至燃料的新技术。以下是甲烷化学链燃烧的示意图。下列有关说法正确的是
A.Cu2O中铜元素显+2价
B.“空气反应器”中N2是生成物
C.“燃料反应器”中发生的是分解反应
D.化学链燃烧有利于CO2的分离处理
3.以下归纳和总结完全正确的一组是
A.化学与环境 B.化学与安全
①使用脱硫煤可完全解决酸雨问题 ②工业废水未经处理就排放会造成水污染 ①点燃可燃性气体前一定要验纯 ②煤气泄漏应立即打开排气扇通风
C.化学与社会发展 D.化学与生活
①使用乙醇汽油可以节约石油资源 ②青铜和钢都属于金属材料 ①用碳素墨水书写档案 ②铝锅上的污垢用钢丝刷擦洗
A.A B.B C.C D.D
4.推理是化学学习中常用的思维方法,需具备科学严谨性,以下推理错误的是
A.物质与氧气发生的反应属于氧化反应,所以硫的燃烧是氧化反应
B.用洗涤剂去油污是乳化现象,所以汽油去油污也是乳化现象
C.溶液是均一、稳定的混合物,所以高锰酸钾溶液中各部分的组成和性质相同
D.合金的硬度一般比组成他们的纯金属高,因此铝合金的硬度大于铝
二、选择题:本题共3小题,每小题5分,共15分。每小题有一个或两个选项符合题意,全部选对得5分,选对但不全的得3分,有选错的得0分。
5.下列所选实验方案正确的一组是
项目 物质 实验方案
A 鉴别黄铜和真金 灼烧后观察颜色
B 除去中的 高温
C 鉴别、 加水根据温度判断
D 除去中混有的CO 将混合气体点燃
A.A B.B C.C D.D
6.如图所示四个图像对应的变化过程正确的是
A.气体物质的溶解度与温度和压强的关系
B.向饱和碳酸钠溶液中继续加氯化钠固体
C.加热碳和氧化铜的混合物
D.向等质量的Zn、Fe中滴加等浓度等质量的稀盐酸
7.在硝酸铜、硝酸银、硝酸镁的混合溶液中加入一定量的锌粉,充分反应后过滤。下列说法正确的是
A.若滤液为蓝色,溶液的质量可能减小
B.若滤液为无色,则滤渣中一定有银、铜和锌
C.若滤液为蓝色,则滤液中的溶质一定有硝酸铜、硝酸锌,可能有硝酸银
D.若往滤渣中加入稀盐酸有气泡产生,则滤液中的溶质只有硝酸镁、硝酸锌
三、非选择题:本题共4小题,共69分。
8.如图是实验室制取气体及性质检验的常用装置,回答下列问题。
(1)仪器a的名称是 ,检验图A装置的气密性的方法是 。
(2)若用装置C制取二氧化碳,反应的化学方程式为 。若用装置G收集二氧化碳,则气体应从 (填“m”或“n")端进入。
(3)已知氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水;加热熟石灰和氯化铵的固体混合物可以生成氨气。
①制取氨气发生和收集的装置组合是 (从A-E中选择)。
②测定氨气生成的体积可以选用H装置,若测定出来的氨气体积明显小于理论值可能的原因有 (填序号)。
A.反应一开始产生气体就通入H中
B.等气体平稳产生时才通入H中
C.装置漏气
D.收集氨气前H装置中植物油上方有空气
(4)图中J是小组同学组装的实验室制取二氧化碳的发生装置,为探究该装置的优点,他们在装置J中连接压强传感器(如图K),从而测定实验中试管内气体压强变化的情况(如图L)。已知oa段是正常制取气体的状态,下列说法错误的是______。
A.ab段试管中液面逐渐上升 B.bc段石灰石与稀盐酸脱离接触
C.c点的对应操作是打开弹簧夹 D.cd段二氧化碳输出
9.氨基钠(NaNH,)是合成维生素A的原料。工业上以煤、空气、水为原料合成氦气,再利用金属钠和液氨(NH3)生产氨基钠的工艺流程如图1所示:
(1)煤加入“煤气发生炉”前需进行粉碎处理,其目的是 。
(2)已知“煤气发生炉”中的主要反应为:①C+O2CO2,②C+H2OCO2+H2,以上两个反应必须要进行调控才能保持炉内所需达到的温度,则反应② (填“放出”或“吸收”)热量。
(3)“合成塔”中的物质在高温、高压和一定催化剂的条件下进行反应,请写出反应的化学方程式 。
(4)加热条件下“反应釜”中发生反应获得氨基钠,化学方程式为 。
(5)整个生产过程中,可以循环利用的物质有 。
(6)为研究温度、金属钠的投加量对产物中氮基钠含量的影响,每次取120mL 液氨做系列实验,结果如图 2 所示。分析可知,用120mL 液氨制备氨基钠的最佳条件是 。
10.纳米零价铁在环保领域应用广泛,以菱铁矿(主要成分为FeCO3,其它成高温分不参与反应)为原料,制备纳米零价铁的反应为:H2 +FeCO3Fe +H2O+CO2,反应一段时间后,某学习小组对剩余固体的成分进行探究。
查阅资料:①浓硫酸吸水,可以对气体进行干燥
②H2O能使无水硫酸铜变蓝
③FeCO3+H2SO4=FeSO4+H2O+CO2 ↑
【提出问题】剩余固体的成分是什么?
【作出猜想】
(1)剩余固体的成分:猜想一:Fe;猜想二:FeCO3;猜想三: 。
【实验探究】该学习小组利用下图装置,对剩余固体成分进行探究,请根据以下实验操作及现象回答问题。
(2)将剩余固体放入装置A中,加入稀硫酸,A中产生气泡且溶液变为浅绿色,小芳同学判断猜想一正确,小刚同学认为小芳的判断不合理,理由是: 。
(3)观察到装置B中溶液变浑浊,写出装置B中的化学反应方程式 。
观察到装置D中黑色粉末变红色。
【实验结论】
(4)猜想 正确
【反思交流】
(5)如果将装置 E 去掉, (填“能”或“不能”)验证剩余固体中含有Fe,理由是 。
(6)制备纳米铁时,需要在充满氩气的环境中进行,是因为 。实验结束后,处理实验后的残余药品时,铁粉和铜粉不小心混在了一起,请你设计实验用化学方法提纯铜粉 。
11.某同学取和KCl固体混合物10.8g,加水使其完全溶解。将100g一定浓度的KOH溶液平均分成5等份,依次加入到上述溶液中,发生反应的化学方程式:(其它物质之间均不发生反应)。生成沉淀的质量与KOH溶液的质量关系如下表:
实验次数 第一次 第二次 第三次 第四次 第五次
KOH溶液的质量/g 20 20 20 20 20
产生沉淀的质量/g 1.45 m 4.35 5.8 5.8
请分析计算:
(1)表中m的值是 。
(2)加入KOH溶液第 次时恰好完全反应。
(3)计算恰好完全反应时,所得溶液中溶质的质量(要写出计算过程)。
试卷第4页,共5页
1.C
【详解】A、氮气化学性质不活泼,很难与其它物质反应化学反应,可用于食品防腐,故A正确;
B、干冰升华吸热,具有制冷效果,可用作制冷剂,故B正确;
C、金刚石硬度大,可用于切割玻璃,作钻头,金刚石可以用于制造钻石,是因为其是无色透明、正八面体形状的固体,故C错误;
D、稀有气体通电时发不同颜色的光,可做霓虹灯,故D正确。
故选C。
2.D
【详解】A、Cu2O中,氧元素化合价为-2价,设铜元素化合价为x,根据“化合物中各元素化合价代数和为零”,则2x+(-2)=0,解得x=+1,该选项说法不正确;
B、由流程可知,“空气反应器”中是将空气中的氮气和氧气分离,没有发生化学变化,该选项说法不正确;
C、“燃料反应器”中,甲烷和氧气反应生成二氧化碳和水,不符合“一变多”的特点,则不属于分解反应,该选项说法不正确;
D、化学链燃烧技术避免了燃料与空气的直接接触,便于捕集处理燃烧时产生的二氧化碳,有利于CO2的分离处理,该选项说法正确。
故选D。
3.C
【详解】A、①造成酸雨的物质有二氧化硫、以及氮的氧化物等,使用脱硫煤可有效解决酸雨问题,并不能完全解决酸雨问题,故错误;②工业废水中含有大量污染物,未经处理就排放会造成水污染,故正确;故A不完全正确,不符合题意;
B、①可燃性气体不纯,遇明火或电火花会发生爆炸,所以点燃可燃性气体前一定要验纯,防止发生爆炸,故正确;②煤气是可燃性气体,一旦泄漏,应先关闭燃气阀门,然后打开门窗通风,切不可打开排气扇,以防电火花引爆煤气,发生危险,故错误;故B不完全正确,不符合题意;
C、①乙醇具有可燃性,使用乙醇汽油可以节约石油资源,故正确;②青铜和钢都属于合金,都属于金属材料,故正确;故C完全正确,符合题意;
D、①碳素墨水的主要成分是碳,常温下,碳的化学性质稳定,则用碳素墨水书写档案,可长时间保存,故正确;②铝在常温下与氧气反应生成一层致密的氧化铝保护膜,可阻止内部铝的进一步氧化,所以铝锅上的污垢不能用钢丝刷擦洗,防止损坏氧化膜保护层,故错误;故D不完全正确,不符合题意;
故选:C。
4.B
【详解】A、物质与氧气发生的反应属于氧化反应,硫燃烧为与氧气的反应,则属于氧化反应,该选项推理正确;
B、洗涤剂具有乳化作用,能除油污,但汽油能除油污,是因为汽油能溶解油污,该选项推理错误;
C、溶液为均一、稳定的混合物,则高锰酸钾溶液的各部分的组成和性质相同,该选项推理正确;
D、合金的硬度一般比组成的纯金属的硬度大,则铝合金的硬度大于铝,该选项推理正确。
故选B。
5.AC
【详解】A. 黄铜是铜和锌的合金,灼烧时,铜与氧气反应生成黑色的氧化铜,而金不与氧气反应,无现象,所以通过灼烧后观察颜色的方法可鉴别黄铜和真金,此选项正确;
B. 氧化钙在高温条件下不能发生反应,所以用高温的方法不能除去氧化钙,此选项错误;
C. 氢氧化钠固体溶于水放出大量的热,温度升高,硝酸铵溶于水吸收大量的热,温度降低,所以将两种固体分别溶于水,温度升高的是氢氧化钠固体,温度降低的是硝酸铵固体,用加水根据温度判断的方法可鉴别氢氧化钠固体和硝酸铵固体,此选项正确;
D.二氧化碳不支持燃烧,一氧化碳在二氧化碳中不能燃烧,用将混合气体点燃的方法不能除去二氧化碳中的一氧化碳,此选项错误。
故选AC。
6.D
【详解】A、气体的溶解度随温度升高而减小,随压强的增大而增大,该图像不正确;
B、饱和溶液是指不能继续溶解该溶质,但能溶解其它溶质,则向饱和碳酸钠溶液中继续加氯化钠固体,氯化钠固体溶解,则溶液质量增大,该图像不正确;
C、碳和氧化铜反应生成铜和二氧化碳,反应过程中固体质量减小,但固体质量不会减为零,该图像不正确;
D、刚开始滴加盐酸时,盐酸完全反应,消耗等量的盐酸时,根据质量守恒定律,可知生成氢气的质量相同,但当盐酸过量时,由于、,消耗等量的铁和锌时,铁生成的氢气质量较多,该选项图像正确。
故选D。
7.AD
【分析】在硝酸铜、硝酸银、硝酸镁的混合溶液中加入一定量的锌粉,锌粉先与硝酸银反应:,再与硝酸铜反应:,锌不能与硝酸镁反应。
【详解】A、当滤液为蓝色时,说明滤液中还有硝酸铜,锌在与硝酸银反应后,可能没有与硝酸铜反应,也可能与部分硝酸铜反应了。
在锌与硝酸银的反应中,每65份质量的锌可置换出216份质量的银,反应后溶液质量变轻。当锌与硝酸银反应后,没有与硝酸铜反应,溶液质量一定减轻;
当锌与硝酸银反应后,也与硝酸铜反应了。在锌与硝酸铜的反应中每65份质量的锌可置换出64份质量的铜,反应后溶液质量变重了,当溶液减轻的质量多于溶液增重的质量,溶液的质量减轻;当溶液减轻的质量少于溶液增重的质量,溶液的质量增重;当溶液减轻的质量等于溶液增重的质量,溶液的质量不变,故选项正确;
B、若滤液为无色,说明锌可能恰好将硝酸银、硝酸铜完全反应,此时滤渣为银、铜;或锌在将硝酸银、硝酸铜完全反应后,锌还过量,此时滤渣为银、铜、锌,故选项不正确;
C、若滤液为蓝色,则滤液中的溶质一定有硝酸铜、硝酸锌、硝酸镁,可能有硝酸银,故选项不正确;
D、若往滤渣中加入稀盐酸有气泡产生,说明滤渣中一定有银、铜、锌,则滤液中的溶质只有硝酸镁、硝酸锌,故选项正确。
故选:AD。
8.(1) 锥形瓶 液封后继续注水,形成的水柱一段时间后高度不发生变化(或液封后推动注射器形成的水柱一段时间后高度不发生变化;或拉动注射器,长颈漏斗下段有气泡出现)
(2) CaCO3+2HCl=CaCl2+H2O+CO2↑ n
(3) BD BC
(4)A
【详解】(1)由图可知,仪器a为锥形瓶;
检查A装置气密性时,可先向装置中装入水,使长颈漏斗下端液封,然后继续注水,由于装置中的气体压缩,装置中的压强增大,则会形成一段稳定的水柱,或拉动注射器,由于装置中的压强减小,则空气会从长颈漏斗中进入,则长颈漏斗下段会有气泡出现。
(2)实验室用大理石和稀盐酸制取二氧化碳,大理石的主要成分为碳酸钙,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:;
二氧化碳密度比空气大,用G装置收集时,气体应从n端进入。
(3)①制取氨气的反应为加热固体的反应,发生装置选B,氨气密度比空气小,极易溶于水,则收集装置选D。
②A、刚产生的气体中混有空气,则会使结果偏大,该选项不符合题意;
B、等气体平稳产生时才通入H中,操作正确,但有部分氨气没有收集,会使结果偏小,该选项符合题意;
C、装置漏气,会有部分气体没有收集,会使结果偏小,该选项符合题意;
D、H中进入氨气后,装置中的压强增大,液体被压入量筒中,则植物油上方有空气,不会影响收集气体的体积,该选项不符合题意。
故选BC。
(4)关闭弹簧夹,产生的气体无法排出,装置中的压强增大,液体被压入长颈漏斗中,固液分离,反应停止,则:
A、ab段压强慢慢增大,说明此时液体被压入长颈漏斗中,试管中的液面逐渐下降,该选项说法错误;
B、bc段压强不变,说明此时固体和液体分离,该选项说法正确;
C、c点后压强减小,至d点时恢复到开始时的压强,说明此时操作为打开弹簧夹,装置中的气体排出,压强减小,该选项说法正确;
D、结合前面分析可知,cd段二氧化碳排出,该选项说法正确。
故选A。
9.(1)增大反应物的接触面积,使反应更快更充分
(2)吸收
(3)N2+3H22NH3
(4)2NH3+2Na2NaNH2+H2↑
(5)H2、N2
(6)温度为50℃,金属钠的投加量为2.5g
【详解】(1)煤加入“煤气发生炉”前需进行粉碎处理,其目的是增大反应物的接触面积,使反应更快更充分;
(2)“煤气发生炉”中的两个反应必须要进行调控才能保持炉内所需达到的温度,碳燃烧放出热量,反应②碳和水蒸气在高温下反应生成二氧化碳和氢气,则该反应吸收热量;
(3)氮气和氢气在高温、高压和一定催化剂的条件下进行反应生成氨气,化学方程式为:;
(4)加热条件下“反应釜”中氨气和钠发生反应生成氨基钠和氢气,化学方程式为:;
(5)根据流程图,整个生产过程中,氢气既是反应物又是生成物,合成塔中没有完全反应的氮气可送回炭化塔作为反应物参加反应,可以循环利用的物质有H2、N2;
(6)由图2可知,当反应条件为50℃,金属钠的投加量为2.5g时,氨基钠的含量最高,则用120mL液氨制备氨基钠的最佳条件是温度为50℃,金属钠的投加量为2.5g。
10.(1)Fe、FeCO3
(2)碳酸亚铁与硫酸反应生成硫酸亚铁、水和二氧化碳,产生气泡,同时生成的硫酸亚铁溶液显浅绿色
(3)CO2 + Ca(OH)2=CaCO3↓+ H2O
(4)三
(5) 能 硫酸与碳酸亚铁生成的二氧化碳不能还原氧化铜,只能是铁与硫酸反应生成氢气,氢气再与氧化铜反应生成铜和水,观察到黑色粉末变红,证明有氢气存在,从而推出固体含有铁
(6) 防止铁粉在高温下被空气中的氧气氧化 取反应后的药品放入装置中,加入足量的稀盐酸(硫酸),过滤,洗涤,干燥
【详解】(1)根据其它猜想可知,剩余固体还可能为铁和碳酸亚铁的混合物。
(2)铁和硫酸反应生成硫酸亚铁和氢气,碳酸亚铁和硫酸反应生成硫酸亚铁、二氧化碳和水,现象均为A中产生气泡且溶液变为浅绿色,则小芳的判断不正确。
(3)二氧化碳和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:。
(4)由于氢气能和氧化铜反应生成铜和水,结合前面分析可知,气体产物中含有氢气和二氧化碳,则说明剩余固体的成分为铁和碳酸亚铁,则猜想三正确。
(5)由于硫酸与碳酸亚铁生成的二氧化碳不能还原氧化铜,只能是铁与硫酸反应生成氢气,氢气再与氧化铜反应生成铜和水,观察到黑色粉末变红,证明有氢气存在,从而推出固体含有铁,则将装置 E 去掉,也能验证剩余固体中有铁。
(6)铁粉在高温条件下会与空气中的氧气反应,则需要在充满氩气的环境中制备纳米铁;
铁能和盐酸或硫酸反应,但铜不能,则可取反应后的药品放入装置中,加入足量的稀盐酸(硫酸),过滤,洗涤,干燥,即可得到纯铜粉。
11.(1)2.9
(2)四
(3)16.2g
解:设参加反应的MgC12的质量为x,生成KC1的质量为y。
,x=5.8g
,y=14.9g
所得溶液中溶质的质量为:10.8g-9.5g+14.9g=16.2g
答:恰好完全反应时,所得溶液中溶质质量是16.2g。
【详解】(1)根据表中数据可知,依次加入KOH溶液时,沉淀质量逐渐增多,第一次加入20gKOH溶液时生成1.45g沉淀,所以表中m的值是1.45+1.45=2.9。
(2)如果MgCl2充足,第四次加入KOH溶液,产生沉淀的质量为:1.45g×4=5.8g,第五次加入KOH溶液时,沉淀质量不再增多,所以加入KOH溶液第四次时恰好完全反应。
(3)见答案
答案第6页,共7页
答案第7页,共7页
同课章节目录
