2024年河北化学中考备考重难专题:氢氧化钠变质的探究 (课件)(共24张PPT)
文档属性
| 名称 | 2024年河北化学中考备考重难专题:氢氧化钠变质的探究 (课件)(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 12:27:45 | ||
图片预览






文档简介
(共24张PPT)
河北 化学
氢氧化钠变质的探究
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
典例精析
巩固练习
2
1.某兴趣小组的同学发现实验室有一瓶瓶塞松动的氢氧化钠溶液,决定对这瓶溶液进行探究。
【提出问题Ⅰ】该溶液是否变质
【知识回忆】 氢氧化钠在空气中变质的化学方程式为__________________________。
【作出猜想】猜想①:没变质;猜想②:已变质。
【实验1】甲同学取少量该溶液于试管中,滴加几滴酚酞溶液,溶液变红色,说明药品已变质。小组同学认为该实验不能得到相应的结论,原因是____________________。
【实验2】乙同学取少量溶液于试管中,滴加氯化钙溶液,观察到_____________,证明氢氧化钠溶液已变质。
【提出问题Ⅱ】探究氢氧化钠溶液是否完全变质?
【做出猜想】猜想③:已完全变质 猜想④:部分变质
【实验验证】丙同学设计如下实验进行验证。
X试剂可以为_________,若观察到_____________,则证明猜想二正确。
【反思评价】上述试管①中发生反应的化学方程式为_______________,加入过量BaCl2溶液的目的是_____________________。
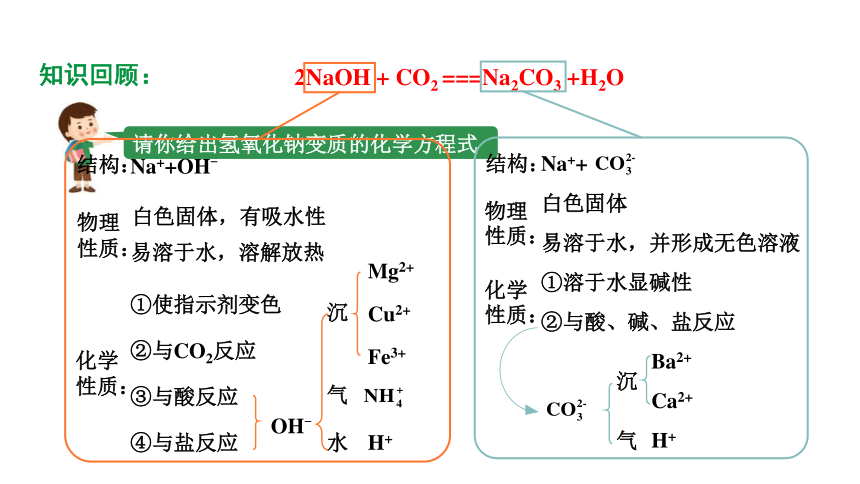
知识回顾:
请你给出氢氧化钠变质的化学方程式
2NaOH + CO2 ===Na2CO3 +H2O
物理
性质:
化学
性质:
结构:
Na++OH-
白色固体,有吸水性
易溶于水,溶解放热
①使指示剂变色
②与CO2反应
③与酸反应
④与盐反应
OH-
沉
气
水
Mg2+
Cu2+
Fe3+
H+
结构:
物理性质:
白色固体
易溶于水,并形成无色溶液
化学性质:
①溶于水显碱性
②与酸、碱、盐反应
沉
气
Ba2+
Ca2+
H+
Na++
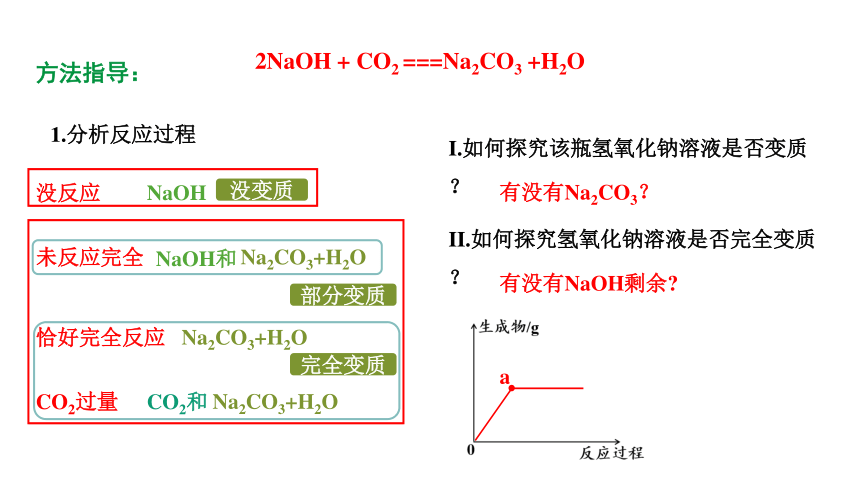
方法指导:
1.分析反应过程
未反应完全
没反应
恰好完全反应
CO2过量
NaOH
Na2CO3+H2O
Na2CO3+H2O
NaOH和
Na2CO3+H2O
CO2和
I.如何探究该瓶氢氧化钠溶液是否变质?
II.如何探究氢氧化钠溶液是否完全变质?
有没有Na2CO3?
有没有NaOH剩余
没变质
部分变质
完全变质
a
2NaOH + CO2 ===Na2CO3 +H2O
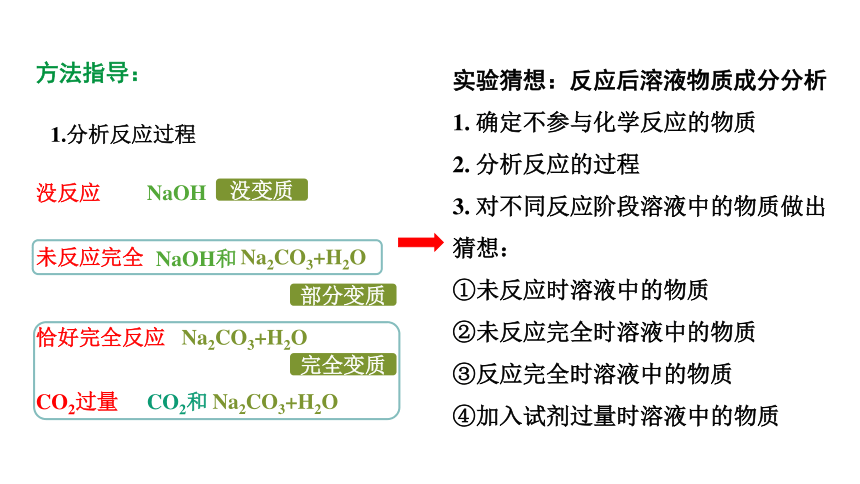
方法指导:
1.分析反应过程
未反应完全
没反应
恰好完全反应
CO2过量
NaOH
Na2CO3+H2O
Na2CO3+H2O
NaOH和
Na2CO3+H2O
CO2和
没变质
部分变质
完全变质
实验猜想:反应后溶液物质成分分析
1. 确定不参与化学反应的物质
2. 分析反应的过程
3. 对不同反应阶段溶液中的物质做出猜想:
①未反应时溶液中的物质
②未反应完全时溶液中的物质
③反应完全时溶液中的物质
④加入试剂过量时溶液中的物质
1.某兴趣小组的同学发现实验室有一瓶瓶塞松动的氢氧化钠溶液,决定对这瓶溶液进行探究。
【提出问题Ⅰ】该溶液是否变质
【知识回忆】 氢氧化钠在空气中变质的化学方程式为_______________________________。
【作出猜想】猜想①:没变质;猜想②:已变质。
【实验1】甲同学取少量该溶液于试管中,滴加几滴酚酞溶液,溶液变红色,说明药品已变质。小组同学讨论后认为该实验不能得到相应的结论,原因是________________________________________。
2NaOH+CO2===Na2CO3+H2O
有没有Na2CO3?
碳酸钠溶液、氢氧化钠溶液都呈碱性,都能使无色酚酞溶液变红
氢氧化钠溶液显碱性,也能使酚酞溶液变红
【实验2】乙同学取少量溶液于试管中,滴加氯化钙溶液,观察到
_________________,证明氢氧化钠溶液已变质。
溶液中存在碳酸钠
产生白色沉淀
实验操作、实验现象、实验结论三者之间的关系
物质+试剂
反映
现象
决定
实验结论
氢氧化钠溶液已变质
碳酸钠+氯化钙
产生白色沉淀
物质的检验与鉴别
列性质
找不同
看现象
还有其他实验方案吗?
沉
气
Ba2+
Ca2+
H+
→滴加可溶性钡盐溶液、氢氧化钡溶液
→滴加可溶性钙盐溶液、氢氧化钙溶液
→滴加过量的盐酸溶液
根据优先反应原则,H+与OH-优先结合,
若盐酸不过量,加入的盐酸未与碳酸钠反应
就先与氢氧化钠反应完
【提出问题Ⅱ】探究氢氧化钠溶液是否完全变质?
【做出猜想】猜想③:已完全变质 猜想④:部分变质
【实验验证】丙同学设计如下实验进行验证。
X试剂可以为_________,若观察到
_____________,则证明猜想④正确。
有Na2CO3,有没有NaOH?
物质+试剂
反映
现象
决定
实验结论
猜想④正确,溶液中有氢氧化钠
物质:氢氧化钠
试剂:①酸碱指示剂
②含Mg2+、Cu2+、Fe3+的可溶性盐
氢氧化钠的化学性质:
①使指示剂变色
②与CO2反应
③与酸反应
④与盐反应
OH-
沉
气
水
Mg2+
Cu2+
Fe3+
H+
酚酞溶液
溶液变为红色
【反思评价】上述试管①中发生反应的化学方程式为
_________________________________,加入过量BaCl2溶液的目的是________________。
BaCl2+Na2CO3====BaCO3↓+2NaCl
完全除去碳酸钠
能将BaCl2换为Ba(OH)2吗?
不能,会引入OH-影响检验
物质的检验与鉴别
列性质
找不同
看现象
除干扰
拓展设问
为除去部分变质的氢氧化钠溶液中的杂质并得到氢氧化钠固体,同学们设计如下方案。请分析,最终所得氢氧化钠固体的质量 (填“>”“<”或“=”)变质样片中氢氧化钠的质量。
>
物质的除杂
找杂质,列性质
变状态,定用量
主不减,杂不增
可以将澄清石灰水换成其他什么物质呢?
NaOH
未变质
部分变质
完全变质
碱性:酚酞
+H+
+Ca2+/Ba2+
碱性:酚酞
OH-+H+
OH-+Cu2+/Fe3+
Na2CO3干扰
+Ca2+/Ba2+
变质
NaOH
(Na2CO3)
碱变质探究一般思路
无
检验Na2CO3
有
无
有
鉴别与检验:
列性质、看现象找不同、除干扰
酸过量
除杂:
找杂质、列性质
变状态、定用量
主不减、杂不增
Cl-
检验NaOH
OH-+
试着建立检验
Ca(OH)2变质模型
OH-
实验猜想一般思路
反应后溶液物质成分分析
1. 确定不参与化学反应的物质
2. 分析反应的过程
3. 对不同反应阶段溶液中的物质做出猜想:
①未反应时溶液中的物质
②未反应完全时溶液中的物质
③反应完全时溶液中的物质
④加入试剂过量时溶液中的物质
实验操作、实验现象、实验结论
三者之间的关系
物质+试剂
反映
现象
决定
实验
结论
巩固练习
1.过氧化钠是一种淡黄色固体,在载人飞船上可作“供氧剂”,若保存不当会因变质而发白。 兴趣小组同学对实验室一瓶完全变质的过氧化钠固体进行如下探究。
【查阅资料】过氧化钠变质的原理有:
2Na2O2+2CO2===2Na2CO3+O2;2Na2O2+2H2O===4NaOH+O2↑。
【提出问题】变质后的固体成分是什么
【猜想假设】猜想一:NaOH;猜想二:Na2CO3;猜想三:NaOH、Na2CO3
【讨论交流】同学们认为变质后的固体中含有碳酸钠的原因是:①过氧化钠变质会生成碳酸钠;②____________________________。
氢氧化钠变质生成碳酸钠
【实验探究】
实验操作 实验现象 实验结论
步骤一:取少量变质后固体,充分溶解后,加入足量的氯化钡溶液 _____________________ 猜想三成立
步骤二:取步骤一所得溶液的上层清液,向其中滴加氯化镁溶液 _____________________ 产生白色沉淀
产生白色沉淀
物质的检验与鉴别
列性质
找不同
看现象
除干扰
【反思评价】某同学只用一种试剂验证猜想三成立,他取少量固体溶解,向其中逐滴加入稀盐酸,观察到的现象为_____________________________________
_____,即可验证猜想三成立。
开始一段时间内无明显现象,后逐渐产生气泡
【拓展延伸】化学教师演示实验,用脱脂棉包住一定量过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来。化学小组对该实验进行探究。
(1)由实验现象可得出两条有关过氧化钠跟水反应的结论是:①有氧气生成;
②__________________。
反应放出大量的热
实验现象
燃烧的条件
可燃物
氧气
能放出大量的热让温度达到着火点
请你用如图所示的装置设计实验验证这两条结论:
实验操作 实验操作 实验现象
结论一 _______________________________________________________________ 木条复燃
结论二 把b导管插入盛有水的小烧杯中 ________________
打开分液漏斗活塞,向试管内滴几滴水,用带火星的木条靠近导管a处
导管口有气泡冒出
2.小明同学将一块薄荷糖投入碳酸饮料中,发现产生大量气泡并带着饮料从瓶口喷出,形成一定高度的“喷泉”。 同学们对此进行了以下探究。
探究 1:产生的气体是什么
【查阅资料 1】薄荷糖中有碳、氢、氧、氮等元素。 薄荷糖是以白砂糖、薄荷为原料,加入阿拉伯胶调配而成的。
【作出猜想 1】同学们根据______________并结合薄荷糖与碳酸饮料的组成元素,猜想产生的气体可能是:①氢气;②氧气;③二氧化碳;④一氧化碳;⑤氮气。
【实验验证 1】 (1) 将一块薄荷糖投入碳酸饮料中,收集一试管产生的气体,将燃着的木条伸入试管中,试管中的气体不燃烧且木条熄灭,说明猜想________不正确。
元素守恒定律
实验现象
不是可燃性气体
气体不支持燃烧
×
×
×
①②④
(2)用如图 1 所示装置进行实验,证明猜想③正确,试剂 X 及现象为__________
____________________,烧杯中发生反应的化学方程式为
____________________________
猜想产生的气体可能是:①氢气;②氧气;③二氧化碳;④一氧化碳;⑤氮气。
实验结论
气体为二氧化碳
二氧化碳的化学性质
①不燃烧也不支持燃烧
②与碱反应
③与水反应
Ca2+
Ba2+
澄清石灰水,
烧杯中产生白色沉淀
CO2+Ca(OH)2===CaCO3↓+H2O
探究 2:快速产生气体的原因是什么
【查阅资料2】该薄荷糖表面含有的阿拉伯胶能加速可乐等碳酸饮料的分解,使之瞬间产生大量气泡,使得饮料瓶中______增大,从而出现喷涌现象。
压强
【作出猜想 2】阿拉伯胶可能是碳酸饮料分解的催化剂。
【实验验证 2】小明按照如图 2 所示装置进行实验,
观察到试管②相比①中产生气泡的速率明显加快,
得出结论阿拉伯胶是碳酸饮料分解的催化剂。
【讨论交流】有同学认为该实验不能得出阿拉伯胶是碳酸饮料分解的催化剂的结论,请你在小明的实验基础上,再设计实验证明阿拉伯胶是碳酸饮料分解的催化剂:____________________________________________________________
____________________________________________________________________(填写实验操作和现象)。
取试管②中完全反应后剩余的固体洗涤、干燥后称量,质量仍为 a g;然后重复试管①②中的实验,观察到试管②相比①中产生气泡的速率明显加快
需要验证的实验结论
催化剂的性质
①改变化学反应速率
②本身的质量和
化学性质不变
检验反应前后阿拉伯胶的质量和化学性质不变
【拓展应用】 催化剂在实际生产、生活中有重要的作用,请列举一例:
______________________________________________。
用催化剂将汽车尾气中的
有害气体转化为无害气体
河北 化学
氢氧化钠变质的探究
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
典例精析
巩固练习
2
1.某兴趣小组的同学发现实验室有一瓶瓶塞松动的氢氧化钠溶液,决定对这瓶溶液进行探究。
【提出问题Ⅰ】该溶液是否变质
【知识回忆】 氢氧化钠在空气中变质的化学方程式为__________________________。
【作出猜想】猜想①:没变质;猜想②:已变质。
【实验1】甲同学取少量该溶液于试管中,滴加几滴酚酞溶液,溶液变红色,说明药品已变质。小组同学认为该实验不能得到相应的结论,原因是____________________。
【实验2】乙同学取少量溶液于试管中,滴加氯化钙溶液,观察到_____________,证明氢氧化钠溶液已变质。
【提出问题Ⅱ】探究氢氧化钠溶液是否完全变质?
【做出猜想】猜想③:已完全变质 猜想④:部分变质
【实验验证】丙同学设计如下实验进行验证。
X试剂可以为_________,若观察到_____________,则证明猜想二正确。
【反思评价】上述试管①中发生反应的化学方程式为_______________,加入过量BaCl2溶液的目的是_____________________。
知识回顾:
请你给出氢氧化钠变质的化学方程式
2NaOH + CO2 ===Na2CO3 +H2O
物理
性质:
化学
性质:
结构:
Na++OH-
白色固体,有吸水性
易溶于水,溶解放热
①使指示剂变色
②与CO2反应
③与酸反应
④与盐反应
OH-
沉
气
水
Mg2+
Cu2+
Fe3+
H+
结构:
物理性质:
白色固体
易溶于水,并形成无色溶液
化学性质:
①溶于水显碱性
②与酸、碱、盐反应
沉
气
Ba2+
Ca2+
H+
Na++
方法指导:
1.分析反应过程
未反应完全
没反应
恰好完全反应
CO2过量
NaOH
Na2CO3+H2O
Na2CO3+H2O
NaOH和
Na2CO3+H2O
CO2和
I.如何探究该瓶氢氧化钠溶液是否变质?
II.如何探究氢氧化钠溶液是否完全变质?
有没有Na2CO3?
有没有NaOH剩余
没变质
部分变质
完全变质
a
2NaOH + CO2 ===Na2CO3 +H2O
方法指导:
1.分析反应过程
未反应完全
没反应
恰好完全反应
CO2过量
NaOH
Na2CO3+H2O
Na2CO3+H2O
NaOH和
Na2CO3+H2O
CO2和
没变质
部分变质
完全变质
实验猜想:反应后溶液物质成分分析
1. 确定不参与化学反应的物质
2. 分析反应的过程
3. 对不同反应阶段溶液中的物质做出猜想:
①未反应时溶液中的物质
②未反应完全时溶液中的物质
③反应完全时溶液中的物质
④加入试剂过量时溶液中的物质
1.某兴趣小组的同学发现实验室有一瓶瓶塞松动的氢氧化钠溶液,决定对这瓶溶液进行探究。
【提出问题Ⅰ】该溶液是否变质
【知识回忆】 氢氧化钠在空气中变质的化学方程式为_______________________________。
【作出猜想】猜想①:没变质;猜想②:已变质。
【实验1】甲同学取少量该溶液于试管中,滴加几滴酚酞溶液,溶液变红色,说明药品已变质。小组同学讨论后认为该实验不能得到相应的结论,原因是________________________________________。
2NaOH+CO2===Na2CO3+H2O
有没有Na2CO3?
碳酸钠溶液、氢氧化钠溶液都呈碱性,都能使无色酚酞溶液变红
氢氧化钠溶液显碱性,也能使酚酞溶液变红
【实验2】乙同学取少量溶液于试管中,滴加氯化钙溶液,观察到
_________________,证明氢氧化钠溶液已变质。
溶液中存在碳酸钠
产生白色沉淀
实验操作、实验现象、实验结论三者之间的关系
物质+试剂
反映
现象
决定
实验结论
氢氧化钠溶液已变质
碳酸钠+氯化钙
产生白色沉淀
物质的检验与鉴别
列性质
找不同
看现象
还有其他实验方案吗?
沉
气
Ba2+
Ca2+
H+
→滴加可溶性钡盐溶液、氢氧化钡溶液
→滴加可溶性钙盐溶液、氢氧化钙溶液
→滴加过量的盐酸溶液
根据优先反应原则,H+与OH-优先结合,
若盐酸不过量,加入的盐酸未与碳酸钠反应
就先与氢氧化钠反应完
【提出问题Ⅱ】探究氢氧化钠溶液是否完全变质?
【做出猜想】猜想③:已完全变质 猜想④:部分变质
【实验验证】丙同学设计如下实验进行验证。
X试剂可以为_________,若观察到
_____________,则证明猜想④正确。
有Na2CO3,有没有NaOH?
物质+试剂
反映
现象
决定
实验结论
猜想④正确,溶液中有氢氧化钠
物质:氢氧化钠
试剂:①酸碱指示剂
②含Mg2+、Cu2+、Fe3+的可溶性盐
氢氧化钠的化学性质:
①使指示剂变色
②与CO2反应
③与酸反应
④与盐反应
OH-
沉
气
水
Mg2+
Cu2+
Fe3+
H+
酚酞溶液
溶液变为红色
【反思评价】上述试管①中发生反应的化学方程式为
_________________________________,加入过量BaCl2溶液的目的是________________。
BaCl2+Na2CO3====BaCO3↓+2NaCl
完全除去碳酸钠
能将BaCl2换为Ba(OH)2吗?
不能,会引入OH-影响检验
物质的检验与鉴别
列性质
找不同
看现象
除干扰
拓展设问
为除去部分变质的氢氧化钠溶液中的杂质并得到氢氧化钠固体,同学们设计如下方案。请分析,最终所得氢氧化钠固体的质量 (填“>”“<”或“=”)变质样片中氢氧化钠的质量。
>
物质的除杂
找杂质,列性质
变状态,定用量
主不减,杂不增
可以将澄清石灰水换成其他什么物质呢?
NaOH
未变质
部分变质
完全变质
碱性:酚酞
+H+
+Ca2+/Ba2+
碱性:酚酞
OH-+H+
OH-+Cu2+/Fe3+
Na2CO3干扰
+Ca2+/Ba2+
变质
NaOH
(Na2CO3)
碱变质探究一般思路
无
检验Na2CO3
有
无
有
鉴别与检验:
列性质、看现象找不同、除干扰
酸过量
除杂:
找杂质、列性质
变状态、定用量
主不减、杂不增
Cl-
检验NaOH
OH-+
试着建立检验
Ca(OH)2变质模型
OH-
实验猜想一般思路
反应后溶液物质成分分析
1. 确定不参与化学反应的物质
2. 分析反应的过程
3. 对不同反应阶段溶液中的物质做出猜想:
①未反应时溶液中的物质
②未反应完全时溶液中的物质
③反应完全时溶液中的物质
④加入试剂过量时溶液中的物质
实验操作、实验现象、实验结论
三者之间的关系
物质+试剂
反映
现象
决定
实验
结论
巩固练习
1.过氧化钠是一种淡黄色固体,在载人飞船上可作“供氧剂”,若保存不当会因变质而发白。 兴趣小组同学对实验室一瓶完全变质的过氧化钠固体进行如下探究。
【查阅资料】过氧化钠变质的原理有:
2Na2O2+2CO2===2Na2CO3+O2;2Na2O2+2H2O===4NaOH+O2↑。
【提出问题】变质后的固体成分是什么
【猜想假设】猜想一:NaOH;猜想二:Na2CO3;猜想三:NaOH、Na2CO3
【讨论交流】同学们认为变质后的固体中含有碳酸钠的原因是:①过氧化钠变质会生成碳酸钠;②____________________________。
氢氧化钠变质生成碳酸钠
【实验探究】
实验操作 实验现象 实验结论
步骤一:取少量变质后固体,充分溶解后,加入足量的氯化钡溶液 _____________________ 猜想三成立
步骤二:取步骤一所得溶液的上层清液,向其中滴加氯化镁溶液 _____________________ 产生白色沉淀
产生白色沉淀
物质的检验与鉴别
列性质
找不同
看现象
除干扰
【反思评价】某同学只用一种试剂验证猜想三成立,他取少量固体溶解,向其中逐滴加入稀盐酸,观察到的现象为_____________________________________
_____,即可验证猜想三成立。
开始一段时间内无明显现象,后逐渐产生气泡
【拓展延伸】化学教师演示实验,用脱脂棉包住一定量过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来。化学小组对该实验进行探究。
(1)由实验现象可得出两条有关过氧化钠跟水反应的结论是:①有氧气生成;
②__________________。
反应放出大量的热
实验现象
燃烧的条件
可燃物
氧气
能放出大量的热让温度达到着火点
请你用如图所示的装置设计实验验证这两条结论:
实验操作 实验操作 实验现象
结论一 _______________________________________________________________ 木条复燃
结论二 把b导管插入盛有水的小烧杯中 ________________
打开分液漏斗活塞,向试管内滴几滴水,用带火星的木条靠近导管a处
导管口有气泡冒出
2.小明同学将一块薄荷糖投入碳酸饮料中,发现产生大量气泡并带着饮料从瓶口喷出,形成一定高度的“喷泉”。 同学们对此进行了以下探究。
探究 1:产生的气体是什么
【查阅资料 1】薄荷糖中有碳、氢、氧、氮等元素。 薄荷糖是以白砂糖、薄荷为原料,加入阿拉伯胶调配而成的。
【作出猜想 1】同学们根据______________并结合薄荷糖与碳酸饮料的组成元素,猜想产生的气体可能是:①氢气;②氧气;③二氧化碳;④一氧化碳;⑤氮气。
【实验验证 1】 (1) 将一块薄荷糖投入碳酸饮料中,收集一试管产生的气体,将燃着的木条伸入试管中,试管中的气体不燃烧且木条熄灭,说明猜想________不正确。
元素守恒定律
实验现象
不是可燃性气体
气体不支持燃烧
×
×
×
①②④
(2)用如图 1 所示装置进行实验,证明猜想③正确,试剂 X 及现象为__________
____________________,烧杯中发生反应的化学方程式为
____________________________
猜想产生的气体可能是:①氢气;②氧气;③二氧化碳;④一氧化碳;⑤氮气。
实验结论
气体为二氧化碳
二氧化碳的化学性质
①不燃烧也不支持燃烧
②与碱反应
③与水反应
Ca2+
Ba2+
澄清石灰水,
烧杯中产生白色沉淀
CO2+Ca(OH)2===CaCO3↓+H2O
探究 2:快速产生气体的原因是什么
【查阅资料2】该薄荷糖表面含有的阿拉伯胶能加速可乐等碳酸饮料的分解,使之瞬间产生大量气泡,使得饮料瓶中______增大,从而出现喷涌现象。
压强
【作出猜想 2】阿拉伯胶可能是碳酸饮料分解的催化剂。
【实验验证 2】小明按照如图 2 所示装置进行实验,
观察到试管②相比①中产生气泡的速率明显加快,
得出结论阿拉伯胶是碳酸饮料分解的催化剂。
【讨论交流】有同学认为该实验不能得出阿拉伯胶是碳酸饮料分解的催化剂的结论,请你在小明的实验基础上,再设计实验证明阿拉伯胶是碳酸饮料分解的催化剂:____________________________________________________________
____________________________________________________________________(填写实验操作和现象)。
取试管②中完全反应后剩余的固体洗涤、干燥后称量,质量仍为 a g;然后重复试管①②中的实验,观察到试管②相比①中产生气泡的速率明显加快
需要验证的实验结论
催化剂的性质
①改变化学反应速率
②本身的质量和
化学性质不变
检验反应前后阿拉伯胶的质量和化学性质不变
【拓展应用】 催化剂在实际生产、生活中有重要的作用,请列举一例:
______________________________________________。
用催化剂将汽车尾气中的
有害气体转化为无害气体
同课章节目录
