人教版化学 九上 5.3利用化学方程式的简单计算教学设计
文档属性
| 名称 | 人教版化学 九上 5.3利用化学方程式的简单计算教学设计 |
|
|
| 格式 | docx | ||
| 文件大小 | 101.6KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 22:23:50 | ||
图片预览



文档简介
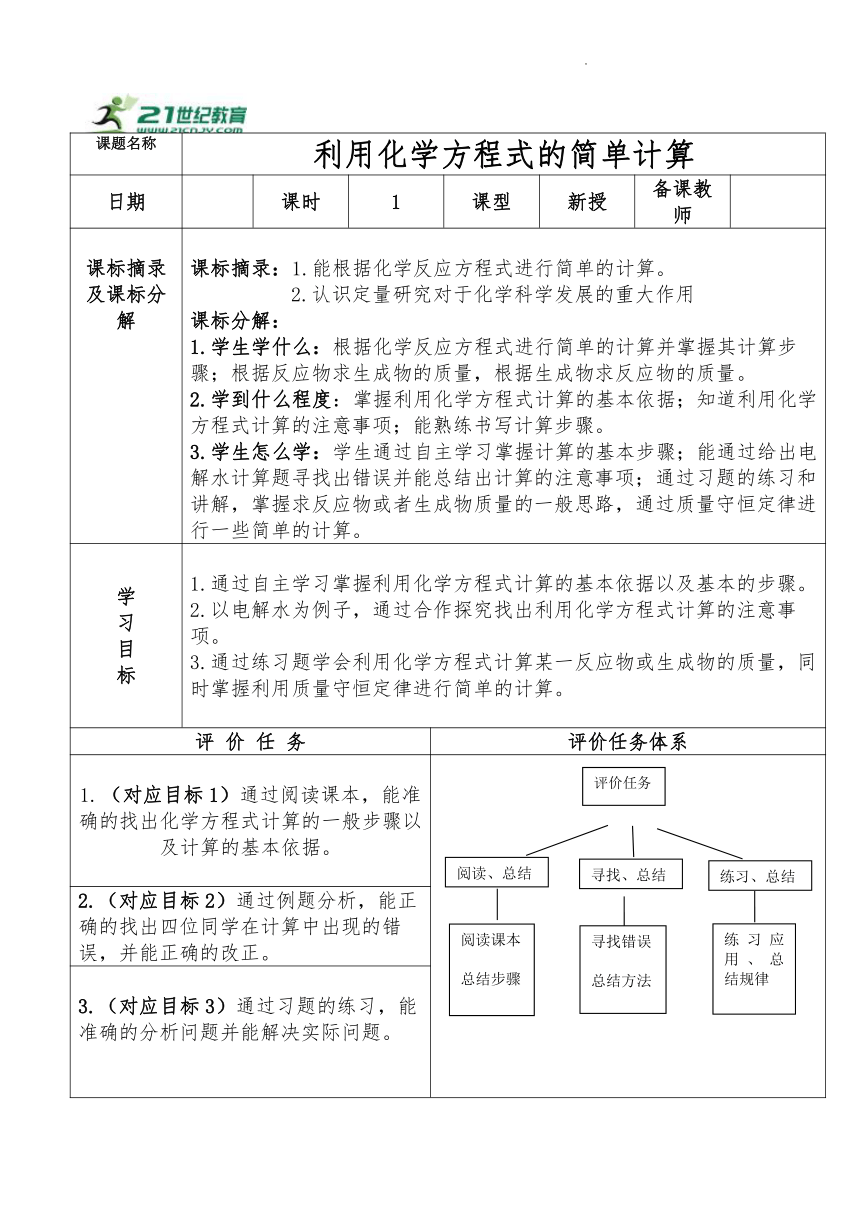
课题名称 利用化学方程式的简单计算
日期 课时 1 课型 新授 备课教师
课标摘录及课标分解 课标摘录:1.能根据化学反应方程式进行简单的计算。 2.认识定量研究对于化学科学发展的重大作用 课标分解: 1.学生学什么:根据化学反应方程式进行简单的计算并掌握其计算步骤;根据反应物求生成物的质量,根据生成物求反应物的质量。 2.学到什么程度:掌握利用化学方程式计算的基本依据;知道利用化学方程式计算的注意事项;能熟练书写计算步骤。 3.学生怎么学:学生通过自主学习掌握计算的基本步骤;能通过给出电解水计算题寻找出错误并能总结出计算的注意事项;通过习题的练习和讲解,掌握求反应物或者生成物质量的一般思路,通过质量守恒定律进行一些简单的计算。
学 习 目 标 1.通过自主学习掌握利用化学方程式计算的基本依据以及基本的步骤。 2.以电解水为例子,通过合作探究找出利用化学方程式计算的注意事项。 3.通过练习题学会利用化学方程式计算某一反应物或生成物的质量,同时掌握利用质量守恒定律进行简单的计算。
评 价 任 务 评价任务体系
(对应目标1)通过阅读课本,能准确的找出化学方程式计算的一般步骤以及计算的基本依据。 (
评价任务
) (
阅读课本
总结步骤
) (
练习应用、总结规律
) (
寻找错误
总结方法
) (
练习、总结
) (
寻找、总结
) (
阅读、总结
)
2.(对应目标2)通过例题分析,能正确的找出四位同学在计算中出现的错误,并能正确的改正。
3.(对应目标3)通过习题的练习,能准确的分析问题并能解决实际问题。
教学过程
教学环节 评价任务 教学活动
导入 化学方程式是反应客观事实的式子,它们能体现出各物质的质量关系,根据方程式的计算,我们就可以指导实际生产,加强生产的计划性,有利于合理利用资源。
一、利用化学方程式计算的步骤 评价任务一: 1.通过镁在氧气中燃烧生成氧化镁的分析,它们之间的质量关系多少? 2.根据课本的例题能总结出计算的一般步骤。 3.能梳理计算的一般思路。 评价标准: 准确写出各物质之间的质量关系。 总结出计算的正确步骤。 3.准确总结出计算的一般思路。 评价预设: 1.计算数据不准确。 2.化学方程式书写错误。 3.步骤总结不全。 4.解题思路总结不到位 【自主学习】阅读课本102页,完成以下内容: 根据化学方程式2Mg+O2 2MgO可知:每?份质量的镁和?份质量的氧气完全反应,就可以得到?份质量的氧化镁。 那么24g镁充分燃烧能生成?g氧化镁;如生成160g氧化镁,需要?g氧气参与反应。参加反应的镁、氧气和生成氧化镁的质量比为 。 我们之所以能根据化学方程式进行计算,是因为化学方程式可以体现各物质之间的质量关系,即各物质的质量比= 化学计量数 ×相对分子质量的比值。 例:磷燃烧的方程式为: 4P + 5O2 2P2O5 该反应中各物质的质量比为 124 160 284 124g ( ) ( ) ( ) 1600g ( ) ( ) ( ) 2.84g (1)根据质量比的意义填写以上空格。 (2)根据填写的数据可知,化学反应中各物质的质量比的比值是_______(填“改变”或“不变”),这就是化学反应方程式计算的依据。 例:加热分解15.8 g高锰酸钾,可以得到多少克氧气 【分析】 该题涉及的化学变化为__________________________ 题目给出的已知量为的质量,未知量为的质量 [解](1)设未知量:设加热分解高锰酸钾可以得到氧气的质量为x (2)写出反应的化学方程式并配平: (3)标出相关物质的相对分子: 2×158 32 质量和已知量、未知量: __ (4)列出比例式并计算: 解出X的数值: (6)写出简明答案:答:加热分解15.8g高锰酸钾可得到g氧气。 总结 归纳:利用化学方程式的计算可分为5个步骤: ①设;②写;③标;④列;⑤解⑥答。
二、利用化学方程式计算的注意事项 评价任务二: 1.分析四位同学的解题步骤,找出其中的错误。 2.总结解题过程中容易出现的错误。 评价标准: 1.准确找出四位同学出现的错误,并能改正。 2.能熟练总结出计算容易出现的错误。 评价预设: 1.错误找不全。 2.总结方法不到位 【合作探究】电解36g水可得到多少克氢气?下面是四位同学的解题过程和结果如下,请你仔细检查后回答:他们做得对吗?分别有什么缺陷?你从中能得到什么启示?
三、利用质量守恒定律的计算 评价任务三: 1.能总结计算的多种方法并能正确写出计算步骤。 2.根据题意分析各题的解题思路 评价标准: 1.正确计算出各题的答案。 2.正确分析各题的解题思路。 评价预设: 计算错误,思路不会分析 1.高温下煅烧18吨碳酸钙可以制取多少吨氧化钙?同时制得二氧化碳多少t?(你有几种计算方法求出二氧化碳?分别展示出来吧!) 2.已知反应A+3B=3C,取出7克A和一定量的B完全反应,可生成8.5克C,则A和B的相对分子质量之比是( ) A 7∶1.5 B 1∶3 C 14∶1 D 14∶3 3.一定条件下,下列物质在密闭的容器内充分反应,测得反应前后各物质的质量如下: 下列说法正确的是( ) A.反应后X的质量为1.5 B.X中一定含有碳元素和氧元素 C. X中一定含有碳元素和氢元素 D. X中两元素质量比为1:1 4.在A+3B=2C+2D的反应中,14克A完全反应生成44克C和18克D,若A的相对分子质量为28,则B的相对分子质量是 ( ) A.16 B.32 C.64 D.96
课堂小结 1.根据化学方程式计算时,利用各物质之间的质量比等于乘以的比;因此在求物质质量时(填需要或不需要)考虑化学计量数;而在计算物质的相对分子质量时考虑化学式前面的化学计量数。 2.若在化学反应中只有一种物质的质量未知,可用质量守恒定律求解
当堂检测 评价任务: 学生限时训练5分钟,老师公布答案学生红笔改错,组内交流完成订正。老师点拨。 1.白磷在空气中燃烧生成P2O5。在这个反应中参加反应的P、O2与反应后生成的P2O5三种物质的质量比为。 2.密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表: 物质XYZQ反应前质量/g82205反应后质量/g待测10813
下列说法正确的是 ( ) A.反应后X的质量为6g B.该反应的反应物是X、Y C.参加反应的X、Z的质量比是1∶3 D.Y、Q的相对分子质量比一定为1∶1 3.已知反应A+BC+D且A与B参加反应的质量比为4∶3,若反应后生成C和D质量共2.8g,则消耗的反应物B为 ( ) A.0.3g B.0.9g C.1.6 g D.1.2g 4.在反应2A+5B=2C+4D中,C、D的相对分子质量之比为9∶22。若2.6gA与B完全反应后生成8.8 gD。则在此反应中,B与D的质量比为 ( ) A.4∶9 B.8∶11 C.10∶11 D.31∶44 5.甲醇( CH3OH )是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应: 8CH3OH +nO2 mCO2+2CO + 16H2O。若反应生成3.6g 水,请计算: (1)m值是; (2)参加反应的氧气质量是多少克?(写出规范计算步骤)
(北京)股份有限公司
日期 课时 1 课型 新授 备课教师
课标摘录及课标分解 课标摘录:1.能根据化学反应方程式进行简单的计算。 2.认识定量研究对于化学科学发展的重大作用 课标分解: 1.学生学什么:根据化学反应方程式进行简单的计算并掌握其计算步骤;根据反应物求生成物的质量,根据生成物求反应物的质量。 2.学到什么程度:掌握利用化学方程式计算的基本依据;知道利用化学方程式计算的注意事项;能熟练书写计算步骤。 3.学生怎么学:学生通过自主学习掌握计算的基本步骤;能通过给出电解水计算题寻找出错误并能总结出计算的注意事项;通过习题的练习和讲解,掌握求反应物或者生成物质量的一般思路,通过质量守恒定律进行一些简单的计算。
学 习 目 标 1.通过自主学习掌握利用化学方程式计算的基本依据以及基本的步骤。 2.以电解水为例子,通过合作探究找出利用化学方程式计算的注意事项。 3.通过练习题学会利用化学方程式计算某一反应物或生成物的质量,同时掌握利用质量守恒定律进行简单的计算。
评 价 任 务 评价任务体系
(对应目标1)通过阅读课本,能准确的找出化学方程式计算的一般步骤以及计算的基本依据。 (
评价任务
) (
阅读课本
总结步骤
) (
练习应用、总结规律
) (
寻找错误
总结方法
) (
练习、总结
) (
寻找、总结
) (
阅读、总结
)
2.(对应目标2)通过例题分析,能正确的找出四位同学在计算中出现的错误,并能正确的改正。
3.(对应目标3)通过习题的练习,能准确的分析问题并能解决实际问题。
教学过程
教学环节 评价任务 教学活动
导入 化学方程式是反应客观事实的式子,它们能体现出各物质的质量关系,根据方程式的计算,我们就可以指导实际生产,加强生产的计划性,有利于合理利用资源。
一、利用化学方程式计算的步骤 评价任务一: 1.通过镁在氧气中燃烧生成氧化镁的分析,它们之间的质量关系多少? 2.根据课本的例题能总结出计算的一般步骤。 3.能梳理计算的一般思路。 评价标准: 准确写出各物质之间的质量关系。 总结出计算的正确步骤。 3.准确总结出计算的一般思路。 评价预设: 1.计算数据不准确。 2.化学方程式书写错误。 3.步骤总结不全。 4.解题思路总结不到位 【自主学习】阅读课本102页,完成以下内容: 根据化学方程式2Mg+O2 2MgO可知:每?份质量的镁和?份质量的氧气完全反应,就可以得到?份质量的氧化镁。 那么24g镁充分燃烧能生成?g氧化镁;如生成160g氧化镁,需要?g氧气参与反应。参加反应的镁、氧气和生成氧化镁的质量比为 。 我们之所以能根据化学方程式进行计算,是因为化学方程式可以体现各物质之间的质量关系,即各物质的质量比= 化学计量数 ×相对分子质量的比值。 例:磷燃烧的方程式为: 4P + 5O2 2P2O5 该反应中各物质的质量比为 124 160 284 124g ( ) ( ) ( ) 1600g ( ) ( ) ( ) 2.84g (1)根据质量比的意义填写以上空格。 (2)根据填写的数据可知,化学反应中各物质的质量比的比值是_______(填“改变”或“不变”),这就是化学反应方程式计算的依据。 例:加热分解15.8 g高锰酸钾,可以得到多少克氧气 【分析】 该题涉及的化学变化为__________________________ 题目给出的已知量为的质量,未知量为的质量 [解](1)设未知量:设加热分解高锰酸钾可以得到氧气的质量为x (2)写出反应的化学方程式并配平: (3)标出相关物质的相对分子: 2×158 32 质量和已知量、未知量: __ (4)列出比例式并计算: 解出X的数值: (6)写出简明答案:答:加热分解15.8g高锰酸钾可得到g氧气。 总结 归纳:利用化学方程式的计算可分为5个步骤: ①设;②写;③标;④列;⑤解⑥答。
二、利用化学方程式计算的注意事项 评价任务二: 1.分析四位同学的解题步骤,找出其中的错误。 2.总结解题过程中容易出现的错误。 评价标准: 1.准确找出四位同学出现的错误,并能改正。 2.能熟练总结出计算容易出现的错误。 评价预设: 1.错误找不全。 2.总结方法不到位 【合作探究】电解36g水可得到多少克氢气?下面是四位同学的解题过程和结果如下,请你仔细检查后回答:他们做得对吗?分别有什么缺陷?你从中能得到什么启示?
三、利用质量守恒定律的计算 评价任务三: 1.能总结计算的多种方法并能正确写出计算步骤。 2.根据题意分析各题的解题思路 评价标准: 1.正确计算出各题的答案。 2.正确分析各题的解题思路。 评价预设: 计算错误,思路不会分析 1.高温下煅烧18吨碳酸钙可以制取多少吨氧化钙?同时制得二氧化碳多少t?(你有几种计算方法求出二氧化碳?分别展示出来吧!) 2.已知反应A+3B=3C,取出7克A和一定量的B完全反应,可生成8.5克C,则A和B的相对分子质量之比是( ) A 7∶1.5 B 1∶3 C 14∶1 D 14∶3 3.一定条件下,下列物质在密闭的容器内充分反应,测得反应前后各物质的质量如下: 下列说法正确的是( ) A.反应后X的质量为1.5 B.X中一定含有碳元素和氧元素 C. X中一定含有碳元素和氢元素 D. X中两元素质量比为1:1 4.在A+3B=2C+2D的反应中,14克A完全反应生成44克C和18克D,若A的相对分子质量为28,则B的相对分子质量是 ( ) A.16 B.32 C.64 D.96
课堂小结 1.根据化学方程式计算时,利用各物质之间的质量比等于乘以的比;因此在求物质质量时(填需要或不需要)考虑化学计量数;而在计算物质的相对分子质量时考虑化学式前面的化学计量数。 2.若在化学反应中只有一种物质的质量未知,可用质量守恒定律求解
当堂检测 评价任务: 学生限时训练5分钟,老师公布答案学生红笔改错,组内交流完成订正。老师点拨。 1.白磷在空气中燃烧生成P2O5。在这个反应中参加反应的P、O2与反应后生成的P2O5三种物质的质量比为。 2.密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表: 物质XYZQ反应前质量/g82205反应后质量/g待测10813
下列说法正确的是 ( ) A.反应后X的质量为6g B.该反应的反应物是X、Y C.参加反应的X、Z的质量比是1∶3 D.Y、Q的相对分子质量比一定为1∶1 3.已知反应A+BC+D且A与B参加反应的质量比为4∶3,若反应后生成C和D质量共2.8g,则消耗的反应物B为 ( ) A.0.3g B.0.9g C.1.6 g D.1.2g 4.在反应2A+5B=2C+4D中,C、D的相对分子质量之比为9∶22。若2.6gA与B完全反应后生成8.8 gD。则在此反应中,B与D的质量比为 ( ) A.4∶9 B.8∶11 C.10∶11 D.31∶44 5.甲醇( CH3OH )是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应: 8CH3OH +nO2 mCO2+2CO + 16H2O。若反应生成3.6g 水,请计算: (1)m值是; (2)参加反应的氧气质量是多少克?(写出规范计算步骤)
(北京)股份有限公司
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
