北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题(pdf无答案)
文档属性
| 名称 | 北京师范大学附属实验中学2023-2024学年高二下学期开学检测化学试题(pdf无答案) |  | |
| 格式 | |||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 14:44:39 | ||
图片预览


文档简介
北师大实验中学 2023-2024 学年度第二学期摸底试卷
高二年级化学
可能用到的相对原子质量 H 1 O 16 As 75
一 选择题(共 14 小题,每题 3 分,共 42 分)
1.中国科学家首次在月球上发现新矿物,并将其命名为“嫦娥石[(Ca8Y)Fe(PO4)7]”。
Y(钇)是金属元素。下列说法不.正.确.的是
A.(Ca8Y)Fe(PO4)7是一种磷酸盐
B.电负性 O>P,嫦娥石中 P 显正价,O 显负价
C.在元素周期表中,O、P、Fe 均属于 s 区元素
D.原子半径:O<P
2.下列过程与水解无.关.的是
A.向饱和 NaCl 溶液中滴加浓盐酸,产生白色沉淀
B.用铁盐作净水剂,生成 Fe(OH)3 胶体能使水中细小悬浮颗粒聚集、沉降
C.向 NaHCO3 溶液中加入少量 CuSO4 溶液,生成沉淀[Cu2(OH)2CO3]
D.用 TiCl4制备 TiO2,制备时加入大量的水,同时加热
3.短周期元素 X、Y、Z、W 的原子序数依次增大。用表中信息判断下列说法正确的是
元素 X Y Z W
最高价氧化物的水化物 H3ZO4
0.1mol L 1溶液对应的 pH(25℃) 1.00 13.00 1.57 0.70
A.元素电负性:ZC.元素第一电离能:Z1
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
钒催化剂
5.2SO2(g) + O2(g) 2SO3(g) ΔH。当 SO2(g)、O2(g)和 N2(g)按一定比例混合时,
SO2平衡转化率 α 随温度、压强的变化如下图所示。
下列说法不.正.确.的是
A.ΔH<0
B.p1>p2>p3
C.钒催化剂能降低反应的活化能,提高反应速率
D.增大压强平衡正向移动,反应平衡常数增大
6.如图所示,将铁棒和石墨棒插入盛有饱和 NaCl 溶液的 U 型管中,下列分析正确的是
﹣ ﹣
A.K1闭合,K2 打开,铁棒上发生的反应为 2Cl ﹣2e ═ Cl2↑
B.K1闭合,K2 打开,石墨棒周围溶液 pH 逐渐减小
C.K1打开,K2 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K1打开,K2 闭合,电路中通过 0.002 mol 电子时,
两极共产生 0.001 mol 气体
7.下列实验中,能达到实验目的的是
测定中和反应的 除去 Cl2 中混有
把化学能转化为电能 在铁上电镀铜
反应热 的少量 HCl
A B C D
8.对室温下 pH 相同、体积相同的氨水与氢氧化钠两种稀溶液,分别采取下列措施,有
关叙述正确的是
A.温度均升高 20℃,两溶液的 pH 均不变
B.加入适量氯化铵固体后,两溶液的 pH 均减小
C.加水稀释 100 倍后,氨水中 c(OH-)比氢氧化钠溶液中的小
D.与足量的氯化铁溶液反应,产生的氢氧化铁沉淀一样多
2
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
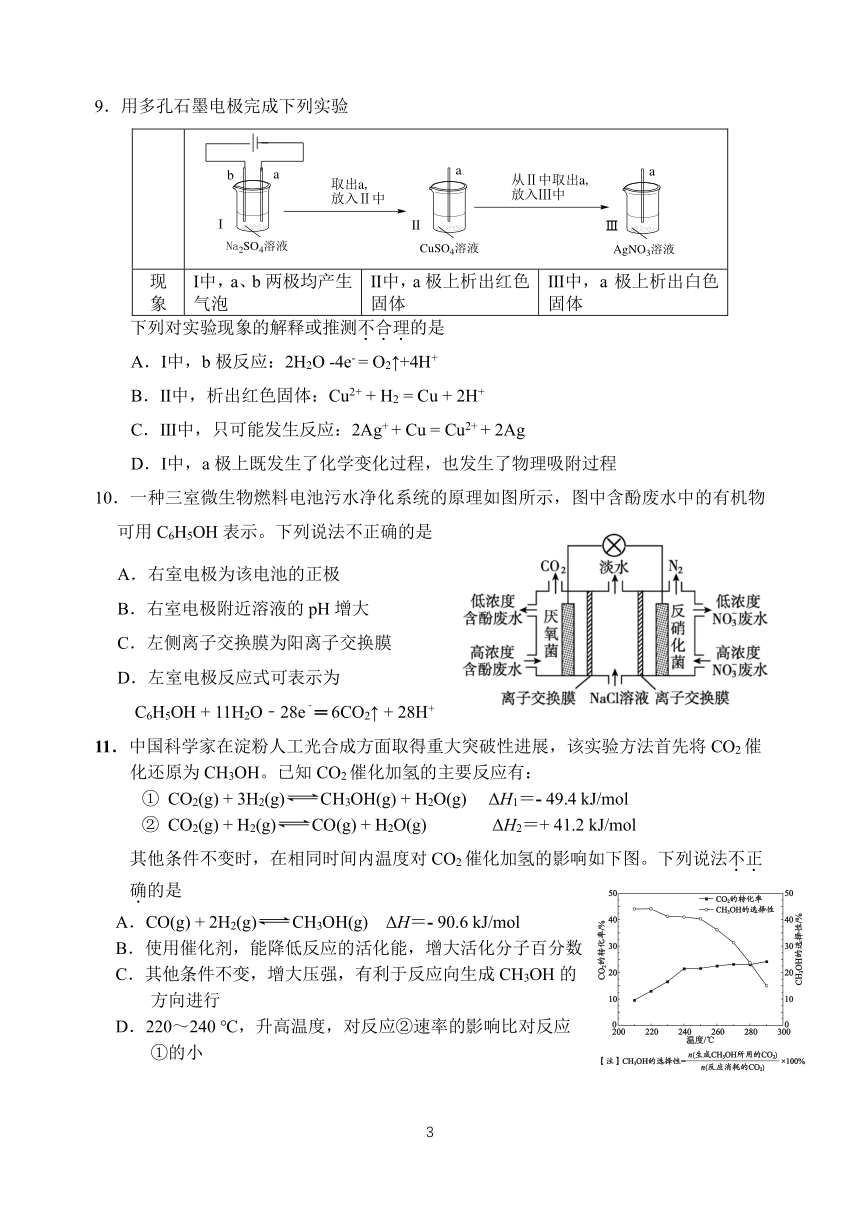
9.用多孔石墨电极完成下列实验
b a a a
取出a, 从Ⅱ中取出a,
放入Ⅱ中 放入Ⅲ中
Ⅰ Ⅱ Ⅲ
Na2SO4溶液 CuSO4溶液 AgNO3溶液
现 Ⅰ中,a、b 两极均产生 Ⅱ中,a 极上析出红色 Ⅲ中,a 极上析出白色
象 气泡 固体 固体
下列对实验现象的解释或推测不.合.理.的是
A.Ⅰ中,b 极反应:2H2O -4e- = O ↑+4H+ 2
B.Ⅱ中,析出红色固体:Cu2+ + H2 = Cu + 2H+
C.Ⅲ中,只可能发生反应:2Ag+ + Cu = Cu2+ + 2Ag
D.Ⅰ中,a 极上既发生了化学变化过程,也发生了物理吸附过程
10.一种三室微生物燃料电池污水净化系统的原理如图所示,图中含酚废水中的有机物
可用 C6H5OH 表示。下列说法不正确的是
A.右室电极为该电池的正极
B.右室电极附近溶液的 pH 增大
C.左侧离子交换膜为阳离子交换膜
D.左室电极反应式可表示为
﹣
C6H5OH + 11H2O﹣28e ═ 6CO2↑ + 28H+
11.中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将 CO2 催
化还原为 CH3OH。已知 CO2催化加氢的主要反应有:
① CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
② CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
其他条件不变时,在相同时间内温度对 CO2 催化加氢的影响如下图。下列说法不.正.
确.的是
A.CO(g) + 2H2(g) CH3OH(g) ΔH=- 90.6 kJ/mol
B.使用催化剂,能降低反应的活化能,增大活化分子百分数
C.其他条件不变,增大压强,有利于反应向生成 CH3OH 的
方向进行
D.220~240 ℃,升高温度,对反应②速率的影响比对反应
①的小
3
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
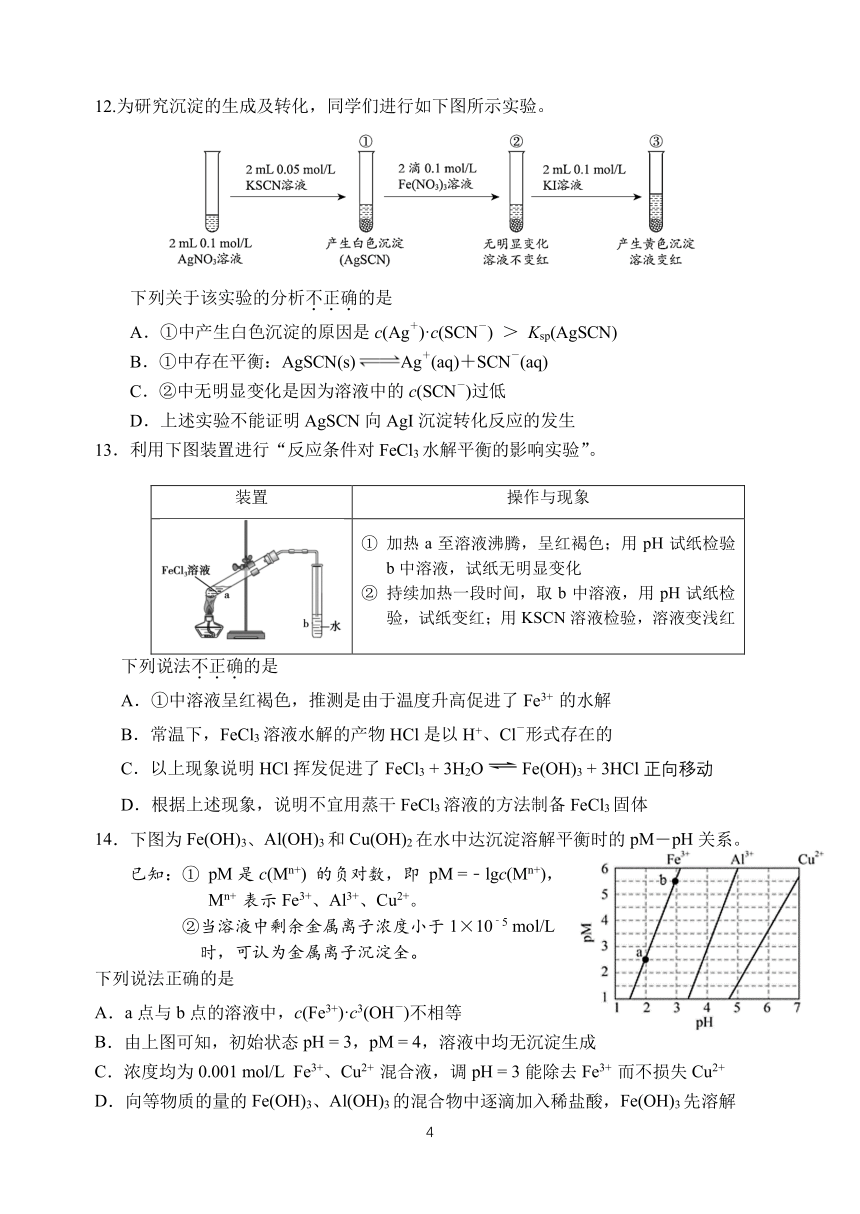
12.为研究沉淀的生成及转化,同学们进行如下图所示实验。
下列关于该实验的分析不.正.确.的是
+ -
A.①中产生白色沉淀的原因是 c(Ag )·c(SCN ) > Ksp(AgSCN)
+ -
B.①中存在平衡:AgSCN(s) Ag (aq)+SCN (aq)
-
C.②中无明显变化是因为溶液中的 c(SCN )过低
D.上述实验不能证明 AgSCN 向 AgI 沉淀转化反应的发生
13.利用下图装置进行“反应条件对 FeCl3 水解平衡的影响实验”。
装置 操作与现象
① 加热 a 至溶液沸腾,呈红褐色;用 pH 试纸检验
b 中溶液,试纸无明显变化
② 持续加热一段时间,取 b 中溶液,用 pH 试纸检
验,试纸变红;用 KSCN 溶液检验,溶液变浅红
下列说法不.正.确.的是
A.①中溶液呈红褐色,推测是由于温度升高促进了 Fe3+ 的水解
B.常温下,FeCl 溶液水解的产物 HCl 是以 H+
-
3 、Cl 形式存在的
C.以上现象说明 HCl 挥发促进了 FeCl3 + 3H2O Fe(OH)3 + 3HCl 正向移动
D.根据上述现象,说明不宜用蒸干 FeCl3溶液的方法制备 FeCl3固体
14.下图为 Fe(OH)3、Al(OH)3 和 Cu(OH)2 在水中达沉淀溶解平衡时的 pM―pH 关系。
已知:① pM 是 c(Mn+) 的负对数,即 pM =﹣lgc(Mn+),
Mn+ 表示 Fe3+、Al3+、Cu2+。
﹣
②当溶液中剩余金属离子浓度小于 1×10 5 mol/L
时,可认为金属离子沉淀全。
下列说法正确的是
A.a 点与 b 点的溶液中,c(Fe3+)·c3 -(OH )不相等
B.由上图可知,初始状态 pH = 3,pM = 4,溶液中均无沉淀生成
C.浓度均为 0.001 mol/L Fe3+、Cu2+ 混合液,调 pH = 3 能除去 Fe3+ 而不损失 Cu2+
D.向等物质的量的 Fe(OH)3、Al(OH)3的混合物中逐滴加入稀盐酸,Fe(OH)3先溶解
4
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
二 填空题 (共 52 分)
15.下表为元素周期表的一部分,其中的编号代表对应的不同元素。
① ② ③ ④ ⑤ ⑥
⑦ ⑧ ⑨ ⑩
回答下列问题(用化学用语作答):
(1)写出⑥基态原子的电子排布式________。
(2)基态③原子中电子占据最高能级的符号是______,该能级的电子云轮廓图为______形。
基态⑦原子共有_______种不同运动状态的电子。
(3)表中属于 ds 区的元素是______。
(4)写出⑧的氧化物与 NaOH 溶液反应的离子方程式_______。
(5)用相关理论解释非金属性⑩>⑨: 。
(6)元素 (设为字母 A)和元素 (设为字母 B)的部分电离能数据(用 I1,I2 ,I3表示)如表:
元素 A B
I1 717 759
电离能 -/(kJ·mol 1) I2 1509 1561
I3 3248 2573
比较两元素的 I ,I 可知,气态 A2+,再失去一个电子比气态 B2+2 3 再失去一个电子难,
请解释原因 。
16.
5
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
17.三价砷毒性很强,其废水需要处理后才能排放。
Ⅰ. 常温下,用 NaOH 溶液滴定 H3AsO3时,①~④四种含砷微粒的物质的量分数随
pH 的变化曲线如图所示,其中 a、b、c、d 四点的横坐标分别为 9.3、12.1、12.8
和 13.5。
(1)该温度下,H3AsO3的 Ka1= 。
(2)结合化学用语解释 KH2AsO3溶液显碱性的原因 。
(3)下列说法正确的是 。(填字母)
+ 3 2 -A.c 点的溶液中,c(H ) = 3c(AsO 3 ) + 2c(HAsO 3 ) + c(H2AsO 3 ) + c(OH )
2 2
B.pH 在 12~14 之间,随 pH 增大,HAsO 3 电离程度增大,c(HAsO 3 )减小
-
C. 2 3 NaH2AsO3 溶液中,c(H+) + c(H3AsO3) = c(HAsO 3 ) + c(OH ) + 2c(AsO 3 )
Ⅱ. 用化学沉降法处理酸性含砷废水的工艺流程如下:
2- 2- 3-资料:As2S3 与过量的 S 存在反应:As2S3 + 3S 2AsS 3
Ksp(FeAsO ) = 5.7×10-214
(4)用平衡移动原理解释加入 FeSO4 的作用是 。
(5)写出 H2O2与含砷物质反应的化学方程式 。
(6)沉淀 X 为 。
(7)含砷废水允许排放标准为≤0.5 mg L-1 。若低浓度含砷废水(假设砷均以
3-
AsO4
形式存在)中 Fe3+的浓度为 1.0×10-4 mol L-1,定量说明该含砷废水是否符合排放
标准 。
6
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
18.含钛高炉渣的主要化学成分为 TiO2、Al2O3、MgO、CaO、SiO2、Fe2O3、FeO 和金
属 Fe 等,对其综合利用具有重要的经济价值和社会效益。
I.一种含钛高炉渣提钛工艺流程如下图所示。
已知:① TiO2 不溶于水、稀酸和碱溶液; ② Al2O3能与强酸、强碱反应。
(1)盐酸酸浸过程中 Al2O3发生反应的离子方程式为________。
(2)“磁选”的目的是________。
(3)下列说法正确的是________(填字母序号)。
a.滤渣 1 的主要成分为 TiO2、SiO2
b.若将流程 A 部分与流程 B 部分互换顺序,最终得到的滤渣成分相同
c.若将流程 A 部分与流程 B 部分互换顺序,理论上氢氧化钠用量不变
II.含钛高炉渣中金属 Fe 含量的测定:
i.配制金属 Fe 浸取液:取一定量的亚硫酸钠和邻菲罗啉(抑制 Fe2+水解)溶于水,
加入乙酸和乙酸铵混合溶液调 pH=4.5,此时铁的化合物不溶解。
ii.取 m1 g 粉碎后的含钛高炉渣,加入足量金属 Fe 浸取液,室温下浸取 1 h。
iii.过滤,将滤液及洗涤液全部转移至盛有过量 H2O2溶液的烧杯中,加入稀硫酸
充分反应。
iv.将反应后的溶液煮沸至冒大气泡并继续微沸 10 min。
v.冷却,用浓度为 c mol·L-1 的抗坏血酸(C6H8O6)标准液滴定,消耗抗坏血酸标
准液 V mL。
已知:① 酸性条件下,SO 2- + Fe → S O 2-3 2 3 + Fe2+(未配平)
② C6H8O6(抗坏血酸) + 2Fe3+=C6H6O6(脱氢抗坏血酸) + 2Fe2+ + 2H+
(4)步骤 ii 中浸取铁时发生反应的离子方程式为________。
(5)步骤 iii 中加入过量 H2O2 溶液的主要作用是________(用离子方程式表示)。
(6)该含钛高炉渣中金属 Fe 的质量分数= ________(用代数式表示)。
(7)下列两种情况均会对“金属 Fe 的质量分数”测定结果造成偏差,任选其中一种
情况分析并说明判断理由。
情况一:配制金属 Fe 浸取液时,溶液 pH 等于 2
情况二:未进行步骤 iv,直接用抗坏血酸标准液滴定
① 情况________的测定结果________(填“偏高”或“偏低”)。
②理由是_________。
7
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
19.某课外小组探究 Cu(Ⅱ)盐与 Na2S2O3溶液的反应。
【查阅资料】
i. 2S O 2 +Cu2+2 3 [Cu(S 2 2O3)2] (绿色),2S O 2 +Cu+2 3 [Cu(S 3 2O3)2] (无色);
ii.2NH3+Cu+ [Cu(NH3) +2] (无色),[Cu(NH +3)2] 遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
iii. S 2 2 2 2O3 易被氧化为 S4O6 或 SO4 。
【猜想假设】
同学们根据资料认为 Cu(Ⅱ)盐与 Na2S2O3 可能会发生两种反应。
假设 2- 1:Cu2+与 S2O3 在溶液中发生络合反应生成[Cu(S2O3) ]2 2 ;
假设 2: 2- Cu(II)有________性,Cu2+与 S2O3 在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究 CuSO4与 Na2S2O3溶液的反应。
实验 V1 V2
实验操作 逐滴加入 Na2S2O3溶液时的实验现象
序号 (mL) (mL)
a 1.5 0.5
先加 V mL 蒸馏水, 溶液逐渐变为绿色,静置无变化 1
再加 V2 mL 2 mol/L 溶液先变为绿色,后逐渐变成浅绿色,
Na2S2O3 溶液,边滴 b 1.0 1.0
静置无变化
边振荡
溶液先变为绿色,后逐渐变浅至无色,
1 mL 1 mol/L c 0 2.0
CuSO4 溶液 静置无变化
(1)根据实验 a 的现象可推测溶液中生成的含 Cu 微粒是_______(填化学式)。
(2)甲同学认为实验一可证明假设 2 成立,他的理由是________。
实验二:探究 CuCl2 与 Na2S2O3的反应。
(3)乙同学利用已知资料进一步确证了无色溶液中存在 Cu(I),他的实验方案是:取
少量无色溶液,___________。
(4)经检验白色沉淀中含 CuCl,从化学平衡的角度解释继续加 Na2S2O3 溶液后 CuCl
沉淀溶解的原因:_____________。
(5)经检验氧化产物以 2- S 2+ 2- 4O6 形式存在,写出 Cu 与 S2O3 发生氧化还原反应得到无色
溶液的离子方程式:___________。
【获得结论】
综合以上实验,同学们认为 Cu(Ⅱ)盐与 Na2S2O3 在溶液中的反应与多种因素有关,得
到实验结论:①随 n(S O 2 ) :n(Cu2+2 3 )的增大, ___________;②_________。
8
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
高二年级化学
可能用到的相对原子质量 H 1 O 16 As 75
一 选择题(共 14 小题,每题 3 分,共 42 分)
1.中国科学家首次在月球上发现新矿物,并将其命名为“嫦娥石[(Ca8Y)Fe(PO4)7]”。
Y(钇)是金属元素。下列说法不.正.确.的是
A.(Ca8Y)Fe(PO4)7是一种磷酸盐
B.电负性 O>P,嫦娥石中 P 显正价,O 显负价
C.在元素周期表中,O、P、Fe 均属于 s 区元素
D.原子半径:O<P
2.下列过程与水解无.关.的是
A.向饱和 NaCl 溶液中滴加浓盐酸,产生白色沉淀
B.用铁盐作净水剂,生成 Fe(OH)3 胶体能使水中细小悬浮颗粒聚集、沉降
C.向 NaHCO3 溶液中加入少量 CuSO4 溶液,生成沉淀[Cu2(OH)2CO3]
D.用 TiCl4制备 TiO2,制备时加入大量的水,同时加热
3.短周期元素 X、Y、Z、W 的原子序数依次增大。用表中信息判断下列说法正确的是
元素 X Y Z W
最高价氧化物的水化物 H3ZO4
0.1mol L 1溶液对应的 pH(25℃) 1.00 13.00 1.57 0.70
A.元素电负性:Z
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
钒催化剂
5.2SO2(g) + O2(g) 2SO3(g) ΔH。当 SO2(g)、O2(g)和 N2(g)按一定比例混合时,
SO2平衡转化率 α 随温度、压强的变化如下图所示。
下列说法不.正.确.的是
A.ΔH<0
B.p1>p2>p3
C.钒催化剂能降低反应的活化能,提高反应速率
D.增大压强平衡正向移动,反应平衡常数增大
6.如图所示,将铁棒和石墨棒插入盛有饱和 NaCl 溶液的 U 型管中,下列分析正确的是
﹣ ﹣
A.K1闭合,K2 打开,铁棒上发生的反应为 2Cl ﹣2e ═ Cl2↑
B.K1闭合,K2 打开,石墨棒周围溶液 pH 逐渐减小
C.K1打开,K2 闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K1打开,K2 闭合,电路中通过 0.002 mol 电子时,
两极共产生 0.001 mol 气体
7.下列实验中,能达到实验目的的是
测定中和反应的 除去 Cl2 中混有
把化学能转化为电能 在铁上电镀铜
反应热 的少量 HCl
A B C D
8.对室温下 pH 相同、体积相同的氨水与氢氧化钠两种稀溶液,分别采取下列措施,有
关叙述正确的是
A.温度均升高 20℃,两溶液的 pH 均不变
B.加入适量氯化铵固体后,两溶液的 pH 均减小
C.加水稀释 100 倍后,氨水中 c(OH-)比氢氧化钠溶液中的小
D.与足量的氯化铁溶液反应,产生的氢氧化铁沉淀一样多
2
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
9.用多孔石墨电极完成下列实验
b a a a
取出a, 从Ⅱ中取出a,
放入Ⅱ中 放入Ⅲ中
Ⅰ Ⅱ Ⅲ
Na2SO4溶液 CuSO4溶液 AgNO3溶液
现 Ⅰ中,a、b 两极均产生 Ⅱ中,a 极上析出红色 Ⅲ中,a 极上析出白色
象 气泡 固体 固体
下列对实验现象的解释或推测不.合.理.的是
A.Ⅰ中,b 极反应:2H2O -4e- = O ↑+4H+ 2
B.Ⅱ中,析出红色固体:Cu2+ + H2 = Cu + 2H+
C.Ⅲ中,只可能发生反应:2Ag+ + Cu = Cu2+ + 2Ag
D.Ⅰ中,a 极上既发生了化学变化过程,也发生了物理吸附过程
10.一种三室微生物燃料电池污水净化系统的原理如图所示,图中含酚废水中的有机物
可用 C6H5OH 表示。下列说法不正确的是
A.右室电极为该电池的正极
B.右室电极附近溶液的 pH 增大
C.左侧离子交换膜为阳离子交换膜
D.左室电极反应式可表示为
﹣
C6H5OH + 11H2O﹣28e ═ 6CO2↑ + 28H+
11.中国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将 CO2 催
化还原为 CH3OH。已知 CO2催化加氢的主要反应有:
① CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH1=- 49.4 kJ/mol
② CO2(g) + H2(g) CO(g) + H2O(g) ΔH2=+ 41.2 kJ/mol
其他条件不变时,在相同时间内温度对 CO2 催化加氢的影响如下图。下列说法不.正.
确.的是
A.CO(g) + 2H2(g) CH3OH(g) ΔH=- 90.6 kJ/mol
B.使用催化剂,能降低反应的活化能,增大活化分子百分数
C.其他条件不变,增大压强,有利于反应向生成 CH3OH 的
方向进行
D.220~240 ℃,升高温度,对反应②速率的影响比对反应
①的小
3
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
12.为研究沉淀的生成及转化,同学们进行如下图所示实验。
下列关于该实验的分析不.正.确.的是
+ -
A.①中产生白色沉淀的原因是 c(Ag )·c(SCN ) > Ksp(AgSCN)
+ -
B.①中存在平衡:AgSCN(s) Ag (aq)+SCN (aq)
-
C.②中无明显变化是因为溶液中的 c(SCN )过低
D.上述实验不能证明 AgSCN 向 AgI 沉淀转化反应的发生
13.利用下图装置进行“反应条件对 FeCl3 水解平衡的影响实验”。
装置 操作与现象
① 加热 a 至溶液沸腾,呈红褐色;用 pH 试纸检验
b 中溶液,试纸无明显变化
② 持续加热一段时间,取 b 中溶液,用 pH 试纸检
验,试纸变红;用 KSCN 溶液检验,溶液变浅红
下列说法不.正.确.的是
A.①中溶液呈红褐色,推测是由于温度升高促进了 Fe3+ 的水解
B.常温下,FeCl 溶液水解的产物 HCl 是以 H+
-
3 、Cl 形式存在的
C.以上现象说明 HCl 挥发促进了 FeCl3 + 3H2O Fe(OH)3 + 3HCl 正向移动
D.根据上述现象,说明不宜用蒸干 FeCl3溶液的方法制备 FeCl3固体
14.下图为 Fe(OH)3、Al(OH)3 和 Cu(OH)2 在水中达沉淀溶解平衡时的 pM―pH 关系。
已知:① pM 是 c(Mn+) 的负对数,即 pM =﹣lgc(Mn+),
Mn+ 表示 Fe3+、Al3+、Cu2+。
﹣
②当溶液中剩余金属离子浓度小于 1×10 5 mol/L
时,可认为金属离子沉淀全。
下列说法正确的是
A.a 点与 b 点的溶液中,c(Fe3+)·c3 -(OH )不相等
B.由上图可知,初始状态 pH = 3,pM = 4,溶液中均无沉淀生成
C.浓度均为 0.001 mol/L Fe3+、Cu2+ 混合液,调 pH = 3 能除去 Fe3+ 而不损失 Cu2+
D.向等物质的量的 Fe(OH)3、Al(OH)3的混合物中逐滴加入稀盐酸,Fe(OH)3先溶解
4
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
二 填空题 (共 52 分)
15.下表为元素周期表的一部分,其中的编号代表对应的不同元素。
① ② ③ ④ ⑤ ⑥
⑦ ⑧ ⑨ ⑩
回答下列问题(用化学用语作答):
(1)写出⑥基态原子的电子排布式________。
(2)基态③原子中电子占据最高能级的符号是______,该能级的电子云轮廓图为______形。
基态⑦原子共有_______种不同运动状态的电子。
(3)表中属于 ds 区的元素是______。
(4)写出⑧的氧化物与 NaOH 溶液反应的离子方程式_______。
(5)用相关理论解释非金属性⑩>⑨: 。
(6)元素 (设为字母 A)和元素 (设为字母 B)的部分电离能数据(用 I1,I2 ,I3表示)如表:
元素 A B
I1 717 759
电离能 -/(kJ·mol 1) I2 1509 1561
I3 3248 2573
比较两元素的 I ,I 可知,气态 A2+,再失去一个电子比气态 B2+2 3 再失去一个电子难,
请解释原因 。
16.
5
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
17.三价砷毒性很强,其废水需要处理后才能排放。
Ⅰ. 常温下,用 NaOH 溶液滴定 H3AsO3时,①~④四种含砷微粒的物质的量分数随
pH 的变化曲线如图所示,其中 a、b、c、d 四点的横坐标分别为 9.3、12.1、12.8
和 13.5。
(1)该温度下,H3AsO3的 Ka1= 。
(2)结合化学用语解释 KH2AsO3溶液显碱性的原因 。
(3)下列说法正确的是 。(填字母)
+ 3 2 -A.c 点的溶液中,c(H ) = 3c(AsO 3 ) + 2c(HAsO 3 ) + c(H2AsO 3 ) + c(OH )
2 2
B.pH 在 12~14 之间,随 pH 增大,HAsO 3 电离程度增大,c(HAsO 3 )减小
-
C. 2 3 NaH2AsO3 溶液中,c(H+) + c(H3AsO3) = c(HAsO 3 ) + c(OH ) + 2c(AsO 3 )
Ⅱ. 用化学沉降法处理酸性含砷废水的工艺流程如下:
2- 2- 3-资料:As2S3 与过量的 S 存在反应:As2S3 + 3S 2AsS 3
Ksp(FeAsO ) = 5.7×10-214
(4)用平衡移动原理解释加入 FeSO4 的作用是 。
(5)写出 H2O2与含砷物质反应的化学方程式 。
(6)沉淀 X 为 。
(7)含砷废水允许排放标准为≤0.5 mg L-1 。若低浓度含砷废水(假设砷均以
3-
AsO4
形式存在)中 Fe3+的浓度为 1.0×10-4 mol L-1,定量说明该含砷废水是否符合排放
标准 。
6
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
18.含钛高炉渣的主要化学成分为 TiO2、Al2O3、MgO、CaO、SiO2、Fe2O3、FeO 和金
属 Fe 等,对其综合利用具有重要的经济价值和社会效益。
I.一种含钛高炉渣提钛工艺流程如下图所示。
已知:① TiO2 不溶于水、稀酸和碱溶液; ② Al2O3能与强酸、强碱反应。
(1)盐酸酸浸过程中 Al2O3发生反应的离子方程式为________。
(2)“磁选”的目的是________。
(3)下列说法正确的是________(填字母序号)。
a.滤渣 1 的主要成分为 TiO2、SiO2
b.若将流程 A 部分与流程 B 部分互换顺序,最终得到的滤渣成分相同
c.若将流程 A 部分与流程 B 部分互换顺序,理论上氢氧化钠用量不变
II.含钛高炉渣中金属 Fe 含量的测定:
i.配制金属 Fe 浸取液:取一定量的亚硫酸钠和邻菲罗啉(抑制 Fe2+水解)溶于水,
加入乙酸和乙酸铵混合溶液调 pH=4.5,此时铁的化合物不溶解。
ii.取 m1 g 粉碎后的含钛高炉渣,加入足量金属 Fe 浸取液,室温下浸取 1 h。
iii.过滤,将滤液及洗涤液全部转移至盛有过量 H2O2溶液的烧杯中,加入稀硫酸
充分反应。
iv.将反应后的溶液煮沸至冒大气泡并继续微沸 10 min。
v.冷却,用浓度为 c mol·L-1 的抗坏血酸(C6H8O6)标准液滴定,消耗抗坏血酸标
准液 V mL。
已知:① 酸性条件下,SO 2- + Fe → S O 2-3 2 3 + Fe2+(未配平)
② C6H8O6(抗坏血酸) + 2Fe3+=C6H6O6(脱氢抗坏血酸) + 2Fe2+ + 2H+
(4)步骤 ii 中浸取铁时发生反应的离子方程式为________。
(5)步骤 iii 中加入过量 H2O2 溶液的主要作用是________(用离子方程式表示)。
(6)该含钛高炉渣中金属 Fe 的质量分数= ________(用代数式表示)。
(7)下列两种情况均会对“金属 Fe 的质量分数”测定结果造成偏差,任选其中一种
情况分析并说明判断理由。
情况一:配制金属 Fe 浸取液时,溶液 pH 等于 2
情况二:未进行步骤 iv,直接用抗坏血酸标准液滴定
① 情况________的测定结果________(填“偏高”或“偏低”)。
②理由是_________。
7
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
19.某课外小组探究 Cu(Ⅱ)盐与 Na2S2O3溶液的反应。
【查阅资料】
i. 2S O 2 +Cu2+2 3 [Cu(S 2 2O3)2] (绿色),2S O 2 +Cu+2 3 [Cu(S 3 2O3)2] (无色);
ii.2NH3+Cu+ [Cu(NH3) +2] (无色),[Cu(NH +3)2] 遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
iii. S 2 2 2 2O3 易被氧化为 S4O6 或 SO4 。
【猜想假设】
同学们根据资料认为 Cu(Ⅱ)盐与 Na2S2O3 可能会发生两种反应。
假设 2- 1:Cu2+与 S2O3 在溶液中发生络合反应生成[Cu(S2O3) ]2 2 ;
假设 2: 2- Cu(II)有________性,Cu2+与 S2O3 在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究 CuSO4与 Na2S2O3溶液的反应。
实验 V1 V2
实验操作 逐滴加入 Na2S2O3溶液时的实验现象
序号 (mL) (mL)
a 1.5 0.5
先加 V mL 蒸馏水, 溶液逐渐变为绿色,静置无变化 1
再加 V2 mL 2 mol/L 溶液先变为绿色,后逐渐变成浅绿色,
Na2S2O3 溶液,边滴 b 1.0 1.0
静置无变化
边振荡
溶液先变为绿色,后逐渐变浅至无色,
1 mL 1 mol/L c 0 2.0
CuSO4 溶液 静置无变化
(1)根据实验 a 的现象可推测溶液中生成的含 Cu 微粒是_______(填化学式)。
(2)甲同学认为实验一可证明假设 2 成立,他的理由是________。
实验二:探究 CuCl2 与 Na2S2O3的反应。
(3)乙同学利用已知资料进一步确证了无色溶液中存在 Cu(I),他的实验方案是:取
少量无色溶液,___________。
(4)经检验白色沉淀中含 CuCl,从化学平衡的角度解释继续加 Na2S2O3 溶液后 CuCl
沉淀溶解的原因:_____________。
(5)经检验氧化产物以 2- S 2+ 2- 4O6 形式存在,写出 Cu 与 S2O3 发生氧化还原反应得到无色
溶液的离子方程式:___________。
【获得结论】
综合以上实验,同学们认为 Cu(Ⅱ)盐与 Na2S2O3 在溶液中的反应与多种因素有关,得
到实验结论:①随 n(S O 2 ) :n(Cu2+2 3 )的增大, ___________;②_________。
8
{#{QQABJYSQogCAABBAAQhCEwVICgCQkBEAAIoGxBAAMAABCRNABAA=}#}
同课章节目录
