1.3.3 元素周期表的应用 课件(共23张PPT含图片) 2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 1.3.3 元素周期表的应用 课件(共23张PPT含图片) 2023-2024学年高一化学鲁科版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 15:39:22 | ||
图片预览







文档简介
(共23张PPT)
第三节 元素周期表的应用
第3课时 预测元素及其化合物的性质
第一章
复习回顾
同一周期元素,从左到右,原子核外电子层数 ,随着核电荷数的递增,元素原子的最外层电子数 ,原子半径逐渐 ,原子核对核外电子的吸引力逐渐 ,元素原子失电子能力逐渐 ,得电子能力逐渐 。
相同
逐渐增加
减小
增强
减弱
增强
同一主族元素,从上到下,对非金属元素来说,各元素原子的核外电子层数逐渐 ,核电荷数 ,原子半径逐渐 ,对最外层电子的引力逐渐 ,元素原子的得电子能力逐渐 ,氧化性逐渐 ,最高价氧化物形成的水化物的酸性逐渐 。
减弱
增加
增多
增加
减弱
减弱
减弱
你能根据硅元素在元素周期表中的位置、原子结构来预测硅的性质吗?
1.能根据学过的一些典型元素的性质预测同主族其他元素的性质。
2.了解硅及其化合物的性质及应用。
3.了解元素周期表的应用。
学习目标
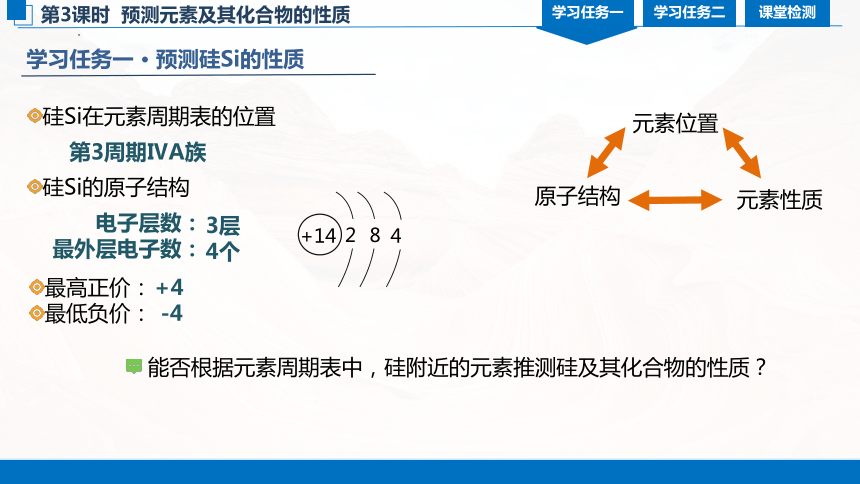
学习任务一 · 预测硅Si的性质
元素位置
原子结构
元素性质
硅Si在元素周期表的位置
第3周期ⅣA族
硅Si的原子结构
电子层数:
最外层电子数:
3层
4个
2
8
+14
4
能否根据元素周期表中,硅附近的元素推测硅及其化合物的性质?
最高正价:
最低负价:
+4
-4
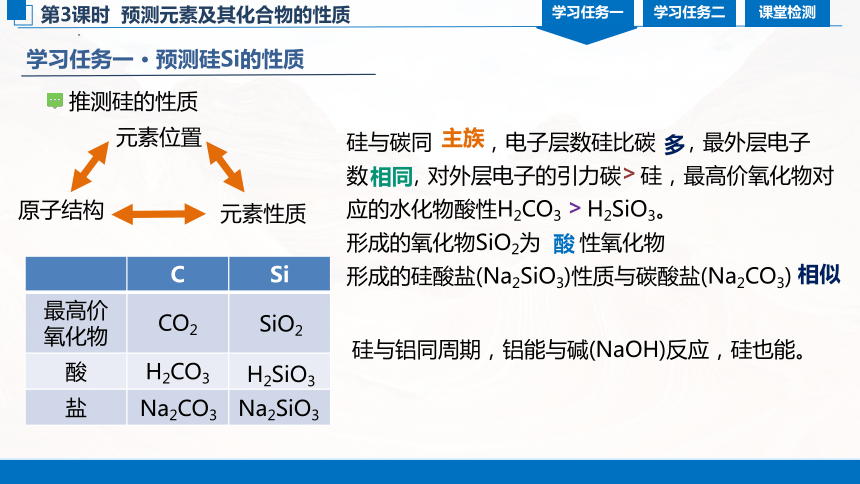
学习任务一 · 预测硅Si的性质
推测硅的性质
硅与碳同 ,电子层数硅比碳 ,最外层电子数 ,对外层电子的引力碳 硅,最高价氧化物对应的水化物酸性H2CO3 H2SiO3。
形成的氧化物SiO2为 性氧化物
形成的硅酸盐(Na2SiO3)性质与碳酸盐(Na2CO3)
主族
元素位置
原子结构
元素性质
多
相同
>
>
酸
相似
硅与铝同周期,铝能与碱(NaOH)反应,硅也能。
C Si
最高价氧化物 CO2
酸 H2CO3
盐
SiO2
H2SiO3
Na2CO3
Na2SiO3
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
1.单质硅的性质
(1)物理性质及用途
灰黑色,有金属光泽,稳定的半导体材料,自然界中没有游离态的硅
主要用于制造芯片
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
1.单质硅的性质
(2)化学性质
①常温下,硅的化学性质不活泼,只与F2、HF、强碱(如NaOH)溶液反应:
Si+ F2 = SiF4
Si+ HF = SiF4 + H2↑
Si+2NaOH+H2O = Na2SiO3 +2H2↑
②加热条件下和某些非金属单质(如O2、Cl2)发生反应:
2
4
2
Si+O2 = SiO2
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
2.二氧化硅SiO2的性质
常温下固态,不溶于水,沙子、石英、水晶、玛瑙的主要成分
可用于制造光导纤维(光纤)、玻璃
(1)物理性质及用途
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
2.二氧化硅SiO2的性质
(2)化学性质
b.高温下SiO2与碱性氧化物反应生成盐:
①酸性氧化物的通性
a.常温下SiO2与强碱溶液反应生成盐和水:
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2Na2O === NaSiO3
高温
②弱氧化性
SiO2+2C === Si+ 2CO↑
高温
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
2.二氧化硅SiO2的性质
(2)化学性质
③特性:与氢氟酸反应
SiO2+4HF = SiF4↑+ 2H2O
用于刻蚀玻璃
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
3.硅酸H2SiO3的性质
(1)物理性质
难溶于水
(2)化学性质
①弱酸性:酸性比碳酸弱
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
强酸制弱酸
②不稳定性
H2SiO3 = SiO2+H2O
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
3.硅酸H2SiO3的性质
(3)制备
Na2SiO3+2HCl=H2SiO3↓+2NaCl
(4)用途
硅酸凝胶做干燥剂
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
4.硅酸盐的性质
(1)硅酸盐材料:陶瓷、玻璃、水泥
普通水泥 普通玻璃 陶瓷
主要原料 石灰石、黏土、石膏 纯碱、石灰石、石英 黏土、长石、石英
主要成分 硅酸三钙(3CaO·SiO2) 硅酸二钙(2CaO·SiO2) 铝酸三钙(3CaO·Al2O3) NaSiO3 CaSiO3 SiO2 硅酸盐材料
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
4.硅酸盐的性质
(2)硅酸钠(Na2SiO3)
Na2SiO3水溶液俗称水玻璃,具有黏结力强、耐高温等特性。
实验室盛放碱溶液的试剂瓶应使用橡胶塞,而不用玻璃塞。
原因:玻璃中的SiO2易和碱溶液中的OH 反应生成NaSiO3,它是一种具有粘性的物质,导致瓶塞与瓶口粘在一起。
相关方程式:SiO2+2NaOH=Na2SiO3+H2O
课堂检测
学习任务二 · 利用元素周期表寻找新材料
元素周期表已成为化学家的得力工具,为研究物质结构、发现新元素、合成新物质、寻找新材料提供了许多有价值的指导。
根据在元素周期表中位置相近的元素具有相似的性质这一规律
(1)在金属元素和非金属元素的交界处寻找半导体材料
(2)在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素
(3)寻找合适的超导材料、磁性材料。
课堂检测
1.下列有关硅和硅的化合物的用途错误的是( )
A.晶体硅作半导体材料
B.二氧化硅作光导纤维材料
C.硅单质作耐火材料
D.高纯硅作计算机芯片材料
课堂检测
2.熔融苛性钠应选用的器皿是( )
A.陶瓷坩埚
B.石英坩埚
C.普通玻璃坩埚
D.铁坩埚
课堂检测
3.下列关于硅及其化合物的叙述正确的是( )
A.硅是良好的半导体材料,也可用于制造光缆
B.SiO是酸性氧化物,不溶于水,也不溶于任何酸
C.可以用焦炭还原二氧化硅生产粗硅:
D.生产水泥和玻璃用到的原料均有石灰石
SiO2+C === Si+ CO2↑
高温
课堂检测
4.下列有关硅及硅酸盐材料的说法正确的是( )
A.硅酸钠可以保存在磨口玻璃塞瓶中
B.高纯度的硅单质用于制造光导纤维
C.普通玻璃、塑料、水泥等均属于硅酸盐材料
D.SiO2是水晶、玛瑙的主要成分,也是制造光导纤维的原料
课堂检测
5.下列判断不正确的是()
A.在过渡元素中寻找半导体材料
B.在周期表中氟、氯、硫、磷等元素位置附近找合成农药的元素
C.在周期表中铁、铬、锰元素位置附近可找合成催化剂的元素
D.钛铁合金和镧镍合金可用于合成储氢材料
课堂检测
6. 5G技术中的核心材料是芯片,在元素周期表中能找到可用于制作半导体芯片材料的区域是()
A.过渡元素(副族)区域
B.金属元素和非金属元素的分界线附近
C.镧系元素和锕系元素区域
D.ⅠA族元素和稀有气体元素中
课堂检测
7.锗是一种重要的半导体材料,用于制造晶体管及各种电子装置,锗(Ge)是第4周期ⅣA族元素,位于元素周期表中金属区与非金属区的交界线上。下列叙述正确的是( )
A.锗的单质具有半导体的性能
B.锗是金属性很强的元素
C.锗化氢(GeH4)稳定性很强
D.锗酸(H4GeO4)是难溶于水的强酸
第2课时
第三节 元素周期表的应用
第3课时 预测元素及其化合物的性质
第一章
复习回顾
同一周期元素,从左到右,原子核外电子层数 ,随着核电荷数的递增,元素原子的最外层电子数 ,原子半径逐渐 ,原子核对核外电子的吸引力逐渐 ,元素原子失电子能力逐渐 ,得电子能力逐渐 。
相同
逐渐增加
减小
增强
减弱
增强
同一主族元素,从上到下,对非金属元素来说,各元素原子的核外电子层数逐渐 ,核电荷数 ,原子半径逐渐 ,对最外层电子的引力逐渐 ,元素原子的得电子能力逐渐 ,氧化性逐渐 ,最高价氧化物形成的水化物的酸性逐渐 。
减弱
增加
增多
增加
减弱
减弱
减弱
你能根据硅元素在元素周期表中的位置、原子结构来预测硅的性质吗?
1.能根据学过的一些典型元素的性质预测同主族其他元素的性质。
2.了解硅及其化合物的性质及应用。
3.了解元素周期表的应用。
学习目标
学习任务一 · 预测硅Si的性质
元素位置
原子结构
元素性质
硅Si在元素周期表的位置
第3周期ⅣA族
硅Si的原子结构
电子层数:
最外层电子数:
3层
4个
2
8
+14
4
能否根据元素周期表中,硅附近的元素推测硅及其化合物的性质?
最高正价:
最低负价:
+4
-4
学习任务一 · 预测硅Si的性质
推测硅的性质
硅与碳同 ,电子层数硅比碳 ,最外层电子数 ,对外层电子的引力碳 硅,最高价氧化物对应的水化物酸性H2CO3 H2SiO3。
形成的氧化物SiO2为 性氧化物
形成的硅酸盐(Na2SiO3)性质与碳酸盐(Na2CO3)
主族
元素位置
原子结构
元素性质
多
相同
>
>
酸
相似
硅与铝同周期,铝能与碱(NaOH)反应,硅也能。
C Si
最高价氧化物 CO2
酸 H2CO3
盐
SiO2
H2SiO3
Na2CO3
Na2SiO3
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
1.单质硅的性质
(1)物理性质及用途
灰黑色,有金属光泽,稳定的半导体材料,自然界中没有游离态的硅
主要用于制造芯片
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
1.单质硅的性质
(2)化学性质
①常温下,硅的化学性质不活泼,只与F2、HF、强碱(如NaOH)溶液反应:
Si+ F2 = SiF4
Si+ HF = SiF4 + H2↑
Si+2NaOH+H2O = Na2SiO3 +2H2↑
②加热条件下和某些非金属单质(如O2、Cl2)发生反应:
2
4
2
Si+O2 = SiO2
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
2.二氧化硅SiO2的性质
常温下固态,不溶于水,沙子、石英、水晶、玛瑙的主要成分
可用于制造光导纤维(光纤)、玻璃
(1)物理性质及用途
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
2.二氧化硅SiO2的性质
(2)化学性质
b.高温下SiO2与碱性氧化物反应生成盐:
①酸性氧化物的通性
a.常温下SiO2与强碱溶液反应生成盐和水:
SiO2+2NaOH=Na2SiO3+H2O
SiO2+2Na2O === NaSiO3
高温
②弱氧化性
SiO2+2C === Si+ 2CO↑
高温
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
2.二氧化硅SiO2的性质
(2)化学性质
③特性:与氢氟酸反应
SiO2+4HF = SiF4↑+ 2H2O
用于刻蚀玻璃
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
3.硅酸H2SiO3的性质
(1)物理性质
难溶于水
(2)化学性质
①弱酸性:酸性比碳酸弱
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
强酸制弱酸
②不稳定性
H2SiO3 = SiO2+H2O
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
3.硅酸H2SiO3的性质
(3)制备
Na2SiO3+2HCl=H2SiO3↓+2NaCl
(4)用途
硅酸凝胶做干燥剂
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
4.硅酸盐的性质
(1)硅酸盐材料:陶瓷、玻璃、水泥
普通水泥 普通玻璃 陶瓷
主要原料 石灰石、黏土、石膏 纯碱、石灰石、石英 黏土、长石、石英
主要成分 硅酸三钙(3CaO·SiO2) 硅酸二钙(2CaO·SiO2) 铝酸三钙(3CaO·Al2O3) NaSiO3 CaSiO3 SiO2 硅酸盐材料
课堂检测
学习任务一 · 预测硅Si的性质
总结硅及其化合物性质
4.硅酸盐的性质
(2)硅酸钠(Na2SiO3)
Na2SiO3水溶液俗称水玻璃,具有黏结力强、耐高温等特性。
实验室盛放碱溶液的试剂瓶应使用橡胶塞,而不用玻璃塞。
原因:玻璃中的SiO2易和碱溶液中的OH 反应生成NaSiO3,它是一种具有粘性的物质,导致瓶塞与瓶口粘在一起。
相关方程式:SiO2+2NaOH=Na2SiO3+H2O
课堂检测
学习任务二 · 利用元素周期表寻找新材料
元素周期表已成为化学家的得力工具,为研究物质结构、发现新元素、合成新物质、寻找新材料提供了许多有价值的指导。
根据在元素周期表中位置相近的元素具有相似的性质这一规律
(1)在金属元素和非金属元素的交界处寻找半导体材料
(2)在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素
(3)寻找合适的超导材料、磁性材料。
课堂检测
1.下列有关硅和硅的化合物的用途错误的是( )
A.晶体硅作半导体材料
B.二氧化硅作光导纤维材料
C.硅单质作耐火材料
D.高纯硅作计算机芯片材料
课堂检测
2.熔融苛性钠应选用的器皿是( )
A.陶瓷坩埚
B.石英坩埚
C.普通玻璃坩埚
D.铁坩埚
课堂检测
3.下列关于硅及其化合物的叙述正确的是( )
A.硅是良好的半导体材料,也可用于制造光缆
B.SiO是酸性氧化物,不溶于水,也不溶于任何酸
C.可以用焦炭还原二氧化硅生产粗硅:
D.生产水泥和玻璃用到的原料均有石灰石
SiO2+C === Si+ CO2↑
高温
课堂检测
4.下列有关硅及硅酸盐材料的说法正确的是( )
A.硅酸钠可以保存在磨口玻璃塞瓶中
B.高纯度的硅单质用于制造光导纤维
C.普通玻璃、塑料、水泥等均属于硅酸盐材料
D.SiO2是水晶、玛瑙的主要成分,也是制造光导纤维的原料
课堂检测
5.下列判断不正确的是()
A.在过渡元素中寻找半导体材料
B.在周期表中氟、氯、硫、磷等元素位置附近找合成农药的元素
C.在周期表中铁、铬、锰元素位置附近可找合成催化剂的元素
D.钛铁合金和镧镍合金可用于合成储氢材料
课堂检测
6. 5G技术中的核心材料是芯片,在元素周期表中能找到可用于制作半导体芯片材料的区域是()
A.过渡元素(副族)区域
B.金属元素和非金属元素的分界线附近
C.镧系元素和锕系元素区域
D.ⅠA族元素和稀有气体元素中
课堂检测
7.锗是一种重要的半导体材料,用于制造晶体管及各种电子装置,锗(Ge)是第4周期ⅣA族元素,位于元素周期表中金属区与非金属区的交界线上。下列叙述正确的是( )
A.锗的单质具有半导体的性能
B.锗是金属性很强的元素
C.锗化氢(GeH4)稳定性很强
D.锗酸(H4GeO4)是难溶于水的强酸
第2课时
