化学人教版(2019)必修第一册4.3.1化学键(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.1化学键(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 23.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 18:15:59 | ||
图片预览




文档简介
(共31张PPT)
化
学
键
旧知回顾--宏观感知
1
2
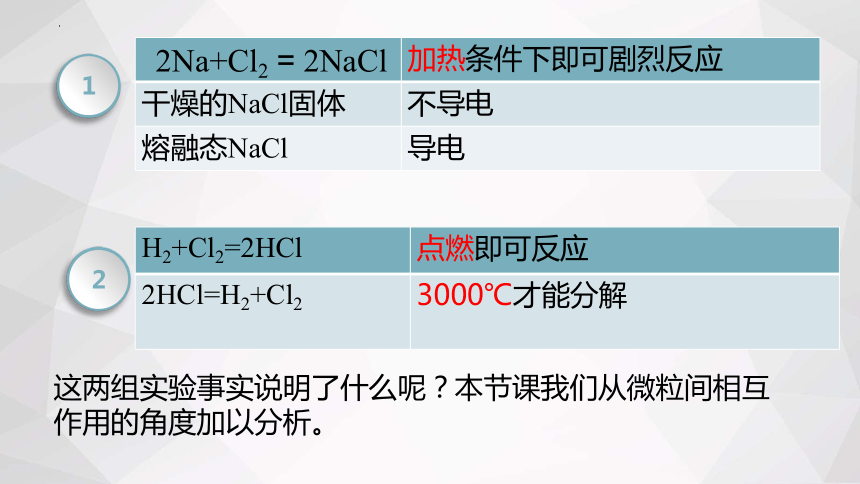
加热条件下即可剧烈反应
干燥的NaCl固体 不导电
熔融态NaCl 导电
2Na+Cl2 = 2NaCl
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
这两组实验事实说明了什么呢?本节课我们从微粒间相互作用的角度加以分析。
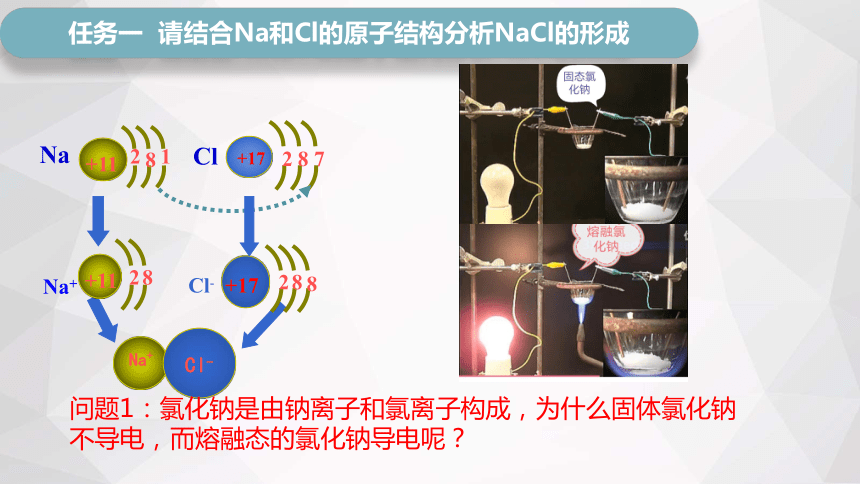
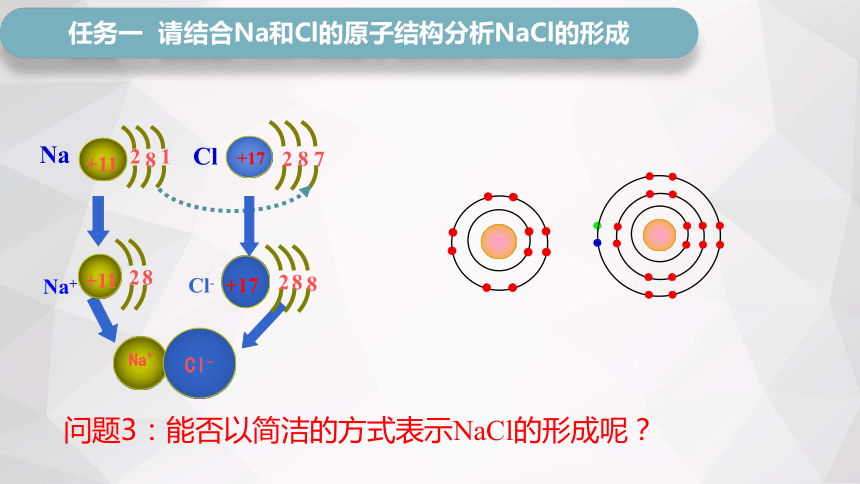
任务一 请结合Na和Cl的原子结构分析NaCl的形成
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
Na+
+17
8
8
2
Cl-
问题1:氯化钠是由钠离子和氯离子构成,为什么固体氯化钠不导电,而熔融态的氯化钠导电呢?
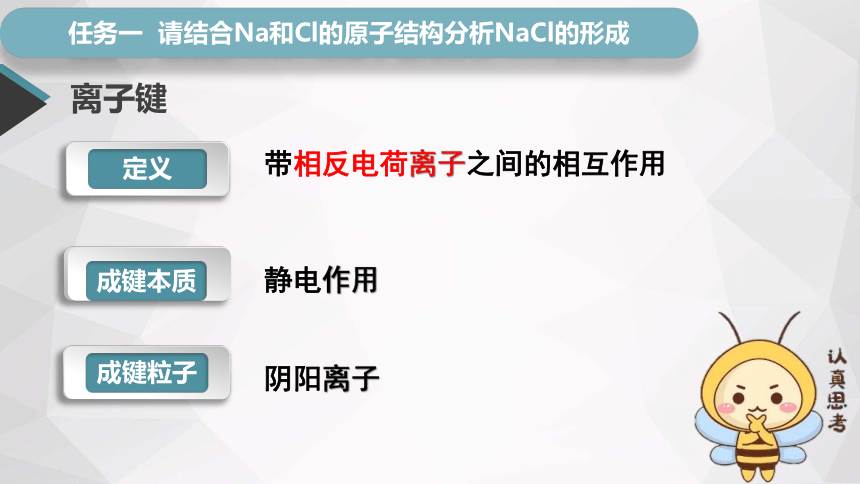
任务一 请结合Na和Cl的原子结构分析NaCl的形成
静电作用
离子键
成键粒子
定义
成键本质
带相反电荷离子之间的相互作用
静电作用
阴阳离子
任务一 请结合Na和Cl的原子结构分析NaCl的形成
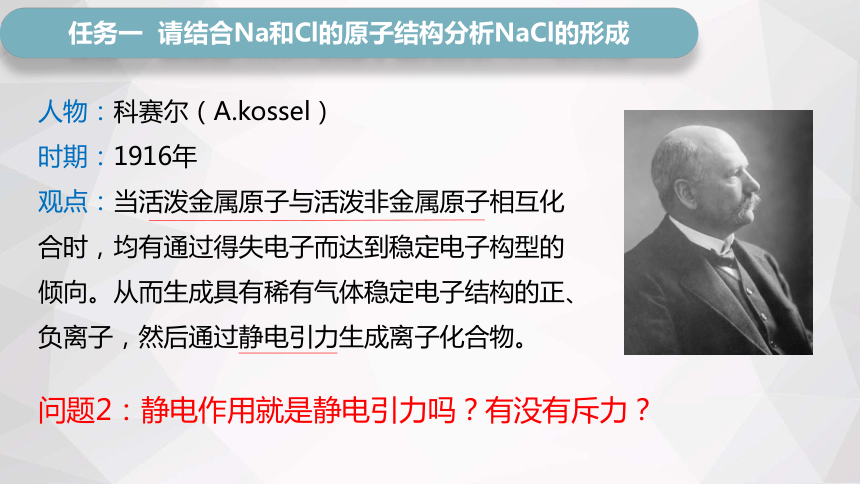
问题2:静电作用就是静电引力吗?有没有斥力?
任务一 请结合Na和Cl的原子结构分析NaCl的形成
人物:科赛尔(A.kossel)
时期:1916年
观点:当活泼金属原子与活泼非金属原子相互化合时,均有通过得失电子而达到稳定电子构型的倾向。从而生成具有稀有气体稳定电子结构的正、负离子,然后通过静电引力生成离子化合物。
任务一 请结合Na和Cl的原子结构分析NaCl的形成
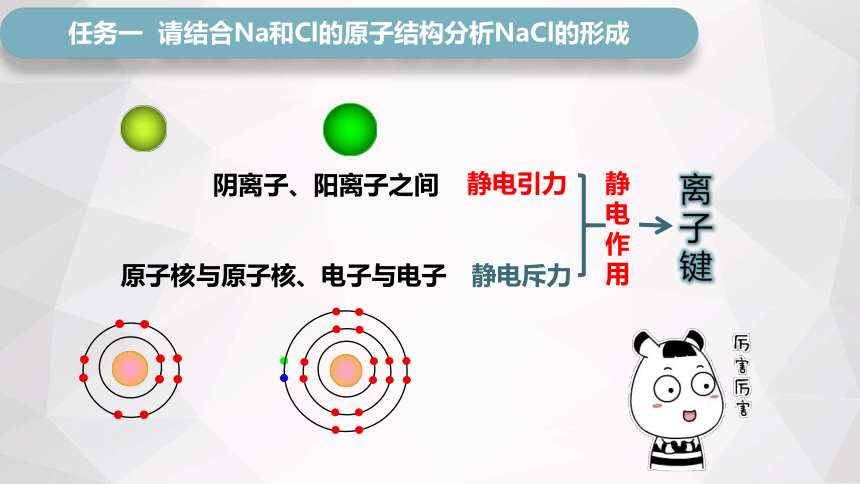
静电作用
静电斥力
静电引力
离子键
阴离子、阳离子之间
原子核与原子核、电子与电子
任务一 请结合Na和Cl的原子结构分析NaCl的形成
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
Na+
+17
8
8
2
Cl-
问题3:能否以简洁的方式表示NaCl的形成呢?
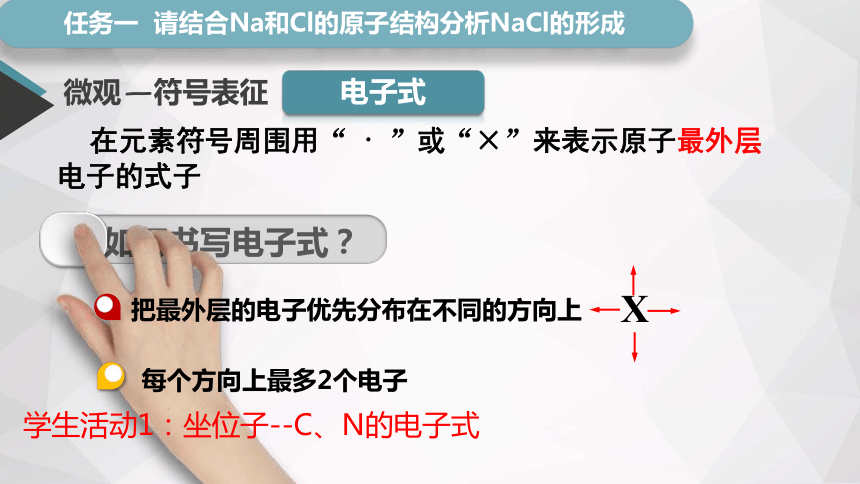
微观—符号表征
电子式
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子
如何书写电子式?
X
把最外层的电子优先分布在不同的方向上
每个方向上最多2个电子
任务一 请结合Na和Cl的原子结构分析NaCl的形成
学生活动1:坐位子--C、N的电子式
原子的电子式
一般用 表示
R
n-
直接用离子符号
简单阳离子
简单阴离子
Cl
Na
O
2
练习1:结合原子结构示意图,你能用电子式表示出下列原子吗?
任务一 请结合Na和Cl的原子结构分析NaCl的形成
He Mg Al O
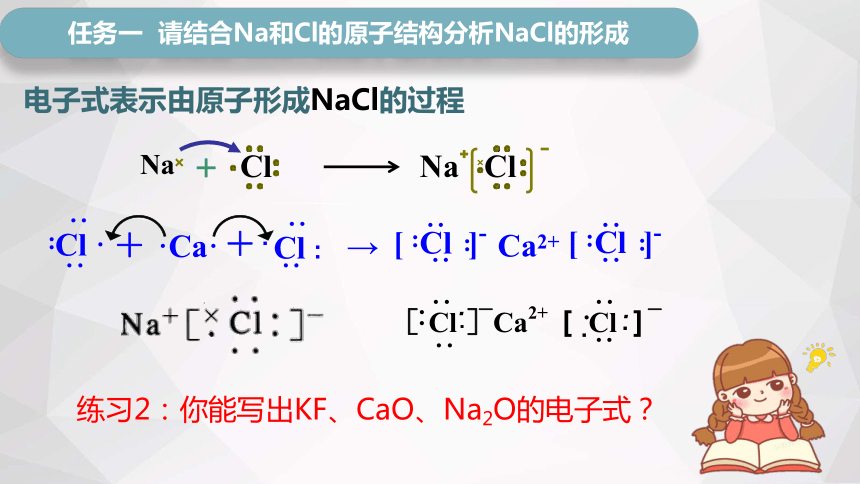
电子式表示由原子形成NaCl的过程
Cl
Na
Cl
Na
任务一 请结合Na和Cl的原子结构分析NaCl的形成
练习2:你能写出KF、CaO、Na2O的电子式?
Cl ·
··
··
:
Cl :
··
··
·
·Ca·
+
+
→
Ca2+
[ Cl ]-
··
··
:
:
[ Cl ]-
··
··
:
:
[ Cl ]Ca2+ [ Cl ]
-
··
··
··
·
·
··
··
· ·
·
·
-
任务二 请结合H和Cl的原子结构分析HCl的形成
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
练习1:HCl中的作用力也是离子键吗?你能分析并表示出HCl的形成过程吗?
H
+
Cl
HCl的形成过程:
任务二 请结合H和Cl的原子结构分析HCl的形成
人物:路易斯(G.N.Lewis)
时期:1923年
观点:发展了科赛尔的理论,提出共价键的电子对理论,“认为分子中的原子都有形成稀有气体电子结构的趋势,求得本身稳定。而达到这种稳定结构可以不通过电子转移形成离子和离子键完成,而是通过共用电子对实现。
任务二 请结合H和Cl的原子结构分析HCl的形成
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
练习1:你能分析并表示出HCl的形成过程吗?HCl中的作用力也是离子键吗?
H
+
Cl
H
Cl
HCl的形成过程:
电子式:
共价键
成键粒子
定义
成键本质
任务二 请结合H和Cl的原子结构分析HCl的形成
原子间通过共用电子对所形成的相互作用
共用电子对
一般为非金属原子
稳定结构
任务二 请结合H和Cl的原子结构分析HCl的形成
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
练习1:你能分析并表示出HCl的形成过程吗?HCl中的作用力也是离子键吗?
H
+
Cl
H
Cl
HCl的形成过程:
结构式:H-Cl
结构式:只用一根短线表示一对共用电子.其他电子不用表示出来.
Cl-Cl
Cl
+
Cl
Cl
Cl
H2O的形成过程:
O
H
H
··
··
O
·
·
H· +
+·H
··
··
Cl2的形成过程:
任务二 请结合H和Cl的原子结构分析HCl的形成
H-O-H
练习2:你可以试着写出H2O的电子式和结构式吗?
N≡N
O=C=O
N
任务二 请结合H和Cl的原子结构分析HCl的形成
N2
CO2
NH3
CH4
练习3:师生共同书写N2、CO2、NH3、CH4、的电子式与结构式
问题1:C、H、O、N分别要形成几个共价键达到稳定结构?
问题2:共价键形成的分子都是平面结构吗?
任务二 请结合H和Cl的原子结构分析HCl的形成
1940年亨利·希吉维克和托马斯·坡维尔在总结实验事实的基础上提出了简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经罗纳德·吉列斯比和罗纳德·尼霍尔姆在20世纪50年代加以发展,定名为价层电子对互斥理论。
人物:莱纳斯·鲍林(Linus Carl Pauling)
时期:1930年
观点:研究了甲烷的正四面体结构,并提出轨道杂化理论,因此获得诺贝尔奖。
任务二 请结合H和Cl的原子结构分析HCl的形成
活动1:动手组装H2、HCl、H2O、CO2、CH4的分子结构模型
分子 电子式 结构式 分子结构模型 空间结构
H2
HCl
CO2
H2O
CH4
H–H
H–Cl
O=C=O
H–O–H
直线型
V型
正四面体
直线型
直线型
H–C–H
–
–
H
H
任务二 请结合H和Cl的原子结构分析HCl的形成
物质 Cl2 HCl
结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
键的类型
Cl-Cl
相同
不偏移
不显电性
问题3:Cl2、HCl中均形成一个共价键,它们完全相同吗?
H-Cl
Cl强于H
偏向Cl,偏离H
Cl显负电,H显正电
任务二 请结合H和Cl的原子结构分析HCl的形成
H Cl
非极性键
极性共价键
【小结】
非极性键(同种原子组成,共用电子对不发生偏移)
极性键(不同种原子组成,共用电子对发生偏移)
共价键
离子键
化学键
直接相邻的
原子或离子之间存在的
强烈的相互作用
任务三 “化学键”的意义建构
“键”是什么意思?
“重中之重”为何称之为“关键”?
“化学键”又是什么?
“使轮轴与车轮等连结并固定在一起的零件。”(俗称销钉)
1.为什么是“键”?
任务三 “化学键”的意义建构
问题1:找出下面两图中“键”的位置在哪里?
任务三 “化学键”的意义建构
问题1:找出下面两图中“键”的位置在哪里?
这就是“键”(销钉)
任务三 “化学键”的意义建构
问题2:什么是化学“键”呢?
以上分析:“键”的作用是连接物体,使之合而为一。
在化学中,就借用“键”的这种作用来形象描述原子与原子形成分子或阴阳离子间的强烈的相互作用。
键
物理键
化学键
离子键
共价键
金属键
极性键
非极性键
任务三 “化学键”的意义建构
问题3:为什么100多种元素可以形成上亿种物质?
美国化学文摘社宣布收录第一亿个化合物
全球化学信息权威机构美国化学文摘社(CAS)
近期在CAS物质数据库中收录了第一亿个
化学物质。-----2015年5月
相同或者不同元素的原子(离子)间就是通过化学键形成了上亿种物质,才构成了丰富多彩的世界。
任务三 “化学键”的意义建构
2.化学键的神奇之力
化学创造美好生活
下
节
见
课
THANK YOU
化
学
键
旧知回顾--宏观感知
1
2
加热条件下即可剧烈反应
干燥的NaCl固体 不导电
熔融态NaCl 导电
2Na+Cl2 = 2NaCl
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
这两组实验事实说明了什么呢?本节课我们从微粒间相互作用的角度加以分析。
任务一 请结合Na和Cl的原子结构分析NaCl的形成
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
Na+
+17
8
8
2
Cl-
问题1:氯化钠是由钠离子和氯离子构成,为什么固体氯化钠不导电,而熔融态的氯化钠导电呢?
任务一 请结合Na和Cl的原子结构分析NaCl的形成
静电作用
离子键
成键粒子
定义
成键本质
带相反电荷离子之间的相互作用
静电作用
阴阳离子
任务一 请结合Na和Cl的原子结构分析NaCl的形成
问题2:静电作用就是静电引力吗?有没有斥力?
任务一 请结合Na和Cl的原子结构分析NaCl的形成
人物:科赛尔(A.kossel)
时期:1916年
观点:当活泼金属原子与活泼非金属原子相互化合时,均有通过得失电子而达到稳定电子构型的倾向。从而生成具有稀有气体稳定电子结构的正、负离子,然后通过静电引力生成离子化合物。
任务一 请结合Na和Cl的原子结构分析NaCl的形成
静电作用
静电斥力
静电引力
离子键
阴离子、阳离子之间
原子核与原子核、电子与电子
任务一 请结合Na和Cl的原子结构分析NaCl的形成
Na
+11
8
1
2
Cl
+17
8
7
2
Na+
Cl-
+11
8
2
Na+
+17
8
8
2
Cl-
问题3:能否以简洁的方式表示NaCl的形成呢?
微观—符号表征
电子式
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子
如何书写电子式?
X
把最外层的电子优先分布在不同的方向上
每个方向上最多2个电子
任务一 请结合Na和Cl的原子结构分析NaCl的形成
学生活动1:坐位子--C、N的电子式
原子的电子式
一般用 表示
R
n-
直接用离子符号
简单阳离子
简单阴离子
Cl
Na
O
2
练习1:结合原子结构示意图,你能用电子式表示出下列原子吗?
任务一 请结合Na和Cl的原子结构分析NaCl的形成
He Mg Al O
电子式表示由原子形成NaCl的过程
Cl
Na
Cl
Na
任务一 请结合Na和Cl的原子结构分析NaCl的形成
练习2:你能写出KF、CaO、Na2O的电子式?
Cl ·
··
··
:
Cl :
··
··
·
·Ca·
+
+
→
Ca2+
[ Cl ]-
··
··
:
:
[ Cl ]-
··
··
:
:
[ Cl ]Ca2+ [ Cl ]
-
··
··
··
·
·
··
··
· ·
·
·
-
任务二 请结合H和Cl的原子结构分析HCl的形成
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
练习1:HCl中的作用力也是离子键吗?你能分析并表示出HCl的形成过程吗?
H
+
Cl
HCl的形成过程:
任务二 请结合H和Cl的原子结构分析HCl的形成
人物:路易斯(G.N.Lewis)
时期:1923年
观点:发展了科赛尔的理论,提出共价键的电子对理论,“认为分子中的原子都有形成稀有气体电子结构的趋势,求得本身稳定。而达到这种稳定结构可以不通过电子转移形成离子和离子键完成,而是通过共用电子对实现。
任务二 请结合H和Cl的原子结构分析HCl的形成
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
练习1:你能分析并表示出HCl的形成过程吗?HCl中的作用力也是离子键吗?
H
+
Cl
H
Cl
HCl的形成过程:
电子式:
共价键
成键粒子
定义
成键本质
任务二 请结合H和Cl的原子结构分析HCl的形成
原子间通过共用电子对所形成的相互作用
共用电子对
一般为非金属原子
稳定结构
任务二 请结合H和Cl的原子结构分析HCl的形成
H2+Cl2=2HCl 点燃即可反应
2HCl=H2+Cl2 3000℃才能分解
练习1:你能分析并表示出HCl的形成过程吗?HCl中的作用力也是离子键吗?
H
+
Cl
H
Cl
HCl的形成过程:
结构式:H-Cl
结构式:只用一根短线表示一对共用电子.其他电子不用表示出来.
Cl-Cl
Cl
+
Cl
Cl
Cl
H2O的形成过程:
O
H
H
··
··
O
·
·
H· +
+·H
··
··
Cl2的形成过程:
任务二 请结合H和Cl的原子结构分析HCl的形成
H-O-H
练习2:你可以试着写出H2O的电子式和结构式吗?
N≡N
O=C=O
N
任务二 请结合H和Cl的原子结构分析HCl的形成
N2
CO2
NH3
CH4
练习3:师生共同书写N2、CO2、NH3、CH4、的电子式与结构式
问题1:C、H、O、N分别要形成几个共价键达到稳定结构?
问题2:共价键形成的分子都是平面结构吗?
任务二 请结合H和Cl的原子结构分析HCl的形成
1940年亨利·希吉维克和托马斯·坡维尔在总结实验事实的基础上提出了简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经罗纳德·吉列斯比和罗纳德·尼霍尔姆在20世纪50年代加以发展,定名为价层电子对互斥理论。
人物:莱纳斯·鲍林(Linus Carl Pauling)
时期:1930年
观点:研究了甲烷的正四面体结构,并提出轨道杂化理论,因此获得诺贝尔奖。
任务二 请结合H和Cl的原子结构分析HCl的形成
活动1:动手组装H2、HCl、H2O、CO2、CH4的分子结构模型
分子 电子式 结构式 分子结构模型 空间结构
H2
HCl
CO2
H2O
CH4
H–H
H–Cl
O=C=O
H–O–H
直线型
V型
正四面体
直线型
直线型
H–C–H
–
–
H
H
任务二 请结合H和Cl的原子结构分析HCl的形成
物质 Cl2 HCl
结构式
原子对电子的吸引能力
共用电子对是否发生偏移
成键原子是否显电性
键的类型
Cl-Cl
相同
不偏移
不显电性
问题3:Cl2、HCl中均形成一个共价键,它们完全相同吗?
H-Cl
Cl强于H
偏向Cl,偏离H
Cl显负电,H显正电
任务二 请结合H和Cl的原子结构分析HCl的形成
H Cl
非极性键
极性共价键
【小结】
非极性键(同种原子组成,共用电子对不发生偏移)
极性键(不同种原子组成,共用电子对发生偏移)
共价键
离子键
化学键
直接相邻的
原子或离子之间存在的
强烈的相互作用
任务三 “化学键”的意义建构
“键”是什么意思?
“重中之重”为何称之为“关键”?
“化学键”又是什么?
“使轮轴与车轮等连结并固定在一起的零件。”(俗称销钉)
1.为什么是“键”?
任务三 “化学键”的意义建构
问题1:找出下面两图中“键”的位置在哪里?
任务三 “化学键”的意义建构
问题1:找出下面两图中“键”的位置在哪里?
这就是“键”(销钉)
任务三 “化学键”的意义建构
问题2:什么是化学“键”呢?
以上分析:“键”的作用是连接物体,使之合而为一。
在化学中,就借用“键”的这种作用来形象描述原子与原子形成分子或阴阳离子间的强烈的相互作用。
键
物理键
化学键
离子键
共价键
金属键
极性键
非极性键
任务三 “化学键”的意义建构
问题3:为什么100多种元素可以形成上亿种物质?
美国化学文摘社宣布收录第一亿个化合物
全球化学信息权威机构美国化学文摘社(CAS)
近期在CAS物质数据库中收录了第一亿个
化学物质。-----2015年5月
相同或者不同元素的原子(离子)间就是通过化学键形成了上亿种物质,才构成了丰富多彩的世界。
任务三 “化学键”的意义建构
2.化学键的神奇之力
化学创造美好生活
下
节
见
课
THANK YOU
