5.2.3铵盐课件 (共50张PPT)人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3铵盐课件 (共50张PPT)人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 81.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-01 23:18:32 | ||
图片预览











文档简介
(共50张PPT)
铵盐
有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?
化学性质
铵 盐
氨的制法
物理性质
总结归纳
习情境导入>>>
学
学习情境化·情境趣味化
抓小偷
提示:在太阳光的照射下,碳酸氢铵受热分解生成NH3、CO2、水蒸气,故固体减少。
铵盐
由铵根离子(NH4+)和酸根离子构成的化合物即铵盐。铵盐一般为无色或白色晶体、都易溶解于水。
⑵铵盐受热易分解
⑴铵盐都易溶于水
铵盐的性质
NH4HCO3 = NH3↑ + CO2↑+ H2O
△
NH4Cl = NH3 ↑ + HCl ↑
△
化学性质
铵 盐
氨的制法
物理性质
总结归纳
NH4HCO3 = NH3↑ + CO2↑+ H2O
△
不是所有的铵盐受热都会放出氨气,
如硝酸铵受热分解为硝酸、氮气和水
知识系统化·系统条理化
加热到300℃左右时:
5NH4NO3=2HNO3+4N2↑+9H2O
相关链接
铵盐受热分解的产物
(1)如果组成铵盐的酸是易挥发或易分解的酸,则固体铵盐受热分解时,氨气与酸一起挥发,冷却时又重新结合成铵盐。如NH4Cl、NH4HCO3等。
(2)如果组成铵盐的酸是难挥发性酸,则固体铵盐受热分解时,只有氨呈气态逸出,而难挥发性酸残留在容器中,如(NH4)2SO4分解的化学方程式为(NH4)2SO4 NH3↑+NH4HSO4或(NH4)2SO4 2NH3↑+H2SO4。
(3)如果组成铵盐的酸是具有强氧化性的酸,则在较低的温度下慢慢分解可得到NH3和相应的酸,如NH4NO3。由于生成的氨气具有还原性,硝酸具有氧化性,生成的NH3易被HNO3氧化,则反应时的温度不同,形成氮的化合物也不同,如将NH4NO3在不同的温度下加热分解分别可得到N2O、NO2、N2O3、N2等。
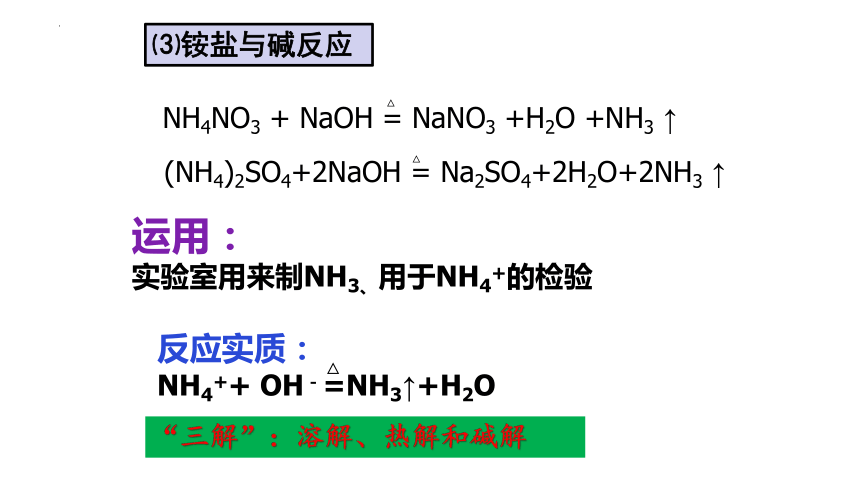
NH4NO3 + NaOH = NaNO3 +H2O +NH3 ↑
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3 ↑
运用:
*在实验室中,常利用铵盐和强碱反应产生氨这一性质来检验铵根离子的存在和制取氨
反应实质:
NH4++ OH-=NH3↑+H2O
△
△
△
⑶铵盐与碱反应
“三解”:溶解、热解和碱解
NH4+的检验:铵盐与强碱共热产生气体,用石蕊试纸或浓盐酸检验。
NH4NO3 + NaOH = NaNO3 +H2O +NH3 ↑
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3 ↑
运用:
实验室用来制NH3、用于NH4+的检验
反应实质:
NH4++ OH-=NH3↑+H2O
△
△
△
“三解”:溶解、热解和碱解
⑶铵盐与碱反应
应用:
a.实验室用来制NH3
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
b.用于NH4+的检验:
加热时,能与碱液反应产生使湿润的红色石蕊试纸变蓝的气体的物质一定是铵盐
(1)固体铵盐与固体碱之间的反应不写离子方程式;如:实验室制取氨气
(2)铵盐溶液和碱溶液混合后的离子方程式:
(3)铵盐溶液和碱溶液混合并加热有氨气逸出的离子方程式:
NH4++ OH-=NH3·H2O
注意事项:
NH4++ OH-=NH3↑+H2O
△
铵根离子的检验
检验方法:
1、先将其与强碱共热逸出NH3
2、用湿润红色石蕊试纸或浓盐酸检验逸出的氨气
3.NH4+的检验
样品
强碱
△
刺激性气味气体
湿润红色石蕊试纸变蓝
蘸有浓盐酸的玻棒靠近有白烟
NH4+
(2)方法
①NaOH溶液法
取少量固体样品或溶液于试管中,再加入浓的NaOH溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体(或将蘸有浓盐酸的玻璃棒靠近管口,有白烟产生),证明固体样品或溶液中含有NH 。
②碱石灰法
把碱石灰与某物质的固体混合物在研钵里研磨,产生的气体能使湿润的红色石蕊试纸变蓝(或将蘸有浓盐酸的玻璃棒靠近研钵口,有白烟产生),则可以判断该物质是铵盐。
铵盐的用途
大量的铵盐用于生产氮肥
硝酸铵用于制炸药、氯化铵常用作印染
和制干电池的原料,也可以用于金属的焊接,以除去金属表面的氧化物薄膜。
氯化铵的妙用
——防火布
将一块普通的棉布浸在氯化铵的饱和溶液中,片刻之后,取出晾干就成防火布了。将这块经过化学处理的布用火柴点,不但点不着,而且还冒出白色的烟雾。
科学视野
原来,经过这种化学处理的棉布(防火布)的表面附满了氯化铵的晶体颗粒,氯化铵这种物质,它有个怪脾气,就是特别怕热,一遇热就会发生化学变化,分解出两种不能燃烧的气体,一种是氨气,另一种是氯化氢气体。
上一页
下一页
结束
回目录
这两种气体把棉布与空气隔绝起来,棉布在没有氧气的条件下当然就不能燃烧了。当这两种气体保护棉布不被火烧的同时,它们又在空气中相遇,重新化合而成氯化铵小晶体,这些小晶体分布在空气中,就象白烟一样。实际上,氯化铵这种化学物质是很好的防火能手,戏院里的舞台布景、舰艇上的木料等,都经常用氯化铵处理,以求达到防火的目的。
1.下列有关氨气的性质的叙述中正确的是( )
A.氨气不能在空气中燃烧,是因为O2不能将NH3氧化
B.氨气是非电解质,NH3·H2O是电解质
C.氨气和酸相遇都能产生酸雾
D.氨气呈碱性,能使石蕊试纸变蓝
2. 下列不属于铵盐的通性的是( )
A.易溶于水 B.含有NH4+
C.易分解放出氨气 D.能和碱反应生成氨气
3. 下列有关氨及其铵盐的叙述中不正确的是( )
A.铵态氮肥不能和碱性物质混合使用
B.氨气极易溶于水,因此氨水为强碱溶液
C.可用NaOH溶液和红色石蕊试纸检验溶液中的NH4+
D.氨气具有还原性,一定条件下可与有氧化性的O2反应
限时训练(5min)
B
C
B
氨和铵盐
向空气要面包
氨态氮肥
喷泉实验
氨水的热稳定性
铵态氮肥
氨与盐酸
铵盐的性质
硝态氮肥
氨的实验室制法
课堂小结
课后练习
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与浓盐酸反应产生了NH4Cl固体
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液
D 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 NH3是一种可溶性碱
5. 如右图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
√
(二)NH3的实验室制法
原理:加热铵盐与碱的固体混合物
如:将固体NH4Cl与Ca(OH)2混合加热,即得到NH3
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
讨论:
NH3如何收集?
如何检验NH3已经收满?剩余的NH3如何处理?
若要制备干燥的NH3 ,可用什么作干燥剂?
目录
实验5-13
重
实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气,装置如图所示:
请思考下列问题:
1.NH4Cl受热分解也能产生NH3,实验室能否用直接加热NH4Cl的方法制取氨气
2.收集装置中棉花的作用
3.氨气是一种碱性气体,可用那些试剂干燥氨气
5.氨气是一种污染性气体,实验室制取或使用时要有尾气处理装置,你认为应如何吸收氨气
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
4.如何检验氨气
观看实验视频
氨气的实验室制法
NH3的实验室制法
(1)原料:NH4Cl Ca(OH)2
(2)原理:
2NH4Cl+Ca(OH)2==2NH3↑+2H2O+CaCl2
(3)制取装置:
固固加热装置
棉花的作用:
防止空气对流
△
(2)装置:
(4)收集装置: 向下排空气法
(5)检验: a:使湿润的酚酞试纸变红
b:遇浓盐酸产生大量的白烟
(6)尾气处理:用水或稀硫酸浸湿的棉花球吸收NH3
要得到干燥的氨气,常用试剂有哪些?
①CaO、碱石灰等碱性干燥剂
②无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
装置 选择 选择原因
制备 装置 固+固 反应原理
净化 装置 装有碱石灰的干燥管 NH3具有碱性,不与碱石灰反应
不用浓硫酸和无水氯化钙 NH3能被浓硫酸和无水氯化钙吸收
收集 装置 向下排空气法 NH3的密度远小于空气,且常温下不与空气成分反应
不采用排水法 NH3极易溶于水
装置 选择 选择原因
验满 方法 将湿润的红色石蕊试纸置于试管口,试纸变蓝色 氨水显碱性
将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生 氨气遇挥发性酸反应生成固体铵盐小颗粒
尾气 处理 试管口放一团用水或稀硫酸浸湿的棉花球 NH3极易溶于水,与酸反应
【易错提醒】(1)收集装置和反应装置的试管和导管必须是干燥的。
(2)发生装置的试管口略向下倾斜。
(3)由于氨气的密度比空气小,因此收集氨气时,导管口应插入试管的底部。
(4)棉花团上蘸有稀硫酸,既防止空气对流又防止氨气逸出污染空气。
(5)干燥NH3不能用P2O5、浓硫酸等酸性干燥剂,也不能用CaCl2干燥,原因是CaCl2与NH3反应生成CaCl2·8NH3。
【母题追问】(1)干燥氨气时可以使用什么装置?
提示:干燥氨气时使用固体干燥剂,如碱石灰、氢氧化钠固体等,故仪器为干燥管或U形管。
1.制取氨气的发生装置与实验室制取哪种气体的相同?使用该装置需注意什么问题?
提示 与实验室制取氧气的发生装置相同。该套装置在使用时要特别注意加热时要使试管口略低于管底,以防止冷凝水倒流使试管炸裂。
2.在制取氨的实验装置中,使用棉花的作用是什么?
提示 若为干燥的棉花则起到减缓氨气与空气对流的作用;若为蘸有水或稀硫酸的棉花,则还可以吸收多余的NH3。
深度思考
【思考·讨论】
(1)实验室制取氨气时,碱不选用NaOH、KOH,其原因是什么?
提示:消石灰不能用NaOH、KOH代替,原因是NaOH、KOH具有吸湿性,易结块,不利于产生氨气,在加热条件下还会腐蚀试管。
(2)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl来制备氨气,你怎么看?
提示:不行。NH4Cl分解得到NH3和HCl,两种气体在试管口遇冷反应又生成NH4Cl,得不到氨气。
特别提示
(1)制取氨时,不能用硝酸铵代替氯化铵。因为硝酸铵在加热过程中可能发生爆炸性的反应,发生危险。
(2)制取氨时,不能用氢氧化钠代替熟石灰。因为氢氧化钠具有吸湿性,易结块,不利于产生NH3,且在加热条件下易腐蚀试管。
(3)氨气是碱性气体,不能用酸性干燥剂(浓硫酸等)干燥,也不能用无水CaCl2干燥,因为它们均能与氨气发生反应,常用碱石灰作干燥剂。
1.原理:2NH4Cl +Ca(OH)2 == NH3↑+CaCl2+2H2O
2.装置:固 + 固 →气体
4.收集:向下排空气法
(棉花:防止空气对流,提高集气的速度和纯度)
5.检验:①用湿润的红色石蕊试纸(变蓝)
②蘸有浓盐酸的玻璃棒靠近瓶口(白烟)
3.干燥:生石灰、碱石灰等碱性干燥剂
1min速记 氨的实验室制法
6.尾气处理:稀硫酸溶液、用水吸收
7.实验室制取氨气常用方法
①加热NH4Cl和Ca(OH)2固体
②加热浓氨水法
③浓氨水加生石灰法
实验室中还可以用
哪些方法快速制氨气:
①加热浓氨水法
浓氨水
NH3·H2O NH3↑+ H2O
氨的实验室制法
化学性质
铵 盐
氨的制法
物理性质
总结归纳
方法 化学方程式(或原理) 气体发生装置
浓氨水 +固体 NaOH NaOH溶于水放热,促使氨水分解,且OH-浓度的增大有利于NH3的放出
浓氨水 +固体 CaO NH3·H2O +CaO==== NH3↑+Ca(OH)2,CaO的作用:①吸水后放热促进NH3的放出;②增加溶液中的OH-浓度,减小NH3的溶解度 ←浓氨水
←固体CaO
思考:有什么现象?为什么有此现象?
1. 吸收水分,减少溶剂。
2. 增加OH-的浓度。减小NH3的溶解度 。
3. 放出热量,升高温度。
②浓氨水加生石灰法
1.(2019·贵阳高一检测)在实验室里,某学习小组设计了下列制取纯净干燥氨气的方案,简易、可行的方案是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
跟踪强化
1
2
√
(2)NH3是一种污染性气体,为避免污染空气,实验中多余的NH3应如何进行吸收处理?试画出相应装置图。
提示:NH3是有刺激性气味的气体,多余的NH3要吸收掉以避免污染空气。可采用在导管口放一团用水或稀硫酸浸湿的棉花球吸收等方法,但多余气体在尾气吸收时要防止倒吸。常采用的装置有:
2.实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
√
1
2
【补偿训练】
1.下列制备氨水的实验装置中最合理的是( )
【解析】选B。制备氨水不需要干燥氨气,A、C选项错误;D选项,不能防止倒吸,错误。
氨气的物理性质
氨气的用途
氨气的化学性质
铵盐及其性质
氨气的实验室制法
铵根离子的检验
NH4Cl +NaOH==NaCl+NH3↑+H2O
△
无色,有刺激性气味,极易溶于水
1.与水反应
2.与酸反应生成铵盐
3.与氧气反应
铵盐的性质
1.易溶于水
2.受热易分解
3.与碱反应生成氨
铵盐与碱反应的应用
1.NH3的实验室制法
2.铵离子的检验
氨的性质
化学性质
物理性质:
NH3+H2O NH3·H2O NH4+ + OH–
NH3 +HCl =NH4Cl
4 NH3+5O2 4NO+6H2O
△
催化剂
NH4Cl==NH3↑+HCl↑
△
NH4HCO3==NH3↑+H2O↑+CO2↑
△
2NH4Cl+Ca(OH)2 ==CaCl2+2NH3↑+H2O
△
化学性质
铵 盐
氨的制法
总结归纳
习体验分享>>>
学
学习系统化·成果共享化
【课堂回眸】
再见
铵盐
有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?
化学性质
铵 盐
氨的制法
物理性质
总结归纳
习情境导入>>>
学
学习情境化·情境趣味化
抓小偷
提示:在太阳光的照射下,碳酸氢铵受热分解生成NH3、CO2、水蒸气,故固体减少。
铵盐
由铵根离子(NH4+)和酸根离子构成的化合物即铵盐。铵盐一般为无色或白色晶体、都易溶解于水。
⑵铵盐受热易分解
⑴铵盐都易溶于水
铵盐的性质
NH4HCO3 = NH3↑ + CO2↑+ H2O
△
NH4Cl = NH3 ↑ + HCl ↑
△
化学性质
铵 盐
氨的制法
物理性质
总结归纳
NH4HCO3 = NH3↑ + CO2↑+ H2O
△
不是所有的铵盐受热都会放出氨气,
如硝酸铵受热分解为硝酸、氮气和水
知识系统化·系统条理化
加热到300℃左右时:
5NH4NO3=2HNO3+4N2↑+9H2O
相关链接
铵盐受热分解的产物
(1)如果组成铵盐的酸是易挥发或易分解的酸,则固体铵盐受热分解时,氨气与酸一起挥发,冷却时又重新结合成铵盐。如NH4Cl、NH4HCO3等。
(2)如果组成铵盐的酸是难挥发性酸,则固体铵盐受热分解时,只有氨呈气态逸出,而难挥发性酸残留在容器中,如(NH4)2SO4分解的化学方程式为(NH4)2SO4 NH3↑+NH4HSO4或(NH4)2SO4 2NH3↑+H2SO4。
(3)如果组成铵盐的酸是具有强氧化性的酸,则在较低的温度下慢慢分解可得到NH3和相应的酸,如NH4NO3。由于生成的氨气具有还原性,硝酸具有氧化性,生成的NH3易被HNO3氧化,则反应时的温度不同,形成氮的化合物也不同,如将NH4NO3在不同的温度下加热分解分别可得到N2O、NO2、N2O3、N2等。
NH4NO3 + NaOH = NaNO3 +H2O +NH3 ↑
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3 ↑
运用:
*在实验室中,常利用铵盐和强碱反应产生氨这一性质来检验铵根离子的存在和制取氨
反应实质:
NH4++ OH-=NH3↑+H2O
△
△
△
⑶铵盐与碱反应
“三解”:溶解、热解和碱解
NH4+的检验:铵盐与强碱共热产生气体,用石蕊试纸或浓盐酸检验。
NH4NO3 + NaOH = NaNO3 +H2O +NH3 ↑
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3 ↑
运用:
实验室用来制NH3、用于NH4+的检验
反应实质:
NH4++ OH-=NH3↑+H2O
△
△
△
“三解”:溶解、热解和碱解
⑶铵盐与碱反应
应用:
a.实验室用来制NH3
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
b.用于NH4+的检验:
加热时,能与碱液反应产生使湿润的红色石蕊试纸变蓝的气体的物质一定是铵盐
(1)固体铵盐与固体碱之间的反应不写离子方程式;如:实验室制取氨气
(2)铵盐溶液和碱溶液混合后的离子方程式:
(3)铵盐溶液和碱溶液混合并加热有氨气逸出的离子方程式:
NH4++ OH-=NH3·H2O
注意事项:
NH4++ OH-=NH3↑+H2O
△
铵根离子的检验
检验方法:
1、先将其与强碱共热逸出NH3
2、用湿润红色石蕊试纸或浓盐酸检验逸出的氨气
3.NH4+的检验
样品
强碱
△
刺激性气味气体
湿润红色石蕊试纸变蓝
蘸有浓盐酸的玻棒靠近有白烟
NH4+
(2)方法
①NaOH溶液法
取少量固体样品或溶液于试管中,再加入浓的NaOH溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体(或将蘸有浓盐酸的玻璃棒靠近管口,有白烟产生),证明固体样品或溶液中含有NH 。
②碱石灰法
把碱石灰与某物质的固体混合物在研钵里研磨,产生的气体能使湿润的红色石蕊试纸变蓝(或将蘸有浓盐酸的玻璃棒靠近研钵口,有白烟产生),则可以判断该物质是铵盐。
铵盐的用途
大量的铵盐用于生产氮肥
硝酸铵用于制炸药、氯化铵常用作印染
和制干电池的原料,也可以用于金属的焊接,以除去金属表面的氧化物薄膜。
氯化铵的妙用
——防火布
将一块普通的棉布浸在氯化铵的饱和溶液中,片刻之后,取出晾干就成防火布了。将这块经过化学处理的布用火柴点,不但点不着,而且还冒出白色的烟雾。
科学视野
原来,经过这种化学处理的棉布(防火布)的表面附满了氯化铵的晶体颗粒,氯化铵这种物质,它有个怪脾气,就是特别怕热,一遇热就会发生化学变化,分解出两种不能燃烧的气体,一种是氨气,另一种是氯化氢气体。
上一页
下一页
结束
回目录
这两种气体把棉布与空气隔绝起来,棉布在没有氧气的条件下当然就不能燃烧了。当这两种气体保护棉布不被火烧的同时,它们又在空气中相遇,重新化合而成氯化铵小晶体,这些小晶体分布在空气中,就象白烟一样。实际上,氯化铵这种化学物质是很好的防火能手,戏院里的舞台布景、舰艇上的木料等,都经常用氯化铵处理,以求达到防火的目的。
1.下列有关氨气的性质的叙述中正确的是( )
A.氨气不能在空气中燃烧,是因为O2不能将NH3氧化
B.氨气是非电解质,NH3·H2O是电解质
C.氨气和酸相遇都能产生酸雾
D.氨气呈碱性,能使石蕊试纸变蓝
2. 下列不属于铵盐的通性的是( )
A.易溶于水 B.含有NH4+
C.易分解放出氨气 D.能和碱反应生成氨气
3. 下列有关氨及其铵盐的叙述中不正确的是( )
A.铵态氮肥不能和碱性物质混合使用
B.氨气极易溶于水,因此氨水为强碱溶液
C.可用NaOH溶液和红色石蕊试纸检验溶液中的NH4+
D.氨气具有还原性,一定条件下可与有氧化性的O2反应
限时训练(5min)
B
C
B
氨和铵盐
向空气要面包
氨态氮肥
喷泉实验
氨水的热稳定性
铵态氮肥
氨与盐酸
铵盐的性质
硝态氮肥
氨的实验室制法
课堂小结
课后练习
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3与浓盐酸反应产生了NH4Cl固体
B 浓硫酸附近无明显现象 NH3与浓硫酸不发生反应
C 氯化物溶液变浑浊 该溶液一定是AlCl3溶液
D 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 NH3是一种可溶性碱
5. 如右图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是
√
(二)NH3的实验室制法
原理:加热铵盐与碱的固体混合物
如:将固体NH4Cl与Ca(OH)2混合加热,即得到NH3
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
讨论:
NH3如何收集?
如何检验NH3已经收满?剩余的NH3如何处理?
若要制备干燥的NH3 ,可用什么作干燥剂?
目录
实验5-13
重
实验室用加热NH4Cl和Ca(OH)2固体混合物的方法制取氨气,装置如图所示:
请思考下列问题:
1.NH4Cl受热分解也能产生NH3,实验室能否用直接加热NH4Cl的方法制取氨气
2.收集装置中棉花的作用
3.氨气是一种碱性气体,可用那些试剂干燥氨气
5.氨气是一种污染性气体,实验室制取或使用时要有尾气处理装置,你认为应如何吸收氨气
2NH4Cl+Ca(OH)2 = CaCl2+2H2O+2NH3↑
△
4.如何检验氨气
观看实验视频
氨气的实验室制法
NH3的实验室制法
(1)原料:NH4Cl Ca(OH)2
(2)原理:
2NH4Cl+Ca(OH)2==2NH3↑+2H2O+CaCl2
(3)制取装置:
固固加热装置
棉花的作用:
防止空气对流
△
(2)装置:
(4)收集装置: 向下排空气法
(5)检验: a:使湿润的酚酞试纸变红
b:遇浓盐酸产生大量的白烟
(6)尾气处理:用水或稀硫酸浸湿的棉花球吸收NH3
要得到干燥的氨气,常用试剂有哪些?
①CaO、碱石灰等碱性干燥剂
②无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
装置 选择 选择原因
制备 装置 固+固 反应原理
净化 装置 装有碱石灰的干燥管 NH3具有碱性,不与碱石灰反应
不用浓硫酸和无水氯化钙 NH3能被浓硫酸和无水氯化钙吸收
收集 装置 向下排空气法 NH3的密度远小于空气,且常温下不与空气成分反应
不采用排水法 NH3极易溶于水
装置 选择 选择原因
验满 方法 将湿润的红色石蕊试纸置于试管口,试纸变蓝色 氨水显碱性
将蘸有浓盐酸的玻璃棒置于试管口,有白烟产生 氨气遇挥发性酸反应生成固体铵盐小颗粒
尾气 处理 试管口放一团用水或稀硫酸浸湿的棉花球 NH3极易溶于水,与酸反应
【易错提醒】(1)收集装置和反应装置的试管和导管必须是干燥的。
(2)发生装置的试管口略向下倾斜。
(3)由于氨气的密度比空气小,因此收集氨气时,导管口应插入试管的底部。
(4)棉花团上蘸有稀硫酸,既防止空气对流又防止氨气逸出污染空气。
(5)干燥NH3不能用P2O5、浓硫酸等酸性干燥剂,也不能用CaCl2干燥,原因是CaCl2与NH3反应生成CaCl2·8NH3。
【母题追问】(1)干燥氨气时可以使用什么装置?
提示:干燥氨气时使用固体干燥剂,如碱石灰、氢氧化钠固体等,故仪器为干燥管或U形管。
1.制取氨气的发生装置与实验室制取哪种气体的相同?使用该装置需注意什么问题?
提示 与实验室制取氧气的发生装置相同。该套装置在使用时要特别注意加热时要使试管口略低于管底,以防止冷凝水倒流使试管炸裂。
2.在制取氨的实验装置中,使用棉花的作用是什么?
提示 若为干燥的棉花则起到减缓氨气与空气对流的作用;若为蘸有水或稀硫酸的棉花,则还可以吸收多余的NH3。
深度思考
【思考·讨论】
(1)实验室制取氨气时,碱不选用NaOH、KOH,其原因是什么?
提示:消石灰不能用NaOH、KOH代替,原因是NaOH、KOH具有吸湿性,易结块,不利于产生氨气,在加热条件下还会腐蚀试管。
(2)某同学根据铵盐受热分解的性质,认为可以采用加热NH4Cl来制备氨气,你怎么看?
提示:不行。NH4Cl分解得到NH3和HCl,两种气体在试管口遇冷反应又生成NH4Cl,得不到氨气。
特别提示
(1)制取氨时,不能用硝酸铵代替氯化铵。因为硝酸铵在加热过程中可能发生爆炸性的反应,发生危险。
(2)制取氨时,不能用氢氧化钠代替熟石灰。因为氢氧化钠具有吸湿性,易结块,不利于产生NH3,且在加热条件下易腐蚀试管。
(3)氨气是碱性气体,不能用酸性干燥剂(浓硫酸等)干燥,也不能用无水CaCl2干燥,因为它们均能与氨气发生反应,常用碱石灰作干燥剂。
1.原理:2NH4Cl +Ca(OH)2 == NH3↑+CaCl2+2H2O
2.装置:固 + 固 →气体
4.收集:向下排空气法
(棉花:防止空气对流,提高集气的速度和纯度)
5.检验:①用湿润的红色石蕊试纸(变蓝)
②蘸有浓盐酸的玻璃棒靠近瓶口(白烟)
3.干燥:生石灰、碱石灰等碱性干燥剂
1min速记 氨的实验室制法
6.尾气处理:稀硫酸溶液、用水吸收
7.实验室制取氨气常用方法
①加热NH4Cl和Ca(OH)2固体
②加热浓氨水法
③浓氨水加生石灰法
实验室中还可以用
哪些方法快速制氨气:
①加热浓氨水法
浓氨水
NH3·H2O NH3↑+ H2O
氨的实验室制法
化学性质
铵 盐
氨的制法
物理性质
总结归纳
方法 化学方程式(或原理) 气体发生装置
浓氨水 +固体 NaOH NaOH溶于水放热,促使氨水分解,且OH-浓度的增大有利于NH3的放出
浓氨水 +固体 CaO NH3·H2O +CaO==== NH3↑+Ca(OH)2,CaO的作用:①吸水后放热促进NH3的放出;②增加溶液中的OH-浓度,减小NH3的溶解度 ←浓氨水
←固体CaO
思考:有什么现象?为什么有此现象?
1. 吸收水分,减少溶剂。
2. 增加OH-的浓度。减小NH3的溶解度 。
3. 放出热量,升高温度。
②浓氨水加生石灰法
1.(2019·贵阳高一检测)在实验室里,某学习小组设计了下列制取纯净干燥氨气的方案,简易、可行的方案是
A.加热氯化铵固体,再通过碱石灰
B.在氮气和氢气的混合气体中加入铁触媒,并加热至500 ℃,再通过碱石灰
C.加热浓氨水,再通过浓硫酸
D.在生石灰中加入浓氨水,再通过碱石灰
跟踪强化
1
2
√
(2)NH3是一种污染性气体,为避免污染空气,实验中多余的NH3应如何进行吸收处理?试画出相应装置图。
提示:NH3是有刺激性气味的气体,多余的NH3要吸收掉以避免污染空气。可采用在导管口放一团用水或稀硫酸浸湿的棉花球吸收等方法,但多余气体在尾气吸收时要防止倒吸。常采用的装置有:
2.实验室制取少量干燥的氨气涉及下列装置,其中正确的是
A.①是氨气发生装置 B.②是氨气吸收装置
C.③是氨气发生装置 D.④是氨气收集、检验装置
√
1
2
【补偿训练】
1.下列制备氨水的实验装置中最合理的是( )
【解析】选B。制备氨水不需要干燥氨气,A、C选项错误;D选项,不能防止倒吸,错误。
氨气的物理性质
氨气的用途
氨气的化学性质
铵盐及其性质
氨气的实验室制法
铵根离子的检验
NH4Cl +NaOH==NaCl+NH3↑+H2O
△
无色,有刺激性气味,极易溶于水
1.与水反应
2.与酸反应生成铵盐
3.与氧气反应
铵盐的性质
1.易溶于水
2.受热易分解
3.与碱反应生成氨
铵盐与碱反应的应用
1.NH3的实验室制法
2.铵离子的检验
氨的性质
化学性质
物理性质:
NH3+H2O NH3·H2O NH4+ + OH–
NH3 +HCl =NH4Cl
4 NH3+5O2 4NO+6H2O
△
催化剂
NH4Cl==NH3↑+HCl↑
△
NH4HCO3==NH3↑+H2O↑+CO2↑
△
2NH4Cl+Ca(OH)2 ==CaCl2+2NH3↑+H2O
△
化学性质
铵 盐
氨的制法
总结归纳
习体验分享>>>
学
学习系统化·成果共享化
【课堂回眸】
再见
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
