4.2电解原理的应用课件 (共39张PPT)人教版(2019)选择性必修1
文档属性
| 名称 | 4.2电解原理的应用课件 (共39张PPT)人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 07:36:55 | ||
图片预览









文档简介
(共39张PPT)
第四章 第三节
电解原理的应用
学习目标
1、认识电解饱和食盐水、电镀、电解精炼铜、电冶金的原理,会写其电极反应式及总反应式
2.学会电解的有关计算,特别是守恒法的应用。
(2)生成物H2和Cl2混合有什么危险?
(1) Cl2接触NaOH溶液会反应,反应方程式:
Cl2 +2 NaOH =NaCl + NaClO + H2O
混合遇火或强光能反应
使用离子交换膜将池分开
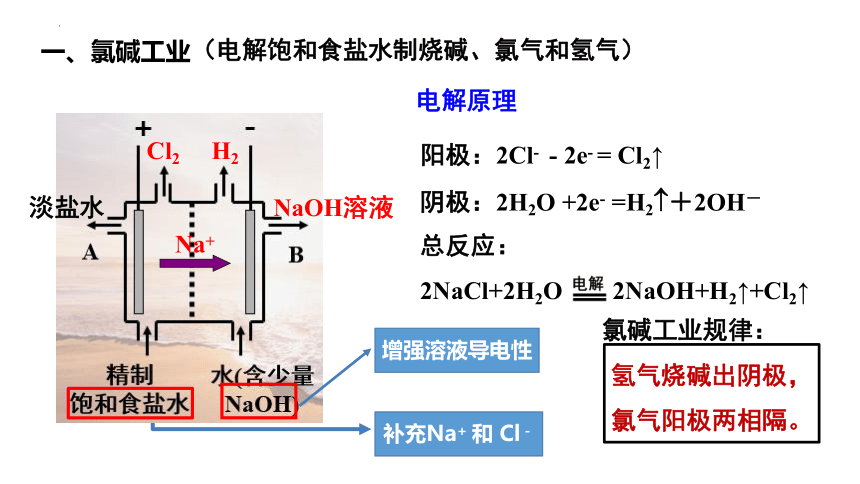
阳极:2Cl- -2e- =Cl2 阴极:2H2O +2e- =H2 +2OH-
总反应:2NaCl+2H2O==Cl2 +H2 +2NaOH
离子反应:2Cl- +2H2O==Cl2 +H2 +2OH-
电解
电解
用惰性电极电解NaCl溶液
(3)如何不让生成物H2和Cl2混合
复习旧知:
电解原理
阳极:2Cl- - 2e- = Cl2↑
阴极:2H2O +2e- =H2 +2OH-
总反应:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(电解饱和食盐水制烧碱、氯气和氢气)
一、氯碱工业
增强溶液导电性
补充Na+ 和 Cl-
氢气烧碱出阴极,
氯气阳极两相隔。
氯碱工业规律:
Cl2 H2
Na+
淡盐水
NaOH溶液
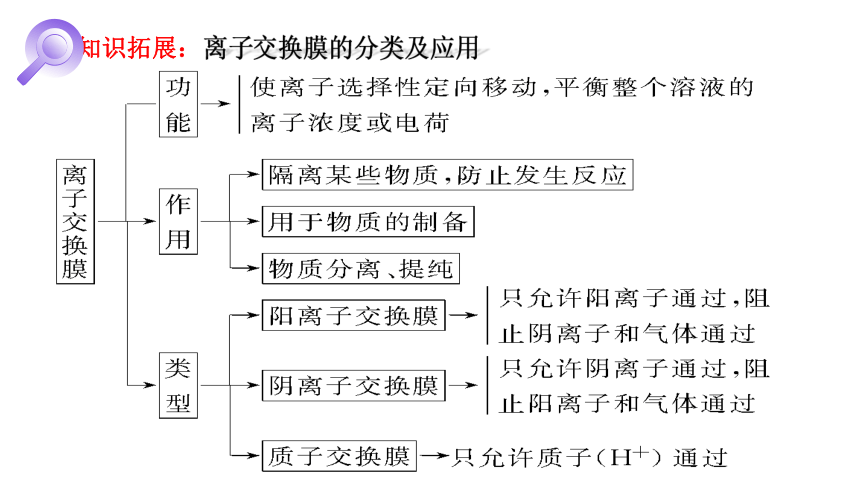
1.生产设备名称:阳离子交换膜电解槽
阳离子交换膜:只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
c、平衡电荷,形成闭合回路;
d、避免Cl-进入阴极区导致制得的NaOH不纯。
2.阳离子交换膜的作用:
a、防止Cl2和H2混合而引起爆炸
b、避免Cl2与NaOH反应生成NaClO影响NaOH的产量。
离子交换膜的分类及应用
知识拓展:
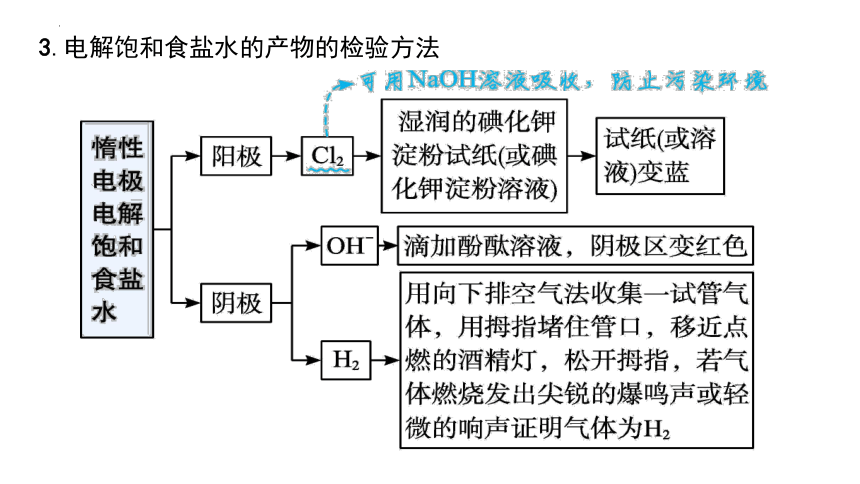
3.电解饱和食盐水的产物的检验方法
奥运金牌是纯银镀金,按照规定,镀金不低于6克;银牌则是百分之百纯银,铜牌中95%-98%的成分为铜,再加上一部分锌。预计6000枚奥运奖牌将会用去超过1吨的黄金和白银。
思考:制作奥运金牌时,如何纯银上镀金?
【导】
请写出阴阳两极的电极反应式:
阳:Cu - 2e— = Cu2+
阴:Cu2+ + 2e— = Cu
①阳极的铜质量减轻;
分析两极、水溶液中的现象:
②阴极的铁增重,表面均匀覆盖一层红色固体物质;
③溶液的颜色始终无变化(原因:Cu2+ 浓度不变)。
1 定义:
利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的过程。
2 目的:
4 特点:
3 电镀材料的选择:
阴极——镀件
电镀液——含有镀层金属离子的溶液
阳极——镀层金属
使金属增强抗腐蚀的能力,增加美观和表面硬度。
阳极本身参加电极反应;电解质溶液的浓度保持不变(电镀液的组成及酸碱性保持不变)。
二、金属电镀
●一增(阴极有镀层金属沉积),一减(阳极有镀层金属溶解),一不变(电镀液浓度),阴、阳质量变化要相等。
●镀层阳极待镀阴,镀层离子溶液跟。我与电解共原理,浓度不变要记得。
电镀规律:
电镀摆件及电镀金杯
电镀车间
三、电解精炼铜
1、含义:
利用电解原理将粗铜中的杂质(如锌、铁、镍、银、金等)除去,以获得电解铜(含Cu的质量分数达99.95%~99.98%)的过程。
2、目的:
制得电解铜,以增强铜的导电性
阳极: Zn-2e-=Zn2+ Fe - 2e- = Fe2+
Ni-2e-=Ni2+ Cu-2e-=Cu2+ Ag、Au
阴极:Cu2++2e-=Cu
阳极:粗铜 (Zn、Fe、Ni、Cu、Ag、Au等)
阴极:纯铜
电解液: CuSO4溶液(或CuCl2)
电解精炼铜后CuSO4溶液的浓度略有减小
阳极泥
3.原理:
阳极泥:阳极上活泼性比铜差的金属不能失电子,而是以单质形式沉积于阳极底部,成为阳极泥,这样就可以提炼金、银等贵重金属。
阳极泥成分判断:活泼性<精炼的金属
略减小
【思考】电解完后,CuSO4溶液的浓度有何变化?
阴极增重与阳极减重相等吗?
不相等
电解精炼规律:“两不等”
电解质溶液浓度在电解前后不相等;
阴极增加的质量和阳极减少的质量不相等。
铜精炼阳极炉车间
镍铁精炼炉
电解精炼铜
1. 金属冶炼的本质:
使矿石中的金属离子获得电子,从它们的化合物中还原出来,电解法用于冶炼活泼金属冶炼钠、钙、镁、铝这些金属
四、电冶金
2NaCl (熔融) 2Na + Cl2↑
MgCl2 (熔融) Mg + Cl2↑
2Al2O3 (熔融) 4Al + 3O2↑
电解
冰晶石
电解是最强有力的氧化还原手段
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)降低Al2O3的熔点
(1)电解法制钠、钾、镁、铝时不能电解含有这些金属阳离子的水溶液。
(2)工业上用电解熔融MgCl2而不是MgO的方法制Mg;用电解熔融Al2O3而不是AlCl3的方法制Al。
(由于AlCl3是共价化合物,无法导电)
2. 注意:
要点阐述
(1)若装置中无外加电源,则该装置可能为原电池,然后根据原电池的构成条件进行分析判断。
(2)若装置中有外加电源,且两电极插入电解质溶液中并构成闭合回路,则该装置为电解池或电镀池,电解质溶液中含有阳极金属离子的即为电镀池,否则为一般电解池。
(3)多池组合(有多个电化学装置直接连接时)判断:
①有外电源:全部为电解池或电镀池、精炼池 。
②无外电源:其中金属活动性相差最大的装置作原电池(自发氧还),其余装置作电解池。
1.原电池、电解池、电镀池的判断方法
①原电池中负极金属活动性强于正极金属活动性。
②电解池的阳极上先放电的阴离子的还原性强于后放电的阴离子的还原性。
③电解池的阴极上先放电的阳离子的氧化性强于后放电的阳离子的氧化性。
(4)根据装置判断金属或阴、阳离子的活动性
要点阐述
电镀铜与精炼铜的比较
电镀铜 精炼铜
能量转变 电能转化为化学能 电能转化为化学能
阳极材料 纯铜 粗铜(含锌、银、金等杂质)
阴极材料 镀件 纯铜
阳极反应 Cu-2e-=Cu2+ Zn-2e-=Zn2+
Cu-2e-=Cu2+等
阴极反应 Cu2++2e-=Cu Cu2++2e-=Cu
电解质溶液 及其变化 硫酸铜溶液 浓度保持不变 反应后硫酸铜溶液中混有Zn2+等,
Cu2+浓度减小
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
应用电解原理将不纯的金属提纯的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:不纯金属;
阴极:纯金属
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
原电池 电解池 电镀池
定义 将化学能转化成电能的装置 将电能转化成化学能的装置 应用电解原理在某些金属表面镀一层其他金属(或合金)的装置
装置举例
形成条件 ①活泼性不同的两电极; ②电解质溶液(电极插入其中,并能与电极发生自发的氧化还原反应);③形成闭合回路 ①两电极接直流电源; ②两电极插入电解质溶液中;③形成闭合回路 ①镀层金属接电源正极,待镀金属接电源负极;
②电镀液必须含有镀层金属的离子(电镀过程浓度不变)
电极名称 负极:氧化反应,金属或氢气等还原性物质失电子; 正极:发生还原反应,溶液中阳离子或氧气等氧化学物质得电子 阳极:发生氧化反应,溶液中的阴离子或金属电极失电子; 阴极:发生还原反应,溶液中的阳离子得电子 阳极:金属失电子;
阴极:电镀液中镀层金属阳离子得电子(水电离产生的H+及OH-一般不放电)
电子流向
原电池 电解池 电镀池
带电离子移动移动方向 阳离子→正极 阴离子→负极 阳离子→阴极 阴离子→阳极 阳离子→阴极
阴离子→阳极
是否自发 自发 非自发 非自发
主要应用 ①金属电化学腐蚀 ②制造化学电源 ①氯碱工业 ②电冶金 ③电解精炼铜 ④电镀 镀铜/银/镍/金
1、三个计算原则
(1)阳极失去的电子数等于阴极得到的电子数。
(2)串联电池中各电极上转移的电子数目相等。
(3)电源输出的电子总数和电解池中各电极上转移的电子数目相等。
五、电化学的有关计算
2、三种常见计算方法
如以通过为桥梁可构建如下关系式:
3.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为____________________________________。
原电池
CH3OH-6e-+8OH-=== +6H2O
解析 甲池为原电池,通入CH3OH的电极为负极,电极反应式为CH3OH-6e-+8OH-=== +6H2O。
(2)乙池中A(石墨)电极的名称为______(填“正极”“负极”“阴极”或“阳极”),总反应式为_______________________________________。
阳极
4AgNO3+2H2O 4Ag+O2↑+4HNO3
解析 乙池中电解AgNO3溶液,其中C作阳极,Ag作阴极,总反应式为4AgNO3+2H2O 4Ag+O2↑+4HNO3。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为_____mL(标准状况下),丙池中____极析出______g铜。
280
D
1.60
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将______(填“增大”“减小”或“不变”);丙中溶液的pH将______(填“增大”“减小”或“不变”)。
减小
增大
例.三室式电渗析法处理含Na2SO4废水的原理如图,采用惰性电极,ab、cd均为离子交换膜,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
思考:离子交换膜作用?
1.特定离子的回收再利用
2.分离两种物质
如果将膜去掉会有什么影响?
(1)B口和C口产物分别是什么?
(2)A口产物和D口产物分别是什么?
(3) 如何得到的A、D两口的产物?
【拓展延伸】
双离子交换
考点
电极
溶液
外电路
电极判断、电极反应书写、产物
离子移动、pH变化、浓度变化
电流方向、电子移动、电子数目
离子交换膜
分离
提纯
制备
防止副反应
如何完成有离子交换膜的电解应用题的解答?
定电极
析溶液
膜类型
出产物
【归纳总结】
电解原理应用的易错易混点:
(1)电镀时,阳极(镀层金属)失去电子的数目跟阴极镀层金属离子得到电子的数目相等,因此电镀液的浓度保持不变。精炼铜时由于阳极发生多个反应,阴极增重质量不等于阳极减少的质量,并且溶液中c(Cu2+)减小。
教材阅读 想一想自学教材“2. 电镀”。
思考:电镀铜和电解精炼铜时所用的电解质溶液中都含有Cu2+,通电一段时间后,电解质溶液中的c(Cu2+)分别如何变化
提示 电镀铜时,c(Cu2+)不变;而电解精炼铜时,c(Cu2+)减小。
(1)在镀件上电镀铜时,也可以用惰性材料作阳极,用硫酸铜溶液作电解液( )
(2)电解饱和食盐水时,两个电极均不能用金属材料( )
(3)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变( )
(4)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3( )
(5)电解精炼时,阳极泥可以作为提炼贵重金属的原料( )
(6)用Zn作阳极,Fe作阴极,ZnCl2作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌( )
√
×
×
×
√
×
1、工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4。电解时应以 作阴极,电解过程中阴极附近溶液pH将会 ,
阳极反应式为 ,总电解反应式为 。
Fe
增大
MnO42-→MnO4- + e-
2K2MnO4+2H2O === 2KMnO4+2KOH+H2↑
通电
课堂巩固
课堂巩固
2.某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
(1)通入氢气的电极为________(填“正极”或“负极”),负极的电极反应式为: 。
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜
溶液浓度将________(填“增大”“减小”或“不变”)。
负极
H2-2e-+2OH-===2H2O
减小
3.将含有0.4 mol CuSO4和0.2 mol NaCl的水溶液1 L,用惰性电极
电解一段时间后,在一个电极上得到0.3 mol Cu,另一个电极上
析出气体在标准状况下的体积为( )
A.4.48 L B.5.6 L
C.6.72 L D.13.44 L
课堂巩固
4.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D
课堂巩固
5.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字会出现红色字迹。则下列叙述正确的是( )
铂片 滤纸 铅笔
祝你成功
a
b
直流电源
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
D
第四章 第三节
电解原理的应用
学习目标
1、认识电解饱和食盐水、电镀、电解精炼铜、电冶金的原理,会写其电极反应式及总反应式
2.学会电解的有关计算,特别是守恒法的应用。
(2)生成物H2和Cl2混合有什么危险?
(1) Cl2接触NaOH溶液会反应,反应方程式:
Cl2 +2 NaOH =NaCl + NaClO + H2O
混合遇火或强光能反应
使用离子交换膜将池分开
阳极:2Cl- -2e- =Cl2 阴极:2H2O +2e- =H2 +2OH-
总反应:2NaCl+2H2O==Cl2 +H2 +2NaOH
离子反应:2Cl- +2H2O==Cl2 +H2 +2OH-
电解
电解
用惰性电极电解NaCl溶液
(3)如何不让生成物H2和Cl2混合
复习旧知:
电解原理
阳极:2Cl- - 2e- = Cl2↑
阴极:2H2O +2e- =H2 +2OH-
总反应:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
(电解饱和食盐水制烧碱、氯气和氢气)
一、氯碱工业
增强溶液导电性
补充Na+ 和 Cl-
氢气烧碱出阴极,
氯气阳极两相隔。
氯碱工业规律:
Cl2 H2
Na+
淡盐水
NaOH溶液
1.生产设备名称:阳离子交换膜电解槽
阳离子交换膜:只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
c、平衡电荷,形成闭合回路;
d、避免Cl-进入阴极区导致制得的NaOH不纯。
2.阳离子交换膜的作用:
a、防止Cl2和H2混合而引起爆炸
b、避免Cl2与NaOH反应生成NaClO影响NaOH的产量。
离子交换膜的分类及应用
知识拓展:
3.电解饱和食盐水的产物的检验方法
奥运金牌是纯银镀金,按照规定,镀金不低于6克;银牌则是百分之百纯银,铜牌中95%-98%的成分为铜,再加上一部分锌。预计6000枚奥运奖牌将会用去超过1吨的黄金和白银。
思考:制作奥运金牌时,如何纯银上镀金?
【导】
请写出阴阳两极的电极反应式:
阳:Cu - 2e— = Cu2+
阴:Cu2+ + 2e— = Cu
①阳极的铜质量减轻;
分析两极、水溶液中的现象:
②阴极的铁增重,表面均匀覆盖一层红色固体物质;
③溶液的颜色始终无变化(原因:Cu2+ 浓度不变)。
1 定义:
利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的过程。
2 目的:
4 特点:
3 电镀材料的选择:
阴极——镀件
电镀液——含有镀层金属离子的溶液
阳极——镀层金属
使金属增强抗腐蚀的能力,增加美观和表面硬度。
阳极本身参加电极反应;电解质溶液的浓度保持不变(电镀液的组成及酸碱性保持不变)。
二、金属电镀
●一增(阴极有镀层金属沉积),一减(阳极有镀层金属溶解),一不变(电镀液浓度),阴、阳质量变化要相等。
●镀层阳极待镀阴,镀层离子溶液跟。我与电解共原理,浓度不变要记得。
电镀规律:
电镀摆件及电镀金杯
电镀车间
三、电解精炼铜
1、含义:
利用电解原理将粗铜中的杂质(如锌、铁、镍、银、金等)除去,以获得电解铜(含Cu的质量分数达99.95%~99.98%)的过程。
2、目的:
制得电解铜,以增强铜的导电性
阳极: Zn-2e-=Zn2+ Fe - 2e- = Fe2+
Ni-2e-=Ni2+ Cu-2e-=Cu2+ Ag、Au
阴极:Cu2++2e-=Cu
阳极:粗铜 (Zn、Fe、Ni、Cu、Ag、Au等)
阴极:纯铜
电解液: CuSO4溶液(或CuCl2)
电解精炼铜后CuSO4溶液的浓度略有减小
阳极泥
3.原理:
阳极泥:阳极上活泼性比铜差的金属不能失电子,而是以单质形式沉积于阳极底部,成为阳极泥,这样就可以提炼金、银等贵重金属。
阳极泥成分判断:活泼性<精炼的金属
略减小
【思考】电解完后,CuSO4溶液的浓度有何变化?
阴极增重与阳极减重相等吗?
不相等
电解精炼规律:“两不等”
电解质溶液浓度在电解前后不相等;
阴极增加的质量和阳极减少的质量不相等。
铜精炼阳极炉车间
镍铁精炼炉
电解精炼铜
1. 金属冶炼的本质:
使矿石中的金属离子获得电子,从它们的化合物中还原出来,电解法用于冶炼活泼金属冶炼钠、钙、镁、铝这些金属
四、电冶金
2NaCl (熔融) 2Na + Cl2↑
MgCl2 (熔融) Mg + Cl2↑
2Al2O3 (熔融) 4Al + 3O2↑
电解
冰晶石
电解是最强有力的氧化还原手段
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)降低Al2O3的熔点
(1)电解法制钠、钾、镁、铝时不能电解含有这些金属阳离子的水溶液。
(2)工业上用电解熔融MgCl2而不是MgO的方法制Mg;用电解熔融Al2O3而不是AlCl3的方法制Al。
(由于AlCl3是共价化合物,无法导电)
2. 注意:
要点阐述
(1)若装置中无外加电源,则该装置可能为原电池,然后根据原电池的构成条件进行分析判断。
(2)若装置中有外加电源,且两电极插入电解质溶液中并构成闭合回路,则该装置为电解池或电镀池,电解质溶液中含有阳极金属离子的即为电镀池,否则为一般电解池。
(3)多池组合(有多个电化学装置直接连接时)判断:
①有外电源:全部为电解池或电镀池、精炼池 。
②无外电源:其中金属活动性相差最大的装置作原电池(自发氧还),其余装置作电解池。
1.原电池、电解池、电镀池的判断方法
①原电池中负极金属活动性强于正极金属活动性。
②电解池的阳极上先放电的阴离子的还原性强于后放电的阴离子的还原性。
③电解池的阴极上先放电的阳离子的氧化性强于后放电的阳离子的氧化性。
(4)根据装置判断金属或阴、阳离子的活动性
要点阐述
电镀铜与精炼铜的比较
电镀铜 精炼铜
能量转变 电能转化为化学能 电能转化为化学能
阳极材料 纯铜 粗铜(含锌、银、金等杂质)
阴极材料 镀件 纯铜
阳极反应 Cu-2e-=Cu2+ Zn-2e-=Zn2+
Cu-2e-=Cu2+等
阴极反应 Cu2++2e-=Cu Cu2++2e-=Cu
电解质溶液 及其变化 硫酸铜溶液 浓度保持不变 反应后硫酸铜溶液中混有Zn2+等,
Cu2+浓度减小
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
应用电解原理将不纯的金属提纯的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:不纯金属;
阴极:纯金属
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
原电池 电解池 电镀池
定义 将化学能转化成电能的装置 将电能转化成化学能的装置 应用电解原理在某些金属表面镀一层其他金属(或合金)的装置
装置举例
形成条件 ①活泼性不同的两电极; ②电解质溶液(电极插入其中,并能与电极发生自发的氧化还原反应);③形成闭合回路 ①两电极接直流电源; ②两电极插入电解质溶液中;③形成闭合回路 ①镀层金属接电源正极,待镀金属接电源负极;
②电镀液必须含有镀层金属的离子(电镀过程浓度不变)
电极名称 负极:氧化反应,金属或氢气等还原性物质失电子; 正极:发生还原反应,溶液中阳离子或氧气等氧化学物质得电子 阳极:发生氧化反应,溶液中的阴离子或金属电极失电子; 阴极:发生还原反应,溶液中的阳离子得电子 阳极:金属失电子;
阴极:电镀液中镀层金属阳离子得电子(水电离产生的H+及OH-一般不放电)
电子流向
原电池 电解池 电镀池
带电离子移动移动方向 阳离子→正极 阴离子→负极 阳离子→阴极 阴离子→阳极 阳离子→阴极
阴离子→阳极
是否自发 自发 非自发 非自发
主要应用 ①金属电化学腐蚀 ②制造化学电源 ①氯碱工业 ②电冶金 ③电解精炼铜 ④电镀 镀铜/银/镍/金
1、三个计算原则
(1)阳极失去的电子数等于阴极得到的电子数。
(2)串联电池中各电极上转移的电子数目相等。
(3)电源输出的电子总数和电解池中各电极上转移的电子数目相等。
五、电化学的有关计算
2、三种常见计算方法
如以通过为桥梁可构建如下关系式:
3.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。
请回答下列问题:
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为____________________________________。
原电池
CH3OH-6e-+8OH-=== +6H2O
解析 甲池为原电池,通入CH3OH的电极为负极,电极反应式为CH3OH-6e-+8OH-=== +6H2O。
(2)乙池中A(石墨)电极的名称为______(填“正极”“负极”“阴极”或“阳极”),总反应式为_______________________________________。
阳极
4AgNO3+2H2O 4Ag+O2↑+4HNO3
解析 乙池中电解AgNO3溶液,其中C作阳极,Ag作阴极,总反应式为4AgNO3+2H2O 4Ag+O2↑+4HNO3。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为_____mL(标准状况下),丙池中____极析出______g铜。
280
D
1.60
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将______(填“增大”“减小”或“不变”);丙中溶液的pH将______(填“增大”“减小”或“不变”)。
减小
增大
例.三室式电渗析法处理含Na2SO4废水的原理如图,采用惰性电极,ab、cd均为离子交换膜,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
思考:离子交换膜作用?
1.特定离子的回收再利用
2.分离两种物质
如果将膜去掉会有什么影响?
(1)B口和C口产物分别是什么?
(2)A口产物和D口产物分别是什么?
(3) 如何得到的A、D两口的产物?
【拓展延伸】
双离子交换
考点
电极
溶液
外电路
电极判断、电极反应书写、产物
离子移动、pH变化、浓度变化
电流方向、电子移动、电子数目
离子交换膜
分离
提纯
制备
防止副反应
如何完成有离子交换膜的电解应用题的解答?
定电极
析溶液
膜类型
出产物
【归纳总结】
电解原理应用的易错易混点:
(1)电镀时,阳极(镀层金属)失去电子的数目跟阴极镀层金属离子得到电子的数目相等,因此电镀液的浓度保持不变。精炼铜时由于阳极发生多个反应,阴极增重质量不等于阳极减少的质量,并且溶液中c(Cu2+)减小。
教材阅读 想一想自学教材“2. 电镀”。
思考:电镀铜和电解精炼铜时所用的电解质溶液中都含有Cu2+,通电一段时间后,电解质溶液中的c(Cu2+)分别如何变化
提示 电镀铜时,c(Cu2+)不变;而电解精炼铜时,c(Cu2+)减小。
(1)在镀件上电镀铜时,也可以用惰性材料作阳极,用硫酸铜溶液作电解液( )
(2)电解饱和食盐水时,两个电极均不能用金属材料( )
(3)电镀铜和电解精炼铜时,电解质溶液中c(Cu2+)均保持不变( )
(4)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3( )
(5)电解精炼时,阳极泥可以作为提炼贵重金属的原料( )
(6)用Zn作阳极,Fe作阴极,ZnCl2作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌( )
√
×
×
×
√
×
1、工业上采用Fe、C为电极电解K2MnO4溶液制KMnO4。电解时应以 作阴极,电解过程中阴极附近溶液pH将会 ,
阳极反应式为 ,总电解反应式为 。
Fe
增大
MnO42-→MnO4- + e-
2K2MnO4+2H2O === 2KMnO4+2KOH+H2↑
通电
课堂巩固
课堂巩固
2.某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
(1)通入氢气的电极为________(填“正极”或“负极”),负极的电极反应式为: 。
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜
溶液浓度将________(填“增大”“减小”或“不变”)。
负极
H2-2e-+2OH-===2H2O
减小
3.将含有0.4 mol CuSO4和0.2 mol NaCl的水溶液1 L,用惰性电极
电解一段时间后,在一个电极上得到0.3 mol Cu,另一个电极上
析出气体在标准状况下的体积为( )
A.4.48 L B.5.6 L
C.6.72 L D.13.44 L
课堂巩固
4.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D
课堂巩固
5.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字会出现红色字迹。则下列叙述正确的是( )
铂片 滤纸 铅笔
祝你成功
a
b
直流电源
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
D
