6.2.1化学反应的速率 课件(共14张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.2.1化学反应的速率 课件(共14张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 150.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 10:33:51 | ||
图片预览






文档简介
(共14张PPT)
化学反应的速率
准备:必修二、作业本、导学案6.2.1
今天作业:导学案6.2.1(P3-4)、作业本P54
周末作业:纠错、整理
思考
如何观察该反应快慢?
1、产生气体的快慢
2、固体大小的变化
3、温度的变化
4、……
小结
定性
定量
化学反应速率是用来衡量化学反应过程进行的快慢的物理量。通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
一、化学反应速率
1.定义
2.计算公式
3.常用单位
mol/(L·min) 或 mol/(L·s) 或mol·L-1·min-1
v (x) = —— = ——
Δc(x)
Δ t
Δ t
Δn(x)
V
——
4.实例
某反应的反应物A浓度在5 min内由6 mol·L-1变成了2 mol·L-1,则v(A)= 。
0.8 mol·L-1·min-1
1、在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0mol/L,在这5s内B的化学反应速率为 。
2、一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余6.8mol,这种反应物的化学反应速率为___________。
0.3mol/(L·S)
0.048mol/(L·min)
【课堂练习】
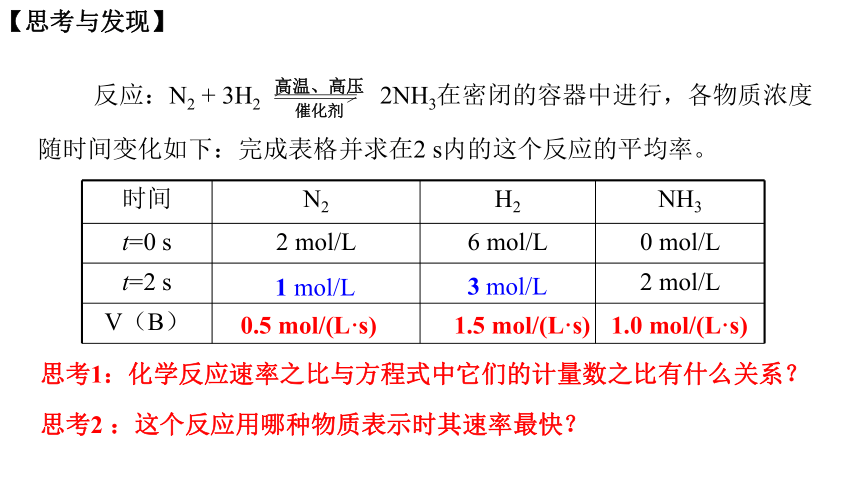
反应:N2 + 3H2 2NH3在密闭的容器中进行,各物质浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均率。
高温、高压
催化剂
时间 N2 H2 NH3
t=0 s 2 mol/L 6 mol/L 0 mol/L
t=2 s 2 mol/L
V(B)
1 mol/L
3 mol/L
0.5 mol/(L·s)
1.5 mol/(L·s)
1.0 mol/(L·s)
思考1:化学反应速率之比与方程式中它们的计量数之比有什么关系?
思考2 :这个反应用哪种物质表示时其速率最快?
【思考与发现】
(1)化学反应速率表示的是一段时间内的平均速率;
(2)不能用固体或纯液体表示速率,因其“浓度”不变;
(3)对于同一反应,反应物和生成物均可表示速率,因此必须带上相应的物质,如v(A)或v(C),且这其中有一个规律:
对于反应aA+bB=cC+dD存在以下等式:
注意
思考
盐酸与Fe或Zn反应,后者更快
根据以下事实,总结化学反应速率的影响因素:
反应物本身性质
将食品置于低温条件下,常常可以保存更长的时间
1mol·L-1盐酸与0.1mol·L-1盐酸与铁反应,前者更快
温度
浓度
思考
工业合成氨气,通常使用高压条件
压强
加酶洗衣粉的去污能力比普通洗衣粉要强的多
催化剂
盐酸与块状/粉末状碳酸钙反应,后者反应更快
固体反应物颗粒大小
根据以下事实,总结化学反应速率的影响因素:
总结
化学反应速率的影响因素:
1.内部因素:反应物本身的性质;
2.外部因素:浓度、温度、压强、催化剂、固体反应物颗粒大小、反应接触面积大小等
其他条件不变时,压强_____,本质是气体浓度_____,从而导致反应速率_____。
气体压强与浓度的关系
增大
增大
资料卡
增大
压强:限于有气体参加的反应,
且以改变浓度为前提!
辨析
对于反应C(s) + H2O(g) = CO(g) + H2(g),以下操作对反应速率有何影响?
①增加C的量
②将容器缩小一半
③保持容积不变,充入N2增大压强
④保持压强不变,充入N2增大容积
⑤保持容积不变,充入水蒸气
⑥升高温度
无影响
增大
无影响
减小
增大
增大
2.向下列四种盐酸溶液中,分别加入等质量的碳酸钙,其中反应速率最大的是( )
A.10 mL、2 mol·L-1 B.20 mL、2 mol·L-1
C.10 mL、4 mol·L-1 D.40 mL、1 mol·L-1
C
1.把下列金属分别投入0.1mol·L-1盐酸中,能发生反应但反应最缓慢的是( )
A.Fe B.Al C.Mg D.Cu
A
当堂检测
3.把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液
B
【课堂练习】
化学反应的速率
准备:必修二、作业本、导学案6.2.1
今天作业:导学案6.2.1(P3-4)、作业本P54
周末作业:纠错、整理
思考
如何观察该反应快慢?
1、产生气体的快慢
2、固体大小的变化
3、温度的变化
4、……
小结
定性
定量
化学反应速率是用来衡量化学反应过程进行的快慢的物理量。通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
一、化学反应速率
1.定义
2.计算公式
3.常用单位
mol/(L·min) 或 mol/(L·s) 或mol·L-1·min-1
v (x) = —— = ——
Δc(x)
Δ t
Δ t
Δn(x)
V
——
4.实例
某反应的反应物A浓度在5 min内由6 mol·L-1变成了2 mol·L-1,则v(A)= 。
0.8 mol·L-1·min-1
1、在某一化学反应中,生成物B的浓度在5s内从0.5mol/L变成2.0mol/L,在这5s内B的化学反应速率为 。
2、一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余6.8mol,这种反应物的化学反应速率为___________。
0.3mol/(L·S)
0.048mol/(L·min)
【课堂练习】
反应:N2 + 3H2 2NH3在密闭的容器中进行,各物质浓度随时间变化如下:完成表格并求在2 s内的这个反应的平均率。
高温、高压
催化剂
时间 N2 H2 NH3
t=0 s 2 mol/L 6 mol/L 0 mol/L
t=2 s 2 mol/L
V(B)
1 mol/L
3 mol/L
0.5 mol/(L·s)
1.5 mol/(L·s)
1.0 mol/(L·s)
思考1:化学反应速率之比与方程式中它们的计量数之比有什么关系?
思考2 :这个反应用哪种物质表示时其速率最快?
【思考与发现】
(1)化学反应速率表示的是一段时间内的平均速率;
(2)不能用固体或纯液体表示速率,因其“浓度”不变;
(3)对于同一反应,反应物和生成物均可表示速率,因此必须带上相应的物质,如v(A)或v(C),且这其中有一个规律:
对于反应aA+bB=cC+dD存在以下等式:
注意
思考
盐酸与Fe或Zn反应,后者更快
根据以下事实,总结化学反应速率的影响因素:
反应物本身性质
将食品置于低温条件下,常常可以保存更长的时间
1mol·L-1盐酸与0.1mol·L-1盐酸与铁反应,前者更快
温度
浓度
思考
工业合成氨气,通常使用高压条件
压强
加酶洗衣粉的去污能力比普通洗衣粉要强的多
催化剂
盐酸与块状/粉末状碳酸钙反应,后者反应更快
固体反应物颗粒大小
根据以下事实,总结化学反应速率的影响因素:
总结
化学反应速率的影响因素:
1.内部因素:反应物本身的性质;
2.外部因素:浓度、温度、压强、催化剂、固体反应物颗粒大小、反应接触面积大小等
其他条件不变时,压强_____,本质是气体浓度_____,从而导致反应速率_____。
气体压强与浓度的关系
增大
增大
资料卡
增大
压强:限于有气体参加的反应,
且以改变浓度为前提!
辨析
对于反应C(s) + H2O(g) = CO(g) + H2(g),以下操作对反应速率有何影响?
①增加C的量
②将容器缩小一半
③保持容积不变,充入N2增大压强
④保持压强不变,充入N2增大容积
⑤保持容积不变,充入水蒸气
⑥升高温度
无影响
增大
无影响
减小
增大
增大
2.向下列四种盐酸溶液中,分别加入等质量的碳酸钙,其中反应速率最大的是( )
A.10 mL、2 mol·L-1 B.20 mL、2 mol·L-1
C.10 mL、4 mol·L-1 D.40 mL、1 mol·L-1
C
1.把下列金属分别投入0.1mol·L-1盐酸中,能发生反应但反应最缓慢的是( )
A.Fe B.Al C.Mg D.Cu
A
当堂检测
3.把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液
B
【课堂练习】
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
