【教师用】化学初高中课程衔接:第八讲——氧化还原反应(课程目标+学海导航+例题解析+强化训练)(无答案)
文档属性
| 名称 | 【教师用】化学初高中课程衔接:第八讲——氧化还原反应(课程目标+学海导航+例题解析+强化训练)(无答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 76.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-08-21 10:07:07 | ||
图片预览


文档简介
第八讲 氧化还原反应
课程目标
1、了解氧化反应、还原反应、氧化还原反应、被氧化、被还原、氧化剂、还原剂、氧化产物、还原产物等基本概念;
2、从本质上认识氧化还原反应,学会氧化还原反应电子转移的表示方法;
3、理解氧化还原反应中的守恒关系。
1、【温故知新】:初中学过四种基本反应类型是: 、 、
、 。完成下表中的基本反应类型一栏。
2、【新知探究】:
(1)【承上启下】:判断下列反应是否属于四种基本反应类型。请注明反应方程中所有元素的化合价,指出反应物中的变价元素。
①3CO + Fe2O3 2Fe + 3CO2 ②Cl2 + H2O = HClO + HCl
(2)阅读课本有关氧化还原反应的知识,理清以下基本概念。
①氧化还原反应:在反应过程中 的化学反应。
非氧化还原反应:在反应过程中没有元素化合价变化的化学反应。
②氧化剂:在氧化还原反应中, ,称为氧化剂,
具有 性。
还原剂:在氧化还原反应中, ,称为还原剂,
具有 性。
③氧化反应:在氧化还原反应中, 称为氧化反应。
即 剂被氧化,化合价升高,发生氧化反应。
还原反应:在氧化还原反应中, 称为还原反应。
即 剂被还原,化合价降低,发生还原反应。
④氧化产物:在氧化还原反应中, 剂被氧化后的生成物叫做氧化产物。
还原产物:在氧化还原反应中, 剂被还原后的生成物叫做还原产物。
(3)【导练】:判断“温故知新”表格中的反应是否是氧化还原反应,判断氧化剂、还原剂、氧化产物、还原产物。
化学方程式 基本反应类型 是否是氧化还原反应 氧化剂 还原剂 氧化产物 还原产物
S + O2 点燃 SO2
Na2O + H2O = 2NaOH
化学方程式 基本反应类型 是否是氧化还原反应 氧化剂 还原剂 氧化产物 还原产物
2HClO 光照 2HCl + O2↑
CaCO3CaO+CO2↑
C+CuOCu+CO↑
Fe + CuSO4 = Cu + FeSO4
NaOH + HCl = NaCl + H2O
AgNO3+NaCl = AgCl↓+NaNO3
【课堂探究导学】
一、氧化还原反应的特征
【问题组探究一】:1、如何判断一个反应是否是氧化还原反应?
2、化合价升降和氧化剂、还原剂、氧化反应、还原反应、
氧化产物、还原产物的关系如何?
3、四种基本反应类型与氧化还原反应之间有什么关系?
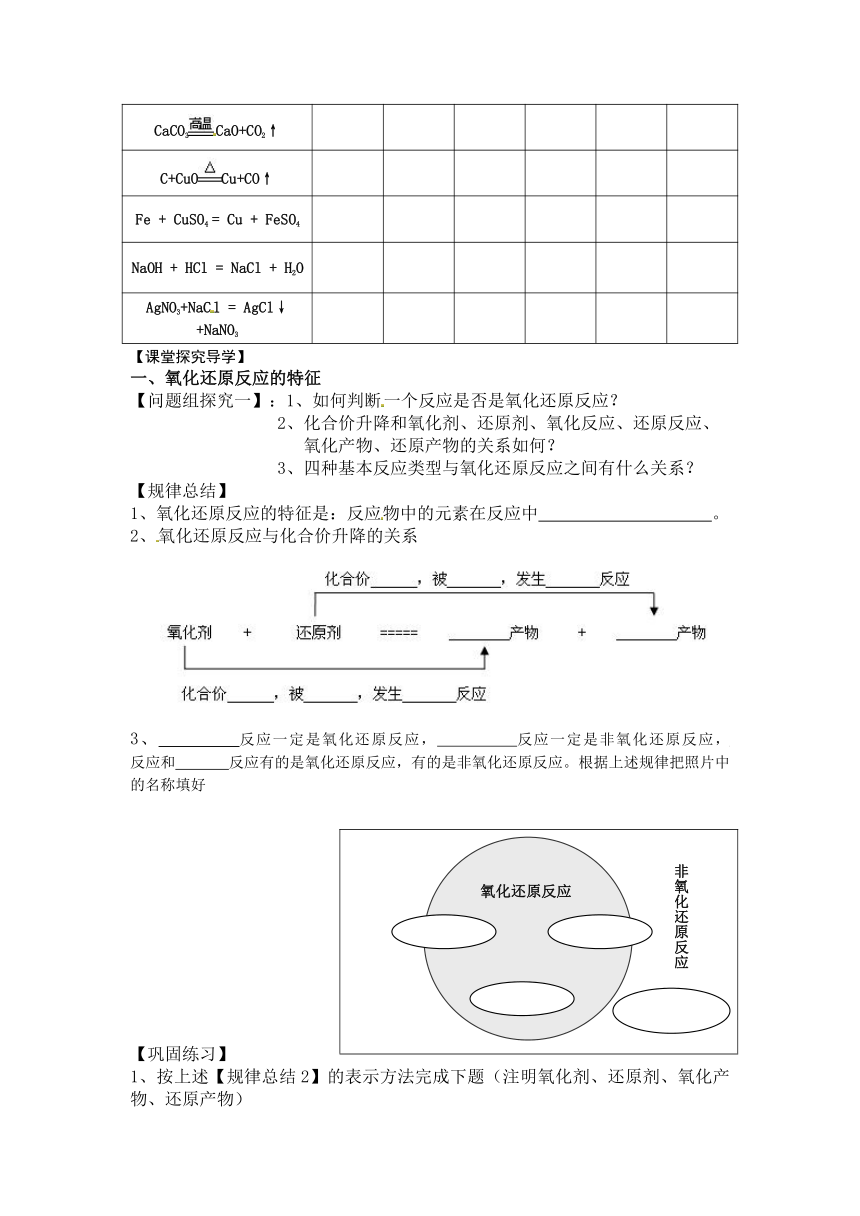
【规律总结】
1、氧化还原反应的特征是:反应物中的元素在反应中 。
2、氧化还原反应与化合价升降的关系
3、 反应一定是氧化还原反应, 反应一定是非氧化还原反应, 反应和 反应有的是氧化还原反应,有的是非氧化还原反应。根据上述规律把照片中的名称填好
【巩固练习】
1、按上述【规律总结2】的表示方法完成下题(注明氧化剂、还原剂、氧化产物、还原产物)
CuO + H2 Cu + H2O
2、对Cl2 + H2O = HClO + HCl反应说法正确的是( )。
A. Cl2既是氧化剂又是还原剂 B. H2O既是氧化剂又是还原剂
C. Cl2是氧化剂, H2O是还原剂 D. Cl2是还原剂, H2O是氧化剂
二、氧化还原反应的实质
【问题组探究二】从原子结构角度探究氧化还原反应的实质
1、写出钠在氯气中燃烧的方程式,注明化合价变化,这个反应是氧化还原反应吗?
【实验探究】从实验角度探究氧化还原反应的实质
实验:将铁钉放入硫酸铜溶液中,观察现象。写出该反应的化学方程式,判断该反应是否是氧化还原反应。
【规律总结】氧化还原反应的实质: 。
氧化剂→ 电子→化合价降低
还原剂→ 电子→化合价升高
【思考】判断下列说法的正误,错误的指明原因。
①金属单质在反应中只能作还原剂,非金属单质只能作氧化剂
②失电子多的金属还原性强
③在氧化还原反应中一种元素被氧化,一定有另一种元素被还原
三、氧化还原反应电子转移的表示方法
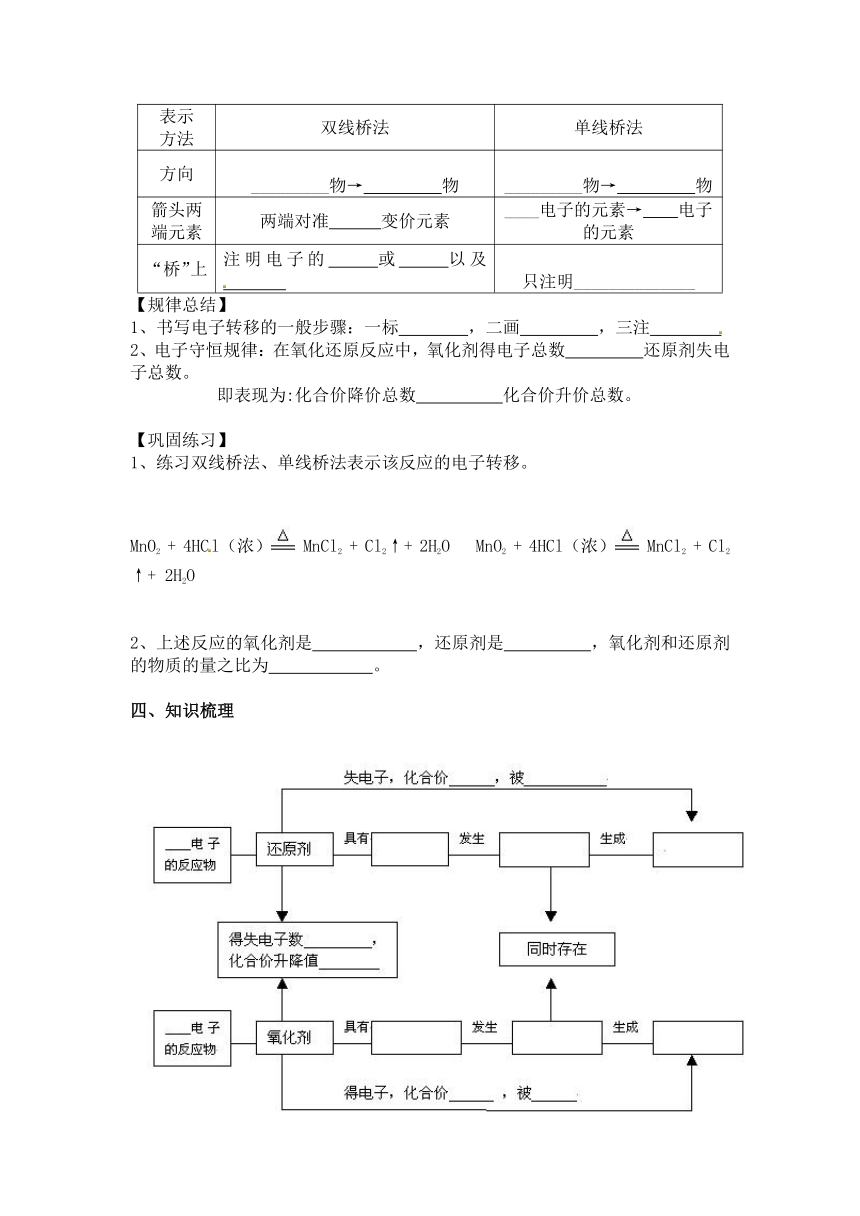
【比较归纳】对比表示电子转移的两种方法,归纳总结这两种方法的特点有何不同。
表示方法 双线桥法 单线桥法
方向 _________物→ 物 _________物→ 物
箭头两端元素 两端对准 变价元素 ____电子的元素→ 电子的元素
“桥”上 注明电子的 或 以及 只注明______________
【规律总结】
1、书写电子转移的一般步骤:一标 ,二画 ,三注
2、电子守恒规律:在氧化还原反应中,氧化剂得电子总数 还原剂失电子总数。
即表现为:化合价降价总数 化合价升价总数。
【巩固练习】
1、练习双线桥法、单线桥法表示该反应的电子转移。
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
2、上述反应的氧化剂是 ,还原剂是 ,氧化剂和还原剂的物质的量之比为 。
四、知识梳理
【知识运用导练】
【基础巩固】
1、(氧化还原反应与基本反应类型的关系)下列反应一定属于氧化还原反应的是
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
2、(氧化还原反应的特征)下列说法中,完全正确的是
A、有氧元素参加的反应一定是氧化还原反应
B、没有氧元素参加的反应一定不是氧化还原反应
C、有单质生成的分解反应一定是氧化还原反应
D、复分解反应不一定是氧化还原反应
3、(氧化还原反应的特征)元素在化学反应中由化合态变为游离态,则该元素
A、一定被氧化了
B、一定被还原了
C、即可能被氧化,也可能被还原
D、即不可能被氧化,也不可能被还原
4、(氧化性和还原性)下列Cl2既表现氧化性又表现还原性的反应是( )
A、Cl2 + 2NaOH = NaCl +NaClO +H2O
B、2HClO 光照 2HCl + O2↑
C、Cl2 + Cu 点燃 CuCl2
D、MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
5、(氧化产物和还原产物)在反应2KMnO4 K2MnO4 + MnO2 + O2↑中,还原产物是( )
A、K2MnO4 B、MnO2 C、O2 D、KMnO4
6、(氧化还原反应的实质)氧化还原反应的实质是:( )
A.元素化合价发生变化
B.反应中有氧原子的得失
C.反应中有电子得失或电子对的偏移
D.反应后生成新的物质
7、(氧化还原反应的基本概念)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原,氧化产物是 ,还原产物是 。此反应中,HCl表现的性质有 性和 性。
8、(氧化还原反应电子转移的表示方法)用单线桥法和双线桥法标出电子转移的方向和数目。
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
5NH4NO3 4N2↑+ 9H2O + 2HNO3
2H2S+SO2 = 3S + 2H2O
【能力提升】
1、下列微粒既有氧化性又有还原性的是:( )
A.H+ B.Fe2+ C.Cu2+ D.Al
2、在一定条件下发生如下反应:2KClO3+I2=2KIO3+Cl2↑,则下列推断正确的是 ( )
A、该反应中还原剂为KClO3
B、I2发生氧化反应
C、Cl2是氧化产物
D、该反应属于置换反应
3、氢化钠是一种生氢剂,可发生如下反应:NaH + H2O = NaOH + H2↑对这一反应的描述正确的是( )
A、NaH是氧化剂 B、NaOH是氧化产物
C、NaOH是还原产物 D、氧化产物和还原产物的质量比是1:1
4、下列过程中,需加入氧化剂的是( )
A、HCl →H2 B、H20→02 C、H2SO4(浓)→SO2 D、Fe→Fe3O4
5、苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,这说明维生素C具有( )
A、氧化性 B、还原性 C、碱性 D、酸性
一、选择题(每小题有1——2个正确答案)
1、对于氧化还原反应,下列说法正确的是( )
A、氧化剂发生氧化反应 B、还原剂发生还原反应
C、还原剂失电子被氧化 D、氧化剂得电子被氧化
2、下列属于氧化还原反应的是( )
A、CaCO3 == CaO + CO2 B、3Cu+8HNO3==3Cu(NO3)2+2NO+4H2O
C、NaCO3+2HCl==2NaCl+H2O+CO2 D、Fe+CuSO4==Cu+FeSO4
3、单质X和Y相互反应生成X、Y,现有下列叙述:(1)X被氧化,(2)X是氧化剂,(3)X是有氧化性,(4)Y2-是还原产物,(5)Y2-具有还原性,(6)X2+具有氧化性,(7)Y的氧化性比X2+的氧化性强,其中正确的是( ) A、 (1)(2)(3)(4) B、(2)(3)(4) C、(1)(4)(5)(6)(7) D、(1)(3)(4)(5)
4、若实现下列变化,需加入氧化剂的有( )
A、Na NaCl B、P2O5 H3PO4 C、H2SO4 H2 D、KClO3 O2
5、下列反应中,氯气只表现氧化性的有( )
A、H2+Cl2====2HCl B、Cl2+H2O====HCl+HClO
C、2HClO====2HCl+O2 D、2KBr+Cl2====2KCl+Br2
6、下列物质通常情况下能作氧化剂的是( )
A、H2 B、O2 C、I- D、HCl
7、实验室用MnO2+4HCl==MnCl2+Cl2+H2O反应制取Cl2,二氧化锰是( )
A、催化剂 B、氧化剂 C、还原剂 D、既是氧化剂又是还原剂
8、下列物质放在空气中,会因发生氧化还原反应而变化的是( )
A、烧碱 B、白磷 C、生石灰 D、浓盐酸
9、在反应中3Cl2+6NaOH===KClO3+5KCl+3H2O中,氧化剂和还原剂的质量比( )
A、1:1 B、5:1 C、3:1 D、1:5
10、化学反应:(1)6Fe+3Br2==4FeCl3+2FeBr3 (2)2KBr+Cl2==2KCl+Br2
(3)2KI+2FeCl3==2KCl+I2+2FeCl2中氧化性比较正确的是( )
A、Cl2>Br2>FeCl2 B、Br2>I2>FeCl3 C、Br2>FeCl3>I2 D、Cl2>FeCl3>Br2
11、离子反应式M2O7X-与S2-能在酸性溶液中发生如下反应:aM2O7X-+bS2-+cH+==dM3++eS+fH2O若b=3,d=2,则M2O7X-中M的化合价( )A、+2 B、+3 C、+4 D、+6
12、铜和足量的浓硫酸共热反应,若反应中有3.2g的铜被氧化,则被还原的硫酸的质量为( )[Cu+2H2SO4==CuSO4+SO2+2H2O]A、9.8g B、4.9g C 、14.7g D、12.25g
13、对于反应CaH2+2H2O===Ca(OH)2+2H2,有下列叙述:(a)H2是氧化产物,(b)H2是还原产物;(c)H2O是氧化剂,(d)CaH2中的氢元素既被氧化,也被还原;(e)此反应中的氧化产物和还原产物的物质的量之比是1∶1。上述说法中正确的是( )
( A )(a)(d)(e) ( B )(b)和(d) ( C )只有(a) ( D )(c)和(e)
14、溴化碘(IBr)的化学性质类似卤素,能跟大多数金属、非金属反应生成卤化物,也跟水发生反应:IBr+H2O==HBr+HIO,下列有关IBr性质的叙述中错误的是( )
( A )IBr是共价化合物
( B )在很多反应中IBr是强氧化剂
( C )IBr与水反应时,它既是氧化剂也是还原剂
( D )IBr与NaOH溶液反应生成NaBr和NaIO
15、关于3Cl2+6KOHKClO3+5KCl+3H2O的反应,以下说法正确的是( )
( A )Cl2是氧化剂,KOH是还原剂
( B )被氧化的氯元素的质量为被还原的氯元素质量的5倍
( C )上述反应是氧化-还原反应
( D )KOH既不是氧化剂又不是还原剂
16、在8NH3+3Cl2==N2+6NH4Cl反应中,有21.3克氯气参加了反应,则被氧化的NH3的质量是( )
( A )136克 ( B )102克 ( C )34克 ( D )3.4克
17、不同卤原子之间可以共用电子对,形成卤素互化物,其通式为XX′n(n=1,3,5,7)。这种互化物绝大多数不稳定,易发生水解反应。如果BrFn和水反应时物质的量之比为3:5,生成溴酸、氢氟酸、溴单质和氧气,则下列叙述中正确的是( )
(A)此卤素互化物的分子式为BrF3
(B)此卤素互化物的分子式为BrF5
(C)每摩BrFn完全反应,可生成等物质的量的Br2和O2
(D)BrFn的许多性质类似于卤素单质,有强还原性
二、填空题
18、将铁钉投入硫酸铜溶液中,反应的化学方程式为
铜丝投入氯化汞溶液中,反应的化学方程式
在这两个反应中, 是氧化剂, 是还原剂。根据以上事实判断这三种金属的还原性由强到弱的顺序为
19、实验室用氯酸钾、锌粒、盐酸、二氧化锰制取氢气、氧气和氯气[MnO2+4HCl==MnCl2+Cl2+2H2O]
写出制取氧气和氢气的化学方程式
在制取氧气的反应中二氧化锰作 剂,在制取氯气的反应中二氧化锰作 剂。
在制 的反应中,盐酸作氧化剂;在制 的反应中,盐酸作还原剂。
20、用单线桥与双线桥分别表示出下列反应中电子转移的方向和数目,并指明氧化剂与还原剂
(1)、16HCl + 2KMnO4 ==2KCl + 2MnCl2 + 8H2O + 5Cl2
(2)、3Fe + 2O2 ===== Fe3O4
(3)、KClO3+6HCl===KCl+3Cl2+3HO
(4)、CS2+3O2===CO2+2SO2
(5)、2NaOH+Cl2==NaCl+NaClO+H2O
(6)、H2S+H2SO4(浓)==S+SO2+2H2O
非氧化还原反应
氧化还原反应
高温
光照
点燃
课程目标
1、了解氧化反应、还原反应、氧化还原反应、被氧化、被还原、氧化剂、还原剂、氧化产物、还原产物等基本概念;
2、从本质上认识氧化还原反应,学会氧化还原反应电子转移的表示方法;
3、理解氧化还原反应中的守恒关系。
1、【温故知新】:初中学过四种基本反应类型是: 、 、
、 。完成下表中的基本反应类型一栏。
2、【新知探究】:
(1)【承上启下】:判断下列反应是否属于四种基本反应类型。请注明反应方程中所有元素的化合价,指出反应物中的变价元素。
①3CO + Fe2O3 2Fe + 3CO2 ②Cl2 + H2O = HClO + HCl
(2)阅读课本有关氧化还原反应的知识,理清以下基本概念。
①氧化还原反应:在反应过程中 的化学反应。
非氧化还原反应:在反应过程中没有元素化合价变化的化学反应。
②氧化剂:在氧化还原反应中, ,称为氧化剂,
具有 性。
还原剂:在氧化还原反应中, ,称为还原剂,
具有 性。
③氧化反应:在氧化还原反应中, 称为氧化反应。
即 剂被氧化,化合价升高,发生氧化反应。
还原反应:在氧化还原反应中, 称为还原反应。
即 剂被还原,化合价降低,发生还原反应。
④氧化产物:在氧化还原反应中, 剂被氧化后的生成物叫做氧化产物。
还原产物:在氧化还原反应中, 剂被还原后的生成物叫做还原产物。
(3)【导练】:判断“温故知新”表格中的反应是否是氧化还原反应,判断氧化剂、还原剂、氧化产物、还原产物。
化学方程式 基本反应类型 是否是氧化还原反应 氧化剂 还原剂 氧化产物 还原产物
S + O2 点燃 SO2
Na2O + H2O = 2NaOH
化学方程式 基本反应类型 是否是氧化还原反应 氧化剂 还原剂 氧化产物 还原产物
2HClO 光照 2HCl + O2↑
CaCO3CaO+CO2↑
C+CuOCu+CO↑
Fe + CuSO4 = Cu + FeSO4
NaOH + HCl = NaCl + H2O
AgNO3+NaCl = AgCl↓+NaNO3
【课堂探究导学】
一、氧化还原反应的特征
【问题组探究一】:1、如何判断一个反应是否是氧化还原反应?
2、化合价升降和氧化剂、还原剂、氧化反应、还原反应、
氧化产物、还原产物的关系如何?
3、四种基本反应类型与氧化还原反应之间有什么关系?
【规律总结】
1、氧化还原反应的特征是:反应物中的元素在反应中 。
2、氧化还原反应与化合价升降的关系
3、 反应一定是氧化还原反应, 反应一定是非氧化还原反应, 反应和 反应有的是氧化还原反应,有的是非氧化还原反应。根据上述规律把照片中的名称填好
【巩固练习】
1、按上述【规律总结2】的表示方法完成下题(注明氧化剂、还原剂、氧化产物、还原产物)
CuO + H2 Cu + H2O
2、对Cl2 + H2O = HClO + HCl反应说法正确的是( )。
A. Cl2既是氧化剂又是还原剂 B. H2O既是氧化剂又是还原剂
C. Cl2是氧化剂, H2O是还原剂 D. Cl2是还原剂, H2O是氧化剂
二、氧化还原反应的实质
【问题组探究二】从原子结构角度探究氧化还原反应的实质
1、写出钠在氯气中燃烧的方程式,注明化合价变化,这个反应是氧化还原反应吗?
【实验探究】从实验角度探究氧化还原反应的实质
实验:将铁钉放入硫酸铜溶液中,观察现象。写出该反应的化学方程式,判断该反应是否是氧化还原反应。
【规律总结】氧化还原反应的实质: 。
氧化剂→ 电子→化合价降低
还原剂→ 电子→化合价升高
【思考】判断下列说法的正误,错误的指明原因。
①金属单质在反应中只能作还原剂,非金属单质只能作氧化剂
②失电子多的金属还原性强
③在氧化还原反应中一种元素被氧化,一定有另一种元素被还原
三、氧化还原反应电子转移的表示方法
【比较归纳】对比表示电子转移的两种方法,归纳总结这两种方法的特点有何不同。
表示方法 双线桥法 单线桥法
方向 _________物→ 物 _________物→ 物
箭头两端元素 两端对准 变价元素 ____电子的元素→ 电子的元素
“桥”上 注明电子的 或 以及 只注明______________
【规律总结】
1、书写电子转移的一般步骤:一标 ,二画 ,三注
2、电子守恒规律:在氧化还原反应中,氧化剂得电子总数 还原剂失电子总数。
即表现为:化合价降价总数 化合价升价总数。
【巩固练习】
1、练习双线桥法、单线桥法表示该反应的电子转移。
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
2、上述反应的氧化剂是 ,还原剂是 ,氧化剂和还原剂的物质的量之比为 。
四、知识梳理
【知识运用导练】
【基础巩固】
1、(氧化还原反应与基本反应类型的关系)下列反应一定属于氧化还原反应的是
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
2、(氧化还原反应的特征)下列说法中,完全正确的是
A、有氧元素参加的反应一定是氧化还原反应
B、没有氧元素参加的反应一定不是氧化还原反应
C、有单质生成的分解反应一定是氧化还原反应
D、复分解反应不一定是氧化还原反应
3、(氧化还原反应的特征)元素在化学反应中由化合态变为游离态,则该元素
A、一定被氧化了
B、一定被还原了
C、即可能被氧化,也可能被还原
D、即不可能被氧化,也不可能被还原
4、(氧化性和还原性)下列Cl2既表现氧化性又表现还原性的反应是( )
A、Cl2 + 2NaOH = NaCl +NaClO +H2O
B、2HClO 光照 2HCl + O2↑
C、Cl2 + Cu 点燃 CuCl2
D、MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
5、(氧化产物和还原产物)在反应2KMnO4 K2MnO4 + MnO2 + O2↑中,还原产物是( )
A、K2MnO4 B、MnO2 C、O2 D、KMnO4
6、(氧化还原反应的实质)氧化还原反应的实质是:( )
A.元素化合价发生变化
B.反应中有氧原子的得失
C.反应中有电子得失或电子对的偏移
D.反应后生成新的物质
7、(氧化还原反应的基本概念)在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O的反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原,氧化产物是 ,还原产物是 。此反应中,HCl表现的性质有 性和 性。
8、(氧化还原反应电子转移的表示方法)用单线桥法和双线桥法标出电子转移的方向和数目。
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2
5NH4NO3 4N2↑+ 9H2O + 2HNO3
2H2S+SO2 = 3S + 2H2O
【能力提升】
1、下列微粒既有氧化性又有还原性的是:( )
A.H+ B.Fe2+ C.Cu2+ D.Al
2、在一定条件下发生如下反应:2KClO3+I2=2KIO3+Cl2↑,则下列推断正确的是 ( )
A、该反应中还原剂为KClO3
B、I2发生氧化反应
C、Cl2是氧化产物
D、该反应属于置换反应
3、氢化钠是一种生氢剂,可发生如下反应:NaH + H2O = NaOH + H2↑对这一反应的描述正确的是( )
A、NaH是氧化剂 B、NaOH是氧化产物
C、NaOH是还原产物 D、氧化产物和还原产物的质量比是1:1
4、下列过程中,需加入氧化剂的是( )
A、HCl →H2 B、H20→02 C、H2SO4(浓)→SO2 D、Fe→Fe3O4
5、苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,这说明维生素C具有( )
A、氧化性 B、还原性 C、碱性 D、酸性
一、选择题(每小题有1——2个正确答案)
1、对于氧化还原反应,下列说法正确的是( )
A、氧化剂发生氧化反应 B、还原剂发生还原反应
C、还原剂失电子被氧化 D、氧化剂得电子被氧化
2、下列属于氧化还原反应的是( )
A、CaCO3 == CaO + CO2 B、3Cu+8HNO3==3Cu(NO3)2+2NO+4H2O
C、NaCO3+2HCl==2NaCl+H2O+CO2 D、Fe+CuSO4==Cu+FeSO4
3、单质X和Y相互反应生成X、Y,现有下列叙述:(1)X被氧化,(2)X是氧化剂,(3)X是有氧化性,(4)Y2-是还原产物,(5)Y2-具有还原性,(6)X2+具有氧化性,(7)Y的氧化性比X2+的氧化性强,其中正确的是( ) A、 (1)(2)(3)(4) B、(2)(3)(4) C、(1)(4)(5)(6)(7) D、(1)(3)(4)(5)
4、若实现下列变化,需加入氧化剂的有( )
A、Na NaCl B、P2O5 H3PO4 C、H2SO4 H2 D、KClO3 O2
5、下列反应中,氯气只表现氧化性的有( )
A、H2+Cl2====2HCl B、Cl2+H2O====HCl+HClO
C、2HClO====2HCl+O2 D、2KBr+Cl2====2KCl+Br2
6、下列物质通常情况下能作氧化剂的是( )
A、H2 B、O2 C、I- D、HCl
7、实验室用MnO2+4HCl==MnCl2+Cl2+H2O反应制取Cl2,二氧化锰是( )
A、催化剂 B、氧化剂 C、还原剂 D、既是氧化剂又是还原剂
8、下列物质放在空气中,会因发生氧化还原反应而变化的是( )
A、烧碱 B、白磷 C、生石灰 D、浓盐酸
9、在反应中3Cl2+6NaOH===KClO3+5KCl+3H2O中,氧化剂和还原剂的质量比( )
A、1:1 B、5:1 C、3:1 D、1:5
10、化学反应:(1)6Fe+3Br2==4FeCl3+2FeBr3 (2)2KBr+Cl2==2KCl+Br2
(3)2KI+2FeCl3==2KCl+I2+2FeCl2中氧化性比较正确的是( )
A、Cl2>Br2>FeCl2 B、Br2>I2>FeCl3 C、Br2>FeCl3>I2 D、Cl2>FeCl3>Br2
11、离子反应式M2O7X-与S2-能在酸性溶液中发生如下反应:aM2O7X-+bS2-+cH+==dM3++eS+fH2O若b=3,d=2,则M2O7X-中M的化合价( )A、+2 B、+3 C、+4 D、+6
12、铜和足量的浓硫酸共热反应,若反应中有3.2g的铜被氧化,则被还原的硫酸的质量为( )[Cu+2H2SO4==CuSO4+SO2+2H2O]A、9.8g B、4.9g C 、14.7g D、12.25g
13、对于反应CaH2+2H2O===Ca(OH)2+2H2,有下列叙述:(a)H2是氧化产物,(b)H2是还原产物;(c)H2O是氧化剂,(d)CaH2中的氢元素既被氧化,也被还原;(e)此反应中的氧化产物和还原产物的物质的量之比是1∶1。上述说法中正确的是( )
( A )(a)(d)(e) ( B )(b)和(d) ( C )只有(a) ( D )(c)和(e)
14、溴化碘(IBr)的化学性质类似卤素,能跟大多数金属、非金属反应生成卤化物,也跟水发生反应:IBr+H2O==HBr+HIO,下列有关IBr性质的叙述中错误的是( )
( A )IBr是共价化合物
( B )在很多反应中IBr是强氧化剂
( C )IBr与水反应时,它既是氧化剂也是还原剂
( D )IBr与NaOH溶液反应生成NaBr和NaIO
15、关于3Cl2+6KOHKClO3+5KCl+3H2O的反应,以下说法正确的是( )
( A )Cl2是氧化剂,KOH是还原剂
( B )被氧化的氯元素的质量为被还原的氯元素质量的5倍
( C )上述反应是氧化-还原反应
( D )KOH既不是氧化剂又不是还原剂
16、在8NH3+3Cl2==N2+6NH4Cl反应中,有21.3克氯气参加了反应,则被氧化的NH3的质量是( )
( A )136克 ( B )102克 ( C )34克 ( D )3.4克
17、不同卤原子之间可以共用电子对,形成卤素互化物,其通式为XX′n(n=1,3,5,7)。这种互化物绝大多数不稳定,易发生水解反应。如果BrFn和水反应时物质的量之比为3:5,生成溴酸、氢氟酸、溴单质和氧气,则下列叙述中正确的是( )
(A)此卤素互化物的分子式为BrF3
(B)此卤素互化物的分子式为BrF5
(C)每摩BrFn完全反应,可生成等物质的量的Br2和O2
(D)BrFn的许多性质类似于卤素单质,有强还原性
二、填空题
18、将铁钉投入硫酸铜溶液中,反应的化学方程式为
铜丝投入氯化汞溶液中,反应的化学方程式
在这两个反应中, 是氧化剂, 是还原剂。根据以上事实判断这三种金属的还原性由强到弱的顺序为
19、实验室用氯酸钾、锌粒、盐酸、二氧化锰制取氢气、氧气和氯气[MnO2+4HCl==MnCl2+Cl2+2H2O]
写出制取氧气和氢气的化学方程式
在制取氧气的反应中二氧化锰作 剂,在制取氯气的反应中二氧化锰作 剂。
在制 的反应中,盐酸作氧化剂;在制 的反应中,盐酸作还原剂。
20、用单线桥与双线桥分别表示出下列反应中电子转移的方向和数目,并指明氧化剂与还原剂
(1)、16HCl + 2KMnO4 ==2KCl + 2MnCl2 + 8H2O + 5Cl2
(2)、3Fe + 2O2 ===== Fe3O4
(3)、KClO3+6HCl===KCl+3Cl2+3HO
(4)、CS2+3O2===CO2+2SO2
(5)、2NaOH+Cl2==NaCl+NaClO+H2O
(6)、H2S+H2SO4(浓)==S+SO2+2H2O
非氧化还原反应
氧化还原反应
高温
光照
点燃
同课章节目录
