4.1原电池 随堂检测 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1原电池 随堂检测 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1021.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 11:59:20 | ||
图片预览



文档简介
4.1原电池随堂检测2023-2024学年上学期高二化学人教版(2019)选择性必修1
一、单选题
1.神舟十三号载人飞船刷新了中国载人航天技术的新高度。下列说法正确的是
A.逃逸系统复合材料中的酚醛树脂属于天然高分子材料
B.储能系统的锂离子蓄电池组在放电时将电能转化为化学能
C.计算机系统使用的国产CPU芯片主要成分为SiO2
D.飞船表面结构的铝合金具有高强、高韧的优点
2.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤滴加几滴硫酸铜溶液 ⑥加NaCI溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L的盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
3.氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O、O2+2H2O+4e-=4OH-,下列说法错误的是
A.氢气通入正极,氧气通入负极
B.燃料电池的能量转化率不能达到100%
C.供电时的总反应为:2H2+O2= 2H2O
D.产物为无污染的水,属于环境友好电池
4.燃料电池能量转化效率高、环境污染少,运行质量高。下列物质均可用作燃料电池的燃料,其中能实现碳中和目标的是
A.甲醇 B.天然气 C.氢气 D.一氧化碳
5.以下铜锌原电池工作原理认知模型图中, 不正确的是
A.正负极标注 B.电极反应式
C.电子移动方向 D.H+的移动方向
6.下列叙述不正确的是
A.燃料电池的氧化剂和还原剂不是全部储藏在电池内,而是工作时不断从外界输入
B.可以根据硫酸密度的大小来判断铅蓄电池是否需要充电
C.生铁中含有碳,抗腐蚀能力比纯铁强
D.将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀
7.下列化学用语书写正确的是
A.金属发生电化学腐蚀的正极反应式:
B.溶液中水解的离子方程式:
C.向硫酸铁溶液中滴加碳酸钠溶液:
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:
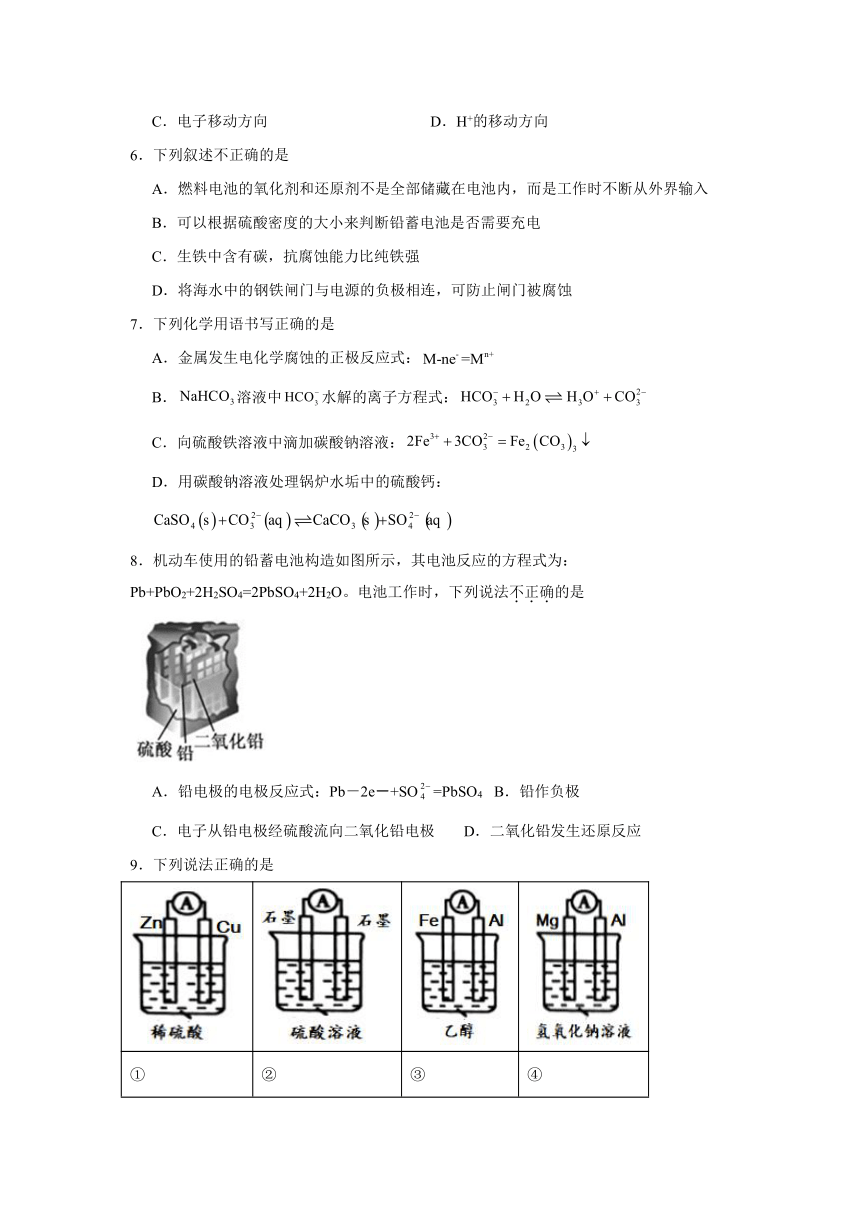
8.机动车使用的铅蓄电池构造如图所示,其电池反应的方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。电池工作时,下列说法不正确的是
A.铅电极的电极反应式:Pb-2e-+SO=PbSO4 B.铅作负极
C.电子从铅电极经硫酸流向二氧化铅电极 D.二氧化铅发生还原反应
9.下列说法正确的是
① ② ③ ④
A.以上四套装置的电流表指针均有偏转
B.装置①中电子由Zn经过电流表流向Cu
C.装置①中H+在Zn表面得电子,变为H2
D.装置④中Mg为负极,发生还原反应
10.将纯锌片和纯铜片按图示方式插入浓度相同的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均增大
D.产生气泡的速度甲比乙快
11.根据如图装置,下列说法正确的是( )
A.锌片表面有大量气泡 B.铜片表面有大量气泡
C.锌片是正极 D.铜片是阴极
12.中国企业比亚迪公司开发的磷酸铁锂刀片电池,具有能量密度大安全性高等特征。下列说法不正确的是
A.该电池工作时将化学能转化为电能
B.该电池工作时负极失电子发生氧化反应
C.该电池工作时电子从负极移向正极
D.该电池的能量转化率可达100%
13.圣路易斯大学研制的新型乙醇燃料电池,用能传递质子()的介质作溶剂,电池总反应为,如图是该电池的示意图,下列说法正确的是
A.b极为电池的负极
B.电池正极的电极反应为:
C.电池工作时电子由b极沿导线经灯泡再到a极
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
14.一种以某固体氧化物为电解质的新型燃料电池,工作原理如图所示。在700~900℃时,O2-可在该固体氧化物电解质中自由移动,产物对环境无污染(设NA为阿伏加德罗常数的值)。下列说法正确的是
A.若A为氢气,则正极反应式为H2-2e-+O2-=H2O
B.若B为氧气,则该电极反应式为O2+4e-+2H2O=4OH-
C.若A为甲烷,则消耗32g甲烷时,外电路中流过的电子数目为16NA
D.若A为肼(N2H4),B为氧气,则电池总反应为N2H4+3O2=2NO2+2H2O
15.用铁片与稀硫酸反应制取氢气时,下列措施能使反应速率加快的是( )
A.降低反应温度 B.用生铁片代替纯铁片
C.延长反应时间 D.用浓硫酸代替稀硫酸
16.图中是利用垃圾假单胞菌株分解有机物的电化学原理图。下列说法不正确的是
A.该过程将化学能转化为电能
B.电子流向:A电极→用电器→B电极
C.A电极上发生氧化反应,电极反应式为:X-2e- =Y+2H+
D.若有机物为葡萄糖(C6H12O6),处理1mol有机物,12molH+透过质子交换膜移动到右室
17.某原电池装置如图所示,该电池工作时,下列说法正确的是
A.氢离子在铜表面被氧化,产生气泡 B.片发生还原反应
C.锌是负极,其质量逐渐减小 D.电子由铜片经导线流向锌片
18.根据实验目的,下列实验及现象、结论都正确的是
选项 实验目的 实验及现象 结论
A 比较金属的活泼性 Mg、Al做电极,NaOH溶液为离子导体构成原电池,Mg电极附近产生气泡 Al为正极
B 探究沉淀的转化 向1mL0.01mol L-1MgCl2溶液中先加入1mL0.05mol L-1NaOH溶液,再逐滴加入0.1mol L-1CuSO4溶液,先出现白色沉淀,后又出现蓝色沉淀 Ksp:Mg(OH)2>Cu(OH)2
C 探究Mg(OH)2溶于铵盐的原理 向Mg(OH)2悬浊液中加入少量NH4Cl固体,溶液变澄清 NH水解产生的H+中和Mg(OH)2溶解平衡产生的OH-,使溶解平衡正向移动
D 比较H2SO3和H2CO3的Ka2 测定浓度均为0.1mol L-1的Na2SO3和Na2CO3溶液的pH值,前者小于后者 Ka2:H2SO3>H2CO3
A.A B.B C.C D.D
19.“定电位”传感器可以用来监测化工厂的氮氧化物气体是否达到排放标准,工作原理如图所示,下列说法正确的是
A.对电极的材料可能为活泼金属锌
B.该方法既能实现完全清除氮氧化物的排放,又能充分利用化学能
C.工作电极上的电极反应式为
D.传感器工作时,电子从工作电极经过放大器后流向对电极
20.碱性锌锰干电池的构造示意图如图所示,电解质为KOH,该电池工作时的总反应为。下列说法中错误的是
A.Zn一端作负极,一端作正极
B.电池工作时,得电子,被还原为
C.理论上每消耗1mol Zn时,一定消耗2mol KOH
D.碱性锌锰电池比普通锌锰电池性能好
21.下列实验操作、现象与结论均正确的是
选项 操作 现象 结论
A 如图,为验证牺牲阳极的阴极保护,向Fe电极附近的溶液中滴加K3[Fe(CN)6]溶液 铁电极表面生成蓝色沉淀 在该原电池中Fe作负极
B 常温下,将打磨后的铝片放入浓硝酸中 无明显现象 常温下铝与浓硝酸不反应
C 向装有X溶液的试管中滴入稀NaOH溶液,将湿润的红色石蕊试纸靠近试管口 无明显现象 X溶液中无NH4+
D 向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸() 溶液 无气体产生 电离常数: K1(碳酸)>K2(水杨酸)
A.A B.B C.C D.D
22.下列四个常用电化学装置的叙述错误的是
图I水果电池 图II干电池 图III铅蓄电池 图IV氢氧燃料电池
A.图I所示电池中,电子从锌片流出
B.图II所示干电池中锌作负极
C.图III所示电池为二次电池,放电时正极的电极反应式为Pb-2e-+=PbSO4
D.图IV所示电池中正极反应为:
23.聚合物锂离子电池是以Li+嵌入化合物为正、负极的二次电池。如图为一种聚合物锂离子电池示意图,其工作原理为LiNiO2+6CLi1-xNiO2+LixC6,下列说法错误的是
A.该电池充电可能引起电池正极发生金属锂沉积
B.充电时当外电路通过1mole-时理论上由2molLi0.9C6转化为Li0.4C6
C.电池放电时电解质的微粒Li+由负极向正极移动
D.电池放电时正极的电极反应式为Li1-xNiO2+xLi++xe-=LiNiO2
24.奥特曼是男孩子们心目中的偶像和大英雄,据悉大多数奥特曼玩具都装有碱性电池。碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。下列说法正确的是
A.电池工作时,负极区PH增大
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
25.常温下,将除去表面氧化膜的Al片、Cu片插入浓HNO3中组成原电池(如下图所示),测得原电池的电流(Ⅰ)随时间(t)的变化如右图所示。反应过程中有红棕色气体产生。下列说法错误的是
A.t1时刻前,Al片作负极
B.t1时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应
C.t1时刻后,失电子作负极,电流方向发生改变
D.烧杯中发生的离子反应为3NO2 + 2OH— = 2NO + NO + H2O
二、填空题
26.化学电源
(1)根据 原理,人们设计了多种化学电源。
(2)分类:化学电源包括 电池、 电池(又称可充电电池)、 电池等几大类。
27.(Ⅰ)合金是生活中常用的材料,请回答下列问题:
(1)生铁和钢是含碳量不同的铁碳合金,含碳量在2%~4.3%的称为 。不锈钢在空气中比较稳定,不易生锈,有强的抗腐蚀能力,其合金元素主要是 ;
(2)钢铁的腐蚀给社会造成的损失是巨大的,所以采取各种措施防止钢铁的腐蚀是十分必要的,请列举三种防止钢铁腐蚀的方法 ;
(3)青铜的主要合金元素为 ,黄铜的主要合金元素为 :
(4)储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。如镧镍合金,它吸收氢气可结合成金属氢化物,其化学式可近似地表示为(中各元素化合价均可看作是零),它跟可组成镍氢可充电电池:,该电池放电时,负极反应是 。市面上出售的标称容量为2000 mA h的1节镍氢电池至少应含有镧镍合金 g(已知1法拉第电量为96500库仑或安培·秒)。
(Ⅱ)有机化合物与生活息息相关。请回答下列有关问题:
(5)棉花、蚕丝、小麦主要成分分别为 、 、 ,它们蕃都属于天然有机高分子化合物;
(6)味精是烹饪常用的调味品,其主要成分的化学名称为 ;
(7)解热镇痛药阿司匹林主要成分的结构简式为 。
28.甲醇是重要的燃料,化学教材《选择性必修1》100页第5题介绍了甲醇()酸性燃料电池,资料显示其结构如图所示。
(1)A为燃料电池的 (填“正”或“负”)极,在其表面发生 反应(填“氧化”或“还原”)。
(2)放电过程中,经过交换膜时,的迁移方向是 (填“A→B”或“B→A”)。
(3)正极反应式 。
(4)负极反应式为 。
(5)在电池反应中,每生成1mol二氧化碳,理论上消耗标准状况下氧气的体积是 。
(6)在25℃、101kPa下,1g液态甲醇燃烧生成和液态水时放热22.5kJ,其热化学方程式为 ;研究表明,甲醇用于火力发电的能量转化率 于燃料电池(填“高”或“低”)。
(7)合成甲醇的反应为: △H。已知CO的结构式为,甲醇的结构式为 ,相关键能数据如下:
化学键 H-H C-O H-O C-H
436 343 1076 465 413
由此计算△H= 。
试卷第1页,共3页
参考答案:
1.D
【详解】A.酚醛树脂是苯酚与甲醛的缩聚产物,属于人工合成的高分子材料,故A错误;
B.锂离子蓄电池组在放电时将化学能转化成电能,故B错误;
C.CPU芯片主要成分为Si,故C错误;
D.铝合金具有高强度、高韧性的优点,故D正确;
故选:D。
2.B
【详解】①加水,稀释了盐酸的浓度,反应速率变慢,故①不符合题意;
②加NaOH固体会消耗H+,降低H2产量,故②不符合题意;
③滴入几滴浓盐酸,使H+浓度变大,由于Fe少量,不影响H2产量,故③符合题意;
④加CuO固体与盐酸反应生成氯化铜和水,氯化铜再与铁发生置换反应生成铜,构成原电池,反应速率加快,但由于消耗铁影响氢气总量,故④不符合题意;
⑤滴加几滴硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量,故⑤不符合题意;
⑥加NaCI溶液相当于加水,稀释了盐酸的浓度,反应速率变慢,故⑥不符合题意;
⑦升高温度,可加快反应速率,不考虑盐酸挥发,不影响H2产量,故⑦符合题意;
⑧改用10mL0.1mol/L的盐酸,增大了盐酸的浓度,反应速率加快,由于Fe少量,不影响H2产量,故⑧符合题意;
综上分析,答案选B。
3.A
【详解】A.氢气化合价升高,失去电子,发生氧化反应,故氢气通入负极,氧气化合价降低,得到电子,发生还原反应,故氧气通入正极,A错误;
B.燃料电池有能量以热量的形式损失,因此燃料电池的能量转化率不能达到100%,B正确;
C.将氢氧燃料电池电极反应相叠加可得总反应为2H2+O2= 2H2O,C正确;
D.氢氧燃料电池总反应为2H2+O2= 2H2O,产物为无污染的水,属于环境友好电池,D正确;
答案选A。
4.C
【详解】实现碳中和目标需要减少二氧化碳的排放,所以A B D错误,C正确;
故选C。
5.A
【详解】铜锌原电池的原理:Zn+2e-=Zn2++H2↑,锌比铜活泼,锌失电子做负极,电极反应式为:Zn-2e-=Zn2+,铜片做正极,电极反应式为:2H++2e-=H2↑;
A.Zn失电子做负极,Cu做正极,正负极标注有错,故A错误;
B.锌片的电极反应式为:Zn-2e-=Zn2+,铜片的电极反应式为:2H++2e-=H2↑,故B正确;
C.电子从负极经导线移动至正极,方向正确,故C正确;
D.H+移向正极得电子,故D正确;
答案选A。
6.C
【详解】A. 燃料电池的氧化剂和还原剂在工作时不断从外界输入,故A正确;
B. 可以根据硫酸密度的大小来判断铅蓄电池是否需要充电,硫酸密度小,说明硫酸剩余少,几乎消耗完,因此应该充电,故B正确;
C. 生铁中含有碳,抗腐蚀能力比纯铁弱,生铁是合金,容易形成电化学腐蚀,故C错误;
D. 将海水中的钢铁闸门与电源的负极相连,是外加电流的阴极保护法,故D正确。
综上所述,答案为C。
7.D
【详解】A.正极得电子,A错误;
B.水解的离子方程式为:,B错误;
C.向硫酸铁溶液中滴加碳酸钠溶液,铁离子与碳酸根离子发生双水解:,C错误;
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙,硫酸钙转化为碳酸钙:,D正确;
答案选D。
8.C
【详解】A.根据总反应式Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅单质化合价升高,PbO2化合价降低,因此铅单质为负极,铅电极的电极反应式:Pb-2e-+SO=PbSO4,故A正确;
B.根据A选项分析得到铅作负极,故B正确;
C.电子从铅电极经导线流向二氧化铅电极,不会经过电解液,故C错误;
D.二氧化铅中铅化合价降低,发生还原反应,故D正确。
综上所述,答案为C。
9.B
【详解】A.①④可以形成原电池,②中两个电极活泼性相同,不能产生电流,③中乙醇是非电解质,不能形成闭合回路,A错误;
B.装置①中Zn为负极,是电子流出端,Cu为正极,是电子流入端,所以装置①中电子由Zn经过电流表流向Cu,B正确;
C.装置①中Zn为负极,Cu为正极,H+在Cu表面得电子生成H2,C错误;
D.装置④中Al和氢氧化钠发生氧化还原反应,Al为负极,失去电子发生氧化反应,D错误;
答案为:B。
10.D
【分析】由图可知,甲图中组成原电池,锌为负极,电极反应为:Zn-2e-=Zn2+,铜为正极,电极反应为:2H++2e-=H2↑,乙图则只有Zn与稀硫酸反应,据此分析解题。
【详解】A.由分析可知,甲烧杯中铜片上产生气泡,而乙烧杯中铜片表面无气泡产生,A错误;
B.由分析可知,甲烧杯组成原电池,铜片是正极,乙烧杯不能组成原电池,铜片不是负极也不是负极,B错误;
C.两烧杯中的总反应式均为:Zn+2H+=Zn2++H2↑,故两烧杯中溶液的c(H+)均减小,C错误;
D.由于甲烧杯中形成原电池反应,加快反应速率,故产生气泡的速度甲比乙快,D正确;
故答案为:D。
11.B
【详解】A. 锌片作负极,失去电子,发生还原反应,电子通过导线流向铜片,氢离子在铜片上得电子生成氢气,铜表面有大量气泡,故A错误;
B. 铜片作正极,发生还原反应,生成氢气,表面有大量气泡,故B正确;
C. 锌片是活泼金属,作原电池的负极,故C错误;
D. 铜片作原电池的正极,故D错误;
故选B。
12.D
【详解】A.磷酸铁锂刀片电池工作时将化学能转化为电能,故A项正确;
B.该电池为原电池,电池工作时,负极失去电子发生氧化反应,故B项正确;
C.电池工作时,电子从负极移向正极,故C项正确;
D.磷酸铁锂刀片电池将化学能转化为电能的同时,还会转化成热能等,能量转化率不能达到100%,故D项错误;
综上所述,本题正确答案为D。
13.B
【分析】通入氧气的一极为正极,则b为正极,发生还原反应;a为负极,发生还原反应。
【详解】A.经过分析,氧气在b极得电子,作正极,故A错误;
B.氧气在正极得电子生成水,其电极反应式为,故B正确;
C.a为负极,b为正极,电子经外电路从负极流向正极,故C错误;
D。负极反应式为,电池工作时,1mol乙醇被氧化时有12mol电子转移,故D错误;
故选B。
14.C
【详解】A.由电子流动方向可知,电极甲为负极,若A为氢气,则负极反应式为H2-2e-+O2-=H2O,故A错误;
B.若B为氧气,则该电极反应式为O2+4e-=2O2-,故B错误;
C.若A为甲烷,电极反应式为CH4-8e-+4O2-=CO+2H2O,消耗32g甲烷的物质的量为=2mol,电路中流过的电子为8×2NA=16NA,故C正确;
D.若A为肼(N2H4),B为氧气,则产物为氮气(产物对环境无污染)和水,故D错误;
故选C。
15.B
【详解】A.降低反应温度,则化学反应速率减慢,故A错误;
B.用生铁片代替纯铁片,可借助于电化学腐蚀使反应速率加快,故B正确;
C.延长反应时间,酸浓度降低, 反应速率减慢,故C错误;
D.因浓硫酸具有强氧化性,铁在浓硫酸中发生钝化现象,加热反应生成二氧化硫而不生成氢气,故D错误;
答案为B。
16.D
【详解】由图示可知,A电极由X转化为Y,该过程是失去了两氢原子,发生氧化反应,为负极,B电极是O2转化为H2O,得到电子发生还原反应,B为正极,据此分析解题:
A.该装置是原电池反应,利用的反应原理为有机物氧化反应,故化学能转化为电能,A正确;
B. 由分析可知:A电极为负极,B为正极,故电子由A电极→用电器→B电极,B正确;
C.由图知X到Y少了2个H,有机物升高2价,失去2个电子,电极反应式正确,C正确;
D.由反应C6H12O6+6O26CO2↑+6H2O 可知1mol葡萄糖反应,转移24mol电子,电极反应也要转移24mol电子,电解质溶液中转移24mol H+,D错误;
故答案为:D。
17.C
【分析】由于Zn的金属活动性比Cu强,所以Zn作负极,Cu作正极。
【详解】A.由于Cu的金属活动性比Zn弱,氢离子在铜表面被还原,产生气泡,选项A不正确;
B.Zn片作负极,失电子发生氧化反应,选项B不正确;
C.锌是负极,失电子溶解其质量逐渐减小,选项C正确;
D.原电池工作时,电子由负极(Zn片)经导线流向正极(铜片),选项D不正确;
答案选C。
18.D
【详解】A.Mg、Al做电极,NaOH溶液为离子导体构成原电池,Mg电极附近产生气泡,即Mg电极附近产生H2,电极反应为:2H2O+2e-=H2+2OH-,原电池中正极发生还原反应,则Mg为正极,Al为负极,从而得出金属性Al大于Mg的错误结论,不能达到实验目的,A不合题意;
B.由反应MgCl2+2NaOH=Mg(OH)2↓+2NaCl可知,向1mL0.01mol L-1MgCl2溶液中先加入1mL0.05mol L-1NaOH溶液,则NaOH过量,故再逐滴加入0.1mol L-1CuSO4溶液,先出现白色沉淀,后又出现蓝色沉淀,不能说明一定发生了Mg(OH)2转化为Cu(OH)2的反应,则不能说明Ksp:Mg(OH)2>Cu(OH)2,B不合题意;
C.Mg(OH)2悬浊液中加入少量氯化铵晶体,由于铵根离子与氢氧根离子反应,使溶解平衡正向移动,存在可逆反应为Mg(OH)2(s)+2═Mg2++2NH3 H2O,故C实验不能得出水解产生的H+中和Mg(OH)2溶解平衡产生的OH-,使溶解平衡正向移动,C错误;
D.测定浓度均为0.1mol L-1的Na2SO3和Na2CO3溶液的pH值,前者小于后者,说明的水解程度小于的水解程度,根据越弱越水解的规律得出Ka2:H2SO3>H2CO3,D正确;
故答案为:D。
19.A
【详解】A.根据图中信息,工作电极表面氮元素化合价降低,作正极,则对电极为负极,因此对电极的材料可能为活泼金属锌,故A正确;
B.该方法是二氧化氮得到电子变为一氧化氮,不能实现完全清除氮氧化物的排放,故B错误;
C.工作电极上二氧化氮得到电子变一氧化氮,其电极反应式为,故C错误;
D.传感器工作时,电子从对电极经过放大器后流向工作电极,故D错误;
综上所述,答案为A。
20.C
【分析】碱性锌锰干电池总反应为Zn+2MnO2+2H2O2MnOOH+Zn(OH)2,Zn在反应中价态升高失电子,故Zn为负极,电极反应式为Zn-2e-+2OH-=Zn(OH)2,MnO2为正极反应物。
【详解】A.根据电池工作时的总反应可知,Zn一端作负极,一端作正极,A项正确;
B.电池工作时,得电子,被还原为,B项正确;
C.由总反应可知,电池工作时,不消耗KOH,C项错误;
D.普通干电池电解质为酸性,易被腐蚀、发生自放电,碱性锌锰电池不易发生自放电,碱性锌锰电池比普通锌锰电池性能好,D项正确;
故选C。
21.D
【详解】A.由图可知,牺牲阳极的阴极保护法中被保护的Fe电极是正极,Zn电极是负极,不会产生Fe2+,滴加K3[Fe(CN)6]溶液不会有蓝色沉淀现象出现,故A错误;
B.铝在浓硝酸中会钝化,没有明显现象,但钝化不是不反应,而是铝在浓硝酸中发生反应生成一层致密的氧化物保护膜,阻止内部金属继续反应,故B错误;
C. 滴入稀的氢氧化钠溶液,可能生成一水合氨,湿润的红色石蕊试纸靠近试管口,试纸没有明显现象,但原溶液中可能含有铵根离子,故C错误;
D.向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸() 溶液,没有气泡产生,说明水杨酸和Na2CO3不能反应生成碳酸,根据强酸制弱酸的原理,碳酸的酸性大于水杨酸,即电离常数:K1(碳酸)>K2(水杨酸),故D正确;
故选D。
22.C
【详解】A.图I水果电池中,锌的活动性比铜强,锌作负极,铜作正极,电子由负极流向正极,A正确;
B.图II为锌锰干电池,锌为金属,锌作负极,石墨作正极,B正确;
C.图III为铅蓄电池,铅作负极,二氧化铅作正极,放电时负极的电极反应式为Pb-2e-+=PbSO4,正极反应式为PbO2+ +4H++2e-=PbSO4+2H2O,C错误;
D.图IV为氢氧燃料电池,氢气作负极失电子,氧气作正极得电子,氧气得电子被还原,由于电解质溶液呈酸性,因此正极电极反应式为:,D正确;
答案选C。
23.A
【分析】由总反应可知,放电时正极得到电子发生还原反应,电极反应式为Li1-xNiO2+xLi++xe-=LiNiO2,LiNiO2为正极、石墨烯极为负极;充电时的阴极反应是放电时负极反应的逆过程,充电时的阳极反应是放电时正极反应的逆过程;
【详解】A.,充电时的阳极为放电时的正极,充电时反应为Li1-xNiO2+LixC6= LiNiO2+6C,阳极反应式为LiNiO2-xe-= Li1-xNiO2+xLi+,正极没有Li沉积,A错误;
B.电极反应Li0.9C6-0.5e-=Li0.4C6+0.5Li+,电路中通过1mol电子时有2molLi0.9C发生反应,B正确;
C.放电时为原电池原理,阳离子向正极移动,则Li+由负极向正极移动,C正确;
D.放电时反应为LiNiO2+6C = Li1-xNiO2+LixC6,正极电极反应式为Li1-xNiO2+xLi++xe-=LiNiO2,D正确;
故选A。
24.B
【分析】由电池总反应分析可知,电池放电时,Zn化合价升高,失去电子,发生氧化反应,做原电池负极,电极反应式为:Zn-2e-+2OH-===Zn(OH)2,MnO2中Mn元素化合价降低,得到电子,发生还原反应,作原电池正极,电极反应式为:2MnO2(s)+H2O(l)+2e-=== Mn2O3+2OH-(aq),据此分析解答。
【详解】A.原电池中较活泼的金属是负极,失去电子,发生氧化反应电极反应式为:Zn-2e-+2OH-===Zn(OH)2,则消耗氢氧根离子,,负极区pH减小,A选项错误;
B.根据总的方程式可知,二氧化锰得到电子,二氧化锰是正极,则电池正极电极反应式为2MnO2(s)+H2O(l)+2e-=== Mn2O3+2OH-(aq),B选项正确;
C.电池工作时,电子由负极通过外电路流向正极,C选项错误;
D.由负极反应式Zn-2e-+2OH-===Zn(OH)2可知,外电路中每通过0.2mol电子,消耗0.1mol锌,锌的质量理论上减小6.5g,D选项错误;
答案选B。
25.D
【详解】A.铝比铜活泼性强,t1时刻前,铝作负极发生氧化反应,正极上HNO3被还原,A正确;
B.t1时刻后,铝表面钝化形成的氧化膜阻碍了铝进一步反应,B正确;
C.t1时刻后,铝表面钝化形成的氧化膜阻碍了铝进一步反应,铜作负极,电流方向发生改变,C正确;
D.NO2与NaOH反应生成NaNO3、NaNO2和H2O,烧杯中发生的离子反应为2NO2+2OH ═NO+NO+H2O,D错误;
答案选D。
26.(1)原电池
(2) 一次 二次 燃料
【解析】略
27.(1) 生铁 铬和镍
(2)在钢铁的表面喷涂油漆;在钢铁的表面镀上铬、锌等金属;对钢铁的表面进行发蓝处理;在钢铁器件上附着一种更易失电子的金属或合金
(3) Sn Zn
(4) LaNi5H6 + 6OH--6e-=LaNi5+ 6H2O 5.4
(5) 纤维素 蛋白质 淀粉
(6)谷氨酸单钠盐(或2-氨基戊二酸单钠盐)
(7)
【详解】(1)生铁和钢是含碳量不同的铁碳合金,含碳量在2%~4.3%的称为生铁;不锈钢主要成分是铁,合金元素主要是铬和镍;故答案为生铁;铬和镍;
(2)防腐的主要目的是阻止金属失电子,发生氧化反应;因此防止钢铁腐蚀的方法:在钢铁的表面喷涂油漆;在钢铁的表面镀上铬、锌等金属;对钢铁的表面进行发蓝处理;在钢铁器件上附着一种更易失电子的金属或合金;故答案为在钢铁的表面喷涂油漆;在钢铁的表面镀上铬、锌等金属;对钢铁的表面进行发蓝处理;在钢铁器件上附着一种更易失电子的金属或合金;
(3)青铜的主要元素为铜,主要合金元素为Sn;黄铜的主要合金元素为Zn;故答案为Sn;Zn;
(4)电池放电时为原电池,充电时为电解池;该电池放电时,LaNi5H6 失电氧化发生反应子,负极极反应为:LaNi5H6+ 6OH-- 6e-=LaNi5+6H2O;因为1mol电子转移时所通过的电量为1法拉第,1法拉第电量为96500库仑或安培秒,则2000mA h的1节镍氢电池则要转移(2000×)×10-3mol电子,又根据阴极反应LaNi5+6e﹣+6H2O═LaNi5H6+6OH﹣,所以1mol镧镍合金转移6mol电子,所以2000mAh的1节镍氢电池则要镧镍合金的质量为(2000×)×10﹣3××(139+59×5+6)g/mol=5.4g;故答案为LaNi5H6+6OH--6e-=LaNi5+6H2O;5.4;
(5)棉花、蚕丝、小麦主要成分分别为纤维素、蛋白质、淀粉;故答案为纤维素、蛋白质、淀粉;
(6)味精是烹饪常用的调味品,其主要成分的化学名称为谷氨酸单钠盐(或2-氨基戊二酸单钠盐);故答案为谷氨酸单钠盐(或2-氨基戊二酸单钠盐);
(7)解热镇痛药阿司匹林主要成分的结构简式为;故答案为。
28.(1) 正 还原
(2)B→A
(3)
(4)
(5)33.6L
(6) 或
低
(7)-99
【详解】(1)根据图示,A通入氧气,氧气得电子生成水,A为燃料电池的正极,发生还原反应。
(2)原电池中,阳离子向正极移动,A是正极、B是负极,放电过程中,经过交换膜时,的迁移方向是B→A。
(3)正极氧气得电子生成水,正极反应式为;
(4)负极甲醇失电子生成二氧化碳,正极反应式为;
(5)根据,每生成1mol二氧化碳,转移6mol电子,根据可知,理论上消耗1.5mol氧气,标准状况下氧气的体积是33.6L。
(6)在25℃、101kPa下,1g液态甲醇燃烧生成和液态水时放热22.5kJ,则1mol液态甲醇燃烧生成和液态水时放热22.5kJ×32=720 kJ,其热化学方程式为 或 ;研究表明,甲醇用于火力发电的能量转化率低于燃料电池。
(7)焓变=反应物总键能-生成物总键能, △H=1076+436×2-413×3-343-465=-99
一、单选题
1.神舟十三号载人飞船刷新了中国载人航天技术的新高度。下列说法正确的是
A.逃逸系统复合材料中的酚醛树脂属于天然高分子材料
B.储能系统的锂离子蓄电池组在放电时将电能转化为化学能
C.计算机系统使用的国产CPU芯片主要成分为SiO2
D.飞船表面结构的铝合金具有高强、高韧的优点
2.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤滴加几滴硫酸铜溶液 ⑥加NaCI溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L的盐酸
A.①⑤⑦ B.③⑦⑧ C.②④⑥ D.③⑥⑦⑧
3.氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2O、O2+2H2O+4e-=4OH-,下列说法错误的是
A.氢气通入正极,氧气通入负极
B.燃料电池的能量转化率不能达到100%
C.供电时的总反应为:2H2+O2= 2H2O
D.产物为无污染的水,属于环境友好电池
4.燃料电池能量转化效率高、环境污染少,运行质量高。下列物质均可用作燃料电池的燃料,其中能实现碳中和目标的是
A.甲醇 B.天然气 C.氢气 D.一氧化碳
5.以下铜锌原电池工作原理认知模型图中, 不正确的是
A.正负极标注 B.电极反应式
C.电子移动方向 D.H+的移动方向
6.下列叙述不正确的是
A.燃料电池的氧化剂和还原剂不是全部储藏在电池内,而是工作时不断从外界输入
B.可以根据硫酸密度的大小来判断铅蓄电池是否需要充电
C.生铁中含有碳,抗腐蚀能力比纯铁强
D.将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀
7.下列化学用语书写正确的是
A.金属发生电化学腐蚀的正极反应式:
B.溶液中水解的离子方程式:
C.向硫酸铁溶液中滴加碳酸钠溶液:
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙:
8.机动车使用的铅蓄电池构造如图所示,其电池反应的方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。电池工作时,下列说法不正确的是
A.铅电极的电极反应式:Pb-2e-+SO=PbSO4 B.铅作负极
C.电子从铅电极经硫酸流向二氧化铅电极 D.二氧化铅发生还原反应
9.下列说法正确的是
① ② ③ ④
A.以上四套装置的电流表指针均有偏转
B.装置①中电子由Zn经过电流表流向Cu
C.装置①中H+在Zn表面得电子,变为H2
D.装置④中Mg为负极,发生还原反应
10.将纯锌片和纯铜片按图示方式插入浓度相同的稀硫酸中一段时间,以下叙述正确的是
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的c(H+)均增大
D.产生气泡的速度甲比乙快
11.根据如图装置,下列说法正确的是( )
A.锌片表面有大量气泡 B.铜片表面有大量气泡
C.锌片是正极 D.铜片是阴极
12.中国企业比亚迪公司开发的磷酸铁锂刀片电池,具有能量密度大安全性高等特征。下列说法不正确的是
A.该电池工作时将化学能转化为电能
B.该电池工作时负极失电子发生氧化反应
C.该电池工作时电子从负极移向正极
D.该电池的能量转化率可达100%
13.圣路易斯大学研制的新型乙醇燃料电池,用能传递质子()的介质作溶剂,电池总反应为,如图是该电池的示意图,下列说法正确的是
A.b极为电池的负极
B.电池正极的电极反应为:
C.电池工作时电子由b极沿导线经灯泡再到a极
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
14.一种以某固体氧化物为电解质的新型燃料电池,工作原理如图所示。在700~900℃时,O2-可在该固体氧化物电解质中自由移动,产物对环境无污染(设NA为阿伏加德罗常数的值)。下列说法正确的是
A.若A为氢气,则正极反应式为H2-2e-+O2-=H2O
B.若B为氧气,则该电极反应式为O2+4e-+2H2O=4OH-
C.若A为甲烷,则消耗32g甲烷时,外电路中流过的电子数目为16NA
D.若A为肼(N2H4),B为氧气,则电池总反应为N2H4+3O2=2NO2+2H2O
15.用铁片与稀硫酸反应制取氢气时,下列措施能使反应速率加快的是( )
A.降低反应温度 B.用生铁片代替纯铁片
C.延长反应时间 D.用浓硫酸代替稀硫酸
16.图中是利用垃圾假单胞菌株分解有机物的电化学原理图。下列说法不正确的是
A.该过程将化学能转化为电能
B.电子流向:A电极→用电器→B电极
C.A电极上发生氧化反应,电极反应式为:X-2e- =Y+2H+
D.若有机物为葡萄糖(C6H12O6),处理1mol有机物,12molH+透过质子交换膜移动到右室
17.某原电池装置如图所示,该电池工作时,下列说法正确的是
A.氢离子在铜表面被氧化,产生气泡 B.片发生还原反应
C.锌是负极,其质量逐渐减小 D.电子由铜片经导线流向锌片
18.根据实验目的,下列实验及现象、结论都正确的是
选项 实验目的 实验及现象 结论
A 比较金属的活泼性 Mg、Al做电极,NaOH溶液为离子导体构成原电池,Mg电极附近产生气泡 Al为正极
B 探究沉淀的转化 向1mL0.01mol L-1MgCl2溶液中先加入1mL0.05mol L-1NaOH溶液,再逐滴加入0.1mol L-1CuSO4溶液,先出现白色沉淀,后又出现蓝色沉淀 Ksp:Mg(OH)2>Cu(OH)2
C 探究Mg(OH)2溶于铵盐的原理 向Mg(OH)2悬浊液中加入少量NH4Cl固体,溶液变澄清 NH水解产生的H+中和Mg(OH)2溶解平衡产生的OH-,使溶解平衡正向移动
D 比较H2SO3和H2CO3的Ka2 测定浓度均为0.1mol L-1的Na2SO3和Na2CO3溶液的pH值,前者小于后者 Ka2:H2SO3>H2CO3
A.A B.B C.C D.D
19.“定电位”传感器可以用来监测化工厂的氮氧化物气体是否达到排放标准,工作原理如图所示,下列说法正确的是
A.对电极的材料可能为活泼金属锌
B.该方法既能实现完全清除氮氧化物的排放,又能充分利用化学能
C.工作电极上的电极反应式为
D.传感器工作时,电子从工作电极经过放大器后流向对电极
20.碱性锌锰干电池的构造示意图如图所示,电解质为KOH,该电池工作时的总反应为。下列说法中错误的是
A.Zn一端作负极,一端作正极
B.电池工作时,得电子,被还原为
C.理论上每消耗1mol Zn时,一定消耗2mol KOH
D.碱性锌锰电池比普通锌锰电池性能好
21.下列实验操作、现象与结论均正确的是
选项 操作 现象 结论
A 如图,为验证牺牲阳极的阴极保护,向Fe电极附近的溶液中滴加K3[Fe(CN)6]溶液 铁电极表面生成蓝色沉淀 在该原电池中Fe作负极
B 常温下,将打磨后的铝片放入浓硝酸中 无明显现象 常温下铝与浓硝酸不反应
C 向装有X溶液的试管中滴入稀NaOH溶液,将湿润的红色石蕊试纸靠近试管口 无明显现象 X溶液中无NH4+
D 向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸() 溶液 无气体产生 电离常数: K1(碳酸)>K2(水杨酸)
A.A B.B C.C D.D
22.下列四个常用电化学装置的叙述错误的是
图I水果电池 图II干电池 图III铅蓄电池 图IV氢氧燃料电池
A.图I所示电池中,电子从锌片流出
B.图II所示干电池中锌作负极
C.图III所示电池为二次电池,放电时正极的电极反应式为Pb-2e-+=PbSO4
D.图IV所示电池中正极反应为:
23.聚合物锂离子电池是以Li+嵌入化合物为正、负极的二次电池。如图为一种聚合物锂离子电池示意图,其工作原理为LiNiO2+6CLi1-xNiO2+LixC6,下列说法错误的是
A.该电池充电可能引起电池正极发生金属锂沉积
B.充电时当外电路通过1mole-时理论上由2molLi0.9C6转化为Li0.4C6
C.电池放电时电解质的微粒Li+由负极向正极移动
D.电池放电时正极的电极反应式为Li1-xNiO2+xLi++xe-=LiNiO2
24.奥特曼是男孩子们心目中的偶像和大英雄,据悉大多数奥特曼玩具都装有碱性电池。碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。下列说法正确的是
A.电池工作时,负极区PH增大
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
25.常温下,将除去表面氧化膜的Al片、Cu片插入浓HNO3中组成原电池(如下图所示),测得原电池的电流(Ⅰ)随时间(t)的变化如右图所示。反应过程中有红棕色气体产生。下列说法错误的是
A.t1时刻前,Al片作负极
B.t1时,因Al在浓硝酸中钝化,氧化膜阻碍了Al继续反应
C.t1时刻后,失电子作负极,电流方向发生改变
D.烧杯中发生的离子反应为3NO2 + 2OH— = 2NO + NO + H2O
二、填空题
26.化学电源
(1)根据 原理,人们设计了多种化学电源。
(2)分类:化学电源包括 电池、 电池(又称可充电电池)、 电池等几大类。
27.(Ⅰ)合金是生活中常用的材料,请回答下列问题:
(1)生铁和钢是含碳量不同的铁碳合金,含碳量在2%~4.3%的称为 。不锈钢在空气中比较稳定,不易生锈,有强的抗腐蚀能力,其合金元素主要是 ;
(2)钢铁的腐蚀给社会造成的损失是巨大的,所以采取各种措施防止钢铁的腐蚀是十分必要的,请列举三种防止钢铁腐蚀的方法 ;
(3)青铜的主要合金元素为 ,黄铜的主要合金元素为 :
(4)储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。如镧镍合金,它吸收氢气可结合成金属氢化物,其化学式可近似地表示为(中各元素化合价均可看作是零),它跟可组成镍氢可充电电池:,该电池放电时,负极反应是 。市面上出售的标称容量为2000 mA h的1节镍氢电池至少应含有镧镍合金 g(已知1法拉第电量为96500库仑或安培·秒)。
(Ⅱ)有机化合物与生活息息相关。请回答下列有关问题:
(5)棉花、蚕丝、小麦主要成分分别为 、 、 ,它们蕃都属于天然有机高分子化合物;
(6)味精是烹饪常用的调味品,其主要成分的化学名称为 ;
(7)解热镇痛药阿司匹林主要成分的结构简式为 。
28.甲醇是重要的燃料,化学教材《选择性必修1》100页第5题介绍了甲醇()酸性燃料电池,资料显示其结构如图所示。
(1)A为燃料电池的 (填“正”或“负”)极,在其表面发生 反应(填“氧化”或“还原”)。
(2)放电过程中,经过交换膜时,的迁移方向是 (填“A→B”或“B→A”)。
(3)正极反应式 。
(4)负极反应式为 。
(5)在电池反应中,每生成1mol二氧化碳,理论上消耗标准状况下氧气的体积是 。
(6)在25℃、101kPa下,1g液态甲醇燃烧生成和液态水时放热22.5kJ,其热化学方程式为 ;研究表明,甲醇用于火力发电的能量转化率 于燃料电池(填“高”或“低”)。
(7)合成甲醇的反应为: △H。已知CO的结构式为,甲醇的结构式为 ,相关键能数据如下:
化学键 H-H C-O H-O C-H
436 343 1076 465 413
由此计算△H= 。
试卷第1页,共3页
参考答案:
1.D
【详解】A.酚醛树脂是苯酚与甲醛的缩聚产物,属于人工合成的高分子材料,故A错误;
B.锂离子蓄电池组在放电时将化学能转化成电能,故B错误;
C.CPU芯片主要成分为Si,故C错误;
D.铝合金具有高强度、高韧性的优点,故D正确;
故选:D。
2.B
【详解】①加水,稀释了盐酸的浓度,反应速率变慢,故①不符合题意;
②加NaOH固体会消耗H+,降低H2产量,故②不符合题意;
③滴入几滴浓盐酸,使H+浓度变大,由于Fe少量,不影响H2产量,故③符合题意;
④加CuO固体与盐酸反应生成氯化铜和水,氯化铜再与铁发生置换反应生成铜,构成原电池,反应速率加快,但由于消耗铁影响氢气总量,故④不符合题意;
⑤滴加几滴硫酸铜溶液,铁把铜置换出来,形成原电池,故反应速率加快,但与盐酸反应的铁减少,故减少了产生氢气的量,故⑤不符合题意;
⑥加NaCI溶液相当于加水,稀释了盐酸的浓度,反应速率变慢,故⑥不符合题意;
⑦升高温度,可加快反应速率,不考虑盐酸挥发,不影响H2产量,故⑦符合题意;
⑧改用10mL0.1mol/L的盐酸,增大了盐酸的浓度,反应速率加快,由于Fe少量,不影响H2产量,故⑧符合题意;
综上分析,答案选B。
3.A
【详解】A.氢气化合价升高,失去电子,发生氧化反应,故氢气通入负极,氧气化合价降低,得到电子,发生还原反应,故氧气通入正极,A错误;
B.燃料电池有能量以热量的形式损失,因此燃料电池的能量转化率不能达到100%,B正确;
C.将氢氧燃料电池电极反应相叠加可得总反应为2H2+O2= 2H2O,C正确;
D.氢氧燃料电池总反应为2H2+O2= 2H2O,产物为无污染的水,属于环境友好电池,D正确;
答案选A。
4.C
【详解】实现碳中和目标需要减少二氧化碳的排放,所以A B D错误,C正确;
故选C。
5.A
【详解】铜锌原电池的原理:Zn+2e-=Zn2++H2↑,锌比铜活泼,锌失电子做负极,电极反应式为:Zn-2e-=Zn2+,铜片做正极,电极反应式为:2H++2e-=H2↑;
A.Zn失电子做负极,Cu做正极,正负极标注有错,故A错误;
B.锌片的电极反应式为:Zn-2e-=Zn2+,铜片的电极反应式为:2H++2e-=H2↑,故B正确;
C.电子从负极经导线移动至正极,方向正确,故C正确;
D.H+移向正极得电子,故D正确;
答案选A。
6.C
【详解】A. 燃料电池的氧化剂和还原剂在工作时不断从外界输入,故A正确;
B. 可以根据硫酸密度的大小来判断铅蓄电池是否需要充电,硫酸密度小,说明硫酸剩余少,几乎消耗完,因此应该充电,故B正确;
C. 生铁中含有碳,抗腐蚀能力比纯铁弱,生铁是合金,容易形成电化学腐蚀,故C错误;
D. 将海水中的钢铁闸门与电源的负极相连,是外加电流的阴极保护法,故D正确。
综上所述,答案为C。
7.D
【详解】A.正极得电子,A错误;
B.水解的离子方程式为:,B错误;
C.向硫酸铁溶液中滴加碳酸钠溶液,铁离子与碳酸根离子发生双水解:,C错误;
D.用碳酸钠溶液处理锅炉水垢中的硫酸钙,硫酸钙转化为碳酸钙:,D正确;
答案选D。
8.C
【详解】A.根据总反应式Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅单质化合价升高,PbO2化合价降低,因此铅单质为负极,铅电极的电极反应式:Pb-2e-+SO=PbSO4,故A正确;
B.根据A选项分析得到铅作负极,故B正确;
C.电子从铅电极经导线流向二氧化铅电极,不会经过电解液,故C错误;
D.二氧化铅中铅化合价降低,发生还原反应,故D正确。
综上所述,答案为C。
9.B
【详解】A.①④可以形成原电池,②中两个电极活泼性相同,不能产生电流,③中乙醇是非电解质,不能形成闭合回路,A错误;
B.装置①中Zn为负极,是电子流出端,Cu为正极,是电子流入端,所以装置①中电子由Zn经过电流表流向Cu,B正确;
C.装置①中Zn为负极,Cu为正极,H+在Cu表面得电子生成H2,C错误;
D.装置④中Al和氢氧化钠发生氧化还原反应,Al为负极,失去电子发生氧化反应,D错误;
答案为:B。
10.D
【分析】由图可知,甲图中组成原电池,锌为负极,电极反应为:Zn-2e-=Zn2+,铜为正极,电极反应为:2H++2e-=H2↑,乙图则只有Zn与稀硫酸反应,据此分析解题。
【详解】A.由分析可知,甲烧杯中铜片上产生气泡,而乙烧杯中铜片表面无气泡产生,A错误;
B.由分析可知,甲烧杯组成原电池,铜片是正极,乙烧杯不能组成原电池,铜片不是负极也不是负极,B错误;
C.两烧杯中的总反应式均为:Zn+2H+=Zn2++H2↑,故两烧杯中溶液的c(H+)均减小,C错误;
D.由于甲烧杯中形成原电池反应,加快反应速率,故产生气泡的速度甲比乙快,D正确;
故答案为:D。
11.B
【详解】A. 锌片作负极,失去电子,发生还原反应,电子通过导线流向铜片,氢离子在铜片上得电子生成氢气,铜表面有大量气泡,故A错误;
B. 铜片作正极,发生还原反应,生成氢气,表面有大量气泡,故B正确;
C. 锌片是活泼金属,作原电池的负极,故C错误;
D. 铜片作原电池的正极,故D错误;
故选B。
12.D
【详解】A.磷酸铁锂刀片电池工作时将化学能转化为电能,故A项正确;
B.该电池为原电池,电池工作时,负极失去电子发生氧化反应,故B项正确;
C.电池工作时,电子从负极移向正极,故C项正确;
D.磷酸铁锂刀片电池将化学能转化为电能的同时,还会转化成热能等,能量转化率不能达到100%,故D项错误;
综上所述,本题正确答案为D。
13.B
【分析】通入氧气的一极为正极,则b为正极,发生还原反应;a为负极,发生还原反应。
【详解】A.经过分析,氧气在b极得电子,作正极,故A错误;
B.氧气在正极得电子生成水,其电极反应式为,故B正确;
C.a为负极,b为正极,电子经外电路从负极流向正极,故C错误;
D。负极反应式为,电池工作时,1mol乙醇被氧化时有12mol电子转移,故D错误;
故选B。
14.C
【详解】A.由电子流动方向可知,电极甲为负极,若A为氢气,则负极反应式为H2-2e-+O2-=H2O,故A错误;
B.若B为氧气,则该电极反应式为O2+4e-=2O2-,故B错误;
C.若A为甲烷,电极反应式为CH4-8e-+4O2-=CO+2H2O,消耗32g甲烷的物质的量为=2mol,电路中流过的电子为8×2NA=16NA,故C正确;
D.若A为肼(N2H4),B为氧气,则产物为氮气(产物对环境无污染)和水,故D错误;
故选C。
15.B
【详解】A.降低反应温度,则化学反应速率减慢,故A错误;
B.用生铁片代替纯铁片,可借助于电化学腐蚀使反应速率加快,故B正确;
C.延长反应时间,酸浓度降低, 反应速率减慢,故C错误;
D.因浓硫酸具有强氧化性,铁在浓硫酸中发生钝化现象,加热反应生成二氧化硫而不生成氢气,故D错误;
答案为B。
16.D
【详解】由图示可知,A电极由X转化为Y,该过程是失去了两氢原子,发生氧化反应,为负极,B电极是O2转化为H2O,得到电子发生还原反应,B为正极,据此分析解题:
A.该装置是原电池反应,利用的反应原理为有机物氧化反应,故化学能转化为电能,A正确;
B. 由分析可知:A电极为负极,B为正极,故电子由A电极→用电器→B电极,B正确;
C.由图知X到Y少了2个H,有机物升高2价,失去2个电子,电极反应式正确,C正确;
D.由反应C6H12O6+6O26CO2↑+6H2O 可知1mol葡萄糖反应,转移24mol电子,电极反应也要转移24mol电子,电解质溶液中转移24mol H+,D错误;
故答案为:D。
17.C
【分析】由于Zn的金属活动性比Cu强,所以Zn作负极,Cu作正极。
【详解】A.由于Cu的金属活动性比Zn弱,氢离子在铜表面被还原,产生气泡,选项A不正确;
B.Zn片作负极,失电子发生氧化反应,选项B不正确;
C.锌是负极,失电子溶解其质量逐渐减小,选项C正确;
D.原电池工作时,电子由负极(Zn片)经导线流向正极(铜片),选项D不正确;
答案选C。
18.D
【详解】A.Mg、Al做电极,NaOH溶液为离子导体构成原电池,Mg电极附近产生气泡,即Mg电极附近产生H2,电极反应为:2H2O+2e-=H2+2OH-,原电池中正极发生还原反应,则Mg为正极,Al为负极,从而得出金属性Al大于Mg的错误结论,不能达到实验目的,A不合题意;
B.由反应MgCl2+2NaOH=Mg(OH)2↓+2NaCl可知,向1mL0.01mol L-1MgCl2溶液中先加入1mL0.05mol L-1NaOH溶液,则NaOH过量,故再逐滴加入0.1mol L-1CuSO4溶液,先出现白色沉淀,后又出现蓝色沉淀,不能说明一定发生了Mg(OH)2转化为Cu(OH)2的反应,则不能说明Ksp:Mg(OH)2>Cu(OH)2,B不合题意;
C.Mg(OH)2悬浊液中加入少量氯化铵晶体,由于铵根离子与氢氧根离子反应,使溶解平衡正向移动,存在可逆反应为Mg(OH)2(s)+2═Mg2++2NH3 H2O,故C实验不能得出水解产生的H+中和Mg(OH)2溶解平衡产生的OH-,使溶解平衡正向移动,C错误;
D.测定浓度均为0.1mol L-1的Na2SO3和Na2CO3溶液的pH值,前者小于后者,说明的水解程度小于的水解程度,根据越弱越水解的规律得出Ka2:H2SO3>H2CO3,D正确;
故答案为:D。
19.A
【详解】A.根据图中信息,工作电极表面氮元素化合价降低,作正极,则对电极为负极,因此对电极的材料可能为活泼金属锌,故A正确;
B.该方法是二氧化氮得到电子变为一氧化氮,不能实现完全清除氮氧化物的排放,故B错误;
C.工作电极上二氧化氮得到电子变一氧化氮,其电极反应式为,故C错误;
D.传感器工作时,电子从对电极经过放大器后流向工作电极,故D错误;
综上所述,答案为A。
20.C
【分析】碱性锌锰干电池总反应为Zn+2MnO2+2H2O2MnOOH+Zn(OH)2,Zn在反应中价态升高失电子,故Zn为负极,电极反应式为Zn-2e-+2OH-=Zn(OH)2,MnO2为正极反应物。
【详解】A.根据电池工作时的总反应可知,Zn一端作负极,一端作正极,A项正确;
B.电池工作时,得电子,被还原为,B项正确;
C.由总反应可知,电池工作时,不消耗KOH,C项错误;
D.普通干电池电解质为酸性,易被腐蚀、发生自放电,碱性锌锰电池不易发生自放电,碱性锌锰电池比普通锌锰电池性能好,D项正确;
故选C。
21.D
【详解】A.由图可知,牺牲阳极的阴极保护法中被保护的Fe电极是正极,Zn电极是负极,不会产生Fe2+,滴加K3[Fe(CN)6]溶液不会有蓝色沉淀现象出现,故A错误;
B.铝在浓硝酸中会钝化,没有明显现象,但钝化不是不反应,而是铝在浓硝酸中发生反应生成一层致密的氧化物保护膜,阻止内部金属继续反应,故B错误;
C. 滴入稀的氢氧化钠溶液,可能生成一水合氨,湿润的红色石蕊试纸靠近试管口,试纸没有明显现象,但原溶液中可能含有铵根离子,故C错误;
D.向Na2CO3溶液中逐滴滴入同浓度、同体积的水杨酸() 溶液,没有气泡产生,说明水杨酸和Na2CO3不能反应生成碳酸,根据强酸制弱酸的原理,碳酸的酸性大于水杨酸,即电离常数:K1(碳酸)>K2(水杨酸),故D正确;
故选D。
22.C
【详解】A.图I水果电池中,锌的活动性比铜强,锌作负极,铜作正极,电子由负极流向正极,A正确;
B.图II为锌锰干电池,锌为金属,锌作负极,石墨作正极,B正确;
C.图III为铅蓄电池,铅作负极,二氧化铅作正极,放电时负极的电极反应式为Pb-2e-+=PbSO4,正极反应式为PbO2+ +4H++2e-=PbSO4+2H2O,C错误;
D.图IV为氢氧燃料电池,氢气作负极失电子,氧气作正极得电子,氧气得电子被还原,由于电解质溶液呈酸性,因此正极电极反应式为:,D正确;
答案选C。
23.A
【分析】由总反应可知,放电时正极得到电子发生还原反应,电极反应式为Li1-xNiO2+xLi++xe-=LiNiO2,LiNiO2为正极、石墨烯极为负极;充电时的阴极反应是放电时负极反应的逆过程,充电时的阳极反应是放电时正极反应的逆过程;
【详解】A.,充电时的阳极为放电时的正极,充电时反应为Li1-xNiO2+LixC6= LiNiO2+6C,阳极反应式为LiNiO2-xe-= Li1-xNiO2+xLi+,正极没有Li沉积,A错误;
B.电极反应Li0.9C6-0.5e-=Li0.4C6+0.5Li+,电路中通过1mol电子时有2molLi0.9C发生反应,B正确;
C.放电时为原电池原理,阳离子向正极移动,则Li+由负极向正极移动,C正确;
D.放电时反应为LiNiO2+6C = Li1-xNiO2+LixC6,正极电极反应式为Li1-xNiO2+xLi++xe-=LiNiO2,D正确;
故选A。
24.B
【分析】由电池总反应分析可知,电池放电时,Zn化合价升高,失去电子,发生氧化反应,做原电池负极,电极反应式为:Zn-2e-+2OH-===Zn(OH)2,MnO2中Mn元素化合价降低,得到电子,发生还原反应,作原电池正极,电极反应式为:2MnO2(s)+H2O(l)+2e-=== Mn2O3+2OH-(aq),据此分析解答。
【详解】A.原电池中较活泼的金属是负极,失去电子,发生氧化反应电极反应式为:Zn-2e-+2OH-===Zn(OH)2,则消耗氢氧根离子,,负极区pH减小,A选项错误;
B.根据总的方程式可知,二氧化锰得到电子,二氧化锰是正极,则电池正极电极反应式为2MnO2(s)+H2O(l)+2e-=== Mn2O3+2OH-(aq),B选项正确;
C.电池工作时,电子由负极通过外电路流向正极,C选项错误;
D.由负极反应式Zn-2e-+2OH-===Zn(OH)2可知,外电路中每通过0.2mol电子,消耗0.1mol锌,锌的质量理论上减小6.5g,D选项错误;
答案选B。
25.D
【详解】A.铝比铜活泼性强,t1时刻前,铝作负极发生氧化反应,正极上HNO3被还原,A正确;
B.t1时刻后,铝表面钝化形成的氧化膜阻碍了铝进一步反应,B正确;
C.t1时刻后,铝表面钝化形成的氧化膜阻碍了铝进一步反应,铜作负极,电流方向发生改变,C正确;
D.NO2与NaOH反应生成NaNO3、NaNO2和H2O,烧杯中发生的离子反应为2NO2+2OH ═NO+NO+H2O,D错误;
答案选D。
26.(1)原电池
(2) 一次 二次 燃料
【解析】略
27.(1) 生铁 铬和镍
(2)在钢铁的表面喷涂油漆;在钢铁的表面镀上铬、锌等金属;对钢铁的表面进行发蓝处理;在钢铁器件上附着一种更易失电子的金属或合金
(3) Sn Zn
(4) LaNi5H6 + 6OH--6e-=LaNi5+ 6H2O 5.4
(5) 纤维素 蛋白质 淀粉
(6)谷氨酸单钠盐(或2-氨基戊二酸单钠盐)
(7)
【详解】(1)生铁和钢是含碳量不同的铁碳合金,含碳量在2%~4.3%的称为生铁;不锈钢主要成分是铁,合金元素主要是铬和镍;故答案为生铁;铬和镍;
(2)防腐的主要目的是阻止金属失电子,发生氧化反应;因此防止钢铁腐蚀的方法:在钢铁的表面喷涂油漆;在钢铁的表面镀上铬、锌等金属;对钢铁的表面进行发蓝处理;在钢铁器件上附着一种更易失电子的金属或合金;故答案为在钢铁的表面喷涂油漆;在钢铁的表面镀上铬、锌等金属;对钢铁的表面进行发蓝处理;在钢铁器件上附着一种更易失电子的金属或合金;
(3)青铜的主要元素为铜,主要合金元素为Sn;黄铜的主要合金元素为Zn;故答案为Sn;Zn;
(4)电池放电时为原电池,充电时为电解池;该电池放电时,LaNi5H6 失电氧化发生反应子,负极极反应为:LaNi5H6+ 6OH-- 6e-=LaNi5+6H2O;因为1mol电子转移时所通过的电量为1法拉第,1法拉第电量为96500库仑或安培秒,则2000mA h的1节镍氢电池则要转移(2000×)×10-3mol电子,又根据阴极反应LaNi5+6e﹣+6H2O═LaNi5H6+6OH﹣,所以1mol镧镍合金转移6mol电子,所以2000mAh的1节镍氢电池则要镧镍合金的质量为(2000×)×10﹣3××(139+59×5+6)g/mol=5.4g;故答案为LaNi5H6+6OH--6e-=LaNi5+6H2O;5.4;
(5)棉花、蚕丝、小麦主要成分分别为纤维素、蛋白质、淀粉;故答案为纤维素、蛋白质、淀粉;
(6)味精是烹饪常用的调味品,其主要成分的化学名称为谷氨酸单钠盐(或2-氨基戊二酸单钠盐);故答案为谷氨酸单钠盐(或2-氨基戊二酸单钠盐);
(7)解热镇痛药阿司匹林主要成分的结构简式为;故答案为。
28.(1) 正 还原
(2)B→A
(3)
(4)
(5)33.6L
(6) 或
低
(7)-99
【详解】(1)根据图示,A通入氧气,氧气得电子生成水,A为燃料电池的正极,发生还原反应。
(2)原电池中,阳离子向正极移动,A是正极、B是负极,放电过程中,经过交换膜时,的迁移方向是B→A。
(3)正极氧气得电子生成水,正极反应式为;
(4)负极甲醇失电子生成二氧化碳,正极反应式为;
(5)根据,每生成1mol二氧化碳,转移6mol电子,根据可知,理论上消耗1.5mol氧气,标准状况下氧气的体积是33.6L。
(6)在25℃、101kPa下,1g液态甲醇燃烧生成和液态水时放热22.5kJ,则1mol液态甲醇燃烧生成和液态水时放热22.5kJ×32=720 kJ,其热化学方程式为 或 ;研究表明,甲醇用于火力发电的能量转化率低于燃料电池。
(7)焓变=反应物总键能-生成物总键能, △H=1076+436×2-413×3-343-465=-99
