4.3.1离子化合物和共价化合物 课件 (共15张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.1离子化合物和共价化合物 课件 (共15张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 12:07:36 | ||
图片预览





文档简介
(共15张PPT)
离子化合物与共价化合物
高中化学 高一年级
学习目标:
(1)能够判断离子化合物和共价化合物
(2)学会用电子式表示离子键和共价键的形成过程
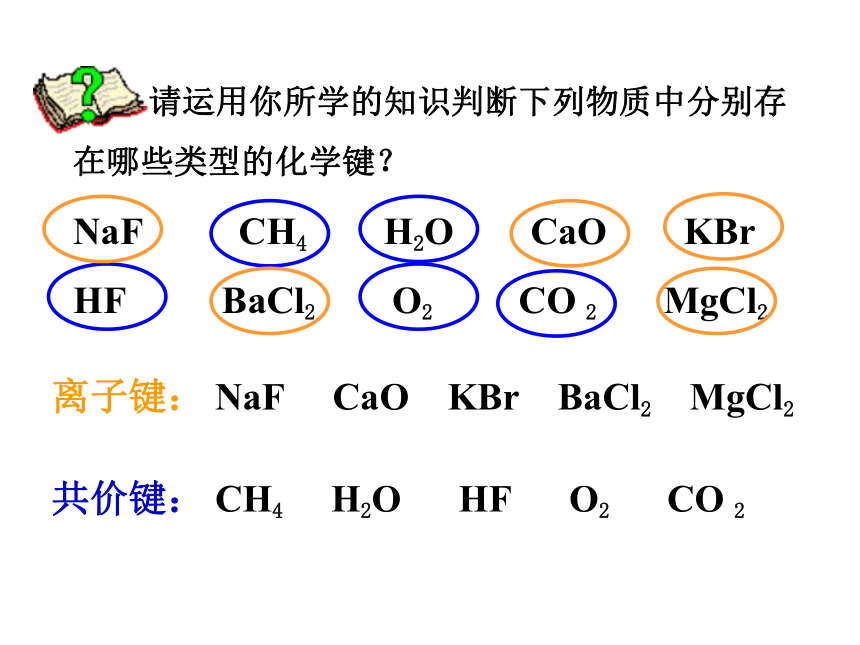
请运用你所学的知识判断下列物质中分别存在哪些类型的化学键?
NaF CH4 H2O CaO KBr
HF BaCl2 O2 CO 2 MgCl2
离子键: NaF CaO KBr BaCl2 MgCl2
共价键: CH4 H2O HF O2 CO 2
离子化合物:含有离子键的化合物。
一般来说含有金属阳离子(或NH4+)的化合物为离子化合物。如:K2O、CaO、KOH、NaCl、CaSO4、Na2S、NH4Cl等。
【注意】
1.离子化合物含有离子键,也可能同时含共价键
2. 大多数盐类物质属于离子化合物(但AlCl3、B eCl2等例外,它们属于共价化合物),活波金属氧化物、强碱均属于离子化合物。
一、离子化合物与共价化合物
注意:
1.共价化合物只含有共价键;含有共价键的化合物不一定是共价化合物,如NaOH、Na2SO4 、NH4Cl等。
2.酸类物质,非金属氧化物、绝大多数的有机化合物均属于共价化合物。
共价化合物:只含有共价键的化合物
一般来说只含非金属元素的化合物为共价化合物。如:HCl、H2O、CO、SO3、H2SO4等。
判断以下说法的正误。
A、离子化合物只含离子键。
B、含离子键的化合物一定为离子化合物。
C、共价化合物只含共价键。
D、 含共价键的化合物一定为共价化合物。
E、由非金属元素组成的化合物一定是共价化合物。
×
×
×
√
√
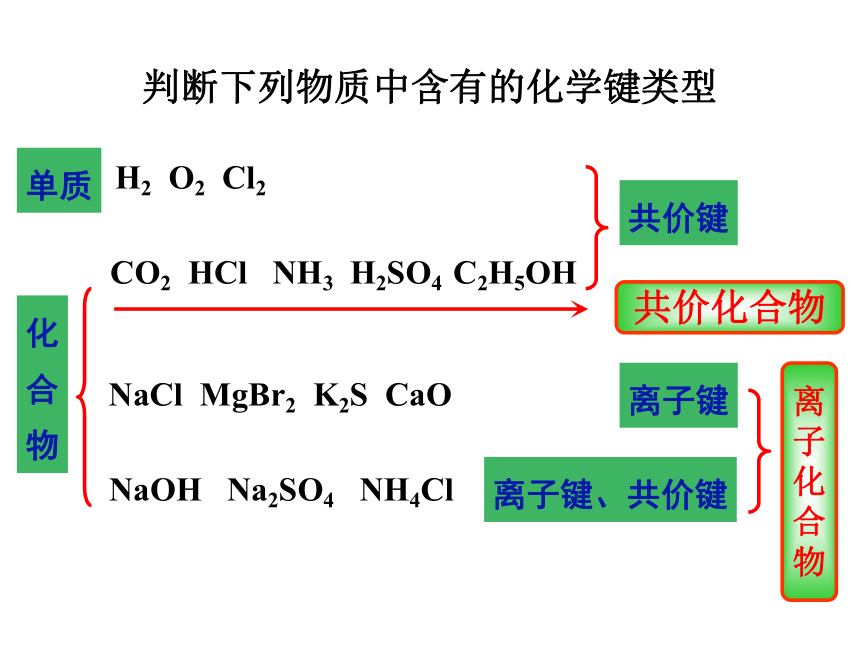
判断下列物质中含有的化学键类型
H2 O2 Cl2
CO2 HCl NH3 H2SO4 C2H5OH
NaCl MgBr2 K2S CaO
NaOH Na2SO4 NH4Cl
单质
化
合
物
共价键
离子键
离子键、共价键
离
子
化
合
物
共价化合物
判断下列化合物是离子化合物还是共价化合物。
离子化合物
共价化合物
CaCl2
SO2
H2O
Na2O
NaOH
NH3
CuSO4
HCl
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
Na×
·Mg ·
·O·
··
··
Cl ·
··
··
··
1、原子的电子式:
原子的电子式:在元素符号周围用小点“.”或“×”来表示其最外层电子。
二、电子式
2、离子的电子式:
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
阳离子的电子式:简单阳离子的电子式就是它的离子符号,复杂阳离子(NH4+)例外。
阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出所带电荷“n-”。
画出下列离子的电子式:S2-、F-、I-
复杂的阴阳离子
OH- :
O22- :
NH4+ :
[ O H]-
‥
‥
‥
‥
‥
‥
[ O O ]2-
‥
‥
‥
‥
‥
‥
H
‥
‥
[H N H]+
H‥
3、共价化合物的电子式
电子式
O
O
C
Cl
H
练习:书写 NH3、CH4、CS2、HClO的电子式
HCl CO2
AB型
AB2型
A2B型
4、离子化合物的电子式
NaCl
MgCl2
Na2S
练习:书写 BaCl2、NaOH、NH4Cl、Na2O2的电子式
H×
+
· Cl :
‥
‥
H ×
· Cl :
‥
‥
Na×
+
· Cl :
‥
‥
Na+ ×
· Cl :
‥
‥
-
用电子式可以直观地表示出离子键、共价键的形成过程
书写要点
1.左边要用原子的电子式表示,相同的可合并。
2.右边相同的离子要分开并且对称写。
3.用于连结左边和右边的符号是 “ ” , 而不是“=”。电子转移的箭头可标也可不标。
谢谢大家!
离子化合物与共价化合物
高中化学 高一年级
学习目标:
(1)能够判断离子化合物和共价化合物
(2)学会用电子式表示离子键和共价键的形成过程
请运用你所学的知识判断下列物质中分别存在哪些类型的化学键?
NaF CH4 H2O CaO KBr
HF BaCl2 O2 CO 2 MgCl2
离子键: NaF CaO KBr BaCl2 MgCl2
共价键: CH4 H2O HF O2 CO 2
离子化合物:含有离子键的化合物。
一般来说含有金属阳离子(或NH4+)的化合物为离子化合物。如:K2O、CaO、KOH、NaCl、CaSO4、Na2S、NH4Cl等。
【注意】
1.离子化合物含有离子键,也可能同时含共价键
2. 大多数盐类物质属于离子化合物(但AlCl3、B eCl2等例外,它们属于共价化合物),活波金属氧化物、强碱均属于离子化合物。
一、离子化合物与共价化合物
注意:
1.共价化合物只含有共价键;含有共价键的化合物不一定是共价化合物,如NaOH、Na2SO4 、NH4Cl等。
2.酸类物质,非金属氧化物、绝大多数的有机化合物均属于共价化合物。
共价化合物:只含有共价键的化合物
一般来说只含非金属元素的化合物为共价化合物。如:HCl、H2O、CO、SO3、H2SO4等。
判断以下说法的正误。
A、离子化合物只含离子键。
B、含离子键的化合物一定为离子化合物。
C、共价化合物只含共价键。
D、 含共价键的化合物一定为共价化合物。
E、由非金属元素组成的化合物一定是共价化合物。
×
×
×
√
√
判断下列物质中含有的化学键类型
H2 O2 Cl2
CO2 HCl NH3 H2SO4 C2H5OH
NaCl MgBr2 K2S CaO
NaOH Na2SO4 NH4Cl
单质
化
合
物
共价键
离子键
离子键、共价键
离
子
化
合
物
共价化合物
判断下列化合物是离子化合物还是共价化合物。
离子化合物
共价化合物
CaCl2
SO2
H2O
Na2O
NaOH
NH3
CuSO4
HCl
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
Na×
·Mg ·
·O·
··
··
Cl ·
··
··
··
1、原子的电子式:
原子的电子式:在元素符号周围用小点“.”或“×”来表示其最外层电子。
二、电子式
2、离子的电子式:
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
阳离子的电子式:简单阳离子的电子式就是它的离子符号,复杂阳离子(NH4+)例外。
阴离子的电子式:不但要画出最外层电子数,而且还要用中括号“[ ]”括起来,并在右上角标出所带电荷“n-”。
画出下列离子的电子式:S2-、F-、I-
复杂的阴阳离子
OH- :
O22- :
NH4+ :
[ O H]-
‥
‥
‥
‥
‥
‥
[ O O ]2-
‥
‥
‥
‥
‥
‥
H
‥
‥
[H N H]+
H‥
3、共价化合物的电子式
电子式
O
O
C
Cl
H
练习:书写 NH3、CH4、CS2、HClO的电子式
HCl CO2
AB型
AB2型
A2B型
4、离子化合物的电子式
NaCl
MgCl2
Na2S
练习:书写 BaCl2、NaOH、NH4Cl、Na2O2的电子式
H×
+
· Cl :
‥
‥
H ×
· Cl :
‥
‥
Na×
+
· Cl :
‥
‥
Na+ ×
· Cl :
‥
‥
-
用电子式可以直观地表示出离子键、共价键的形成过程
书写要点
1.左边要用原子的电子式表示,相同的可合并。
2.右边相同的离子要分开并且对称写。
3.用于连结左边和右边的符号是 “ ” , 而不是“=”。电子转移的箭头可标也可不标。
谢谢大家!
