1.2.1 元素周期律 课件(共18张PPT) 2023-2024学年高一下学期化学鲁科版(2019)必修第二册
文档属性
| 名称 | 1.2.1 元素周期律 课件(共18张PPT) 2023-2024学年高一下学期化学鲁科版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
第2节 元素周期律和元素周期表
第1课时 元素周期律
今天学什么?
1、学规律
2、比大小
1~18号元素原子电子层数、最外层电子数、化合价、原子半径的周期性变化规律。
微粒半径大小比较的规律。
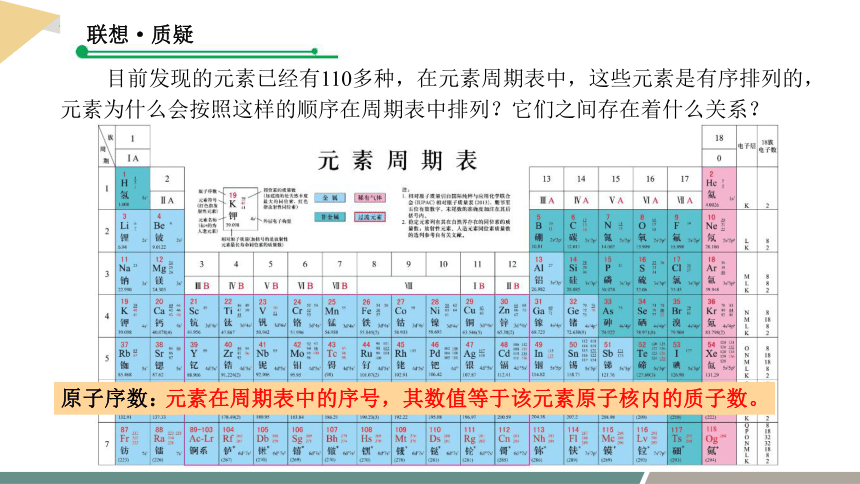
联想·质疑
目前发现的元素已经有110多种,在元素周期表中,这些元素是有序排列的,元素为什么会按照这样的顺序在周期表中排列?它们之间存在着什么关系?
原子序数:
元素在周期表中的序号,其数值等于该元素原子核内的质子数。
一、元素周期律
活动·探究
(1)分组填写教材P11页表中所缺的内容;
(2)请运用作图(直方图、折线图等)的方式对表中各项内容(最外层电子数、化合价、原子半径)进行比较、分析,寻找其中的规律。
(3)小组交流研讨,描述你们发现的规律。
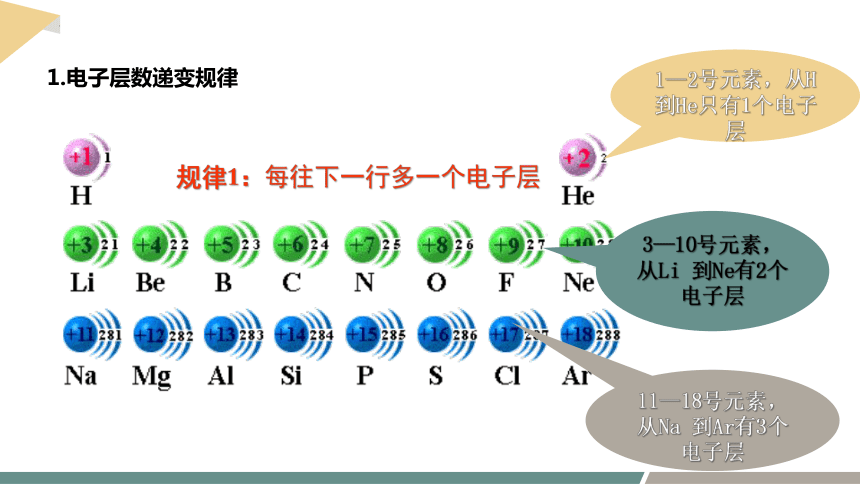
1.电子层数递变规律
3—10号元素,从Li 到Ne有2个电子层
11—18号元素,从Na 到Ar有3个电子层
1—2号元素,从H到He只有1个电子层
规律1:每往下一行多一个电子层
2.最外层电子数的递变规律
1 8
1 8
1 2
最外层电子数
最外层电子数
最外层电子数
周期性变化
事物在运动、变化过程中,某些特征多次重复出现,其连续两次出现所经过的时间叫"周期”。
结论:随着原子序数的递增,元素的原子最外层电子排布呈现周期性变化
3.化合价的变化规律(最高正价、最低负价)
正价渐高,负价绝对值渐低
元素 最高正价 最外层电子数 最低负价
1 H
2 He
3 Li
4 Be
5 B
6 C
7 N
8 O
9 F
10 Ne
1
0
1
2
3
4
5
0
1
2
1
2
3
4
6
5
7
8
1、最高正化合价 = 最外层电子数
-4
-2
-3
-1
2、最外层电子数大于或等于4则出现负价。
3、氟无正价,氧无最高正价。
4、稀有气体化学性质不活泼,看作0价
【观察思考】
2.观察金属元素的化合价有何共性
1.同种元素的最高正价和最低负价有何关系?
3. 除稀有气体外,非金属元素既有正价又有负价。对吗?
最高化合价+ 最低化合价 =8
金属元素只有正价,无负价
不对,F 元素没有正价
某元素R的最高价氧化物对应的水化物是HnRO2n-2,则元素R在其气态氢化物中的化合价是( )A.3n-10 B.12-3n C.3n-4 D.3n-12
【习题探究】
D
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
原子半径/nm 0.037 -
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
原子半径/nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 -
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
原子半径/nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099. -
4.原子半径的递变规律(稀有气体除外)
大
小
大
小
同一横行,原子半径表现为由大到小的周期性变化。
同一纵行,原子半径由小到大。
为什么会有这样的现象?离子半径也遵循这样的规律吗?
微粒直径大小的比较
“三看法”
1、看电子层数
电子层数不同、最外层电子数相同时,电子层数越多,半径越大
1.比较O和S的半径大小
O练一练
2.比较Na和Na+、 O和O2-半径大小
Na>Na+
O2、看核电荷数
电子层数相同时,核电荷数越大,半径越小
练一练
1.比较Na与Mg、Al的原子半径大小
2.比较Na+、O2-、Mg2+的半径大小
Na>Mg>Al
O2->Na+>Mg2+
3、看电子数
同一元素中,阳离子半径<原子,阴离子半径>原子
1、下列微粒半径大小的比较中,正确的是( )A.NaCl->Na+>Al3+
练一练
2、元素X的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素可能为( )
A.Ar B.K C.Al D.P
注意中子数不同的同位素
1.判断正误(正确的打“√”,错误的打“×”)
(1)原子序数与原子的核电荷数一定相等。 ( )
(2)原子序数与离子的核外电子数一定相等。 ( )
(3)原子序数相同的原子是同一种原子。 ( )
(4)随着元素相对原子质量的递增,元素的性质呈周期性变化。( )
[练一练]
√
×
×
×
原子序数=核电荷数=质子数
随着原子序数增加
2.下列关于粒子半径大小的比较,正确的是( )
A.Na+Cl->Na+>Al3+
C.NaB
3、元素X的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素可能为( )
A.Ar B.K C.Al D.P
B
一、元素周期律
1、电子层数递变规律
2、化合价递变规律
4、原子半径递变规律
3、最外层电子数递变规律
二、原子半径比较
三看法
1、看电子层数
2、看核电荷数
3、看电子数
第2节 元素周期律和元素周期表
第1课时 元素周期律
今天学什么?
1、学规律
2、比大小
1~18号元素原子电子层数、最外层电子数、化合价、原子半径的周期性变化规律。
微粒半径大小比较的规律。
联想·质疑
目前发现的元素已经有110多种,在元素周期表中,这些元素是有序排列的,元素为什么会按照这样的顺序在周期表中排列?它们之间存在着什么关系?
原子序数:
元素在周期表中的序号,其数值等于该元素原子核内的质子数。
一、元素周期律
活动·探究
(1)分组填写教材P11页表中所缺的内容;
(2)请运用作图(直方图、折线图等)的方式对表中各项内容(最外层电子数、化合价、原子半径)进行比较、分析,寻找其中的规律。
(3)小组交流研讨,描述你们发现的规律。
1.电子层数递变规律
3—10号元素,从Li 到Ne有2个电子层
11—18号元素,从Na 到Ar有3个电子层
1—2号元素,从H到He只有1个电子层
规律1:每往下一行多一个电子层
2.最外层电子数的递变规律
1 8
1 8
1 2
最外层电子数
最外层电子数
最外层电子数
周期性变化
事物在运动、变化过程中,某些特征多次重复出现,其连续两次出现所经过的时间叫"周期”。
结论:随着原子序数的递增,元素的原子最外层电子排布呈现周期性变化
3.化合价的变化规律(最高正价、最低负价)
正价渐高,负价绝对值渐低
元素 最高正价 最外层电子数 最低负价
1 H
2 He
3 Li
4 Be
5 B
6 C
7 N
8 O
9 F
10 Ne
1
0
1
2
3
4
5
0
1
2
1
2
3
4
6
5
7
8
1、最高正化合价 = 最外层电子数
-4
-2
-3
-1
2、最外层电子数大于或等于4则出现负价。
3、氟无正价,氧无最高正价。
4、稀有气体化学性质不活泼,看作0价
【观察思考】
2.观察金属元素的化合价有何共性
1.同种元素的最高正价和最低负价有何关系?
3. 除稀有气体外,非金属元素既有正价又有负价。对吗?
最高化合价+ 最低化合价 =8
金属元素只有正价,无负价
不对,F 元素没有正价
某元素R的最高价氧化物对应的水化物是HnRO2n-2,则元素R在其气态氢化物中的化合价是( )A.3n-10 B.12-3n C.3n-4 D.3n-12
【习题探究】
D
第 一 周 期 原子序数 1 2
元素名称 氢 氦
元素符号 H He
原子半径/nm 0.037 -
第 二 周 期 原子序数 3 4 5 6 7 8 9 10
元素名称 锂 铍 硼 碳 氮 氧 氟 氖
元素符号 Li Be B C N O F Ne
原子半径/nm 0.152 0.089 0.082 0.077 0.075 0.074 0.071 -
第 三 周 期 原子序数 11 12 13 14 15 16 17 18
元素名称 钠 镁 铝 硅 磷 硫 氯 氩
元素符号 Na Mg Al Si P S Cl Ar
原子半径/nm 0.186 0.160 0.143 0.117 0.110 0.102 0.099. -
4.原子半径的递变规律(稀有气体除外)
大
小
大
小
同一横行,原子半径表现为由大到小的周期性变化。
同一纵行,原子半径由小到大。
为什么会有这样的现象?离子半径也遵循这样的规律吗?
微粒直径大小的比较
“三看法”
1、看电子层数
电子层数不同、最外层电子数相同时,电子层数越多,半径越大
1.比较O和S的半径大小
O
2.比较Na和Na+、 O和O2-半径大小
Na>Na+
O
电子层数相同时,核电荷数越大,半径越小
练一练
1.比较Na与Mg、Al的原子半径大小
2.比较Na+、O2-、Mg2+的半径大小
Na>Mg>Al
O2->Na+>Mg2+
3、看电子数
同一元素中,阳离子半径<原子,阴离子半径>原子
1、下列微粒半径大小的比较中,正确的是( )A.Na
练一练
2、元素X的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素可能为( )
A.Ar B.K C.Al D.P
注意中子数不同的同位素
1.判断正误(正确的打“√”,错误的打“×”)
(1)原子序数与原子的核电荷数一定相等。 ( )
(2)原子序数与离子的核外电子数一定相等。 ( )
(3)原子序数相同的原子是同一种原子。 ( )
(4)随着元素相对原子质量的递增,元素的性质呈周期性变化。( )
[练一练]
√
×
×
×
原子序数=核电荷数=质子数
随着原子序数增加
2.下列关于粒子半径大小的比较,正确的是( )
A.Na+
C.Na
3、元素X的离子与钙离子的核外电子排布相同,且X的离子半径小于负二价硫离子的半径。X元素可能为( )
A.Ar B.K C.Al D.P
B
一、元素周期律
1、电子层数递变规律
2、化合价递变规律
4、原子半径递变规律
3、最外层电子数递变规律
二、原子半径比较
三看法
1、看电子层数
2、看核电荷数
3、看电子数
