4.3.2共价键 分子间作用力 课件(共24张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3.2共价键 分子间作用力 课件(共24张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 12:17:49 | ||
图片预览





文档简介
(共24张PPT)
第三节
《化学键》
第一章 《物质结构 元素周期律》
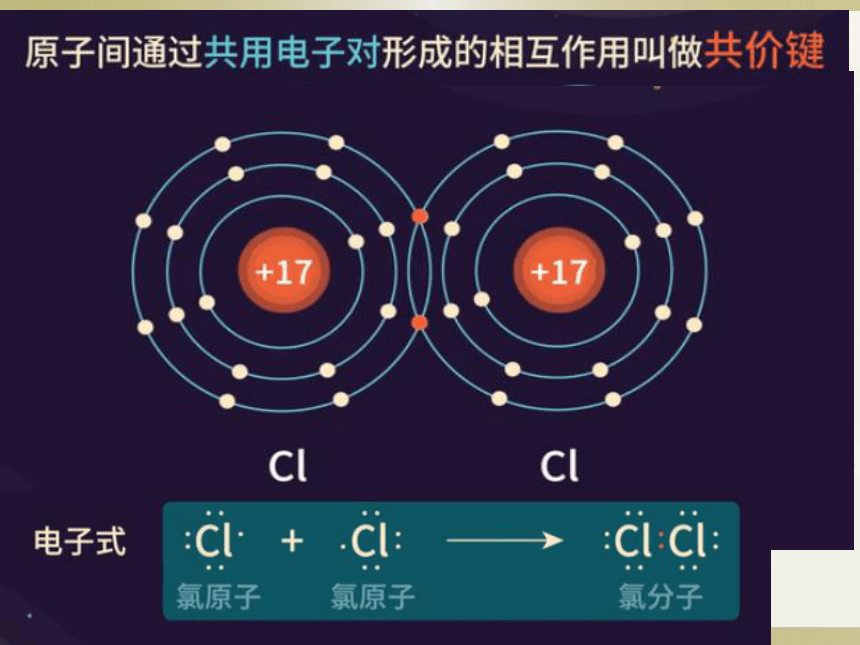
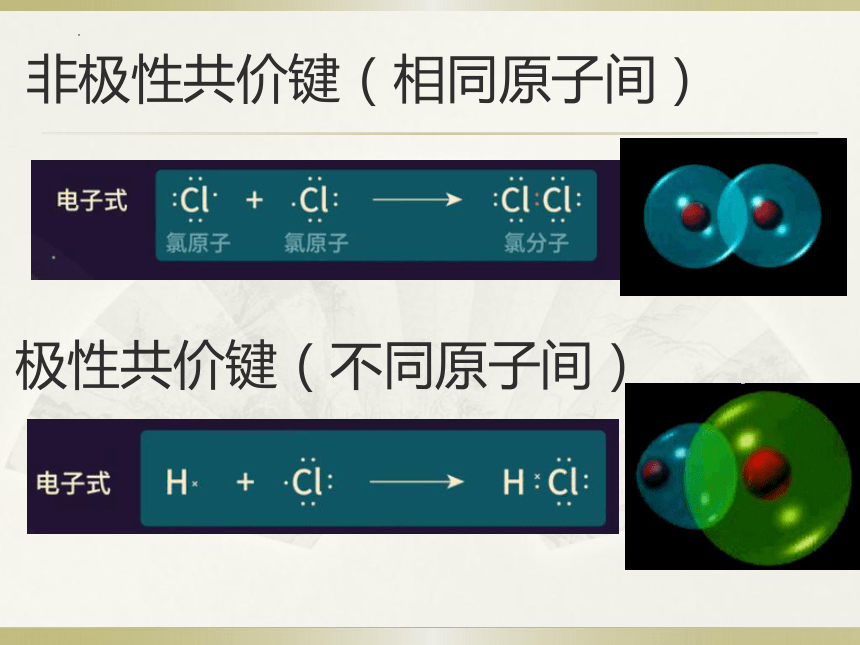
非极性共价键(相同原子间)
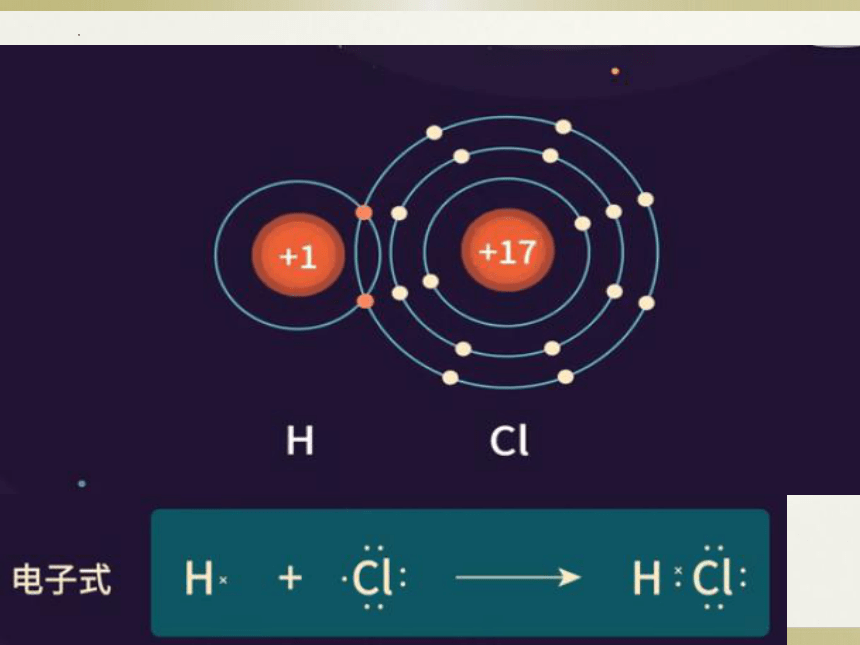
极性共价键(不同原子间)
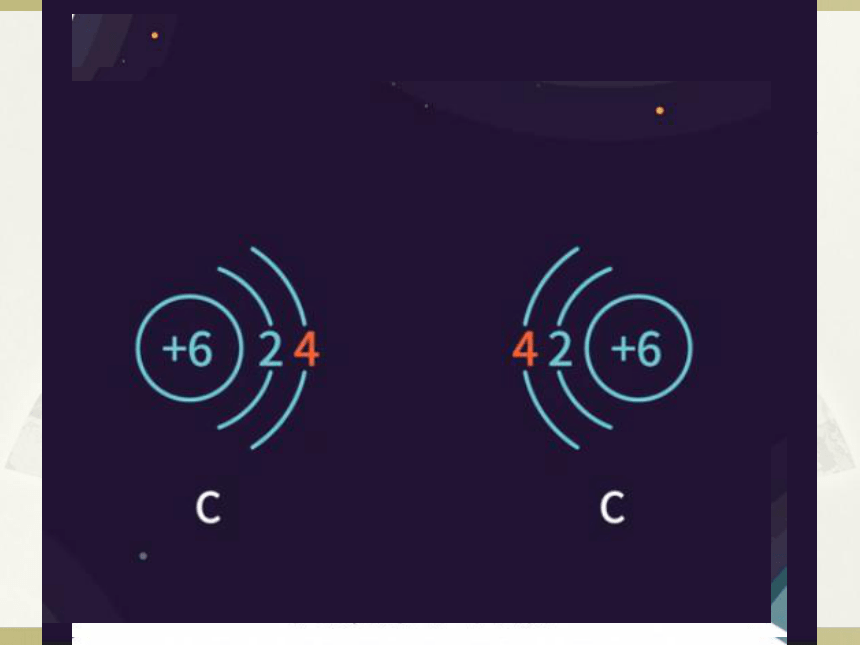
共价化合物
思考:含有共价键的是不是一定是共价化合物?
用电子式表示共用电子对
一对共用电子对
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
两对共用电子对
三对共用电子对
N N
..
..
..
..
..
..
..
O C O
..
..
..
..
..
..
用电子式表示共价化合物
1.每个原子均应达到稳定的结构。
2.不加中括号[ ],不标正负电荷数。
3.原子最外层电子数距8电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子对(即几个共价键)
写出NaOH、Na2O2的电子式,并分析两化合物中的成键情况,请判断属于离子化合物还是共价化合物?
离子键
共价键
共价键
离子键
离子化合物
离子化合物
离子键
一对共用电子对
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
两对共用电子对
三对共用电子对
N N
..
..
..
..
..
用一条短线来表示原子间的一对共用电子对
省略其余的电子。
O=C=O
N N
结构式:
..
..
O C O
..
..
..
..
..
..
H-H Cl-Cl H-Cl
H O O
H
O=C=O
H-O-O-H
CH4 CO2 H2O2
用电子式和结构式表示下列共价分子:
H
H
:
C
:
H
H
C
H
H
H
H
练习
电子式
结构式
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
一般化学物质主要通过离子键或共价键结合而成。化学键的形成与原子结构有关,他主要通过原子的价电子间的转移或共用来实现!
离子键与共价键的比较
项目 类型 共价键 离子键
成键元素
成键粒子
成键本质
化合物电子式
非金属元素间
活泼金属与活
泼非金属化合
原 子
阴、阳离子
形成共用电子对
静电作用
Na [ Cl ]
+
-
X
含有共价键的化合物不一定是共价化合物
共价化合物中一定含有共价键
共价化合物中一定不含离子键
含有离子键的化合物一定是离子化合物。
离子化合物中一定含有离子键
离子化合物中可能是含有共价键
注意辨析:
三、分子间作用力和氢键
1.分子间作用力
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
应用:对于四氟化碳、四氯化碳、四溴化碳、四碘化碳,其熔沸点如何变化?
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对原子质量的关系
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小 意义
化学键
范德华力
原子间
分子之间
作用力大
作用力小
影响化学性质和
物理性质
影响物理性质
(熔沸点等)
分子之间无化学键
为什么HF、H2O和NH3的沸点会反常呢?
讨论:
一些氢化物的沸点
2.氢键
1)形成条件:原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不同,一般为N、O、F)。
3)氢键能级:比化学键弱很多但比分子间作用力稍强
4)特征:具有方向性。
结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
思考:为什么冰会浮在水面上?雪花为什么是六角形的?
结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
5)氢键作用:使物质有较高的熔沸点(H2O、HF 、NH3)、 使物质易溶于水(C2H5OH,CH3COOH) 、解释一些反常现象
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
小结:
有几种形成方式?
第三节
《化学键》
第一章 《物质结构 元素周期律》
非极性共价键(相同原子间)
极性共价键(不同原子间)
共价化合物
思考:含有共价键的是不是一定是共价化合物?
用电子式表示共用电子对
一对共用电子对
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
两对共用电子对
三对共用电子对
N N
..
..
..
..
..
..
..
O C O
..
..
..
..
..
..
用电子式表示共价化合物
1.每个原子均应达到稳定的结构。
2.不加中括号[ ],不标正负电荷数。
3.原子最外层电子数距8电子稳定结构差几个电子,就提供几个电子,并在此原子周围形成几对共用电子对(即几个共价键)
写出NaOH、Na2O2的电子式,并分析两化合物中的成键情况,请判断属于离子化合物还是共价化合物?
离子键
共价键
共价键
离子键
离子化合物
离子化合物
离子键
一对共用电子对
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
两对共用电子对
三对共用电子对
N N
..
..
..
..
..
用一条短线来表示原子间的一对共用电子对
省略其余的电子。
O=C=O
N N
结构式:
..
..
O C O
..
..
..
..
..
..
H-H Cl-Cl H-Cl
H O O
H
O=C=O
H-O-O-H
CH4 CO2 H2O2
用电子式和结构式表示下列共价分子:
H
H
:
C
:
H
H
C
H
H
H
H
练习
电子式
结构式
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
一般化学物质主要通过离子键或共价键结合而成。化学键的形成与原子结构有关,他主要通过原子的价电子间的转移或共用来实现!
离子键与共价键的比较
项目 类型 共价键 离子键
成键元素
成键粒子
成键本质
化合物电子式
非金属元素间
活泼金属与活
泼非金属化合
原 子
阴、阳离子
形成共用电子对
静电作用
Na [ Cl ]
+
-
X
含有共价键的化合物不一定是共价化合物
共价化合物中一定含有共价键
共价化合物中一定不含离子键
含有离子键的化合物一定是离子化合物。
离子化合物中一定含有离子键
离子化合物中可能是含有共价键
注意辨析:
三、分子间作用力和氢键
1.分子间作用力
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
应用:对于四氟化碳、四氯化碳、四溴化碳、四碘化碳,其熔沸点如何变化?
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对原子质量的关系
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小 意义
化学键
范德华力
原子间
分子之间
作用力大
作用力小
影响化学性质和
物理性质
影响物理性质
(熔沸点等)
分子之间无化学键
为什么HF、H2O和NH3的沸点会反常呢?
讨论:
一些氢化物的沸点
2.氢键
1)形成条件:原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不同,一般为N、O、F)。
3)氢键能级:比化学键弱很多但比分子间作用力稍强
4)特征:具有方向性。
结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
思考:为什么冰会浮在水面上?雪花为什么是六角形的?
结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
5)氢键作用:使物质有较高的熔沸点(H2O、HF 、NH3)、 使物质易溶于水(C2H5OH,CH3COOH) 、解释一些反常现象
原子
分子
离子
宏观
物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
小结:
有几种形成方式?
