4.1.3核素 课件 (共20张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.3核素 课件 (共20张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 12:18:39 | ||
图片预览




文档简介
(共20张PPT)
第一节 元素周期表
第三课时 核 素
中央电视台,“鉴宝”栏目春节特别节目中,主持人展示了一根7000多年前的鹤腿骨笛。被看成无价之宝。那人们是如何知道它是7000多年前的呢?
用C-14的半衰期计算的。 C-14和我们见过的C-12是什么关系呢?
在我们学习了本节内容之后就能知道了
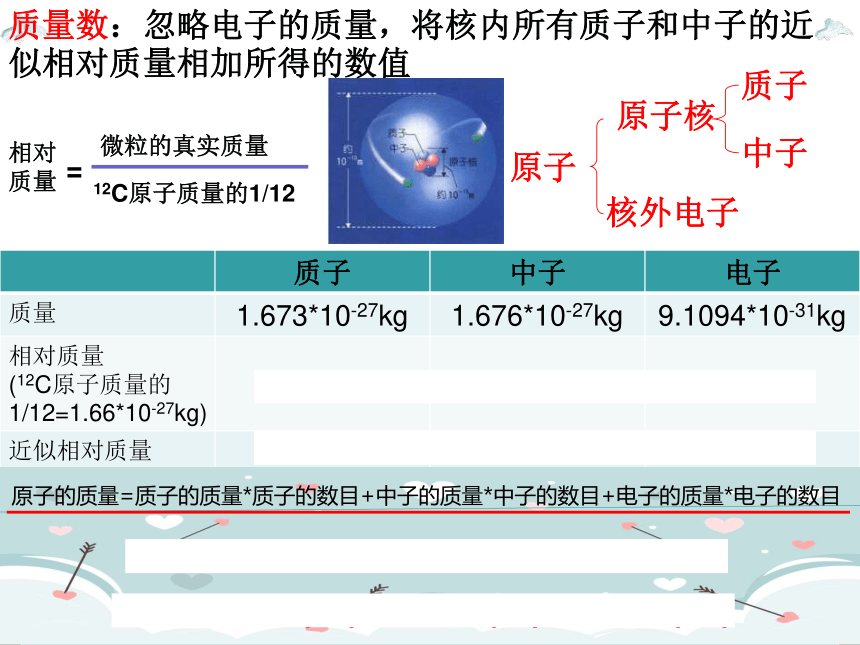
原子
原子核
核外电子
质子
中子
质子 中子 电子
质量 1.673*10-27kg 1.676*10-27kg 9.1094*10-31kg
相对质量 (12C原子质量的1/12=1.66*10-27kg) 1.007 1.008 1/1836
近似相对质量 1 1 0
原子的近似相对原子质量=1*质子数+1*中子数
原子的质量=质子的质量*质子的数目+中子的质量*中子的数目+电子的质量*电子的数目
原子:质量数(A)=质子数(Z)+中子数(N)
质量数:忽略电子的质量,将核内所有质子和中子的近似相对质量相加所得的数值
相对
质量
=
微粒的真实质量
12C原子质量的1/12
质量数:
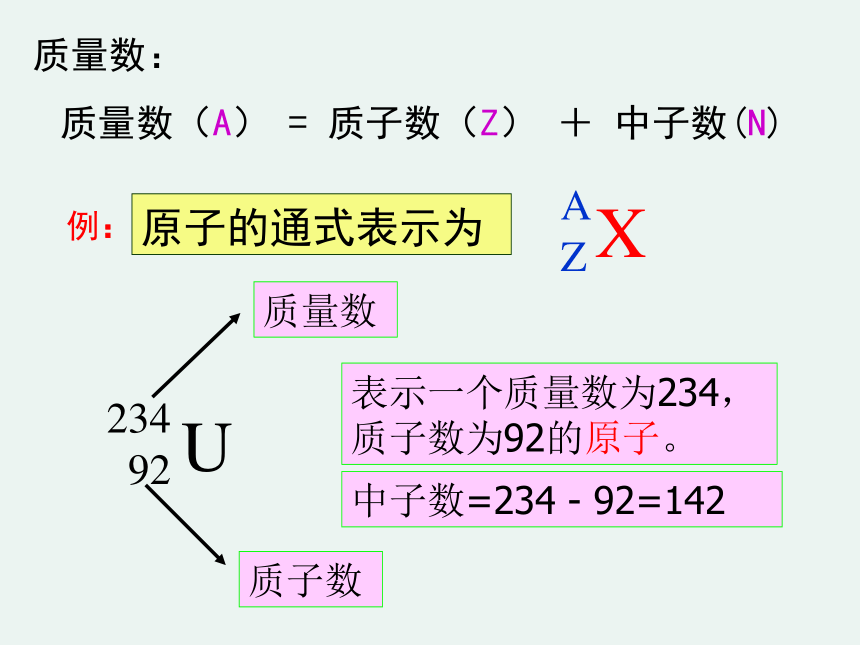
质量数(A) = 质子数(Z) + 中子数(N)
原子的通式表示为
X
A
Z
例:
U
234
92
质量数
质子数
表示一个质量数为234,
质子数为92的原子。
中子数=234 - 92=142
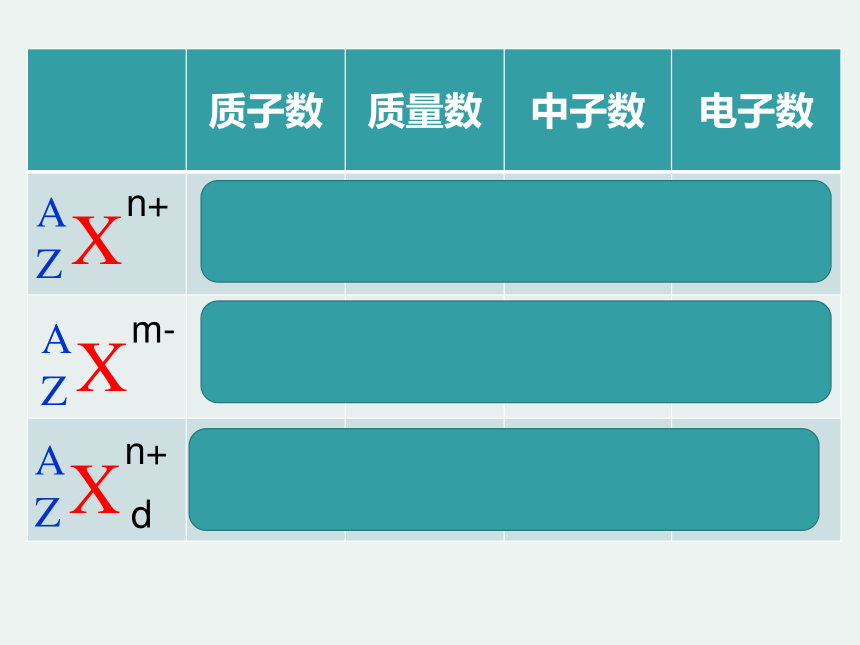
质子数 质量数 中子数 电子数
Z A A-Z Z-n
Z A A-Z Z+m
dZ dA d(A-Z) dZ-n
X
A
Z
n+
X
A
Z
m-
X
A
Z
n+
d
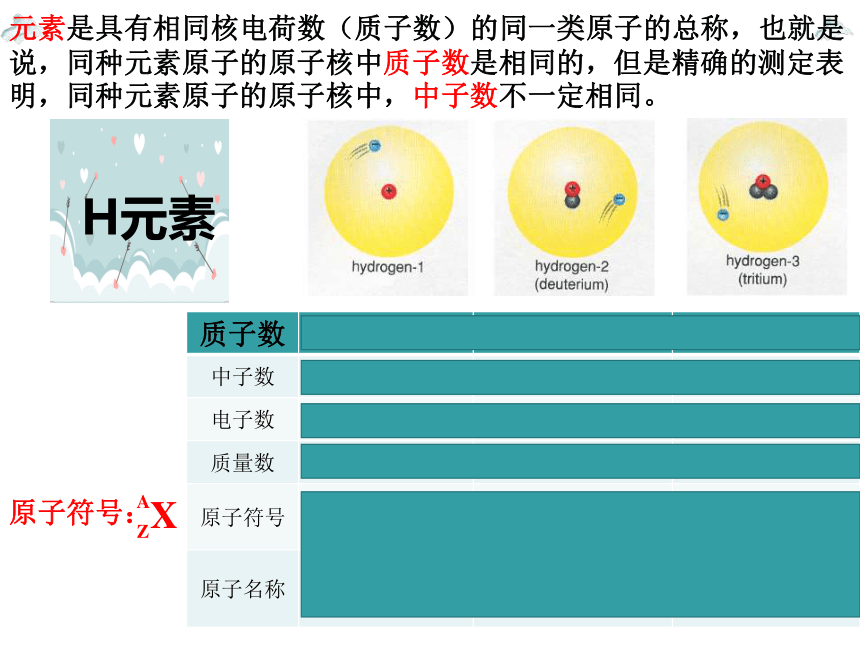
H元素
质子数 1 1 1
中子数 0 1 2
电子数 1 1 1
质量数 1 2 3
原子符号 或D 或T
原子名称 氕 氘 氚
H
1
1
H
2
1
H
3
1
X
A
Z
原子符号:
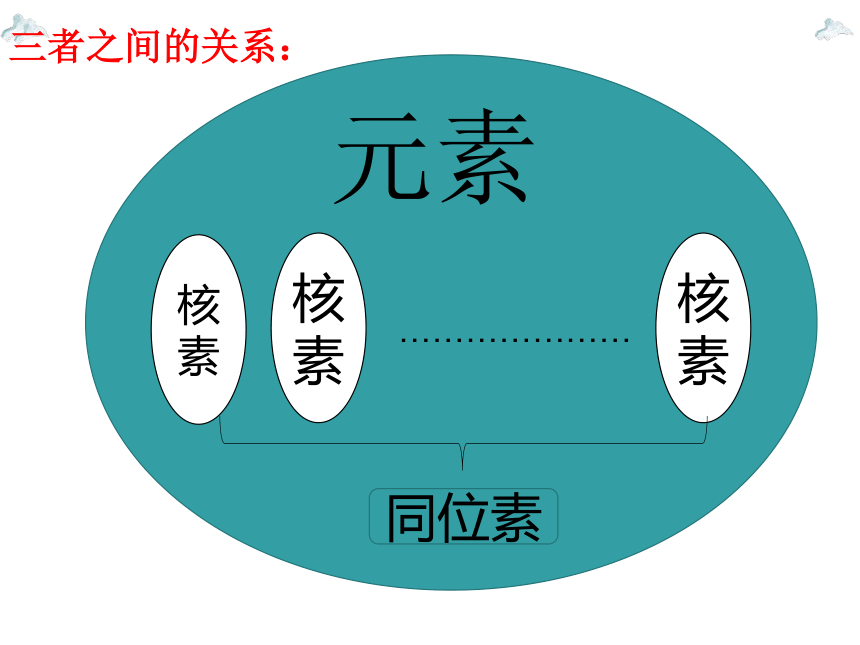
元素是具有相同核电荷数(质子数)的同一类原子的总称,也就是说,同种元素原子的原子核中质子数是相同的,但是精确的测定表明,同种元素原子的原子核中,中子数不一定相同。
元素:具有相同核电荷数的同一类原子的总称。例如:氕、氘、氚都为氢元素
核素:具有一定质子数和一定中子数的某种元素的原子。例如:氕、氘、氚为三种不同的核素
原子:化学变化中的最小粒子。例如一个氢原子
宏观概念,只表示种类,不表示数目
同位素:同一元素的不同核素互称为同位素。例如:氕、氘、氚互为同位素。
微观概念,既表示种类,也表示数目
微观概念,只表示种类,不表示数目
是一种关系
元素
核
素
核
素
核
素
…………………
同位素
三者之间的关系:
如果某原子X的中子数为N,质量数为A,试回答:
(1)A的质子数
(2)AXc+的电子数
(3)mg AXc+含有质子的物质的量是多少?
A-N
A-N-n
原子AXc+的质子数=A-N
原子AXc+的物质的量=m/M=m/A
质子AXc+的物质的量=m/A*(A-N)
在数值上,摩尔质量与相对原子质量相同,近似相对原子质量=质量数
氕[piē]
氕不但是一种优质燃料,还是石油、化工、化肥和冶金工业中的重要原料和物料。石油和其他化石燃料的精炼需要氢;化工中制氨、制甲醇也需要氢。氢还用来还原铁矿石。用氢制成燃料电池可直接发电。采用燃料电池和氢气-蒸汽联合循环发电,其能量转换效率将远高于现有的火电厂。随着制氢技术的进步和贮氢手段的完善,氢能将在21世纪的能源舞台上大展风采。
氘[dāo]
氘为氢的另一种稳定形态的同位素,也被称为重氢。用于热核反应。聚变时放出β射线后形成质量数为 3 的氦。氘被称为"未来的天然燃料"。常温下,氘是一种无色、无味、无毒无害的可燃性气体。它用于核能、可控核聚变反应、氘化光导纤维、氘润滑油、激光器、灯泡、实验研究、半导体材料韧化处理以及核医学,核农业等方面;在军事上,可制造氢弹,中子弹和东风激光武器。
氚[chuān]
氚也被称作超重氢。原子核中有一个质子和两个中子。并带有放射性,会发生β衰变,其半衰期为12.43年。由于氚的β衰变只会放出高速移动的电子,不会穿透人体,因此只有大量吸入氚才会对人体有害。在地球的自然界中,相比一般的氢气,氚的含量极少。氚的产生是当宇宙射线所带的高能量中子撞击氘核,其氘核与中子结合为氚核。氚与氘一样,都是制造氢弹的原料。自然界中存在极微,从核反应制得。主要用于热核反应。
因为很少量的放射性物质就可以很容易被检测出,所以放射性同位素广泛地作为示踪原子应用于跟踪化学反应。这称为示踪方法。
天然存在的放射性同位素具有一定的半衰期,可以作为统一时间的校准“钟”,用来确定地球历史的经历。半衰期最长的同位素,特别是天然放射系的母体,可以提供关于地球的年龄和岩石和陨星的年龄的信息。
放射性另一有趣的应用是通过测定14C的含量,确定含碳物质的年龄。
放射性同位素最早应用之一是用在治疗癌症,用以破坏有害的细胞。近年用改善了癌症的治疗。
同位素的两个特征:
①同一元素的各种同位素的化学性质几乎完全相同,物理性质略有差异
②在天然存在的某种元素里,各种同位素所占的原子个数百分数(也称作“丰度”)一般是不变的。
同位素的理解:
同:同一元素,相同的质子数,位于元素周期表中同一位置
氢的三种核素 氕 氘 氚
原子质量 1.67*10-27kg 3.34*10-27kg 5.01*10-27kg
丰度 (在自然界所占比率) 99.98% 0.016% 0.004%
相对原子质量 (12C原子质量的1/12=1.66*10-27kg) 1.007 2.012 3.018
近似相对原子质量 1 2 3
氢元素
相对原子质量 1.007*99.98%+2.012*0.016%+3.018*0.004%
=1.0068+0.00032+0.00012=1.008
近似相对原子质量 1*99.98%+2*0.016%+3*0.004%
=0.9998+0.00032+0.00012=1
元素的相对原子质量,就是按照该元素各种核素原子所占的一定百分比算出的平均值。
Cl元素相对原子质量=M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453
例:Cl元素相对原子质量的计算
同位素 同位素的相对原子质量(Mi) 丰度(ai)
34.969 75.77%
36.966 24.23%
Cl元素近似相对原子质量= A1×a1 + A2×a2
= 35×75.77% + 37×24.23% = 35.485
35×75% + 37×25% = 35.5
(进一步对丰度作近似处理)
Cl: 34.966 Cl: 36.969
含量:75% 含量:25%
Cl:35.5
问题:
Cl中的35表示: ,
Cl中的34.966表示: ,
Cl中的35.5表示: 。
Cl原子的质量数
35
17
Cl原子的相对原子质量
35
17
氯元素的相对原子质量
35
17
37
17
35
17
35
17
氯的原子序数为17, 3517Cl是氯的一种
核素,下列说法正确的是
A、 3517Cl原子所含的质子数为18
B、1/18mol的1H35Cl分子所含中子数
约为NA个
C、3.5g35Cl2的体积约为2.24L
D、35Cl2气体的摩尔质量为70g/mol
BD
同素异形体
同一元素形成的不同单质,互称为同素异形体。
例如:
氧元素形成的:O2、O3
碳元素形成的:金刚石、石墨、C60
第一节 元素周期表
第三课时 核 素
中央电视台,“鉴宝”栏目春节特别节目中,主持人展示了一根7000多年前的鹤腿骨笛。被看成无价之宝。那人们是如何知道它是7000多年前的呢?
用C-14的半衰期计算的。 C-14和我们见过的C-12是什么关系呢?
在我们学习了本节内容之后就能知道了
原子
原子核
核外电子
质子
中子
质子 中子 电子
质量 1.673*10-27kg 1.676*10-27kg 9.1094*10-31kg
相对质量 (12C原子质量的1/12=1.66*10-27kg) 1.007 1.008 1/1836
近似相对质量 1 1 0
原子的近似相对原子质量=1*质子数+1*中子数
原子的质量=质子的质量*质子的数目+中子的质量*中子的数目+电子的质量*电子的数目
原子:质量数(A)=质子数(Z)+中子数(N)
质量数:忽略电子的质量,将核内所有质子和中子的近似相对质量相加所得的数值
相对
质量
=
微粒的真实质量
12C原子质量的1/12
质量数:
质量数(A) = 质子数(Z) + 中子数(N)
原子的通式表示为
X
A
Z
例:
U
234
92
质量数
质子数
表示一个质量数为234,
质子数为92的原子。
中子数=234 - 92=142
质子数 质量数 中子数 电子数
Z A A-Z Z-n
Z A A-Z Z+m
dZ dA d(A-Z) dZ-n
X
A
Z
n+
X
A
Z
m-
X
A
Z
n+
d
H元素
质子数 1 1 1
中子数 0 1 2
电子数 1 1 1
质量数 1 2 3
原子符号 或D 或T
原子名称 氕 氘 氚
H
1
1
H
2
1
H
3
1
X
A
Z
原子符号:
元素是具有相同核电荷数(质子数)的同一类原子的总称,也就是说,同种元素原子的原子核中质子数是相同的,但是精确的测定表明,同种元素原子的原子核中,中子数不一定相同。
元素:具有相同核电荷数的同一类原子的总称。例如:氕、氘、氚都为氢元素
核素:具有一定质子数和一定中子数的某种元素的原子。例如:氕、氘、氚为三种不同的核素
原子:化学变化中的最小粒子。例如一个氢原子
宏观概念,只表示种类,不表示数目
同位素:同一元素的不同核素互称为同位素。例如:氕、氘、氚互为同位素。
微观概念,既表示种类,也表示数目
微观概念,只表示种类,不表示数目
是一种关系
元素
核
素
核
素
核
素
…………………
同位素
三者之间的关系:
如果某原子X的中子数为N,质量数为A,试回答:
(1)A的质子数
(2)AXc+的电子数
(3)mg AXc+含有质子的物质的量是多少?
A-N
A-N-n
原子AXc+的质子数=A-N
原子AXc+的物质的量=m/M=m/A
质子AXc+的物质的量=m/A*(A-N)
在数值上,摩尔质量与相对原子质量相同,近似相对原子质量=质量数
氕[piē]
氕不但是一种优质燃料,还是石油、化工、化肥和冶金工业中的重要原料和物料。石油和其他化石燃料的精炼需要氢;化工中制氨、制甲醇也需要氢。氢还用来还原铁矿石。用氢制成燃料电池可直接发电。采用燃料电池和氢气-蒸汽联合循环发电,其能量转换效率将远高于现有的火电厂。随着制氢技术的进步和贮氢手段的完善,氢能将在21世纪的能源舞台上大展风采。
氘[dāo]
氘为氢的另一种稳定形态的同位素,也被称为重氢。用于热核反应。聚变时放出β射线后形成质量数为 3 的氦。氘被称为"未来的天然燃料"。常温下,氘是一种无色、无味、无毒无害的可燃性气体。它用于核能、可控核聚变反应、氘化光导纤维、氘润滑油、激光器、灯泡、实验研究、半导体材料韧化处理以及核医学,核农业等方面;在军事上,可制造氢弹,中子弹和东风激光武器。
氚[chuān]
氚也被称作超重氢。原子核中有一个质子和两个中子。并带有放射性,会发生β衰变,其半衰期为12.43年。由于氚的β衰变只会放出高速移动的电子,不会穿透人体,因此只有大量吸入氚才会对人体有害。在地球的自然界中,相比一般的氢气,氚的含量极少。氚的产生是当宇宙射线所带的高能量中子撞击氘核,其氘核与中子结合为氚核。氚与氘一样,都是制造氢弹的原料。自然界中存在极微,从核反应制得。主要用于热核反应。
因为很少量的放射性物质就可以很容易被检测出,所以放射性同位素广泛地作为示踪原子应用于跟踪化学反应。这称为示踪方法。
天然存在的放射性同位素具有一定的半衰期,可以作为统一时间的校准“钟”,用来确定地球历史的经历。半衰期最长的同位素,特别是天然放射系的母体,可以提供关于地球的年龄和岩石和陨星的年龄的信息。
放射性另一有趣的应用是通过测定14C的含量,确定含碳物质的年龄。
放射性同位素最早应用之一是用在治疗癌症,用以破坏有害的细胞。近年用改善了癌症的治疗。
同位素的两个特征:
①同一元素的各种同位素的化学性质几乎完全相同,物理性质略有差异
②在天然存在的某种元素里,各种同位素所占的原子个数百分数(也称作“丰度”)一般是不变的。
同位素的理解:
同:同一元素,相同的质子数,位于元素周期表中同一位置
氢的三种核素 氕 氘 氚
原子质量 1.67*10-27kg 3.34*10-27kg 5.01*10-27kg
丰度 (在自然界所占比率) 99.98% 0.016% 0.004%
相对原子质量 (12C原子质量的1/12=1.66*10-27kg) 1.007 2.012 3.018
近似相对原子质量 1 2 3
氢元素
相对原子质量 1.007*99.98%+2.012*0.016%+3.018*0.004%
=1.0068+0.00032+0.00012=1.008
近似相对原子质量 1*99.98%+2*0.016%+3*0.004%
=0.9998+0.00032+0.00012=1
元素的相对原子质量,就是按照该元素各种核素原子所占的一定百分比算出的平均值。
Cl元素相对原子质量=M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453
例:Cl元素相对原子质量的计算
同位素 同位素的相对原子质量(Mi) 丰度(ai)
34.969 75.77%
36.966 24.23%
Cl元素近似相对原子质量= A1×a1 + A2×a2
= 35×75.77% + 37×24.23% = 35.485
35×75% + 37×25% = 35.5
(进一步对丰度作近似处理)
Cl: 34.966 Cl: 36.969
含量:75% 含量:25%
Cl:35.5
问题:
Cl中的35表示: ,
Cl中的34.966表示: ,
Cl中的35.5表示: 。
Cl原子的质量数
35
17
Cl原子的相对原子质量
35
17
氯元素的相对原子质量
35
17
37
17
35
17
35
17
氯的原子序数为17, 3517Cl是氯的一种
核素,下列说法正确的是
A、 3517Cl原子所含的质子数为18
B、1/18mol的1H35Cl分子所含中子数
约为NA个
C、3.5g35Cl2的体积约为2.24L
D、35Cl2气体的摩尔质量为70g/mol
BD
同素异形体
同一元素形成的不同单质,互称为同素异形体。
例如:
氧元素形成的:O2、O3
碳元素形成的:金刚石、石墨、C60
