4.2.1元素周期律 课件 (共17张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2.1元素周期律 课件 (共17张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-02 12:20:44 | ||
图片预览



文档简介
(共17张PPT)
第二节
元素周期律
2020
第二课时元素周期律
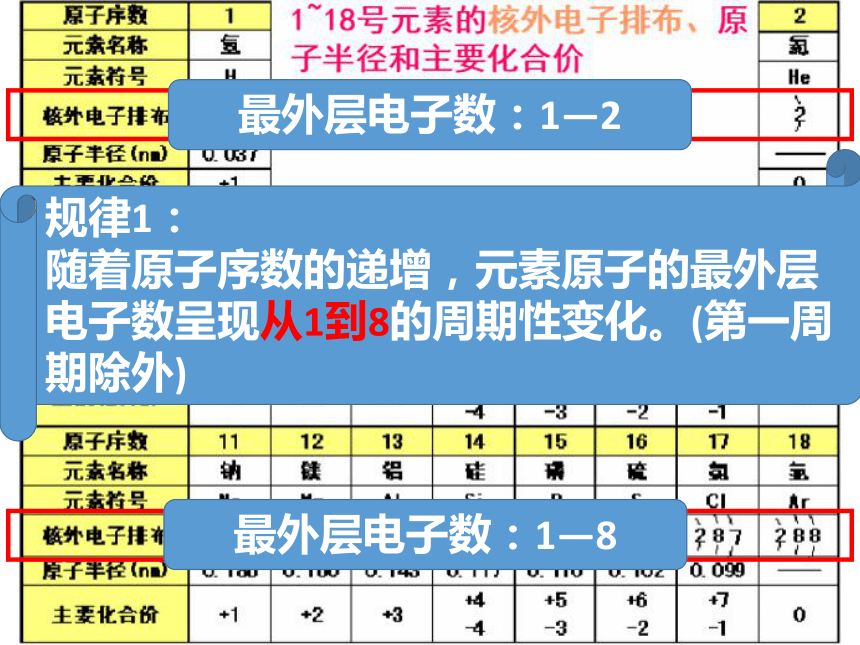
最外层电子数:1—2
最外层电子数:1—8
最外层电子数:1—8
规律1:
随着原子序数的递增,元素原子的最外层电子数呈现从1到8的周期性变化。(第一周期除外)
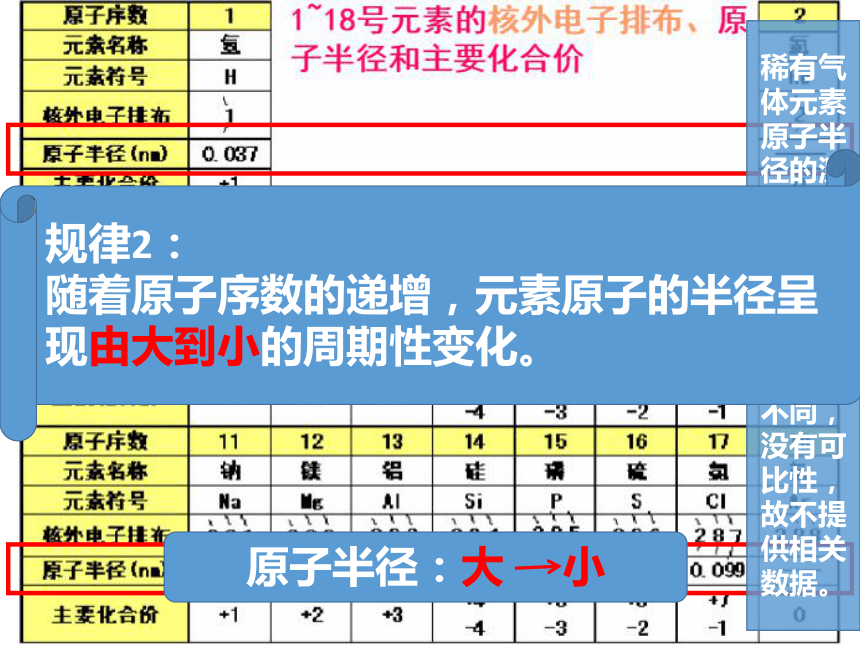
稀有气体元素原子半径的测定依据与相邻非金属元素原子的测定依据不同,没有可比性,故不提供相关数据。
原子半径:大 小
原子半径:大 小
规律2:
随着原子序数的递增,元素原子的半径呈现由大到小的周期性变化。
稀有气体元素性质相对比较稳定,极少进行化学反应,化合价为0 ,不再具体研究
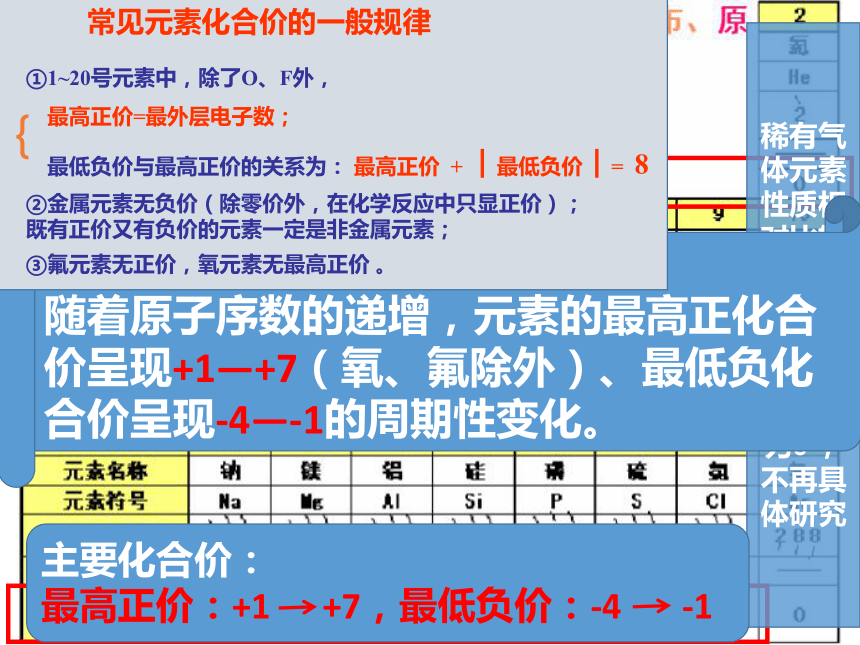
主要化合价:
最高正价:+1 +5,最低负价:-4 -1
主要化合价:
最高正价:+1 +7,最低负价:-4 -1
规律3:
随着原子序数的递增,元素的最高正化合价呈现+1—+7(氧、氟除外)、最低负化合价呈现-4—-1的周期性变化。
常见元素化合价的一般规律
①1~20号元素中,除了O、F外,
最高正价=最外层电子数;
最低负价与最高正价的关系为: 最高正价 + ︱最低负价︱= 8
{
②金属元素无负价(除零价外,在化学反应中只显正价);既有正价又有负价的元素一定是非金属元素;
③氟元素无正价,氧元素无最高正价 。
规律:
随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
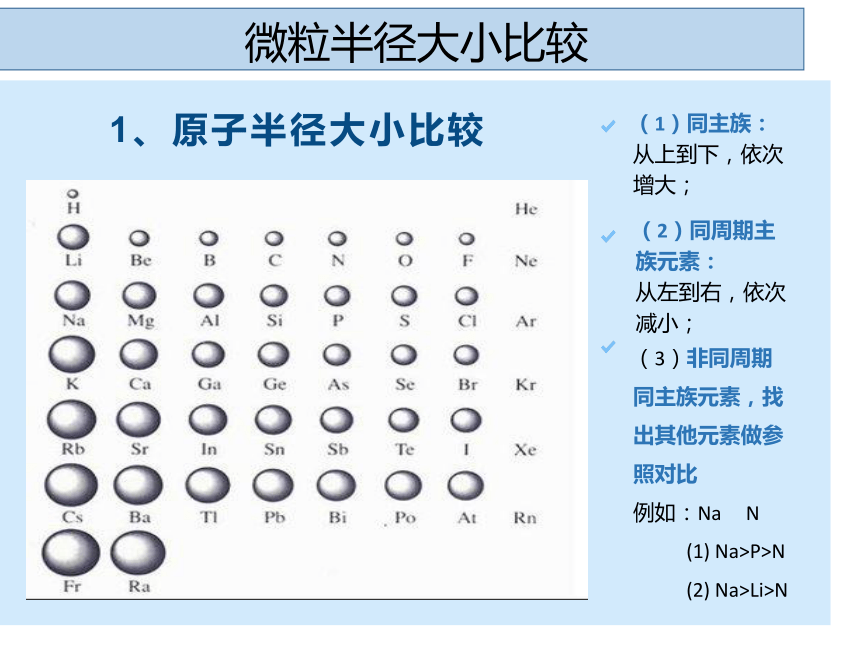
(2)同周期主族元素:
从左到右,依次减小;
(1)同主族:
从上到下,依次增大;
1、原子半径大小比较
(3)非同周期同主族元素,找出其他元素做参照对比
例如:Na N
(1) Na>P>N
(2) Na>Li>N
微粒半径大小比较
2、离子半径大小比较
微粒半径大小比较
(1)同主族:
结论:从上到下,离子半径依次增大
以碱金属为例进行分析:Li+ 核外电子排布为2,Na+核外电子排布为2、8,K+核外电子排布为2、8、8,参照0族元素原子半径大小比较
以卤族元素为例进行分析,F-核外电子排布为2、8,Cl-核外电子排布为2、8、8,Br-核外电子排布为2、8、18、8,参照0族元素原子半径比较
(2)同周期主族元素:
结论:阴离子半径大于阳离子半径
以第三周期为例进行分析:Na+、Mg2+、Al3+、S2-、Cl-
Na+、Mg2+、Al3+ 核外电子排布为 2、8
S2-、Cl- 核外电子排布为 2、8、8
2、离子半径大小比较
微粒半径大小比较
(3)核外电子排布相同的离子:
结论:核电荷数越多,半径越小
以Na+、Mg2+、Al3+为例进行分析:核外电子排布为2、8,核电荷数依次为11、12、13。
核电荷数越多,对核外电子的吸引能力越强,半径越小。
(4)同种元素的不同微粒进行比较:
结论:电子数越多,半径越大
以Na、Na+为例进行分析:核电荷数相同,核外电子数不同,Na+核外电子数少,所以原子核对核外电子引力大,半径小
以Cl、Cl-为例进行分析:核电荷数相同,核外电子数不同,Cl-核外电子数多,引力小,半径大
(5)不同周期、不同主族、电子层结构也不相同的微粒
通过上面的讨论我们知道,原子结构呈现周期性变化。那么元素的金属性和非金属性是否也随着原子序数的变化呈现周期性变化呢?接下来我们通过第三周期元素的一些化学性质来探讨这一问题。
回顾:同主族元素金属性与非金属性的递变规律
实验一:
取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2ml水,并滴入2滴酚酞溶液。观察现象。过一会儿加热试管至水沸腾。观察现象。
现象
方程式
结论
与钠相比
实验探究
实验二:
取一小段镁带和一小片铝,用砂纸磨去它们表面的氧化膜,分别放入两支试管,再各加入2mL1mol/L盐酸,观察发生的现象。
现象
方程式
结论
实验探究
钠、镁、铝(同周期的金属)的性质
钠 镁 铝
单质与水(或酸)反应 与冷水反应:反应 ,放出氢气。 与冷水反应 ,与沸水反应 。 与酸反应 ,都放出氢气。 与酸反应
,放出氢气。
最高价氧化物对应水化物碱性强弱 NaOH Mg(OH)2 Al(OH)3
Na Mg Al 金属性逐渐 。
剧烈
慢
较快
强碱 中强碱 两性氢氧化物
减弱
剧烈
较剧烈
规律4:
同周期从左到右,元素金属性依次减弱。
14Si 15P 16S 17Cl
最高价 氧化物
氧化物的水化物及其酸性强弱
单质与H2反应条件
气态氢化物 及其稳定性
结论
H2SiO3 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸
酸性逐渐增强
高温 加热 加热 点燃或光照
SiH4 PH3 H2S HCl
稳定性逐渐增强
非金属性逐渐增强
SiO2 P2O5 SO3 Cl2O7
硅、磷、硫、氯(同周期的非金属)的性质
规律5:
同周期从左到右,元素非金属性依次增强。
规律:
同周期从左到右,元素金属性依次减弱,非金属性依次增强,呈现周期性变化。
规律1:
随着原子序数的递增,元素原子的最外层电子数呈现从1到8的周期性变化。(第一周期除外)
规律2:
随着原子序数的递增,元素原子的半径呈现由大到小的周期性变化。
规律3:
随着原子序数的递增,元素的最高正化合价呈现+1—+7(氧、氟除外)、最低负化合价呈现-4—-1的周期性变化。
规律4:
同周期从左到右,元素金属性依次减弱。
规律5:
同周期从左到右,元素非金属性依次增强。
总结:
随着原子序数的递增,元素的性质呈现周期性的变化的规律—元素周期律
实质:是元素原子的核外电子排布的周期性变化。
规律:
随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
规律:
同周期从左到右,元素金属性依次减弱,非金属性依次增强,呈现周期性变化。
第二节
元素周期律
2020
第二课时元素周期律
最外层电子数:1—2
最外层电子数:1—8
最外层电子数:1—8
规律1:
随着原子序数的递增,元素原子的最外层电子数呈现从1到8的周期性变化。(第一周期除外)
稀有气体元素原子半径的测定依据与相邻非金属元素原子的测定依据不同,没有可比性,故不提供相关数据。
原子半径:大 小
原子半径:大 小
规律2:
随着原子序数的递增,元素原子的半径呈现由大到小的周期性变化。
稀有气体元素性质相对比较稳定,极少进行化学反应,化合价为0 ,不再具体研究
主要化合价:
最高正价:+1 +5,最低负价:-4 -1
主要化合价:
最高正价:+1 +7,最低负价:-4 -1
规律3:
随着原子序数的递增,元素的最高正化合价呈现+1—+7(氧、氟除外)、最低负化合价呈现-4—-1的周期性变化。
常见元素化合价的一般规律
①1~20号元素中,除了O、F外,
最高正价=最外层电子数;
最低负价与最高正价的关系为: 最高正价 + ︱最低负价︱= 8
{
②金属元素无负价(除零价外,在化学反应中只显正价);既有正价又有负价的元素一定是非金属元素;
③氟元素无正价,氧元素无最高正价 。
规律:
随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
(2)同周期主族元素:
从左到右,依次减小;
(1)同主族:
从上到下,依次增大;
1、原子半径大小比较
(3)非同周期同主族元素,找出其他元素做参照对比
例如:Na N
(1) Na>P>N
(2) Na>Li>N
微粒半径大小比较
2、离子半径大小比较
微粒半径大小比较
(1)同主族:
结论:从上到下,离子半径依次增大
以碱金属为例进行分析:Li+ 核外电子排布为2,Na+核外电子排布为2、8,K+核外电子排布为2、8、8,参照0族元素原子半径大小比较
以卤族元素为例进行分析,F-核外电子排布为2、8,Cl-核外电子排布为2、8、8,Br-核外电子排布为2、8、18、8,参照0族元素原子半径比较
(2)同周期主族元素:
结论:阴离子半径大于阳离子半径
以第三周期为例进行分析:Na+、Mg2+、Al3+、S2-、Cl-
Na+、Mg2+、Al3+ 核外电子排布为 2、8
S2-、Cl- 核外电子排布为 2、8、8
2、离子半径大小比较
微粒半径大小比较
(3)核外电子排布相同的离子:
结论:核电荷数越多,半径越小
以Na+、Mg2+、Al3+为例进行分析:核外电子排布为2、8,核电荷数依次为11、12、13。
核电荷数越多,对核外电子的吸引能力越强,半径越小。
(4)同种元素的不同微粒进行比较:
结论:电子数越多,半径越大
以Na、Na+为例进行分析:核电荷数相同,核外电子数不同,Na+核外电子数少,所以原子核对核外电子引力大,半径小
以Cl、Cl-为例进行分析:核电荷数相同,核外电子数不同,Cl-核外电子数多,引力小,半径大
(5)不同周期、不同主族、电子层结构也不相同的微粒
通过上面的讨论我们知道,原子结构呈现周期性变化。那么元素的金属性和非金属性是否也随着原子序数的变化呈现周期性变化呢?接下来我们通过第三周期元素的一些化学性质来探讨这一问题。
回顾:同主族元素金属性与非金属性的递变规律
实验一:
取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2ml水,并滴入2滴酚酞溶液。观察现象。过一会儿加热试管至水沸腾。观察现象。
现象
方程式
结论
与钠相比
实验探究
实验二:
取一小段镁带和一小片铝,用砂纸磨去它们表面的氧化膜,分别放入两支试管,再各加入2mL1mol/L盐酸,观察发生的现象。
现象
方程式
结论
实验探究
钠、镁、铝(同周期的金属)的性质
钠 镁 铝
单质与水(或酸)反应 与冷水反应:反应 ,放出氢气。 与冷水反应 ,与沸水反应 。 与酸反应 ,都放出氢气。 与酸反应
,放出氢气。
最高价氧化物对应水化物碱性强弱 NaOH Mg(OH)2 Al(OH)3
Na Mg Al 金属性逐渐 。
剧烈
慢
较快
强碱 中强碱 两性氢氧化物
减弱
剧烈
较剧烈
规律4:
同周期从左到右,元素金属性依次减弱。
14Si 15P 16S 17Cl
最高价 氧化物
氧化物的水化物及其酸性强弱
单质与H2反应条件
气态氢化物 及其稳定性
结论
H2SiO3 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 最强酸
酸性逐渐增强
高温 加热 加热 点燃或光照
SiH4 PH3 H2S HCl
稳定性逐渐增强
非金属性逐渐增强
SiO2 P2O5 SO3 Cl2O7
硅、磷、硫、氯(同周期的非金属)的性质
规律5:
同周期从左到右,元素非金属性依次增强。
规律:
同周期从左到右,元素金属性依次减弱,非金属性依次增强,呈现周期性变化。
规律1:
随着原子序数的递增,元素原子的最外层电子数呈现从1到8的周期性变化。(第一周期除外)
规律2:
随着原子序数的递增,元素原子的半径呈现由大到小的周期性变化。
规律3:
随着原子序数的递增,元素的最高正化合价呈现+1—+7(氧、氟除外)、最低负化合价呈现-4—-1的周期性变化。
规律4:
同周期从左到右,元素金属性依次减弱。
规律5:
同周期从左到右,元素非金属性依次增强。
总结:
随着原子序数的递增,元素的性质呈现周期性的变化的规律—元素周期律
实质:是元素原子的核外电子排布的周期性变化。
规律:
随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
规律:
同周期从左到右,元素金属性依次减弱,非金属性依次增强,呈现周期性变化。
