教材图解(思维导图+微试题)人教版化学选修4 3-2水的电离和溶液的酸碱性
文档属性
| 名称 | 教材图解(思维导图+微试题)人教版化学选修4 3-2水的电离和溶液的酸碱性 | 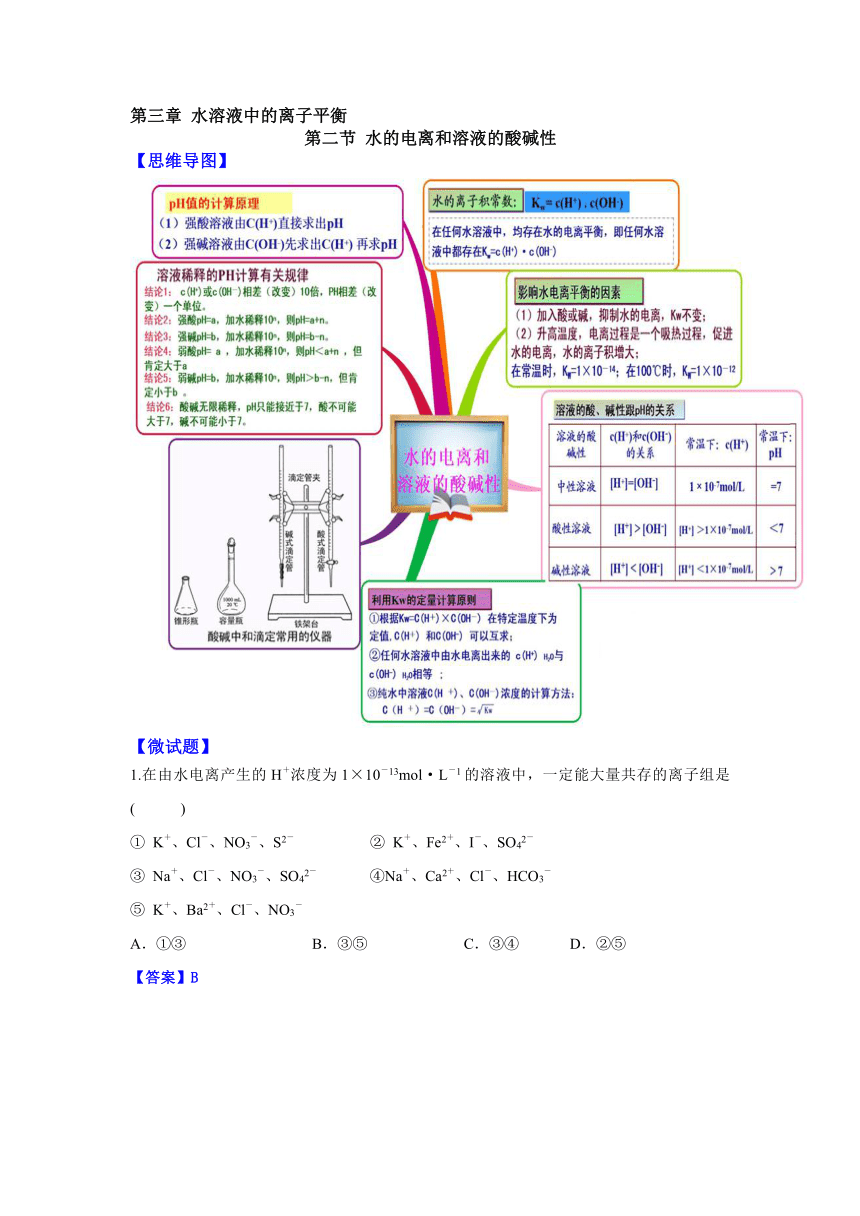 | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-08-21 12:52:18 | ||
图片预览

文档简介
第三章 水溶液中的离子平衡
第二节 水的电离和溶液的酸碱性
【思维导图】
( http: / / www.21cnjy.com )
【微试题】
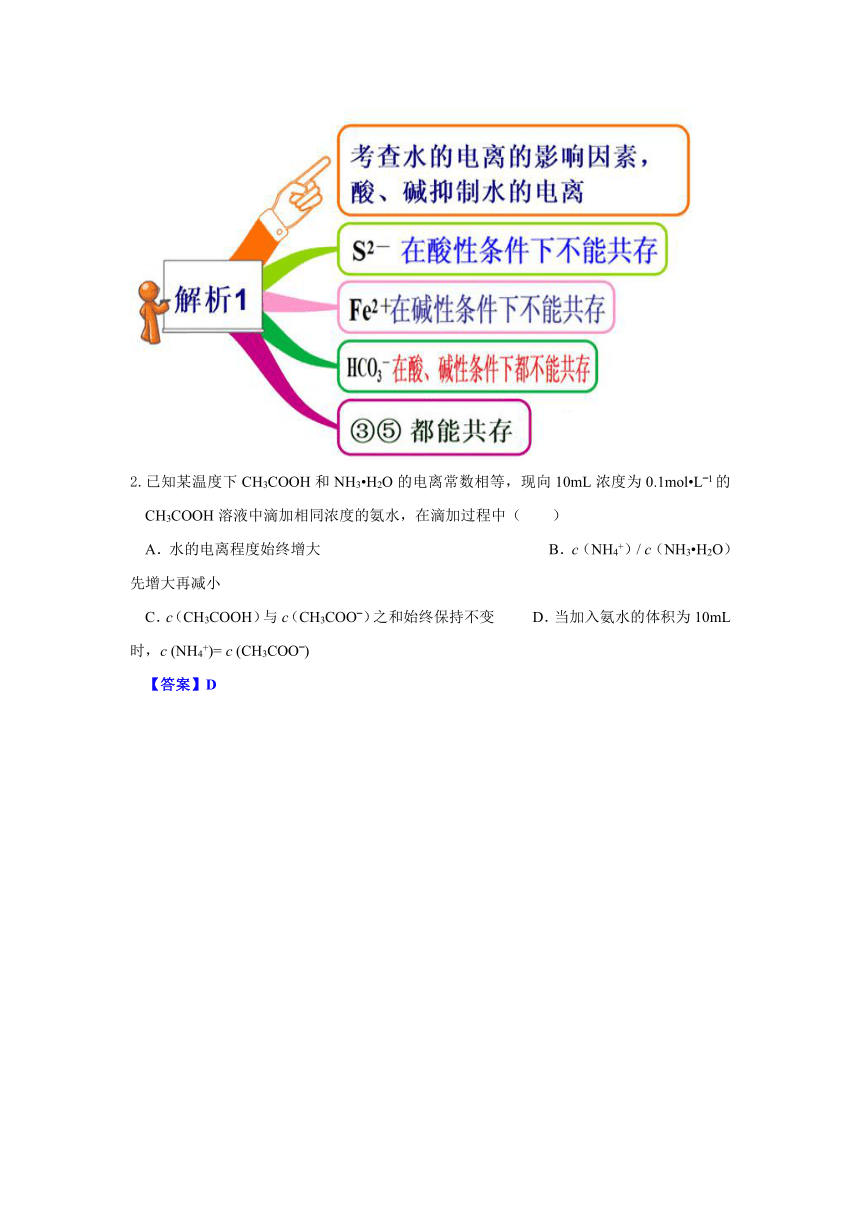
1.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
【答案】B
( http: / / www.21cnjy.com )
2.已知某温度下CH3COOH和NH3 H2O的电离常数相等,现向10mL浓度为0.1mol L 1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大 B.c(NH4+)/ c(NH3 H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO )之和始终保持不变 D.当加入氨水的体积为10mL时,c (NH4+)= c (CH3COO )
【答案】D
( http: / / www.21cnjy.com )
3. 25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
A.a =b B.a >b C.c (A-)= c (Na+) D.c (A-)< c(Na+)
【答案】C
( http: / / www.21cnjy.com )
4.(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2- ,据此判断以下叙述中错误的是( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数
C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)
D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体____________________________。
②NaNH2溶于水的反应____________________________。
③类似于“H++OH—=H2O”的反应____________________________。
(3)下列溶液,一定呈中性的是 ( )
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B.[H+]=1×10-7mol·L-1的溶液
C.pH=14-pOH 的溶液
D.pH=pOH 的溶液
【答案】(1)C (2)①2Na+ ( http: / / www.21cnjy.com )2NH3=H2↑+2NaNH2 ②NaNH2+H2O=NaOH+NH3↑或NH2—+H2O=OH—+NH3↑ ③NH2—+NH4+ =2NH3↑或NH4Cl+NaNH2=2NH3↑+NaCl
(3)D
【解析】(1)(2)此题要求掌握水自偶的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生H+和NH2—,H+与NH3结合生成NH4+,液氨电离产生等量的NH2—与NH4+,一定温度下离子浓度乘积为一常数;NH4+类似于H+,NH2—类似于OH—。具备上述知识后,就可顺利完成解题。
(3)将教材中定义pH方法迁移应用于表示pOH以及pH与pOH的关系,根据pH 的定义方法,可定义pOH= ―lgC(OH―),将室温下水的离子积的表达式C(H+)×C(OH—)=10―14两边取负对数,―lgC(H+)―lgC(OH―)= ―lg10―14,整理得pH+pOH=14。应用所得关系式分析可得D答案
第二节 水的电离和溶液的酸碱性
【思维导图】
( http: / / www.21cnjy.com )
【微试题】
1.在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
【答案】B
( http: / / www.21cnjy.com )
2.已知某温度下CH3COOH和NH3 H2O的电离常数相等,现向10mL浓度为0.1mol L 1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大 B.c(NH4+)/ c(NH3 H2O)先增大再减小
C.c(CH3COOH)与c(CH3COO )之和始终保持不变 D.当加入氨水的体积为10mL时,c (NH4+)= c (CH3COO )
【答案】D
( http: / / www.21cnjy.com )
3. 25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
A.a =b B.a >b C.c (A-)= c (Na+) D.c (A-)< c(Na+)
【答案】C
( http: / / www.21cnjy.com )
4.(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2- ,据此判断以下叙述中错误的是( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数
C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)
D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体____________________________。
②NaNH2溶于水的反应____________________________。
③类似于“H++OH—=H2O”的反应____________________________。
(3)下列溶液,一定呈中性的是 ( )
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B.[H+]=1×10-7mol·L-1的溶液
C.pH=14-pOH 的溶液
D.pH=pOH 的溶液
【答案】(1)C (2)①2Na+ ( http: / / www.21cnjy.com )2NH3=H2↑+2NaNH2 ②NaNH2+H2O=NaOH+NH3↑或NH2—+H2O=OH—+NH3↑ ③NH2—+NH4+ =2NH3↑或NH4Cl+NaNH2=2NH3↑+NaCl
(3)D
【解析】(1)(2)此题要求掌握水自偶的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生H+和NH2—,H+与NH3结合生成NH4+,液氨电离产生等量的NH2—与NH4+,一定温度下离子浓度乘积为一常数;NH4+类似于H+,NH2—类似于OH—。具备上述知识后,就可顺利完成解题。
(3)将教材中定义pH方法迁移应用于表示pOH以及pH与pOH的关系,根据pH 的定义方法,可定义pOH= ―lgC(OH―),将室温下水的离子积的表达式C(H+)×C(OH—)=10―14两边取负对数,―lgC(H+)―lgC(OH―)= ―lg10―14,整理得pH+pOH=14。应用所得关系式分析可得D答案
