教材图解(思维导图+微试题)人教版化学选修4 3-4难溶电解质的溶解平衡
文档属性
| 名称 | 教材图解(思维导图+微试题)人教版化学选修4 3-4难溶电解质的溶解平衡 |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-08-21 12:55:16 | ||
图片预览


文档简介
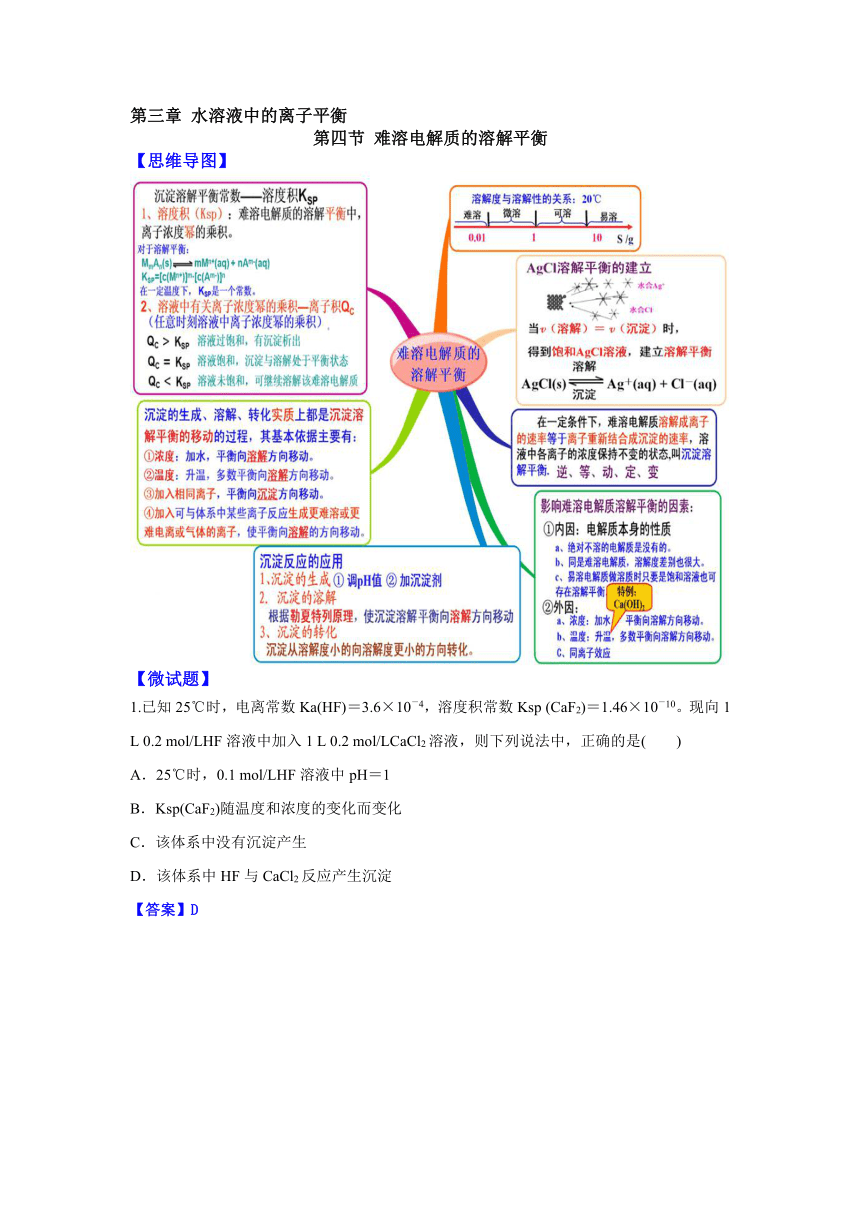
第三章 水溶液中的离子平衡
第四节 难溶电解质的溶解平衡
【思维导图】
( http: / / www.21cnjy.com )
【微试题】
1.已知25℃时,电离常数Ka(HF)= ( http: / / www.21cnjy.com )3.6×10-4,溶度积常数Ksp (CaF2)=1.46×10-10。现向1 L 0.2 mol/LHF溶液中加入1 L 0.2 mol/LCaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1 mol/LHF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
【答案】D
( http: / / www.21cnjy.com )
2.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
提示:BaSO4(g)Ba2+(aq)+S(aq)的平衡常数Ksp=c (Ba2+)·c(SO),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
【答案】C
( http: / / www.21cnjy.com )
3.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如下:
AgCl AgI Ag2S
Ksp 1.8×10-10 8.51×10-16 6.3×10-50
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
【答案】C
( http: / / www.21cnjy.com )
4.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 ;
(2)过程I 加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
【答案】(1)2Fe3+ + Cu == 2Fe2+ + Cu2+;
(2)回收铜 Cu和Fe 加入过量的盐酸后过滤
(3)FeCl2+Ca(OH)2==CaCl2+Fe(OH)2↓ 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4) c(Fe3+)=4.0×10-38/(10-9)3=4.0×10-11 mol·L-1
【解析】(1) Fe3+具有强氧化性,能将Cu氧化,其离子方程式为2Fe3+ + Cu == 2Fe2+ + Cu2+;(2)废液中含有Fe2+和Cu2+,加入过量的铁屑发生的反应为:Fe + Cu2+ = Fe2+ + Cu,故铁屑的作用是回收铜,分离得到的固体为Cu和Fe的混合物,从中得到铜的方法是先加入过量的盐酸,再过滤。
(3)“向滤液中加入一定量石灰水”发生的反 ( http: / / www.21cnjy.com )应为:FeCl2+Ca(OH)2==CaCl2+Fe(OH)2↓;“鼓入足量的空气”发生的反应为:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(4)据Ksp [Fe(OH)3]= c(Fe3+)·[c(OH-)]3 = 4. 0×10-38 ,pH=5,c(OH-)=10-9mol·L-1,可知c(Fe3+)=4.0×10-11 mol·L-1。
第四节 难溶电解质的溶解平衡
【思维导图】
( http: / / www.21cnjy.com )
【微试题】
1.已知25℃时,电离常数Ka(HF)= ( http: / / www.21cnjy.com )3.6×10-4,溶度积常数Ksp (CaF2)=1.46×10-10。现向1 L 0.2 mol/LHF溶液中加入1 L 0.2 mol/LCaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1 mol/LHF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀产生
D.该体系中HF与CaCl2反应产生沉淀
【答案】D
( http: / / www.21cnjy.com )
2.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
提示:BaSO4(g)Ba2+(aq)+S(aq)的平衡常数Ksp=c (Ba2+)·c(SO),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
【答案】C
( http: / / www.21cnjy.com )
3.在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25℃)如下:
AgCl AgI Ag2S
Ksp 1.8×10-10 8.51×10-16 6.3×10-50
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
【答案】C
( http: / / www.21cnjy.com )
4.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 ;
(2)过程I 加入铁屑的主要作用是 ,分离得到固体的主要成分是 ,从固体中分离出铜需采用的方法是 ;
(3)过程II中发生反应的化学方程式为 ;
(4)过程II中调节溶液的pH为5,金属离子浓度为 。(列式计算)
【答案】(1)2Fe3+ + Cu == 2Fe2+ + Cu2+;
(2)回收铜 Cu和Fe 加入过量的盐酸后过滤
(3)FeCl2+Ca(OH)2==CaCl2+Fe(OH)2↓ 4Fe(OH)2+O2+2H2O===4Fe(OH)3
(4) c(Fe3+)=4.0×10-38/(10-9)3=4.0×10-11 mol·L-1
【解析】(1) Fe3+具有强氧化性,能将Cu氧化,其离子方程式为2Fe3+ + Cu == 2Fe2+ + Cu2+;(2)废液中含有Fe2+和Cu2+,加入过量的铁屑发生的反应为:Fe + Cu2+ = Fe2+ + Cu,故铁屑的作用是回收铜,分离得到的固体为Cu和Fe的混合物,从中得到铜的方法是先加入过量的盐酸,再过滤。
(3)“向滤液中加入一定量石灰水”发生的反 ( http: / / www.21cnjy.com )应为:FeCl2+Ca(OH)2==CaCl2+Fe(OH)2↓;“鼓入足量的空气”发生的反应为:4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(4)据Ksp [Fe(OH)3]= c(Fe3+)·[c(OH-)]3 = 4. 0×10-38 ,pH=5,c(OH-)=10-9mol·L-1,可知c(Fe3+)=4.0×10-11 mol·L-1。
