教材图解(思维导图+微试题)人教版化学选修4 4-2化学电源
文档属性
| 名称 | 教材图解(思维导图+微试题)人教版化学选修4 4-2化学电源 |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-08-21 12:58:05 | ||
图片预览

文档简介
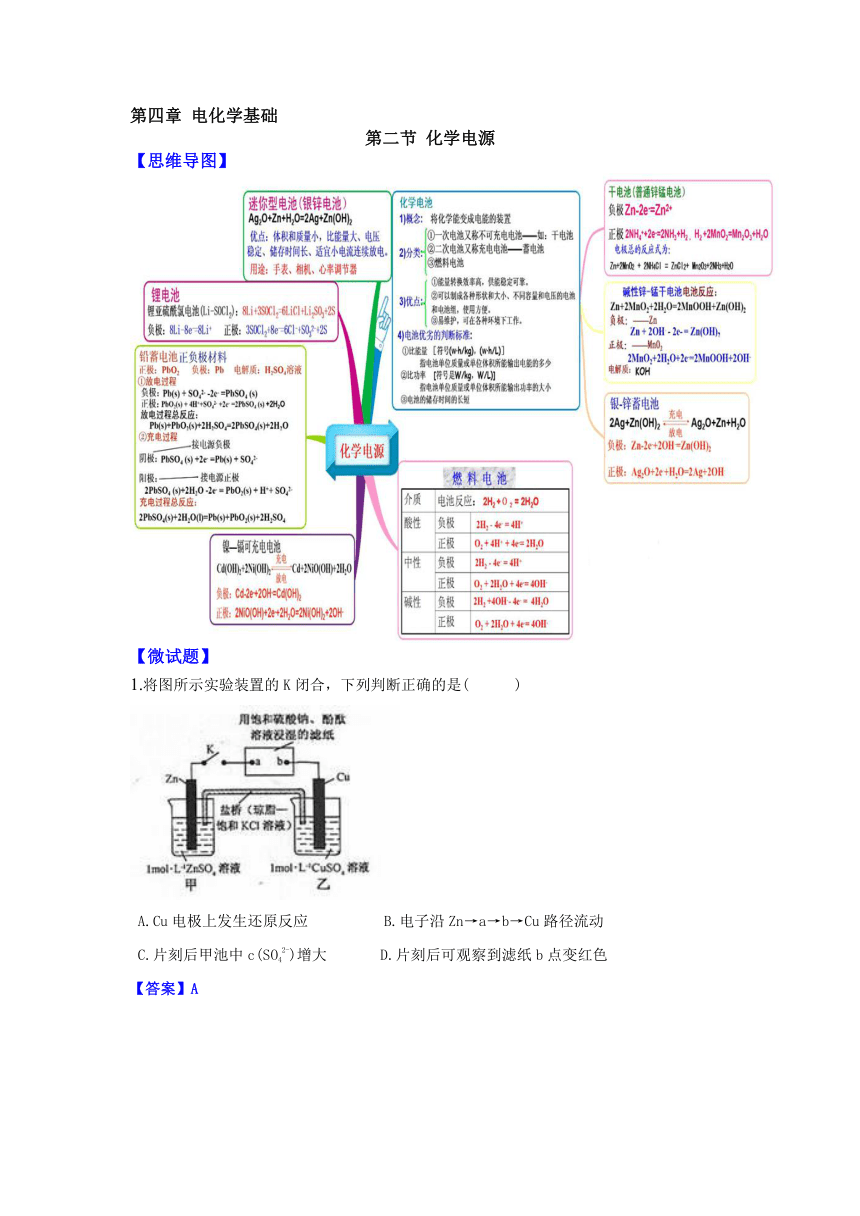
第四章 电化学基础
第二节 化学电源
【思维导图】
( http: / / www.21cnjy.com )
【微试题】
将图所示实验装置的K闭合,下列判断正确的是( )
( http: / / www.21cnjy.com )
A.Cu电极上发生还原反应 B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大 D.片刻后可观察到滤纸b点变红色
【答案】A
( http: / / www.21cnjy.com )
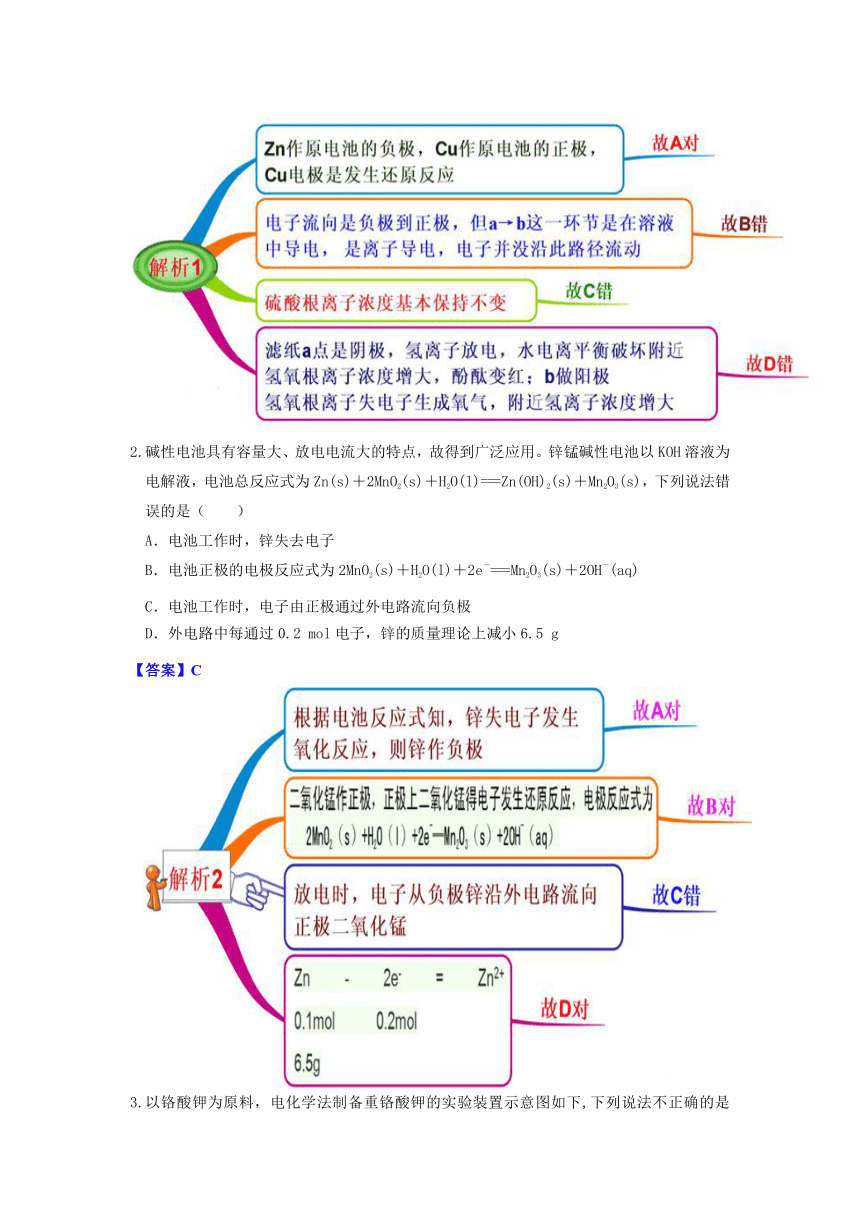
2.碱性电池具有容量大、放电电流大的特点,故得到广泛应用。锌锰碱性电池以KOH溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
【答案】C
( http: / / www.21cnjy.com )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-(d/2)
【答案】D
( http: / / www.21cnjy.com )
4.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中, Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
【答案】(1)b a
(2)MnO2+e-+Li+===LiMnO2
(3)否 电极Li是活泼金属,能与水反应
(4)3MnO2+KClO3+6KOH3K2MnO4+KCl+3H2O 2∶1
【解析】 (1)该电池工作时Li失去电子作负极、MnO2得到电子作正极,故外电路的电流方向是由b极流向a极。(2)电池正极上MnO2得到电子,其中+4价的Mn元素变为+3价,由此可以写出电池的正极反应式为MnO2+e-+Li+===LiMnO2。(3)由于Li易与水反应,故不能用水代替电池中的混合有机溶剂。(4) 因锰元素价态升高,故KClO3被还原为KCl,故可将方程式先写成:MnO2+KOH+KClO3―→K2MnO4+KCl,依得失电子守恒得:3MnO2+KOH+KClO4―→3K2MnO4+KCl,再根据质量守恒知KOH前应该配6,右侧还有“3H2O”。K2MnO4(Mn为+6价)在酸性溶液中歧化,生成KMnO4(锰为+7价)和MnO2(锰为+4价)。由氧化还原反应中得失电子守恒可知生成的KMnO4和MnO2的物质的量之比为2∶1。
第二节 化学电源
【思维导图】
( http: / / www.21cnjy.com )
【微试题】
将图所示实验装置的K闭合,下列判断正确的是( )
( http: / / www.21cnjy.com )
A.Cu电极上发生还原反应 B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大 D.片刻后可观察到滤纸b点变红色
【答案】A
( http: / / www.21cnjy.com )
2.碱性电池具有容量大、放电电流大的特点,故得到广泛应用。锌锰碱性电池以KOH溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
【答案】C
( http: / / www.21cnjy.com )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
A.在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-(d/2)
【答案】D
( http: / / www.21cnjy.com )
4.锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中, Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
【答案】(1)b a
(2)MnO2+e-+Li+===LiMnO2
(3)否 电极Li是活泼金属,能与水反应
(4)3MnO2+KClO3+6KOH3K2MnO4+KCl+3H2O 2∶1
【解析】 (1)该电池工作时Li失去电子作负极、MnO2得到电子作正极,故外电路的电流方向是由b极流向a极。(2)电池正极上MnO2得到电子,其中+4价的Mn元素变为+3价,由此可以写出电池的正极反应式为MnO2+e-+Li+===LiMnO2。(3)由于Li易与水反应,故不能用水代替电池中的混合有机溶剂。(4) 因锰元素价态升高,故KClO3被还原为KCl,故可将方程式先写成:MnO2+KOH+KClO3―→K2MnO4+KCl,依得失电子守恒得:3MnO2+KOH+KClO4―→3K2MnO4+KCl,再根据质量守恒知KOH前应该配6,右侧还有“3H2O”。K2MnO4(Mn为+6价)在酸性溶液中歧化,生成KMnO4(锰为+7价)和MnO2(锰为+4价)。由氧化还原反应中得失电子守恒可知生成的KMnO4和MnO2的物质的量之比为2∶1。
