人教版高三化学选修三第一章第一节《原子结构》课件PPT(64张)
文档属性
| 名称 | 人教版高三化学选修三第一章第一节《原子结构》课件PPT(64张) |  | |
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-08-21 13:09:52 | ||
图片预览







文档简介
课件64张PPT。(人教版选修3)化学:1.1《原子结构》引言化学研究的是构成宏观物体的物质。一、研究物质的组成与结构二、研究物质的性质与变化思考 二者的关系如何?古希腊的“原性论”哲学和我国古代的炼丹术士认为“吞金可长生”
自然哲学,对这两者的关系是如何认定的?思考与交流 1、铁易生锈,真金不怕火炼等事例说明了什么问题?为什么?
2、O2和O3是同素异形体,空气中的O2是须臾不能离开的,而空气中的O3多于1.2mg/L则有害;CO易燃,CO2却能灭火。这由说明了什么问题?为什么?
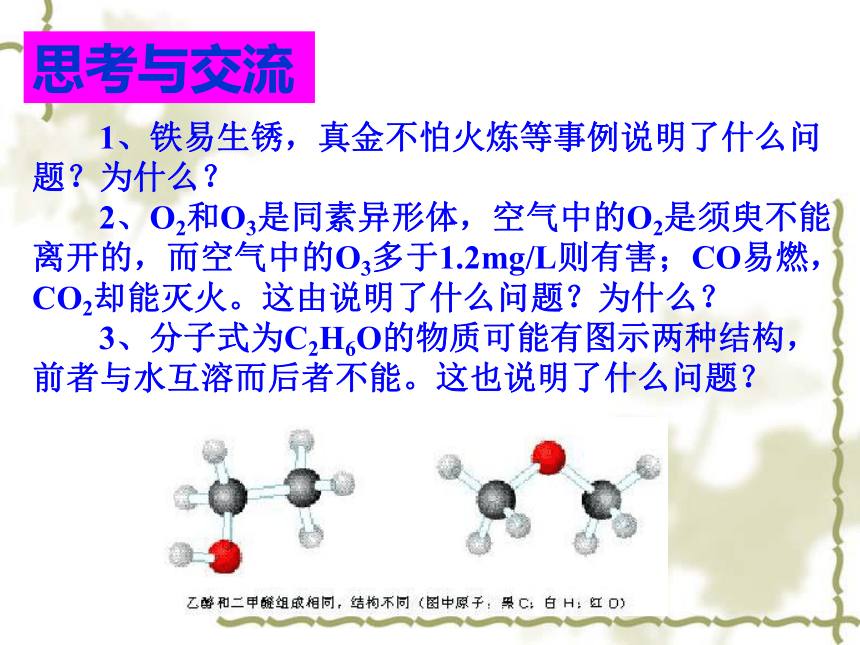
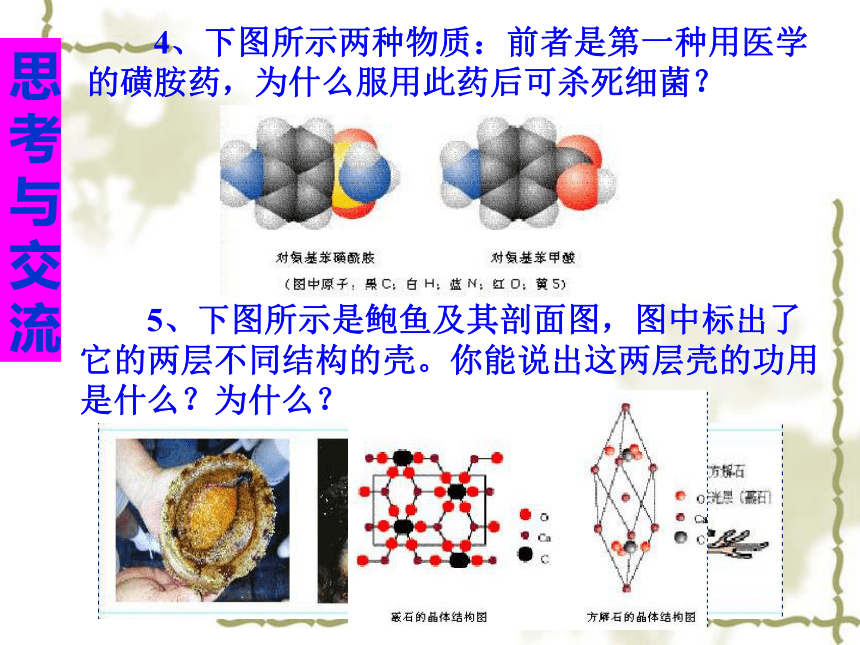
3、分子式为C2H6O的物质可能有图示两种结构,前者与水互溶而后者不能。这也说明了什么问题?思考与交流 4、下图所示两种物质:前者是第一种用医学的磺胺药,为什么服用此药后可杀死细菌? 5、下图所示是鲍鱼及其剖面图,图中标出了它的两层不同结构的壳。你能说出这两层壳的功用是什么?为什么? 引言分子结构原子结构晶体结构结构性质决定原子结构宇宙大爆炸宇宙大爆炸宇宙大爆炸大量的氢
大量的氦
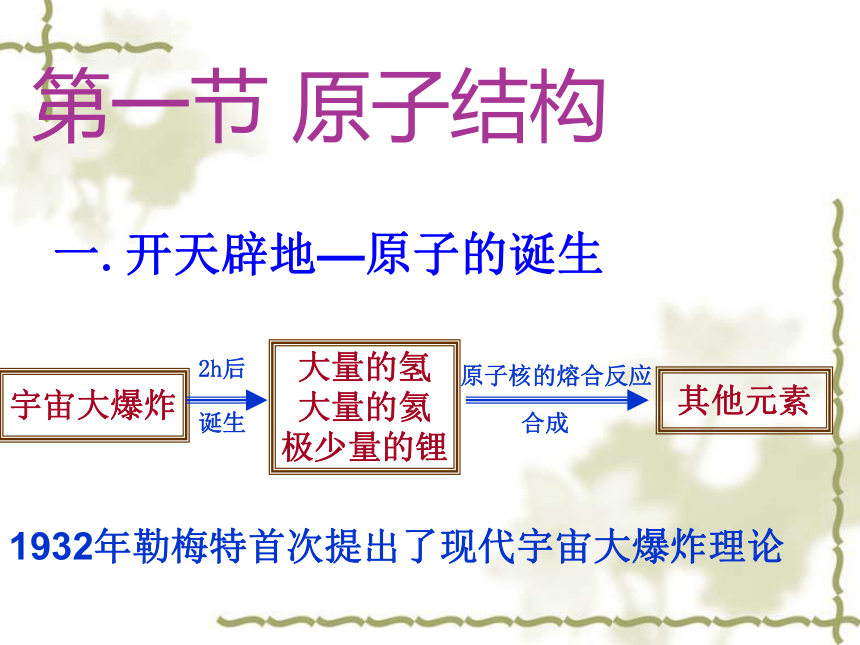
极少量的锂其他元素一.开天辟地—原子的诞生第一节 原子结构1932年勒梅特首次提出了现代宇宙大爆炸理论 有谁知道宇宙中最丰富的元素是那一种?
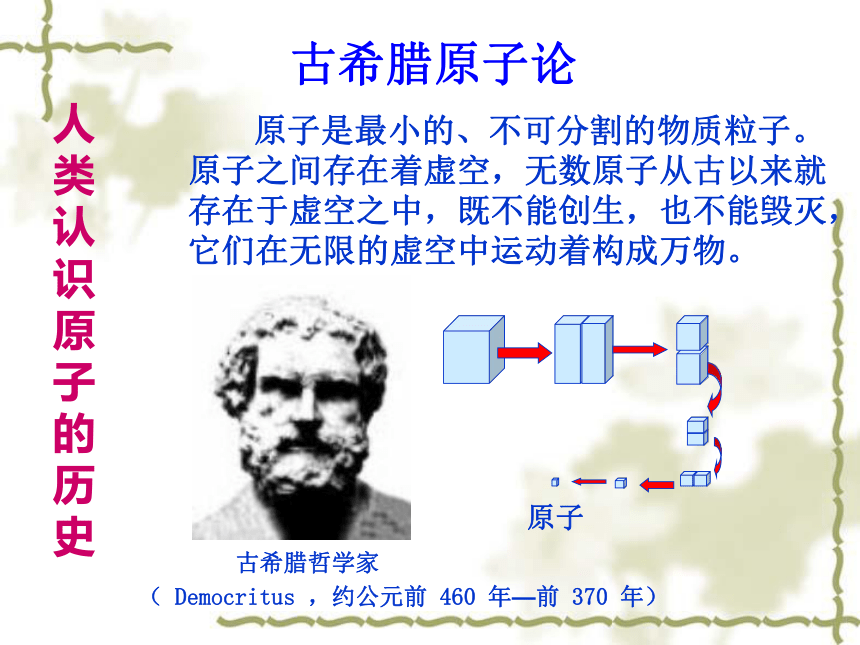
宇宙年龄有多大?地球年龄有多大? 阅读课本后回答:氢元素宇宙中最丰富的元素占88.6%(氦1/8),另外还有90多种元素,宇宙年龄距近约140亿年,地球年龄已有46亿年。古希腊原子论古希腊哲学家 原子是最小的、不可分割的物质粒子。原子之间存在着虚空,无数原子从古以来就存在于虚空之中,既不能创生,也不能毁灭,它们在无限的虚空中运动着构成万物。( Democritus ,约公元前 460 年—前 370 年) 原子人类认识原子的历史近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)道尔顿原子模型原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干镶嵌其中。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)汤姆生原子模型汤姆生原子模型α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)卢瑟福原子模型卢瑟福原子模型玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)玻尔原子模型玻尔原子模型电子云模型电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说人类认识
原子的
历史进程 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。随着现代科学技术的发展,我们现在所学习的科学理论,还会随着人类对客观事物的认识而不断地深入和发展。从原子结构模型的演变你想到了些什么?【思考与交流】1. 原子的特点是什么?
原子是化学变化中的最小微粒
原子的体积和质量都十分微小
原子的大部分质量集中在原子核上 2. 原子的构成、原子核的构成是怎样的? 小结: 构成原子的粒子及其性质1、现代大爆炸理论认为:天然元素源于氢氦等发生的原子核的融合反应。这于一百多年前,普鲁特运用思辨性推测作出“氢是所有元素之母”的预言,恰好“一致”。下列说法正确的是 ( )
A科学研究中若能以思辨性推测为核心,就能加快科学的进程
B普鲁特“既然氢最轻,它就是其他一切元素之母”的推理是符合逻辑的
C“一致”是巧合,普鲁特的预言没有科学事实和理论支撑,只是一种猜测
D“现代大爆炸理论”是解释宇宙诞生的唯一正确的理论 【课堂达标测试1】C3.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是( )
A 只有① B 只有② C 只有③ D ①②③2.支撑“宇宙大爆炸”理论的重要事实之一是 ( )
A.宇宙原子总数的88.6%是氢
B.地球上的元素绝大多数是金属
C.普鲁特“氢是元素之母”的预言
D.宇宙中存在少量稀有气体分子 AD4.在1911年前后,新西兰出生的物理学家卢瑟福把一束变速运动的α粒子(质量数为4的带2个正电荷的质子粒)射向一片极薄的金箔,他惊奇地发现,过去一直认为原子是“实心球”,而这种“实心球”紧密排列而成的金箔,竟为大多数α粒子畅通无阻的通过,就像金箔不在那儿似的,但也有极少数的。粒子发生偏转,或被笔直地弹回。根据以上实验现象能得出关于金箔中Au原子结构的一些结论,试写出其中的三点:
①______________________________________________
②______________________________________________
③______________________________________________ 原子中存在原子核,它占原子中极小的体积
原子核带正电,且电荷数远远大于α粒子
金的原子核质量远远大于α粒子 观察1-18号元素的原子结构示意图,讨论为什么原子核外的电子分层运动? 【思考与交流】依据核外电子的能量不同:
离核远近:近 远
能量高低:低 高核外电子分层排布二、能层与能级
1.能层
(1)定义:在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。(2)表示方法及各能层所容纳的最多电子数:【学与问】1、原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?每一个能层最多可容纳的电子数为2n2个。2.能级
(1)定义:在多电子原子中,同一能层的电子,能量可以不同,还可以把它们分成能级。(2)表示方法及各能级所容纳的最多电子数:【学与问】2.不同的能层分别有多少个能级,与能层的序数(n)间存在什么关系?任一能层的能级数等于该能层的序数。【学与问】 3. 不同能层中,符号相同的能级中所容纳的最多电子数是否相同?以s、p、d、f……排序的各能级可容纳的最多电子数是多少? 不同能层中,符号相同的能级中所容纳的最多电子数相同。以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍,即2、6、10、14。【课后探究】【课堂达标测试2】1、以下能级符号正确的是 ( )
A 6s B 2d C 3f D 7p2、下列各能层中不包含p能级的是 ( )
A. N B. M C. L D. K3、原子核外P能层和p能级可容纳的最多电子数分别为 ( )
A 32和2 B 50和6 C 72和6 D 86和10ADDC4.下列有关认识正确的是 ( )
A.各能级上最多的电子按s、p、d、f的顺序分 别为2、6、10、14
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n—1
D.各能层含有的电子数为2n25、下列各组微粒中,各能层电子数均达到2n2个的是 ( )
A.Ne和 Ar B.H-和Na+
C.Ne和Cl- D.F-和S2-AB【课堂小结】一.开天辟地—原子的诞生二、能层与能级作业:
1、完成本节作业纸
2、教材P5“构造原理”再见第一节 原子结构(第二课时)K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?,在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。同一能层的电子,能量也可不同,可以把它们分成能级。【复习】 1S 2S 2P 3S3P3d 4S4P4d4f 5S5P… 2 2 6 2 6 10 2 6 10 14 2 6… 注:在每一能层中,能级符号的顺序是ns np nd nf….(n代表能层),每一个能层最多可容纳的电子数为2n2个,任一能层的能级数等于该能层的序数。【回顾】1—18号元素原子的电子层排布【回顾】1—18号元素原子的电子层排布核电
荷数元素
名称元素
符号各电子层的电子数K L M N1 氢 H 12 氦 He 23 锂 Li 2 1 4 铍 Be 2 2 5 硼 B 2 3 6 碳 C 2 47 氮 N 2 58 氧 O 2 69 氟 F 2 710 氖 Ne 2 811 钠 Na 2 8 112 镁 Mg 2 8 2 13 铝 Al 2 8 314 硅 Si 2 8 415 磷 P 2 8 516 硫 S 2 8 617 氯 Cl 2 8 718 氩 Ar 2 8 8写出钾元素原子的核外电子层排布?K元素原子的核外电子排布为什么不是:2、8、9,而是2 、8、8、1呢?三、构造原理与能量最低原理 1、构造原理:随原子核电荷数递增,原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。构造原理中排布顺序的实质 ------各能级的能量高低顺序
1)相同能层的不同能级的能量高低顺序 : ns2)英文字母相同的不同能级的能量高低顺序: 1s<2s<3s<4s;2p<3p<4p; 3d<4d
3) 不同层不同能级可由下面的公式得出:
ns < (n-2)f < (n-1)d < np (n为能层序数)
2、构造原理的应用 (1)根据构造原理,电子所排的能级顺序为:_______________________________________ 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f …(2)原子的电子排布式:用数字在能级符号右上角表明该能级上的排布的电子数。氢 H
钠 Na
钾 K1s22s22p63s11s22s22p63s23p64s11s1【练习】(3)原子的简化电子排布:[Ne]3s1【学生活动】你能仿照钠的简化电子排布式写出第8号元素氧、第14号元素硅和第26号元素铁的简化电子排布式吗?上式方括号里的符号的意义是:该元素前一个周期的惰性气体电子排布结构O:[He]2s22p4
Si:[Ne]3s23p2
Fe:[Ar]3d64s2钠 Na的简化电子排布:【讨论】下面是部分元素的基态原子的电子排布【讨论】下面是部分元素的基态原子的电子排布(4)原子核外电子排布规律①? 最外层最多只能容纳 8个电子(氦原子是2个);②? 次外层最多只能容纳18个电子; ③? 倒数第三层最多只能容纳32个电子; ④? 每个能层最多只能容纳2n2电子。⑥核外电子总是尽量先排布在能量较低的能层,然后由里向外,依次排布在能量逐步升高的能层。⑤以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍,即2、6、10、14写出1~36号元素的原子核外电子排布式和简化核外电子排布式【课后练习】短周期核外电子的排布电子填充顺序: 1S→2S →2P → 3S →3P3. 能量最低原理:现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。处于最低能量的原子叫做基态原子。
这样的电子排布是基态原子的电子排布。 从元素周期表中查出铜、银、金的外围电子层排布。它们是否符合构造原理?【知识拓展】3d104s14d105s15d106s1
3d94s24d95s25d96s2 有少数元素的基态原子的电子排布对于构造原理有一个电子的偏差,如Cu、Ag、Au等。2.造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(2s)>E(1s) B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f) 1.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A? +1 B? +2 C? +3 D? -1 AC【课堂达标测试】3.下列各原子或离子的电子排布式错误的是( )
A Al 1s22s22p63s23p1 B O2- 1s22s22p6
C Na+ 1s22s22p6 D Si 1s22s22p2
4.下列表达方式错误的是( )
A 甲烷的电子式
B 氟化钠的电子式
C 硫离子的核外电子排布式 1s22s22p63s23p4
D 碳-12原子 126C
DD
5、下列有几元素的核外电荷数,其中最外层电子数目最多的是( )
A、8 B、14 C、18 D、20
6、由下列微粒的最外层电子排布,能确定形成该微粒的元素在周期表中的位置的是( )
A.1s2 B.3s23p1
C.2s22p6 D.ns2np3 CB(2)各层最多容纳2n2 个电子(3)最外层不超过8个(K层2个)(4)次外层不超过18个,倒数第
三层不超过32个。上述规律相互制约,相互联系(1)能量最低原理小结:排步规律(一低四不超)(3)基态与激发态的关系 四、基态与激发态、光谱1.基态原子与激发态原子(1)基态原子:处于最低能量的原子叫基态原子。(2)激发态原子:当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子。吸收能量释放能量
2.原子光谱: 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称为原子光谱。3. 光谱分析:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。(2)化学研究中利用光谱分析检测一些物质的存在与含量等4. 光谱分析的应用:(1)通过原子光谱发现许多元素。如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦。【课堂达标测试2】1________________________________________________________ ,简称能量最低原理。
_________________________叫做基态原子 1、当基态原子的电子吸收能量后,电子会______________,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将_________能量。光(辐射)是电子___________能量的重要形式之一。原子的电子排布遵循构造原理能使整个原子的能量处于最低状态 处于最低能量的原子跃迁到较高能级 释放 释放 3、不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的________光谱或__________光谱,总称_______光谱。许多元素是通过原子光谱发现的。在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________。
吸收 发射 原子 光谱分析【自主学习】P9科学史话牛顿和七基色1、光谱一词最早是由伟大的物理学家牛顿提出的。2、牛顿类比音乐音阶,选定红、橙、黄、绿、青、篮、紫为“七基色”3、1859年德国科学家本生和基尔霍夫发明了光谱仪,摄取了当时已知元素的光谱图。【课堂小结】三、构造原理与能量最低原理四、基态与激发态、光谱作业:
1、完成本节作业纸
2、教材P10“电子云与原子轨道”再见
自然哲学,对这两者的关系是如何认定的?思考与交流 1、铁易生锈,真金不怕火炼等事例说明了什么问题?为什么?
2、O2和O3是同素异形体,空气中的O2是须臾不能离开的,而空气中的O3多于1.2mg/L则有害;CO易燃,CO2却能灭火。这由说明了什么问题?为什么?
3、分子式为C2H6O的物质可能有图示两种结构,前者与水互溶而后者不能。这也说明了什么问题?思考与交流 4、下图所示两种物质:前者是第一种用医学的磺胺药,为什么服用此药后可杀死细菌? 5、下图所示是鲍鱼及其剖面图,图中标出了它的两层不同结构的壳。你能说出这两层壳的功用是什么?为什么? 引言分子结构原子结构晶体结构结构性质决定原子结构宇宙大爆炸宇宙大爆炸宇宙大爆炸大量的氢
大量的氦
极少量的锂其他元素一.开天辟地—原子的诞生第一节 原子结构1932年勒梅特首次提出了现代宇宙大爆炸理论 有谁知道宇宙中最丰富的元素是那一种?
宇宙年龄有多大?地球年龄有多大? 阅读课本后回答:氢元素宇宙中最丰富的元素占88.6%(氦1/8),另外还有90多种元素,宇宙年龄距近约140亿年,地球年龄已有46亿年。古希腊原子论古希腊哲学家 原子是最小的、不可分割的物质粒子。原子之间存在着虚空,无数原子从古以来就存在于虚空之中,既不能创生,也不能毁灭,它们在无限的虚空中运动着构成万物。( Democritus ,约公元前 460 年—前 370 年) 原子人类认识原子的历史近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)道尔顿原子模型原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干镶嵌其中。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)汤姆生原子模型汤姆生原子模型α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)卢瑟福原子模型卢瑟福原子模型玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。
丹麦物理学家玻尔
(N.Bohr,1885~1962)玻尔原子模型玻尔原子模型电子云模型电子云模型 (现代物质结构学说)现代科学家们在实验中发现,电子在原子核周围有的区域出现的次数多,有的区域出现的次数少,就像“云雾”笼罩在原子核周围。因而提出了“电子云模型”。
电子云密度大的地方,表明电子在核外单位体积内出现的机会多,反之,出现的机会少。
如:氢原子的电子云电子云现代物质结构学说人类认识
原子的
历史进程 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。随着现代科学技术的发展,我们现在所学习的科学理论,还会随着人类对客观事物的认识而不断地深入和发展。从原子结构模型的演变你想到了些什么?【思考与交流】1. 原子的特点是什么?
原子是化学变化中的最小微粒
原子的体积和质量都十分微小
原子的大部分质量集中在原子核上 2. 原子的构成、原子核的构成是怎样的? 小结: 构成原子的粒子及其性质1、现代大爆炸理论认为:天然元素源于氢氦等发生的原子核的融合反应。这于一百多年前,普鲁特运用思辨性推测作出“氢是所有元素之母”的预言,恰好“一致”。下列说法正确的是 ( )
A科学研究中若能以思辨性推测为核心,就能加快科学的进程
B普鲁特“既然氢最轻,它就是其他一切元素之母”的推理是符合逻辑的
C“一致”是巧合,普鲁特的预言没有科学事实和理论支撑,只是一种猜测
D“现代大爆炸理论”是解释宇宙诞生的唯一正确的理论 【课堂达标测试1】C3.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是( )
A 只有① B 只有② C 只有③ D ①②③2.支撑“宇宙大爆炸”理论的重要事实之一是 ( )
A.宇宙原子总数的88.6%是氢
B.地球上的元素绝大多数是金属
C.普鲁特“氢是元素之母”的预言
D.宇宙中存在少量稀有气体分子 AD4.在1911年前后,新西兰出生的物理学家卢瑟福把一束变速运动的α粒子(质量数为4的带2个正电荷的质子粒)射向一片极薄的金箔,他惊奇地发现,过去一直认为原子是“实心球”,而这种“实心球”紧密排列而成的金箔,竟为大多数α粒子畅通无阻的通过,就像金箔不在那儿似的,但也有极少数的。粒子发生偏转,或被笔直地弹回。根据以上实验现象能得出关于金箔中Au原子结构的一些结论,试写出其中的三点:
①______________________________________________
②______________________________________________
③______________________________________________ 原子中存在原子核,它占原子中极小的体积
原子核带正电,且电荷数远远大于α粒子
金的原子核质量远远大于α粒子 观察1-18号元素的原子结构示意图,讨论为什么原子核外的电子分层运动? 【思考与交流】依据核外电子的能量不同:
离核远近:近 远
能量高低:低 高核外电子分层排布二、能层与能级
1.能层
(1)定义:在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。(2)表示方法及各能层所容纳的最多电子数:【学与问】1、原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?每一个能层最多可容纳的电子数为2n2个。2.能级
(1)定义:在多电子原子中,同一能层的电子,能量可以不同,还可以把它们分成能级。(2)表示方法及各能级所容纳的最多电子数:【学与问】2.不同的能层分别有多少个能级,与能层的序数(n)间存在什么关系?任一能层的能级数等于该能层的序数。【学与问】 3. 不同能层中,符号相同的能级中所容纳的最多电子数是否相同?以s、p、d、f……排序的各能级可容纳的最多电子数是多少? 不同能层中,符号相同的能级中所容纳的最多电子数相同。以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍,即2、6、10、14。【课后探究】【课堂达标测试2】1、以下能级符号正确的是 ( )
A 6s B 2d C 3f D 7p2、下列各能层中不包含p能级的是 ( )
A. N B. M C. L D. K3、原子核外P能层和p能级可容纳的最多电子数分别为 ( )
A 32和2 B 50和6 C 72和6 D 86和10ADDC4.下列有关认识正确的是 ( )
A.各能级上最多的电子按s、p、d、f的顺序分 别为2、6、10、14
B.各能层的能级都是从s能级开始至f能级结束
C.各能层含有的能级数为n—1
D.各能层含有的电子数为2n25、下列各组微粒中,各能层电子数均达到2n2个的是 ( )
A.Ne和 Ar B.H-和Na+
C.Ne和Cl- D.F-和S2-AB【课堂小结】一.开天辟地—原子的诞生二、能层与能级作业:
1、完成本节作业纸
2、教材P5“构造原理”再见第一节 原子结构(第二课时)K L M N O P Q 电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动?,在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。同一能层的电子,能量也可不同,可以把它们分成能级。【复习】 1S 2S 2P 3S3P3d 4S4P4d4f 5S5P… 2 2 6 2 6 10 2 6 10 14 2 6… 注:在每一能层中,能级符号的顺序是ns np nd nf….(n代表能层),每一个能层最多可容纳的电子数为2n2个,任一能层的能级数等于该能层的序数。【回顾】1—18号元素原子的电子层排布【回顾】1—18号元素原子的电子层排布核电
荷数元素
名称元素
符号各电子层的电子数K L M N1 氢 H 12 氦 He 23 锂 Li 2 1 4 铍 Be 2 2 5 硼 B 2 3 6 碳 C 2 47 氮 N 2 58 氧 O 2 69 氟 F 2 710 氖 Ne 2 811 钠 Na 2 8 112 镁 Mg 2 8 2 13 铝 Al 2 8 314 硅 Si 2 8 415 磷 P 2 8 516 硫 S 2 8 617 氯 Cl 2 8 718 氩 Ar 2 8 8写出钾元素原子的核外电子层排布?K元素原子的核外电子排布为什么不是:2、8、9,而是2 、8、8、1呢?三、构造原理与能量最低原理 1、构造原理:随原子核电荷数递增,原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。构造原理中排布顺序的实质 ------各能级的能量高低顺序
1)相同能层的不同能级的能量高低顺序 : ns
3) 不同层不同能级可由下面的公式得出:
ns < (n-2)f < (n-1)d < np (n为能层序数)
2、构造原理的应用 (1)根据构造原理,电子所排的能级顺序为:_______________________________________ 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f …(2)原子的电子排布式:用数字在能级符号右上角表明该能级上的排布的电子数。氢 H
钠 Na
钾 K1s22s22p63s11s22s22p63s23p64s11s1【练习】(3)原子的简化电子排布:[Ne]3s1【学生活动】你能仿照钠的简化电子排布式写出第8号元素氧、第14号元素硅和第26号元素铁的简化电子排布式吗?上式方括号里的符号的意义是:该元素前一个周期的惰性气体电子排布结构O:[He]2s22p4
Si:[Ne]3s23p2
Fe:[Ar]3d64s2钠 Na的简化电子排布:【讨论】下面是部分元素的基态原子的电子排布【讨论】下面是部分元素的基态原子的电子排布(4)原子核外电子排布规律①? 最外层最多只能容纳 8个电子(氦原子是2个);②? 次外层最多只能容纳18个电子; ③? 倒数第三层最多只能容纳32个电子; ④? 每个能层最多只能容纳2n2电子。⑥核外电子总是尽量先排布在能量较低的能层,然后由里向外,依次排布在能量逐步升高的能层。⑤以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍,即2、6、10、14写出1~36号元素的原子核外电子排布式和简化核外电子排布式【课后练习】短周期核外电子的排布电子填充顺序: 1S→2S →2P → 3S →3P3. 能量最低原理:现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。处于最低能量的原子叫做基态原子。
这样的电子排布是基态原子的电子排布。 从元素周期表中查出铜、银、金的外围电子层排布。它们是否符合构造原理?【知识拓展】3d104s14d105s15d106s1
3d94s24d95s25d96s2 有少数元素的基态原子的电子排布对于构造原理有一个电子的偏差,如Cu、Ag、Au等。2.造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是
A.E(3s)>E(2s)>E(1s) B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f) 1.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A? +1 B? +2 C? +3 D? -1 AC【课堂达标测试】3.下列各原子或离子的电子排布式错误的是( )
A Al 1s22s22p63s23p1 B O2- 1s22s22p6
C Na+ 1s22s22p6 D Si 1s22s22p2
4.下列表达方式错误的是( )
A 甲烷的电子式
B 氟化钠的电子式
C 硫离子的核外电子排布式 1s22s22p63s23p4
D 碳-12原子 126C
DD
5、下列有几元素的核外电荷数,其中最外层电子数目最多的是( )
A、8 B、14 C、18 D、20
6、由下列微粒的最外层电子排布,能确定形成该微粒的元素在周期表中的位置的是( )
A.1s2 B.3s23p1
C.2s22p6 D.ns2np3 CB(2)各层最多容纳2n2 个电子(3)最外层不超过8个(K层2个)(4)次外层不超过18个,倒数第
三层不超过32个。上述规律相互制约,相互联系(1)能量最低原理小结:排步规律(一低四不超)(3)基态与激发态的关系 四、基态与激发态、光谱1.基态原子与激发态原子(1)基态原子:处于最低能量的原子叫基态原子。(2)激发态原子:当基态原子的电子吸收能量后,电子会跃迁到较高的能级,变成激发态原子。吸收能量释放能量
2.原子光谱: 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称为原子光谱。3. 光谱分析:在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。(2)化学研究中利用光谱分析检测一些物质的存在与含量等4. 光谱分析的应用:(1)通过原子光谱发现许多元素。如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦。【课堂达标测试2】1________________________________________________________ ,简称能量最低原理。
_________________________叫做基态原子 1、当基态原子的电子吸收能量后,电子会______________,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将_________能量。光(辐射)是电子___________能量的重要形式之一。原子的电子排布遵循构造原理能使整个原子的能量处于最低状态 处于最低能量的原子跃迁到较高能级 释放 释放 3、不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的________光谱或__________光谱,总称_______光谱。许多元素是通过原子光谱发现的。在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为________。
吸收 发射 原子 光谱分析【自主学习】P9科学史话牛顿和七基色1、光谱一词最早是由伟大的物理学家牛顿提出的。2、牛顿类比音乐音阶,选定红、橙、黄、绿、青、篮、紫为“七基色”3、1859年德国科学家本生和基尔霍夫发明了光谱仪,摄取了当时已知元素的光谱图。【课堂小结】三、构造原理与能量最低原理四、基态与激发态、光谱作业:
1、完成本节作业纸
2、教材P10“电子云与原子轨道”再见
