鲁教版化学九年级上册第二单元第三节《原子的构成》PPT课件(29张)
文档属性
| 名称 | 鲁教版化学九年级上册第二单元第三节《原子的构成》PPT课件(29张) |

|
|
| 格式 | zip | ||
| 文件大小 | 203.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-08-21 00:00:00 | ||
图片预览






文档简介
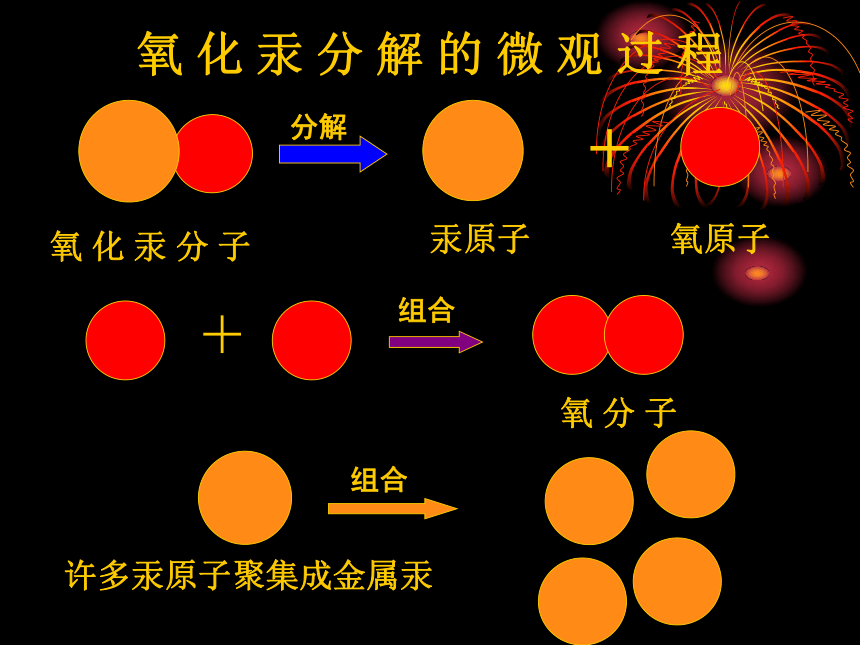
课件29张PPT。原子的构成 氧 化 汞 分 解 的 微 观 过 程
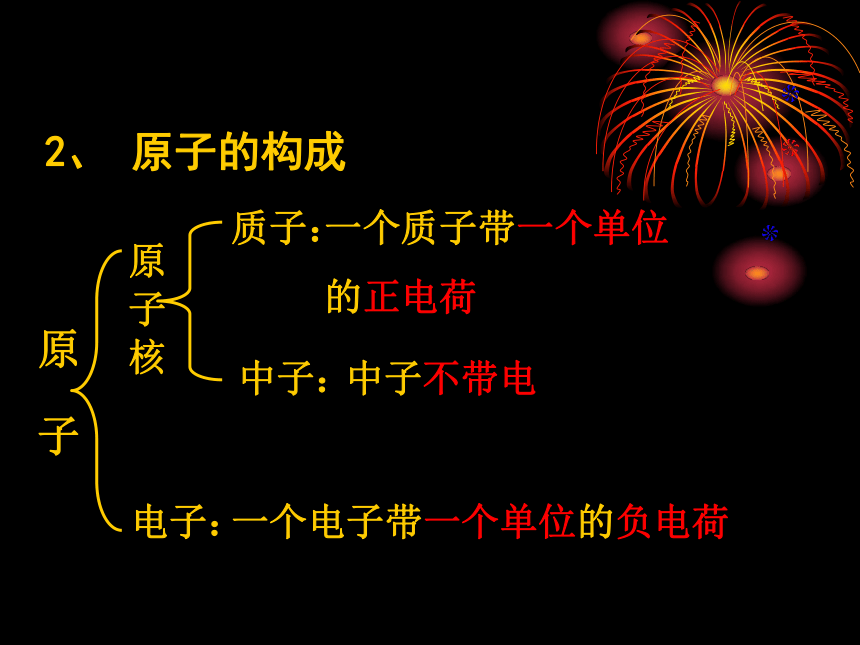
1.定义:原子是化学变化中的最小粒子。一、原子的构成 在化学反应里分子可以分为原子,原子不能再分,那么用其它方法能不能将原子再分呢?原子的结构究竟如何? 1897年,在英国科学家汤姆生发现了电子以后,人们开始揭示了原子内部的秘密。经过20世纪整整一个世纪的努力,科学家不但打开了原子的大门,而且发现小小的原子内部结构十分复杂。质子:一个质子带一个单位
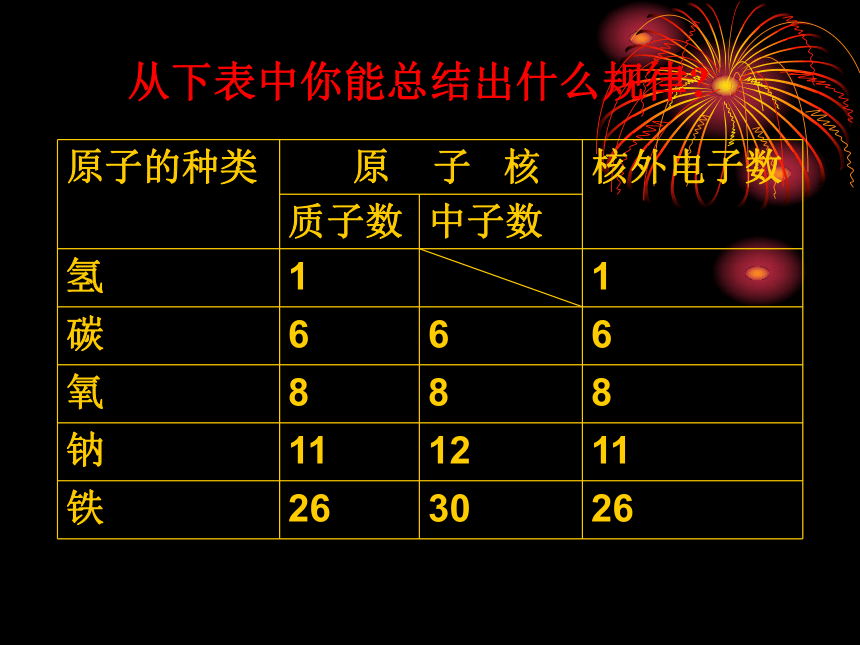
的正电荷中子:中子不带电电子:一个电子带一个单位的负电荷2、 原子的构成构成原子的粒子的电性和质量从下表中你能总结出什么规律?根据表4-1、4-2,思考并回答下列问题:1、构成原子的三种粒子的电性、质量如何?
2、原子中有带点的粒子,那么整个原子是否带电,为什么?
3、是不是所有的原子核内都有中子?
4、同种原子核内的质子数和中子数有何特点?
5、不同种类原子内部结构有何不同?原子构成中的规律:⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)
⑵、质 子 数 不 一 定 等 于 中 子 数
⑶ 、原 子 中 不 一 定 含 有 中 子(4)原子不显电性 由于原子核所带电量和核外电子的
电量相等,但电性相反,所以整个原
子不显电性。4、以碳原子为例描述原子的构成 构成碳原子的粒子有6个质子,6
个中子和6个电子。其中6个质子和6个
中子构成了原子核作为原子的中心,
而6个电子在核外一定空间内绕核做高
速运动。
在 原 子 的 组 成 中, 带 正 电,
带 负 电, 不 带 电, 绕 着 做 高 速 运 动。 占 据 原 子 的 绝 大 部 分 体 积, 集 中原 子 的 主 要 质 量 。
电 子 质 子 中 子 电 子 原 子 核 电 子 原 子 核练习题作业1、教材P72页1(1)、(2); 2
2、高效速练P37 1、2、3 二、相对原子质量 一 个 碳 原 子 的 质 量:
1.993×10-2 6 kg 1、原 子 的 实 际 质 量0.000000000000000
00 000000001993 kg
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。 这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?2、 相 对 原 子 质 量 原子的质量非常小,使用起来很繁琐,不方便,一般不采用。为方便使用确定了原子的相对质量──相对原子质量 (Ar) (1)定 义: 国 际 上 一 致 同 意 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳-12:是含有6个质子和6个中子的碳原子,它的质量的1/12等于1.66×10-27 kg 2、相 对 原 子 质 量 的计 算 公 式: ⑵ 实 质: 相 对 原 子 质 量 是 一 个 比 值, 其 国 际 单 位 为 一,一般不写出来。练习题 氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1碳12的十二分之一的质量 尝试查阅一下如下几种元素的相对原子质量:磷、铝、氮、钠、硫、镁
看谁查得又快又准! 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 从下表中你能总结出什么规律?原子构成中的规律:⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)
⑵、质 子 数 不 一 定 等 于 中 子 数
⑶ 、原 子 中 不 一 定 含 有 中 子
(4)、相对原子质量=质子数+中子数相 对 原 子 质 量 的计 算 公 式(2)相对原子质量(近似值)
= 质子数+中子数练习:把图表中的空白填写清楚已知每个电子的质量约为每个质子(或中子)质量的1/1836,下表是几种原子结构的有关数据。通过上述表格,可以总结出:1、
2、
3、
4、
…………作业1、教材P72页1(3); 4
2、高效速练P37 4、5、7、8、10、11
1.定义:原子是化学变化中的最小粒子。一、原子的构成 在化学反应里分子可以分为原子,原子不能再分,那么用其它方法能不能将原子再分呢?原子的结构究竟如何? 1897年,在英国科学家汤姆生发现了电子以后,人们开始揭示了原子内部的秘密。经过20世纪整整一个世纪的努力,科学家不但打开了原子的大门,而且发现小小的原子内部结构十分复杂。质子:一个质子带一个单位
的正电荷中子:中子不带电电子:一个电子带一个单位的负电荷2、 原子的构成构成原子的粒子的电性和质量从下表中你能总结出什么规律?根据表4-1、4-2,思考并回答下列问题:1、构成原子的三种粒子的电性、质量如何?
2、原子中有带点的粒子,那么整个原子是否带电,为什么?
3、是不是所有的原子核内都有中子?
4、同种原子核内的质子数和中子数有何特点?
5、不同种类原子内部结构有何不同?原子构成中的规律:⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)
⑵、质 子 数 不 一 定 等 于 中 子 数
⑶ 、原 子 中 不 一 定 含 有 中 子(4)原子不显电性 由于原子核所带电量和核外电子的
电量相等,但电性相反,所以整个原
子不显电性。4、以碳原子为例描述原子的构成 构成碳原子的粒子有6个质子,6
个中子和6个电子。其中6个质子和6个
中子构成了原子核作为原子的中心,
而6个电子在核外一定空间内绕核做高
速运动。
在 原 子 的 组 成 中, 带 正 电,
带 负 电, 不 带 电, 绕 着 做 高 速 运 动。 占 据 原 子 的 绝 大 部 分 体 积, 集 中原 子 的 主 要 质 量 。
电 子 质 子 中 子 电 子 原 子 核 电 子 原 子 核练习题作业1、教材P72页1(1)、(2); 2
2、高效速练P37 1、2、3 二、相对原子质量 一 个 碳 原 子 的 质 量:
1.993×10-2 6 kg 1、原 子 的 实 际 质 量0.000000000000000
00 000000001993 kg
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。 这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?2、 相 对 原 子 质 量 原子的质量非常小,使用起来很繁琐,不方便,一般不采用。为方便使用确定了原子的相对质量──相对原子质量 (Ar) (1)定 义: 国 际 上 一 致 同 意 以 一 种 碳 原 子 质 量 的1/12作 为 标 准, 其 他 原 子 的 质 量 跟 它 比 较 所 得 的 值, 就 是 这 种 原 子 的 相 对 原 子 质 量。 碳-12:是含有6个质子和6个中子的碳原子,它的质量的1/12等于1.66×10-27 kg 2、相 对 原 子 质 量 的计 算 公 式: ⑵ 实 质: 相 对 原 子 质 量 是 一 个 比 值, 其 国 际 单 位 为 一,一般不写出来。练习题 氢原子的质量= 1.6726×10- 27 kg
氢原子的相对原子质量
= 1.6726×10- 27 kg÷ 1.66×10- 27 kg ≈ 1碳12的十二分之一的质量 尝试查阅一下如下几种元素的相对原子质量:磷、铝、氮、钠、硫、镁
看谁查得又快又准! 磷——31 铝——27
氮——14 钠——23
硫——32 镁——24 从下表中你能总结出什么规律?原子构成中的规律:⑴、核电荷数 = 质子数 = 核外电子数
(原子核所带的电荷数简称为核电荷数)
⑵、质 子 数 不 一 定 等 于 中 子 数
⑶ 、原 子 中 不 一 定 含 有 中 子
(4)、相对原子质量=质子数+中子数相 对 原 子 质 量 的计 算 公 式(2)相对原子质量(近似值)
= 质子数+中子数练习:把图表中的空白填写清楚已知每个电子的质量约为每个质子(或中子)质量的1/1836,下表是几种原子结构的有关数据。通过上述表格,可以总结出:1、
2、
3、
4、
…………作业1、教材P72页1(3); 4
2、高效速练P37 4、5、7、8、10、11
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
