9.3溶液的浓度同步练习人教版化学九年级下册(含答案)
文档属性
| 名称 | 9.3溶液的浓度同步练习人教版化学九年级下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 234.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-03 00:00:00 | ||
图片预览



文档简介
9.3溶液的浓度
一、多选题
1.如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.t1℃时a、c两种物质的饱和溶液中溶质相等
B.t2℃时,100g a物质饱和溶液中含有50g a物质
C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系是b>a>c
D.a物质中含有少量的b物质,可采用冷却热饱和溶液的方法得到纯a
2.下列说法正确的是
A.已知20℃时NaCl溶解度为36g,在该温度下将40gNaCl加入100g水中,则所得溶液溶质的质量分数约为28.6%
B.在密闭容器中,将6g碳在11.2g氧气中充分燃烧,生成的一氧化碳和二氧化碳的质量比为21∶22
C.将镁和铁的混合物5.6g与200g溶质的质量分数为7.3%的稀盐酸充分反应,生成氢气的质量可能为0.2g
D.将一定质量氧化铁和氧化铜的混合物,与足量的一氧化碳在一定条件下反应,得到金属混合物2.4g及二氧化碳2.2g,则氧化铁和氧化铜的质量比为1∶1
3.下列有关溶液的说法正确的是
A.将5g某物质加入到95g水中,所得溶液中溶质的质量分数是5%
B.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数可能不变
C.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液
D.将一定质量某物质的饱和溶液降温析出晶体后,溶液中溶质的质量一定减小
4.下列涉及学科观点的有关说法正确的是( )
A.转化观:氧气和水在一定条件下可相互转化
B.微拉观:水是氢原子和氧原子构成的
C.结构观:氯原子和氯离子的质子数相同,属于同种元素
D.守恒观:10mL质量分数40%的硫酸,加10mL水后所得溶液的溶质质量分数不变
5.将39gCu和Cu2(OH)2CO3的混合物在空气中加热一段时间后,得到剩余固体35.1g,再向该固体中加入14.6%的稀盐酸,至固体全部溶解,共消耗稀盐酸200g。下列分析不正确的是
A.剩余固体一定为混合物
B.加热过程中共生成H2O和CO2的质量3.1g
C.原混合物中Cu和Cu2(OH)2CO3的质量比为32:111
D.最终所得溶液的质量为232.9g
二、选择题
6.20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,下列说法错误的是
A.溶质的质量增加 B.溶剂的质量不变
C.溶液的质量增加 D.溶液的溶质质量分数不变
7.下列关于溶液说法正确的是
A.将氯化钠和汽油放入水中,充分搅拌后都能形成溶液
B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%
C.向20%C时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g10%的氯化钠溶液一般经过计算、 称量、量取、溶解等步骤
8.下列说法正确的是
A.洗洁精和汽油均可清洗油污,其原理相同
B.同种元素的原子和离子具有相同的质子数
C.饱和溶液转化为不饱和溶液,溶质质量分数一定减小
D.20%的蔗糖溶液中,蔗糖与水的质量比为1:5
9.某温度下,向100 g饱和石灰水中加入5.6 g 生石灰,充分反应后恢复到原来温度。下列叙述中正确的是
A.沉淀物的质量为5.6 g B.沉淀物的质量为7.4 g
C.结束后,溶液的质量分数增大 D.结束后,溶液的质量小于98.2 g
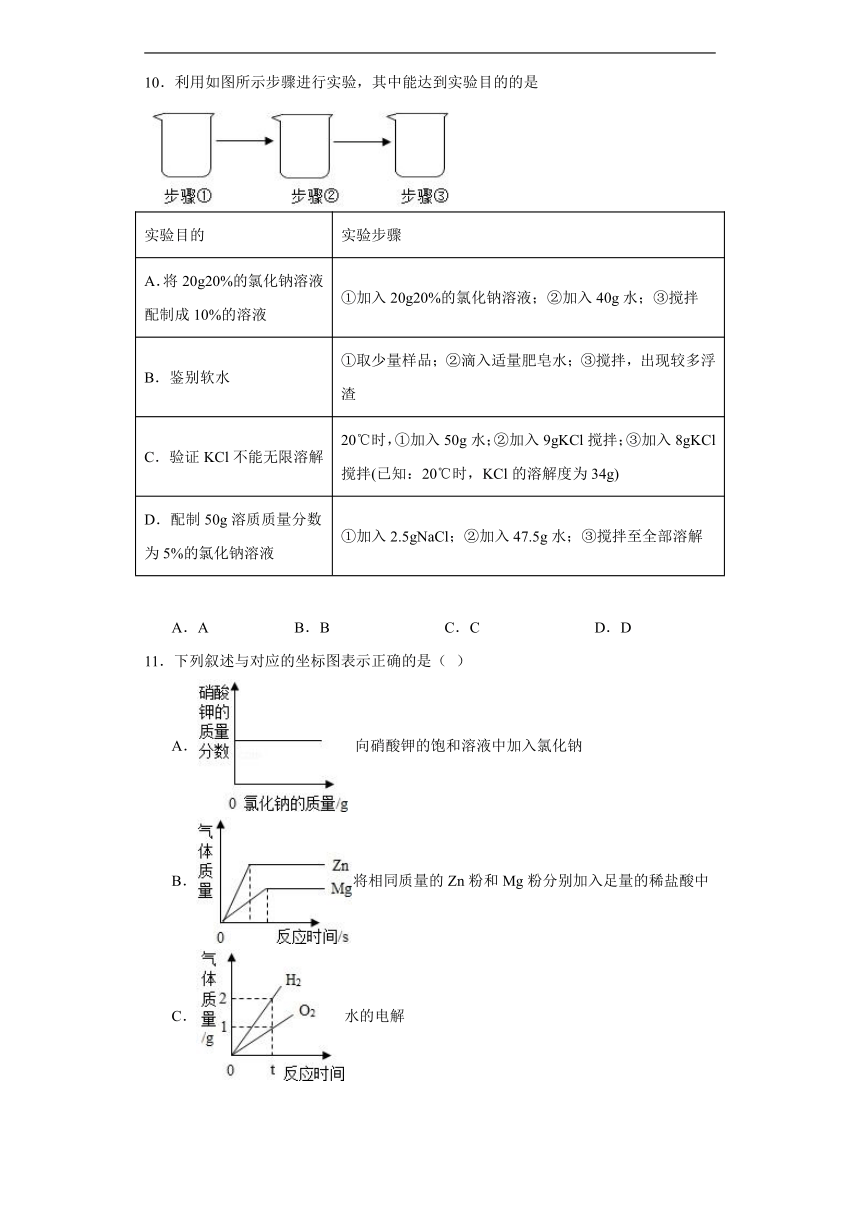
10.利用如图所示步骤进行实验,其中能达到实验目的的是
实验目的 实验步骤
A.将20g20%的氯化钠溶液配制成10%的溶液 ①加入20g20%的氯化钠溶液;②加入40g水;③搅拌
B.鉴别软水 ①取少量样品;②滴入适量肥皂水;③搅拌,出现较多浮渣
C.验证KCl不能无限溶解 20℃时,①加入50g水;②加入9gKCl搅拌;③加入8gKCl搅拌(已知:20℃时,KCl的溶解度为34g)
D.配制50g溶质质量分数为5%的氯化钠溶液 ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解
A.A B.B C.C D.D
11.下列叙述与对应的坐标图表示正确的是( )
A. 向硝酸钾的饱和溶液中加入氯化钠
B.将相同质量的Zn粉和Mg粉分别加入足量的稀盐酸中
C.水的电解
D.盐酸和氯化铁混合溶液中加入过量的氢氧化钠溶液
12.现有溶质质量分数为8%的食盐水40g,要使溶质质量分数达到20%,以下说法正确的是( )
A.加入食盐4g
B.蒸发水分20g
C.加入适量分数为8%的食盐水40g
D.蒸发水分24g
13.有60克溶质质量分数为10%的硝酸钠溶液,欲将其溶质质量分数增加一倍,应该采取的方法是
①把溶剂蒸发掉
②加入6克硝酸钠固体
③把溶剂蒸发掉30克
④加入30%的硝酸钠溶液60克.
A.①② B.②③ C.③④ D.①④
14.如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是
A.要配置相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制t1℃
B.t2℃时,将30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5%
C.要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法
D.将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法
15.某CuSO4溶液的质量分数是10%,该CuSO4溶液中Cu2+与水分子的个数比为
A.1:9 B.1:25 C.1:40 D.1:80
三、综合应用题
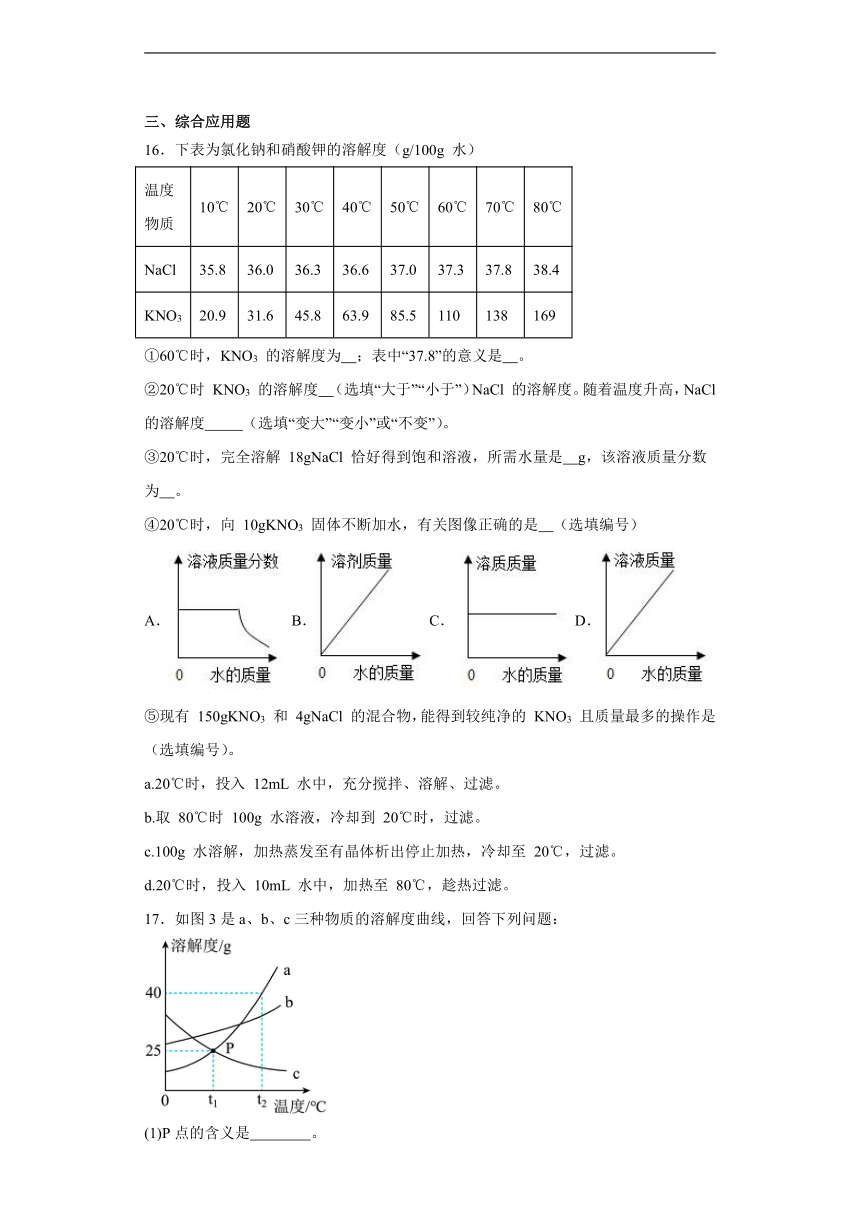
16.下表为氯化钠和硝酸钾的溶解度(g/100g 水)
温度 物质 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃ 80℃
NaCl 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4
KNO3 20.9 31.6 45.8 63.9 85.5 110 138 169
①60℃时,KNO3 的溶解度为 ;表中“37.8”的意义是 。
②20℃时 KNO3 的溶解度 (选填“大于”“小于”)NaCl 的溶解度。随着温度升高,NaCl 的溶解度 (选填“变大”“变小”或“不变”)。
③20℃时,完全溶解 18gNaCl 恰好得到饱和溶液,所需水量是 g,该溶液质量分数为 。
④20℃时,向 10gKNO3 固体不断加水,有关图像正确的是 (选填编号)
A.B.C. D.
⑤现有 150gKNO3 和 4gNaCl 的混合物,能得到较纯净的 KNO3 且质量最多的操作是 (选填编号)。
a.20℃时,投入 12mL 水中,充分搅拌、溶解、过滤。
b.取 80℃时 100g 水溶液,冷却到 20℃时,过滤。
c.100g 水溶解,加热蒸发至有晶体析出停止加热,冷却至 20℃,过滤。
d.20℃时,投入 10mL 水中,加热至 80℃,趁热过滤。
17.如图3是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是 。
(2)t2℃时,将50ga物质加入100g水中,充分溶解后,所得溶液的质量是 g。
(3)若a中含有少量b,可用 (蒸发结晶/降温结晶)的方法提纯a。
(4)t2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为 。
(5)欲配制6%的氯化钠溶液,如下图:
①用上述图示的序号表示配制溶液的操作顺序 (填字母序号)。
②经检测,所配制的溶液质量分数偏小,其原因可能是 (填字母序号)。
a.称量前天平未调平,指针偏右
b.氯化钠固体不纯
c.量取水时,仰视读数
d.装瓶时,有少量溶液洒出
18.二氧化碳的制取与性质是初中化学实验的重要内容。
(1)仪器a的名称是 。
(2)实验室用石灰石与稀盐酸反应制取CO2的化学方程式为 ,选择的发生装置是 (填“甲”或“乙”)。
(3)若试剂X是水,丁中能观察到紫色石蕊试纸变红,若丁中紫色石蕊试纸没有变红,则试剂X可能是 (填字母)。
A.浓硫酸 B.稀盐酸 C.NaOH溶液 D.NaCl溶液
(4)为探究不同形状的碳酸钙和稀盐酸反应的速率,某同学改进了实验装置。该同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,利用传感器技术测得瓶内气压随时间的变化如下图所示。
下列说法正确的是 (填字母)。
A.对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸的反应
B.对比分析c、d点可知,达到相同气压时,碳酸钙粉末与稀盐酸反应所需的时间更短
C.反应后期,反应速率逐渐减慢的主要原因是盐酸的浓度降低
D.碳酸钙粉末与稀盐酸反应产生的二氧化碳更多
(5)将100g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量为 g。
参考答案:
1.CD
2.BD
3.BD
4.AC
5.BC
6.D
7.D
8.B
9.D
10.D
11.D
12.D
13.C
14.B
15.D
16. 110g 70℃时,每 100g 水中最多能溶解 37.8gNaCl 小于 变大 50 26.5% AB a
17.(1)在 t1℃时,a 和 c 的溶解度相等,为25g。
(2)140 ;
(3)降温结晶
(4)c >b >a
(5) DEABC bc
18.(1)试管
(2)
乙
(3)AC
(4)BC
(5)280
一、多选题
1.如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.t1℃时a、c两种物质的饱和溶液中溶质相等
B.t2℃时,100g a物质饱和溶液中含有50g a物质
C.将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系是b>a>c
D.a物质中含有少量的b物质,可采用冷却热饱和溶液的方法得到纯a
2.下列说法正确的是
A.已知20℃时NaCl溶解度为36g,在该温度下将40gNaCl加入100g水中,则所得溶液溶质的质量分数约为28.6%
B.在密闭容器中,将6g碳在11.2g氧气中充分燃烧,生成的一氧化碳和二氧化碳的质量比为21∶22
C.将镁和铁的混合物5.6g与200g溶质的质量分数为7.3%的稀盐酸充分反应,生成氢气的质量可能为0.2g
D.将一定质量氧化铁和氧化铜的混合物,与足量的一氧化碳在一定条件下反应,得到金属混合物2.4g及二氧化碳2.2g,则氧化铁和氧化铜的质量比为1∶1
3.下列有关溶液的说法正确的是
A.将5g某物质加入到95g水中,所得溶液中溶质的质量分数是5%
B.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数可能不变
C.饱和溶液不一定是浓溶液,不饱和溶液一定是稀溶液
D.将一定质量某物质的饱和溶液降温析出晶体后,溶液中溶质的质量一定减小
4.下列涉及学科观点的有关说法正确的是( )
A.转化观:氧气和水在一定条件下可相互转化
B.微拉观:水是氢原子和氧原子构成的
C.结构观:氯原子和氯离子的质子数相同,属于同种元素
D.守恒观:10mL质量分数40%的硫酸,加10mL水后所得溶液的溶质质量分数不变
5.将39gCu和Cu2(OH)2CO3的混合物在空气中加热一段时间后,得到剩余固体35.1g,再向该固体中加入14.6%的稀盐酸,至固体全部溶解,共消耗稀盐酸200g。下列分析不正确的是
A.剩余固体一定为混合物
B.加热过程中共生成H2O和CO2的质量3.1g
C.原混合物中Cu和Cu2(OH)2CO3的质量比为32:111
D.最终所得溶液的质量为232.9g
二、选择题
6.20℃时,通过增加溶质的方法将硝酸钾的不饱和溶液变为饱和溶液,下列说法错误的是
A.溶质的质量增加 B.溶剂的质量不变
C.溶液的质量增加 D.溶液的溶质质量分数不变
7.下列关于溶液说法正确的是
A.将氯化钠和汽油放入水中,充分搅拌后都能形成溶液
B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%
C.向20%C时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g10%的氯化钠溶液一般经过计算、 称量、量取、溶解等步骤
8.下列说法正确的是
A.洗洁精和汽油均可清洗油污,其原理相同
B.同种元素的原子和离子具有相同的质子数
C.饱和溶液转化为不饱和溶液,溶质质量分数一定减小
D.20%的蔗糖溶液中,蔗糖与水的质量比为1:5
9.某温度下,向100 g饱和石灰水中加入5.6 g 生石灰,充分反应后恢复到原来温度。下列叙述中正确的是
A.沉淀物的质量为5.6 g B.沉淀物的质量为7.4 g
C.结束后,溶液的质量分数增大 D.结束后,溶液的质量小于98.2 g
10.利用如图所示步骤进行实验,其中能达到实验目的的是
实验目的 实验步骤
A.将20g20%的氯化钠溶液配制成10%的溶液 ①加入20g20%的氯化钠溶液;②加入40g水;③搅拌
B.鉴别软水 ①取少量样品;②滴入适量肥皂水;③搅拌,出现较多浮渣
C.验证KCl不能无限溶解 20℃时,①加入50g水;②加入9gKCl搅拌;③加入8gKCl搅拌(已知:20℃时,KCl的溶解度为34g)
D.配制50g溶质质量分数为5%的氯化钠溶液 ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解
A.A B.B C.C D.D
11.下列叙述与对应的坐标图表示正确的是( )
A. 向硝酸钾的饱和溶液中加入氯化钠
B.将相同质量的Zn粉和Mg粉分别加入足量的稀盐酸中
C.水的电解
D.盐酸和氯化铁混合溶液中加入过量的氢氧化钠溶液
12.现有溶质质量分数为8%的食盐水40g,要使溶质质量分数达到20%,以下说法正确的是( )
A.加入食盐4g
B.蒸发水分20g
C.加入适量分数为8%的食盐水40g
D.蒸发水分24g
13.有60克溶质质量分数为10%的硝酸钠溶液,欲将其溶质质量分数增加一倍,应该采取的方法是
①把溶剂蒸发掉
②加入6克硝酸钠固体
③把溶剂蒸发掉30克
④加入30%的硝酸钠溶液60克.
A.①② B.②③ C.③④ D.①④
14.如图是甲、乙、丙三种物质的溶解度曲线,下列说法错误的是
A.要配置相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制t1℃
B.t2℃时,将30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5%
C.要从甲物质的饱和溶液中获得晶体甲,可采用降温结晶的方法
D.将丙物质的饱和溶液转化为不饱和溶液可以采用加水或降温的方法
15.某CuSO4溶液的质量分数是10%,该CuSO4溶液中Cu2+与水分子的个数比为
A.1:9 B.1:25 C.1:40 D.1:80
三、综合应用题
16.下表为氯化钠和硝酸钾的溶解度(g/100g 水)
温度 物质 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 70℃ 80℃
NaCl 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4
KNO3 20.9 31.6 45.8 63.9 85.5 110 138 169
①60℃时,KNO3 的溶解度为 ;表中“37.8”的意义是 。
②20℃时 KNO3 的溶解度 (选填“大于”“小于”)NaCl 的溶解度。随着温度升高,NaCl 的溶解度 (选填“变大”“变小”或“不变”)。
③20℃时,完全溶解 18gNaCl 恰好得到饱和溶液,所需水量是 g,该溶液质量分数为 。
④20℃时,向 10gKNO3 固体不断加水,有关图像正确的是 (选填编号)
A.B.C. D.
⑤现有 150gKNO3 和 4gNaCl 的混合物,能得到较纯净的 KNO3 且质量最多的操作是 (选填编号)。
a.20℃时,投入 12mL 水中,充分搅拌、溶解、过滤。
b.取 80℃时 100g 水溶液,冷却到 20℃时,过滤。
c.100g 水溶解,加热蒸发至有晶体析出停止加热,冷却至 20℃,过滤。
d.20℃时,投入 10mL 水中,加热至 80℃,趁热过滤。
17.如图3是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是 。
(2)t2℃时,将50ga物质加入100g水中,充分溶解后,所得溶液的质量是 g。
(3)若a中含有少量b,可用 (蒸发结晶/降温结晶)的方法提纯a。
(4)t2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为 。
(5)欲配制6%的氯化钠溶液,如下图:
①用上述图示的序号表示配制溶液的操作顺序 (填字母序号)。
②经检测,所配制的溶液质量分数偏小,其原因可能是 (填字母序号)。
a.称量前天平未调平,指针偏右
b.氯化钠固体不纯
c.量取水时,仰视读数
d.装瓶时,有少量溶液洒出
18.二氧化碳的制取与性质是初中化学实验的重要内容。
(1)仪器a的名称是 。
(2)实验室用石灰石与稀盐酸反应制取CO2的化学方程式为 ,选择的发生装置是 (填“甲”或“乙”)。
(3)若试剂X是水,丁中能观察到紫色石蕊试纸变红,若丁中紫色石蕊试纸没有变红,则试剂X可能是 (填字母)。
A.浓硫酸 B.稀盐酸 C.NaOH溶液 D.NaCl溶液
(4)为探究不同形状的碳酸钙和稀盐酸反应的速率,某同学改进了实验装置。该同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,利用传感器技术测得瓶内气压随时间的变化如下图所示。
下列说法正确的是 (填字母)。
A.对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸的反应
B.对比分析c、d点可知,达到相同气压时,碳酸钙粉末与稀盐酸反应所需的时间更短
C.反应后期,反应速率逐渐减慢的主要原因是盐酸的浓度降低
D.碳酸钙粉末与稀盐酸反应产生的二氧化碳更多
(5)将100g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需加水的质量为 g。
参考答案:
1.CD
2.BD
3.BD
4.AC
5.BC
6.D
7.D
8.B
9.D
10.D
11.D
12.D
13.C
14.B
15.D
16. 110g 70℃时,每 100g 水中最多能溶解 37.8gNaCl 小于 变大 50 26.5% AB a
17.(1)在 t1℃时,a 和 c 的溶解度相等,为25g。
(2)140 ;
(3)降温结晶
(4)c >b >a
(5) DEABC bc
18.(1)试管
(2)
乙
(3)AC
(4)BC
(5)280
同课章节目录
